Galectin-3和β-catenin在子宫内膜异位症中的表达及二者的相关性
2015-11-17石亚楠黄河玲郭瑞峰刘艺
石亚楠,黄河玲,郭瑞峰,刘艺
临床研究
Galectin-3和β-catenin在子宫内膜异位症中的表达及二者的相关性
石亚楠1,黄河玲2△,郭瑞峰2,刘艺2
目的探讨半乳糖凝集素-3(Galectin-3)和β连环素(β-catenin)在子宫内膜异位症(EMs)患者的异位内膜和在位内膜中的表达及其在EMs发病中的作用及关系。方法应用免疫组织化学法检测34例EMs患者(EMs组)的异位内膜和在位内膜及30例非子宫内膜异位症(正常对照组)的在位子宫内膜中的半乳糖凝集素-3和β连环素的表达情况,并分析二者的相关性。结果半乳糖凝集素-3在EMs组异位内膜、在位内膜及正常对照组在位内膜的阳性表达率分别为88.2%、85.3%、50.0%;β连环素在上述3组的异常表达率分别为55.9%、52.9%、26.7%。EMs异位内膜组、在位内膜组的半乳糖凝集素-3的阳性表达率和β连环素的异常表达率均高于正常对照组(P<0.05)。EMs组异位内膜、在位内膜中的半乳糖凝集素-3的阳性表达和β连环素的异常表达呈正相关(rs分别为0.512、0.428,P<0.01)。结论半乳糖凝集素-3和β连环素可能在EMs的发病中共同起着重要作用。
半乳糖凝集素3;β连环素;子宫内膜异位症;免疫组织化学
子宫内膜异位症(endometriosis,EMs)是育龄期妇女的多发病、常见病,近年来其发病率呈现上升趋势,但其发生发展机制尚无定论。半乳糖凝集素-3(Galectin-3)是半乳糖凝集素家族中唯一的嵌合型成员,具有参与细胞的增殖、分化、凋亡,介导细胞黏附及免疫调节等多种生物学作用,近年来研究表明其与肿瘤的发生、发展及转移密切相关[1]。Wnt/β连环素(β-catenin)信号通路是调控细胞生长、发育和分化的关键途径,β-catenin是Wnt/β-catenin信号通路的关键成员,其异常改变在肿瘤的发生、转移和浸润过程中起重要作用[2]。近年来研究发现Galec⁃tin-3是β-catenin的一种新的结合蛋白配偶体,目前关于其二者在肿瘤中的表达的文献较多,但二者在具有类似肿瘤生物学行为的EMs中的表达及其关系尚鲜见报道。本研究应用免疫组织化学方法检测Galectin-3与β-catenin在EMs患者在位及异位内膜组织中的表达情况,并探讨其二者在EMs发生、侵袭、转移中的作用及二者之间的关系。
1 对象与方法
1.1 研究对象(1)选取2013年1月—2014年3月在解放军二五二医院因卵巢囊肿行开腹及腹腔镜手术,术后病理证实为EMs的患者34例作为研究组。年龄22~47岁,平均(34.21±5.79)岁。取其异位内膜及在位内膜,在位内膜为诊断刮宫或同时切除子宫所得的内膜。(2)选择同期因不孕症(输卵管因素)、卵巢良性病变、宫颈病变(CINⅡ~Ⅲ)等行腹腔镜或开腹手术治疗并排除EMs的正常子宫内膜标本30例作为对照组。年龄26~43岁,平均(36.77±4.97)岁。所有患者均月经周期规则,无长期用药史,术前3个月未经任何内分泌药物治疗,无恶性肿瘤史。所有诊断均经术后病理证实。
1.2 主要试剂鼠抗人Galectin-3单克隆抗体及鼠抗人βcatenin单克隆抗体均购自福州迈新生物技术有限公司,SP试剂盒及DAB试剂盒均购自北京西雅金桥生物技术有限公司。
1.3 方法将蜡块标本连续4 μm切片,分别进行HE染色及免疫组化染色,采用免疫组织化学SP法进行Galectin-3和β-catenin检测,实验操作严格按照说明书进行,以PBS代替一抗作为阴性对照,以已知阳性片作为阳性对照。
1.4 结果判断Galectin-3主要定位于细胞质,但在胞核也有少量表达,结果判定采用半定量积分法[3],高倍镜下在每一切片角及中央取5个高倍视野,各计算100个细胞中阳性细胞所占百分比,取平均值。根据阳性细胞数和染色强度共同判定。首先根据阳性细胞所占百分比定为0~3分:没有为0分,<10%为1分,10%~50%为2分,>50%为3分。再根据染色深浅定为0~3分:0分为无着色,1分为浅黄色,2分为棕黄色,3分为棕褐色。两项评分相加判定结果分为4级:0~1分为(-),2分为(+),3~4分为(++),5~6分为(+++)。
β-catenin结果判断参照Maruyama等[4]的方法,分别从细胞膜、细胞质和细胞核判断β-catenin在细胞内的表达特征:细胞膜β-catenin表达阳性的细胞数>70%判定为正常表达,反之为表达缺失;细胞质或细胞核β-catenin表达阳性的细胞数>10%(包括同时细胞膜表达>70%者)判定为异位表达。膜表达缺失或异位表达均称为表达异常。
1.5 统计学方法实验数据用SPSS 17.0统计软件分析,正态分布计量资料采用均数±标准差表示,组间比较采用单因素方差分析,多重比较采用LSD-t检验。计数资料采用例(%)表示,组间比较采用χ2检验。相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 Galectin-3及β-catenin的表达Galectin-3在EMs异位内膜、在位内膜组的腺体上皮中阳性表达较强,表达以强阳性和中度阳性为主,在正常对照组中表达以弱阳性和阴性为主。Galectin-3在EMs异位内膜组和在位内膜组的阳性表达均较正常对照组高(P<0.05),而异位内膜组与在位内膜组阳性表达率差异无统计学意义(P>0.05)。β-catenin在EMs异位内膜组和在位内膜组的内膜腺体上皮中异常表达较强,在对照组中较弱。β-catenin在EMs异位内膜组和在位内膜组的异常表达较正常对照组高(P<0.05),而异位内膜组与在位内膜组间异常表达率差异无统计学意义(P>0.05)。见图1、表1。
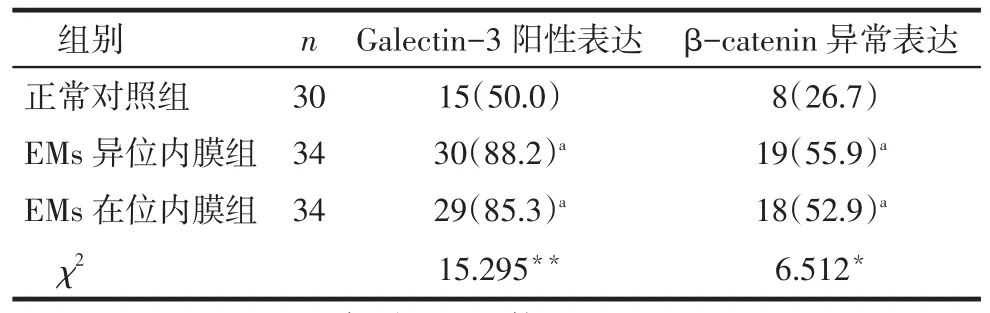
Tab.1Comparison of the expressions of Galectin-3 and β-catenin in ectopic endometrium,eutopic endometrium and normal endometrium groups表1 Galectin-3及β-catenin在EMs组异位、在位内膜及正常对照组内膜中的表达情况例(%)
2.2 Galectin-3与β-catenin的相关性结果表明在EMs异位内膜组和在位内膜组中Galectin-3的阳性表达与β-catenin的异常表达均呈正相关(rs分别为0.512、0.428,P<0.01),见表2。

Tab.2The correlation of Galectin-3 and β-catenin expressions in ectopic endometrium and eutopic endometrium of EM patients表2 EMs异位内膜、在位内膜中Galectin-3与β-catenin的相关性例
3 讨论
3.1 Galectin-3在EMs发病中的作用Galectin-3是一种分子质量为29~35 ku的β-半乳糖苷结合蛋白,可与细胞内糖蛋白、细胞表面分子和细胞外基质相互作用,与肿瘤细胞的黏附转移、血管生成、免疫耐受、抗凋亡等有关[3]。近年来,关于其在甲状腺癌[5]、结肠癌[6]等恶性肿瘤中的表达多有报道,但其在类似于恶性肿瘤生物学行为的EMs中的表达的文献甚少。有研究报道其可能在EMs的发展中有潜在作用[7]。有文献报道Galectin-3与EMs不孕的相关性,发现Galectin-3在EMs患者在位内膜的表达明显降低,降低了子宫内膜的容受性,不利于胚胎的着床[8];但Noël等[7]认为EMs在位内膜中Galectin-3的表达明显高于正常妇女的子宫内膜,结论存在争议。本研究显示,Galectin-3在EMs异位内膜及在位内膜的表达均高于正常对照组,与Noël等的结果相符,提示其在EMs的发病中起着重要作用。
3.2 β-catenin对EMs的细胞黏附及侵袭增殖的影响Wnt/β-catenin信号通路是胚胎发育分化中重要的信号通路,与肿瘤的发生、浸润和转移密切相关[9]。β-catenin是Wnt/β-catenin信号通路的关键成员,通路中任一信号分子发生改变均可引起细胞内游离β-catenin的积累,并进入胞核与淋巴增强因子/T细胞因子(lymphoid enhancer factor/T cell factor,LEF/TCF)转录复合物结合,激活相应下游靶基因进行非正常转录,从而使细胞的增殖、分化失控,导致肿瘤发生。周琦等[10]研究表明Wnt/β-catenin信号通路可能参与了EMs的发生。许金榜等[11]研究也表明β-catenin的高表达可能在EMs的发病过程中起重要作用。本研究显示异位内膜及在位内膜βcatenin的异常表达率增高,细胞膜表达减少或缺失,这很可能导致同型细胞间黏附功能下降,从而导致内膜细胞脱离原位,并发生异位种植;而胞浆及胞核表达增强导致Wnt/β-catenin信号通路的激活,下游相应靶基因(cyclin D1和c-myc)非正常转录,从而参与了EMs的侵袭和增殖。因此β-catenin可能在EMs的细胞黏附及侵袭增殖中发挥了重要作用。
3.3 EMs中Galectin-3的阳性表达与β-catenin异常表达的关系近年来研究发现Galectin-3是Wnt/ β-catenin信号途径的关键调节因子,其与βcatenin、TCF-4组成三元复合物,共同启动下游靶基因(如Cyclin D1,C-myc)的转录,从而促进细胞增殖[12]。Wang等[13]研究表明Galectin-3通过Wnt/βcatenin信号通路激活在舌癌进展中起着重要作用。杨春蓉等[14]研究显示Galectin-3可能与Wnt/βcatenin信号通路密切相关。虽然在多种恶性肿瘤的发生中二者的密切关系已被证实,但在类似于肿瘤生物学行为的EMs中二者的关系尚鲜见报道,本研究表明Galectin-3的阳性表达与β-catenin的异常表达呈正相关,提示在EMs中,Galectin-3确有可能参与了Wnt/β-catenin信号通路,二者共同促进EMs的发生发展,Galectin-3可能通过与β-catenin特异性结合,促进下游信号的转录,从而促进了内膜细胞侵袭增殖。
综上所述,Galectin-3与β-catenin可能共同在EMs的发生发展中发挥着重要作用,高Galectin-3阳性表达、高β-catenin异常表达的在位内膜可能是发生EMs的高危人群,诊刮筛选出此类内膜有望成为诊断预测EMs的新方法。对高危人群实行在位内膜干预可能将为EMs的治疗开辟新途径,其能否作为分子靶向治疗靶点尚有待进一步研究。
(图1见插页)
[1]Zhu XQ,Huang WB,Shao JG,et al.Expressions of Galectin-3 and βcatenin in human colorectal carcinoma and its clinical significance[J]. Chinese Journal of Histochemistry and Cytochemistry,2010,19(1):38-42.[朱晓群,黄文斌,邵金贵,等.结直肠癌中Galectin-3和β-catenin的表达与相关性研究[J].中国组织化学与细胞化学杂志,2010,19(1):38-42].doi:10.3870/j.issn.1004-1850.2010.01.008.
[2]Ueno K,Hirata H,Majid S,et al.Wnt antagonist DICKKOPF-3(Dkk-3)induces apoptosis in human renal cell carcinoma[J].Mol Carcinog,2011,50(6):449-457.doi:10.1002/mc.20729.
[3]Xu MR,Wang XJ,Zhang SL,et al.Expression and significance of Galectin-3 and VEGF in Cervical Lesions[J].Journal of Nanchang University(Medical Science),2014,54(3):13-17.[徐美容,王先进,张书莲,等.Galectin-3和VEGF在宫颈病变组织中的表达及意义[J].南昌大学学报(医学版),2014,54(3):13-17].
[4]Maruyama K,Ochiai A,Akimoto S,et al.Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J].Oncology,2000,59(4):302-309.
[5]Abd-EI Raouf SM,Ibrahim TR.Immunohistochemical expression of HBME-1 and galectin-3 in the differential diagnosis of follicu⁃lar-derived thyroid nodules[J].Pathol Res Pract,2014,210(12):971-978.doi:10.1016/j.prp.2014.06.010.
[6]Li YJ,Zhao EH,Su R,et al.Expression and significance of MMP-2 and Galectin-3 in colon cancer[J].Chinese Journal of Gerontology,2014,14:3910-3912.[李英健,赵恩宏,苏锐,等.大肠癌组织中MMP-2与Galectin-3的表达及临床意义[J].中国老年学杂志,2014,14:3910-3912].doi:10.3969/j.issn.1005-9202.2014.14. 048.
[7]Noël JC,Chapron C,Borghese B,et al.Galectin-3 is overexpressed in various forms of endometriosis[J].Appl Immunohistochem Mol Mor⁃phol,2011,19(3):253-257.doi:10.1097/PAI.0b013e3181f5a05e.
[8]Sun XW,Zhang W,Zhou JP,et al.Expression of galectin-3 in the endometrium from women with endometriosis during the window of implantation[J].CHINESE JOURNAL OF IMMUNOLOGY,2007,23(2):135-141.[孙晓炜,张炜,周剑萍,等.galectin-3在子宫内膜异位症患者在位内膜中的表达及意义[J].中国免疫学杂志,2007,23(2):135-141].
[9]Zhang H,Cao XQ,Dai CY,et al.Expression of β-catenin and antag⁃onist factor SFRP1 in papillary thyroid carcinoma and its clinico⁃pathological significance[J].Zhejiang Medical Journal,2014,36(17):1454-1456.[章辉,曹学全,戴岳楚,等.Wnt信号通路的βcatenin和拮抗因子SFRP1在甲状腺乳头状癌中的表达及意义[J].浙江医学,2014,36(17):1454-1456].
[10]Zhou Q,Li X,Tao L,et al.The expression and significance of four genes on Wnt/β-catenin signal pathway in endometriosis[J].Jour⁃nal of Xinjiang Medical University,2014,37(12):1585-1590.[周琦,李霞,陶玲,等.Wnt/β-catenin信号通路4个基因在子宫内膜异位症中的表达及意义[J].新疆医科大学学报,2014,37(12):1585-1590].doi:10.3969/j.issn.1009-5551.2014.12.011.
[11]Xu JB,Lin DM,Lin Y,et al.The expression and significance of βcatenin and survivin in the ectopic endometrium and eutopic endo⁃metrium of endometriosis patients[J].MILITARY MEDICAL SCI⁃ENCES,2012,36(12):959-960.[许金榜,林丹玫,林元,等.β-连接素和生存素在子宫内膜异位症患者异位内膜和在位内膜的表达及意义[J].军事医学,2012,36(12):959-960].
[12]Song S,Mazurek N,Liu C,et al.Galectin-3 mediates nuclear betacatenin accumulation and Wnt signaling in human colon cancer cells by regulation of glycogen synthase kinase-3beta activity[J]. Cancer Res,2009,69(4):1343-1349.doi:10.1158/0008-5472. CAN-08-4153.
[13]Wang LP,Chen SW,Zhuang SM,et al.Galectin-3 accelerates the progression of oral tongue squamous cell carcinoma via a Wnt/βcatenin-dependent pathway[J].Pathol Oncol Res,2013,19(3):461-474.doi:10.1007/s12253-013-9603-7.
[14]Yang CR,Chen L,Luo DZ,et al.Correlation between Galectin-3 and Wnt pathway-related protein in salivary gland tumor[J].Journal of Chongqing Medical University,2012,37(8):707-710.[杨春蓉,陈路,罗代珍,等.涎腺肿瘤中半乳糖凝集素-3与wnt通路蛋白的相关性研究[J].重庆医科大学学报,2012,37(8):707-710]. doi:10.3969/j.issn.0253-3626.2012.08.013.
(2014-12-15收稿2015-03-09修回)
(本文编辑李鹏)
The expressions of Galectin-3 and β-catenin and their correlation studies in endometriosis
SHI Ya'nan1,HUANG Heling2△,GUO Ruifeng2,LIU Yi2
1 HeBei North University,Zhangjiakou 075000,China;2 The People′s Liberation Army 252 Hospital△
ObjectiveTo investigate the expressions and mutual relationship of Galectin-3 and β-catenin in endome⁃triosis(EM).MethodsImmunohistochemistry was used to detect expression levels of Galectin-3 and β-catenin and their mutual relationship in expression was also examined.Samples were collected from ectopic endometrium of patients with en⁃dometriosis(ectopic endometrium group,n=34),eutopic endometrium of patients with endometriosis(eutopic endometrium group,n=34)and normal endometrium from people without endometriosis(control group,n=30).ResultsThe expressions of Galectin-3 were seen in 88.2%,85.3%,50.0%of cases in ectopic endometrium group,eutopic endometrium group and control group respectively.On the other hand,the expression of β-catenin were seen in 55.9%,52.9%,26.7%of cases in ecto⁃pic endometrium group,eutopic endometrium group and control group respectively.In EMs patients,the expression of Galec⁃tin-3 and β-catenin were significantly higher in ectopic endometrium and eutopic endometrium than those in normal endome⁃trium group(P<0.05).Expression of Galectin-3 was positive correlated with expression of β-catenin(rs=0.512,0.428,P<0.01).ConclusionGalectin-3 and β-catenin may play important roles synergistically in the pathogenesis of endometriosis.
Galectin 3;beta catenin;endometriosis;immunohistochemistry
R711.7
A
10.11958/j.issn.0253-9896.2015.08.012
1河北北方学院(邮编075000);2解放军第二五二医院
石亚楠(1988),女,硕士在读,主要从事妇科肿瘤方向的研究
△通讯作者E-mail:hhl252@aliyun.com
