白细胞介素-1β对大鼠软骨细胞MMP-13表达的影响及miR-27b的调控作用
2015-11-17王欣秦宇
王欣,秦宇
白细胞介素-1β对大鼠软骨细胞MMP-13表达的影响及miR-27b的调控作用
王欣1,2,秦宇1
目的观察白细胞介素(IL)-1β对大鼠软骨细胞基质金属蛋白酶(MMP)-13表达的影响及miR-27b的调控作用。方法雄性Wistar大鼠7只提取软骨细胞。Western blot检测IL-1β刺激软骨细胞0 h、24 h、48 h各时间点MMP-13表达变化;miRNAs微阵列分析48 h内软骨细胞差异表达的miRNAs;Real-time PCR定量分析筛选出下调最为明显的miRNAs;荧光素酶报告基因实验验证miR-27b与MMP-13的靶定调控关系。结果IL-1β刺激软骨细胞后,MMP-13蛋白在0 h、24 h、48 h各时间点表达逐渐增加(P<0.05);miRNAs微阵列分析发现48 h内软骨细胞有36个miRNAs出现表达变化,变化最为明显的有6个,分别为miR-27b、miR-31、miR-26a、miR-26b、miR-23、miR-204;Real-time PCR显示miR-27b下调最为明显;miR-27b拟似物和荧光素酶表达质粒共转染软骨细胞后,荧光素酶活性受到明显抑制(P<0.05)。结论IL-1β刺激软骨细胞后,出现miR-27b的表达下调和MMP-13蛋白的表达上调,miR-27b与MMP-13存在靶定调控关系。
软骨细胞;基质金属蛋白酶13;微RNAs;白细胞介素1β;微阵列分析;微小RNA-27b
骨性关节炎(osteoarthritis,OA)是一种慢性关节疾病,主要表现为负重关节软骨局限性、进行性破坏及关节边缘骨赘形成,并伴有不同程度的滑膜炎症。临床上可产生关节疼痛、活动受限和关节畸形等症状。OA的发病可能与细胞因子、自由基、肥胖、雌激素缺乏等因素有关,但确切病因尚未完全阐明[1-2]。软骨细胞位于细胞外基质中,后者是软骨的主要功能载体,由Ⅱ型胶原蛋白和软骨中特有的蛋白多糖构成[3]。基质金属蛋白酶(matrix metalloproteinases,MMPs)被认为在软骨细胞外基质的破坏和重建中发挥重要作用,其中MMP-13具有广泛的酶活性,对Ⅱ型胶原具有最为活跃的降解能力[4]。白细胞介素(IL)-1β是一种有效的MMP诱导剂,在软骨的降解、退变过程中起重要作用[5]。目前关于IL-1β对MMP-13的调控作用及调控机制的研究鲜有报道。近年发现微小RNA(microRNAs,miRNAs)通过与靶基因3′端非编码区(3′Untranslated Region,3′UTR)结合,在蛋白质翻译水平上抑制靶mRNA表达或诱导mRNA降解,被认为是转录后基因调控的关键因素[6]。有证据表明,miRNAs表达改变参与了OA过程中软骨细胞损伤[7]。本研究拟以大鼠软骨细胞为研究对象,探讨IL-1β的刺激下,miRNAs差异表达与MMP-13之间的关系,为OA早期防治提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物选取体质量180~220 g的雄性Wistar大鼠(SPF级,由天津医科大学实验动物中心提供)。实验室温度20~25℃,湿度50%~60%,自由饮水。
1.1.2 仪器与试剂倒置显微镜(日本Olympus公司);Ther⁃mo Scientific CO2培养箱(美国Thermo公司);LightCycler 96实时荧光定量PCR仪(瑞士罗氏公司);凝胶成像仪(美国SynGene公司);电子天平(上海精密仪器科技有限公司);台式离心机(北京东迅天地医疗仪器有限公司);DMEM胎牛血清、胰蛋白酶(美国Gibco公司);Lipofectamine 2000、NCode™VILO™miRNA cDNA合成试剂盒(美国Invitrogen公司);mirvana™miRNA分离试剂盒、TaqMan MicroRNA Array v2.0(美国Applied Biosystems公司);MMP-13兔抗大鼠单克隆抗体(美国Santa Cruz公司);miR-27b拟似物、miR-27b拮抗剂、阴性对照(上海吉玛制药技术公司);双荧光素酶报告基因实验系统(美国Promega公司)
1.2 方法
1.2.1 大鼠原代软骨细胞的分离、培养及分组参考文献[8],将雄性Wistar大鼠7只,以10%水合氯醛3.5 mL/kg腹腔注射麻醉,超净平台中无菌条件下切去髋关节、膝关节、肩关节软骨,切成1~2 mm3碎块,以0.25%胰蛋白酶消化,再加入0.2%Ⅱ型胶原酶10 mL,于37℃细胞培养箱中消化4~5 h,滤去软骨组织,滤液以3 000 r/min离心5 min,加入含10%胎牛血清DMEM培养液,置于培养箱中培养。细胞贴壁融合率达85%~90%时,即用胰蛋白酶消化并进行传代,第3代软骨细胞按1×106/孔接种于6孔板。每3孔作为一组,分为对照组和IL-1β刺激组。对照组不予刺激。IL-1β刺激组用含有10 μg/L无血清培养基培养大鼠软骨细胞,于第24 h和48 h以倒置显微镜观察细胞生长情况,同时收集细胞并提取RNA。
1.2.2 细胞核形的观察培养的软骨细胞置于玻片上,以PBS洗涤3遍,后滴加几滴DAPI(4′,6-diamidino-2-phenyl⁃indole)染液,染色10 min。流水冲去染液,滤纸吸除多余水分,加1滴荧光封片液,置于荧光显微镜下观察,激发波长360~400 nm。
1.2.3 miRNA微阵列分析软骨细胞总RNA以mirvana™miRNA分离试剂盒提取,分离方法参照说明书进行。总RNA的浓度和纯度用分光光度计评估。提取5 μg RNA进行微阵列分析。
1.2.4 实时荧光定量PCR检测逆转录反应依照NCode™ VILO™miRNA cDNA合成试剂盒的方法合成cDNA,根据GenBank的基因序列为miR-27b、miR-31、miR-26a、miR-26b、miR-23、miR-204设计引物,取U6作为内参。PCR反应程序为:95℃预变性5 min,95℃变性15 s,50℃退火30 s,72℃延伸40 s,共40个循环,最后72℃延伸40 min。结果用Applied Biosystems SDS软件包(2.2版)分析,每组实验重复3次。
1.2.5 荧光素酶报告基因实验验证靶基因首先应用生物信息学软件Targetscan(http://www.targetscan.org)和PicTar(http://pictar.mdc-berlin.de/cgi-bin/new_PicTar_vertebrate.cgi?species=vertebrate)分析miR-27b可能的靶基因。再以基因组DNA为模板扩增MMP-13的3′-UTR,在引物中引入PmeⅠ和XbaⅠ的酶切点和保护碱基。引物序列为:上游5′-GA⁃CAGCAUAGGCGAUAAGAGCGCCGAAAG-3′;下游5′-GCG⁃GAAGACCCGACGGACCCGGAGGCCCG-3′,测序正确后克隆到pmirGLO荧光素酶质粒,获得pGLO-MMP13-3′-UTR重组质粒。体外合成含上述位点突变体的DNA片段,测序正确后克隆到pmirGLO荧光素酶质粒,突变质粒命名为pG⁃LO-MMP13-3′-UTR-mut。将细胞接种于24孔板中,按照Lipofectamine 2000说明书进行瞬时转染。分别转染pGLOMMP13-3′-UTR序列、pGLO-MMP13-3′-UTR-mut序列、miR-27b拟似物序列、miR-27b拮抗剂序列和对照序列。培养24 h后,用荧光素酶检测试剂盒测定萤火虫荧光素酶活性和海肾荧光素酶活性的比值代表细胞荧光素酶的表达水平。转染效率通过Real-time PCR和Western blot法检测。
1.2.6 Western blot检测MMP-13蛋白的表达放射免疫沉淀实验(RIPA)裂解液裂解细胞,离心后取上清液提取总蛋白。每条泳道以40 μg蛋白量上样,7.5%SDS-PAGE分离蛋白质,湿法转移将蛋白电转到聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭1 h,加入制定的MMP-13一抗,4℃过夜,洗膜,后用HRP标记的二抗常规孵育1 h,增强化学发光(ECL)试剂反应1 min,曝光成像。以β-actin作为内参。
1.3 统计学方法采用SPSS 17.0统计软件进行分析,实验结果用均数±标准差表示,多组均数比较采用单因素方差分析,多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IL-1β诱导软骨细胞形态学以及细胞核的改变接种后,光学显微镜下可见悬浮于培养液中的软骨细胞为小圆形,静置24 h后,大多数细胞开始贴壁、增殖,并逐渐融合形成单层,呈不规则立体“铺路石”样。DAPI染色后见细胞核荧光着色均匀,胞核结构正常。IL-1β处理24 h后,部分细胞由圆形或椭圆形逐渐变成长梭形,细胞膜完整性被破坏。DAPI染色后,部分胞核因染色质聚集而呈现出核区致密浓染,核区荧光发白发亮。IL-1β处理48 h后,上述形态变化更加明显,见图1。
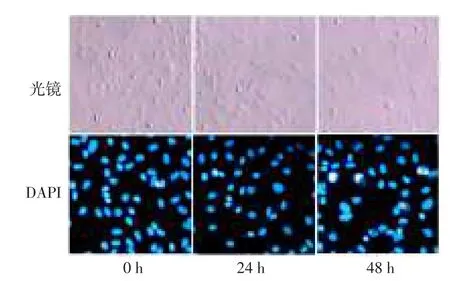
Fig.1Observation of chondrocyte morphology induced by IL-1β(×400)图1 IL-1β诱导软骨细胞形态学观察(×400)
2.2 IL-1β诱导软骨细胞MMP-13表达变化IL-1β处理软骨细胞48 h内MMP-13表达逐渐增加(F=20.453,P<0.05)。其中,24 h时MMP-13蛋白表达较0 h明显增加(0.47±0.04 vs 0.21±0.02,P<0.05),处理48 h后MMP-13蛋白表达(0.77±0.06)较24 h增加更为明显(P<0.05),见图2。
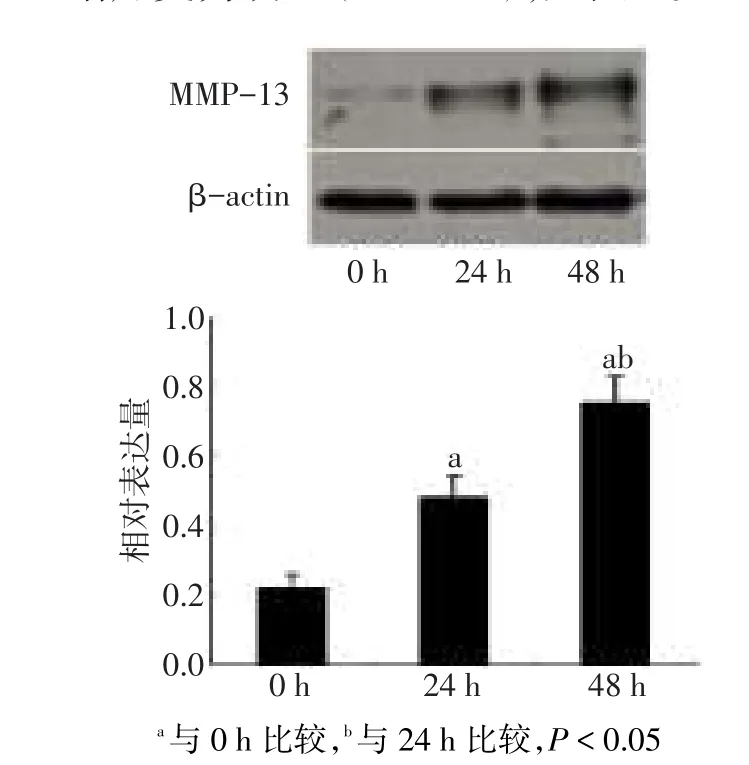
Fig.2Changes in MMP-13 expression in rat chondrocytes upon IL-1β stimulation图2 IL-1β处理后软骨细胞MMP-13蛋白表达变化

Fig.3miRNA microarray of rat chondrocytes 48 h after IL-1β stimulation图3 IL-1β处理软骨细胞48 h后miRNAs微阵列芯片的差异表达分析
Tab.1Expression of 6 most obviously changed miRNAs in rat chondrocytes upon IL-1β stimulation for 48 h表1 IL-1β处理软骨细胞48 h,改变最为明显的6个miRNAs表达情况(n=3,)
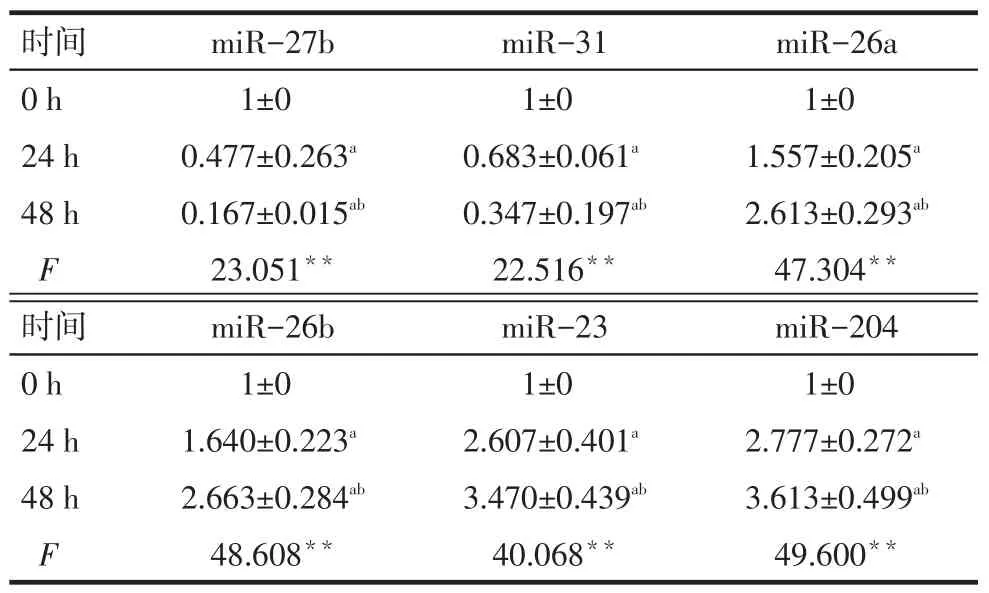
Tab.1Expression of 6 most obviously changed miRNAs in rat chondrocytes upon IL-1β stimulation for 48 h表1 IL-1β处理软骨细胞48 h,改变最为明显的6个miRNAs表达情况(n=3,)
**P<0.01;a与0 h比较,b与24 h比较,P<0.05
时间0 h 2 4 h 4 8 h F m i R -2 7 b 1 ± 0 0 . 4 7 7 ± 0 . 2 6 3 a 0 . 1 6 7 ± 0 . 0 1 5 a b 2 3 . 0 5 1**m i R -3 1 1 ± 0 0 . 6 8 3 ± 0 . 0 6 1 a 0 . 3 4 7 ± 0 . 1 9 7 a b 2 2 . 5 1 6**m i R -2 6 a 1 ± 0 1 . 5 5 7 ± 0 . 2 0 5 a 2 . 6 1 3 ± 0 . 2 9 3 a b 4 7 . 3 0 4**时间0 h 2 4 h 4 8 h F m i R -2 0 4 1 ± 0 2 . 7 7 7 ± 0 . 2 7 2 a 3 . 6 1 3 ± 0 . 4 9 9 a b 4 9 . 6 0 0**m i R -2 6 b 1 ± 0 1 . 6 4 0 ± 0 . 2 2 3 a 2 . 6 6 3 ± 0 . 2 8 4 a b 4 8 . 6 0 8**m i R -2 3 1 ± 0 2 . 6 0 7 ± 0 . 4 0 1 a 3 . 4 7 0 ± 0 . 4 3 9 a b 4 0 . 0 6 8**
2.3 IL-1β诱导软骨细胞miRNAs差异表达变化及结果验证miRNA微阵列分析显示,IL-1β处理软骨细胞的24 h及48 h后,有36个miRNAs表达水平发生改变。在表达减少的miRNAs中,miR-27b、miR-31下调最为明显;表达增加的miRNAs中,miR-26a、miR-26b、miR-23、miR-204上调最为明显,见图3。与miRNAs微阵列分析结果一致,miR-27b和miR-31在IL-1β处理24 h及48 h表达逐渐下调。miR-26a、miR-26b、miR-23、miR-204在24 h及48 h表达逐渐上调,见表1。miRNAs微阵列分析及Realtime PCR均表明,IL-1β处理软骨细胞48 h后,miR-27b下调最为明显。
2.4 miR-27b靶定调控MMP-13Targetscan和Pic⁃ Tar分析发现,miR-27b在基因MMP-13 3′-UTR预测到作用靶点,见图4a。软骨细胞转染miR-27b拟似物后MMP-13蛋白表达下调(P<0.05),见图4b。miR-27b拟似物和荧光素酶表达质粒共转染软骨细胞后,荧光素酶活性受到明显抑制;miR-27b拟似物与pGLO-MMP13-3′-UTR-mut共转染后,荧光素酶活性较对照组无明显变化,见图4c。软骨细胞转染miR-27b拮抗剂抑制内源性miR-27b表达后,荧光素酶活性与对照组比较差异无统计学意义,见图4d。
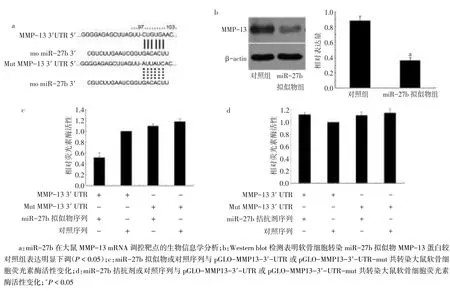
Fig.4miR-27b and MMP-13 present targeted regulation relationship图4 miR-27b靶定调控MMP-13
3 讨论
3.1 miR-27b对OA发展的调控作用本研究显示,正常软骨细胞不表达或表达极微量的MMP-13蛋白,IL-1β处理软骨细胞48 h过程中,MMP-13蛋白表达逐渐增加,miR-27b表达明显下降,经荧光素酶报告基因实验验证miR-27b可以靶定调控软骨细胞MMP13表达,说明miR-27b可能在OA发展过程中起到调控枢纽作用。
3.2 IL-1β、MMP-13与OA过程中软骨破坏密切相关MMPs是一大类具有相似结构的蛋白酶,构成了细胞外基质降解最重要的蛋白水解系统,在组织重建和修复中起重要作用。MMP-13是与OA密切相关的一种胶原酶,主要分解关节原有的Ⅱ型胶原,后者是胶原的主要组成部分,占胶原总量的80%~95%,在关节承受力方面必不可少[9]。Ⅱ型胶原的不断分解可造成软骨慢性进行性破坏,给关节带来不可逆损伤。有研究表明,IL-1β是一种有效的MMP诱导剂,有促进软骨细胞代谢和降解细胞外基质的作用,用抗体中和IL-1β后可以阻止软骨和骨的破坏[10]。IL-1β在OA患者关节液中大量存在,被认为是OA中起关键作用的促炎症性细胞因子[11]。MMP过表达或长时间表达将导致OA的发生,产生MMP的细胞必须采用多重机制保持对MMP的调控[12]。本研究表明,IL-1β刺激大鼠软骨细胞后MMP-13蛋白表达明显增加且呈时间依赖性,IL-1β可能通过转录后调控机制参与了MMP-13蛋白的上调。
3.3 miR-27b靶定调控MMP-13miRNAs是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,通过调控靶基因表达影响细胞生物学行为。单个miRNA分子可以调控数十到数百个基因,内源性miRNA虽然只占人类基因总数的2%,却调控着人类全基因组中30%以上的基因,其作为基因表达和蛋白质翻译过程中的调节分子[13],miRNAs的差异表达可能与OA有关[14]。本研究表明,IL-1β处理软骨细胞的24 h及48 h后,miR-27b下调最为明显。生物信息学分析表明,miR-27b在MMP-13 mRNA 3′-UTR存在潜在作用的靶点。荧光素酶报告基因实验验证MMP-13为miR-27b作用的靶基因。大鼠19号染色体存在2个miR-27基因(Mir27a和Mir27b),成熟的miR-27a和miR-27b在3′-UTR只有1个不同的核苷酸序列。而本研究中大鼠软骨细胞miR-27a的差异表达并未被检测到,由此可以认为与miR-27a不同,miR-27b为IL-1β的应答基因。在IL-1β的刺激下,软骨细胞miR-27b表达明显减少,不能有效靶定下调MMP-13蛋白的表达,从而造成软骨细胞MMP-13的明显上调。
3.4 核因子(NF)-κB可能参与了miR-27b对MMP-13的调控NF-κB属于核转录因子成员,能与多种基因的启动子或增强子上的NF-κB结合位点发生特异性结合启动基因转录。目前的研究显示NF-κB参与对miRNA的表达调控[15]。IL-1β介导的MMP-13蛋白表达需要NF-κB的激活[16],且软骨细胞中NF-κB激活对miR-27b的表达起负性调控作用[17]。本研究显示,IL-1β处理软骨细胞后miR-27b表达明显减少,伴随MMP-13蛋白表达增加,可能与NF-κB的激活有关。
综上所述,IL-1β刺激的软骨细胞miR-27b表达明显下调,对MMP-13靶定调控作用减弱,造成软骨细胞损伤,此过程可能参与了OA的发生、发展。本研究从miRNAs的角度为软骨细胞损伤机制提供了证据,为OA防治提供了新的靶点。
[1]Malemud CJ,Islam N,Haqqi TM.Pathophysiological mechanisms in osteoarthritis lead to novel therapeutic strategies[J].Cells Tissues Organs,2003,174(1-2):34-48.doi:10.1159/000070573.
[2]Chen WG,Yang ZH,Liu QG,et al.Correlation between the severity of osteoarthritis and the serum levels of IL-4 and sIL-4R[J].Med J Chin PLA,2015,40(1):63-65.[陈文革,杨朝晖,刘清高,等.骨关节炎严重程度与血清IL-4和sIL-4R水平的相关性研究[J].解放军医学杂志,2015,40(1):63-65].doi:10.11855/j.issn.0577-7402.2015.01.14.
[3]Wang X,Zhu Y,Tao H,et al.Interaction of ERK1/2 and Smad2/3 signaling pathways in TGF-β1-induced TIMP-3 expression in rat chondrocytes[J].Arch Biochem Biophys,2014,564:229-236.doi:10.1016/j.abb.2014.09.009.
[4]Chen C,Ma C,Zhang Y,et al.Pioglitazone inhibits advanced glyca⁃tion end product-induced TNF-α and MMP-13 expression via the antagonism of NF-κB activation in chondrocytes[J].Pharmacology,2014,94(5-6):265-272.doi:10.1159/000369074.
[5]Sieghart D,Liszt M,Wanivenhaus A,et al.Hydrogen sulphide de⁃creases IL-1β-induced activation of fibroblast-like synoviocytes from patients with osteoarthritis[J].J Cell Mol Med,2015,19(1):187-197.doi:10.1111/jcmm.12405.
[6]Farh KK,Grimson A,Jan C,et al.The widespread impact of mam⁃malian MicroRNAs on mRNA repression and evolution[J].Science,2005,310(5755):1817-1821.doi:10.1126/science.1121158.
[7]Miyaki S,Sato T,Inoue A,et al.MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J].Genes Dev,2010,24(11):1173-1185.doi:10.1101/gad.1915510.
[8]Ando K,Imai S,Isoya E,et al.Effect of dynamic compressive loading and its combination with a growth factor on the chondrocytic phenotype of 3-dimensional scaffold-embedded chondrocytes[J].Acta Orthop,2009,80(6):724-733.doi:10.3109/17453670903413111.
[9]Jansen ID,Hollander AP,Buttle DJ,et al.Type II and VI collagen in nasal and articular cartilage and the effect of IL-1alpha on the distribution of these collagens[J].J Mol Histol,2010,41(1):9-17. doi:10.1007/s10735-010-9257-7.
[10]Joosten LA,Helsen MM,Saxne T,et al.IL-1 alpha beta blockade prevents cartilage and bone destruction in murine type II collageninduced arthritis,whereas TNF-alpha blockade only ameliorates joint inflammation[J].J Immunol,1999,163(9):5049-5055.
[11]Hussein MR,Fathi NA,El-Din AM,et al.Alterations of the CD4(+),CD8(+)T cell subsets,interleukins-1beta,IL-10,IL-17,tu⁃mor necrosis factor-alpha and soluble intercellular adhesion mole⁃cule-1 in rheumatoid arthritis and osteoarthritis:preliminary obser⁃vations[J].Pathol Oncol Res,2008,14(3):321-328.doi:10.1007/ s12253-008-9016-1.
[12]Wang P,Guan PP,Guo C,et al.Fluid shear stress-induced osteoar⁃thritis:roles of cyclooxygenase-2 and its metabolic products in in⁃ducing the expression of proinflammatory cytokines and matrix me⁃talloproteinases[J].FASEB J,2013,27(12):4664-4677.doi:10.1096/ fj.13-234542.
[13]Zheng RL,Jiang YJ,Wang X.Role of microRNAs on therapy resis⁃tance in Non-Hodgkin′s lymphoma[J].Int J Clin Exp Med,2014,7(11):3818-3832.
[14]Jones SW,Watkins G,Le Good N,et al.The identification of differ⁃entially expressed microRNAs in osteoarthritic tissue that modulate the production of TNF-α/MMP-13[J].Ostearthritis Cartilage,2009,17(4):464-472.doi:10.1016/j.joca.2008.09.012.
[15]Zhang X,Liu S,Hu T,et al.Up-regulated microRNA-143 tran⁃scribed by nuclear factor kappa B enhances hepatocarcinoma metas⁃tasis by repressing fibronectin expression[J].Hepatology,2009,50(2):490-499.doi:10.1002/hep.23008.
[16]Mengshol JA,Vincenti MP,Coon CI,et al.Interleukin-1 induction of collagenase 3(matrix metalloproteinase 13)gene expression in chondrocytes requires p38,c-Jun N-terminal kinase,and nuclear factor kappaB:differential regulation of collagenase 1 and collage⁃nase 3[J].Arthritis Rheum,2000,43(4):801-811.doi:10.1002/ 1529-0131(200004)43:4<801.
[17]Akhtar N,Rasheed Z,Ramamurthy S,et al.MicroRNA-27b regu⁃lates the expression of matrix metalloproteinase 13 in human osteo⁃arthritis chondrocytes[J].Arthritis Rheum,2010,62(5):1361-1371.doi:10.1002/art.27329.
(2015-01-08收稿2015-03-06修回)
(本文编辑李鹏)
Effects of interleukin-1β on MMP-13 expression in rat chondrocytes and its regulation of miR-27b
WANG Xin1,2,QIN Yu1
1 Tianjin Medical University,Tianjin 300070,China;2 Department of Orthopedics,Tianjin Harbor Hospital
ObjectiveTo observe the effect of interleukin-1β(IL-1β)on expression of Matrix Metalloproteinases 13(MMP-13)in rat chondrocytes and its regulation of miR-27b.MethodsChondrocytes were extracted from 7 Wistar male rats.Expression of MMP-13 were examined by Western blot at 0 h,24 h,48 h after IL-1β stimulation.Differential miRNAs expression profiles were examined by miRNAs microarray.The most obviously down-regulated miRNAs were confirmed by quantitative Real-time PCR.Targeted regulation relationship between miR-27b and MMP-13 was set up by Luciferase re⁃porter gene experiments.ResultsExpression of MMP-13 in rat chondrocytes was increased at a timely dependent manner upon IL-1β stimulation(P<0.05);Microarray revealed 36 miRNAs whose expression changed,among which 6(miR-27b,miR-31,miR-26a,miR-26b,miR-23,miR-204)were especially obvious.Real-time PCR confirmed that miR-27b was the one whose expression level were most down-regulated.Transient co-transfection of miR-27b mimics with luciferase expres⁃sion plasmids resulted in significant repression of luciferase activity in rat chondrocytes(P<0.05).ConclusionIL-1β stimulation result in down-regulation of miR-27b and up-regulation of MMP-13 expression.MiR-27b and MMP-13 show targeted regulation relationship.
chondrocytes;matrix metalloproteinase 13;microRNAs;interleukin-1beta;microarray analysis;miR-27b
R349.5
A
10.11958/j.issn.0253-9896.2015.08.011
1天津医科大学(邮编300070);2天津港口医院骨科
王欣(1979),男,大学本科,主治医师,主要从事骨科创伤研究
