盐酸苯达莫司汀治疗利妥昔单抗耐药的B细胞惰性淋巴瘤多中心Ⅲ期临床研究
2015-11-16宋腾张会来王华庆李静敏克晓燕曹军宁黄慧强张伟京朱军范云冯继锋
宋腾张会来王华庆李静敏克晓燕曹军宁黄慧强张伟京朱军范云冯继锋
·临床研究与应用·
盐酸苯达莫司汀治疗利妥昔单抗耐药的B细胞惰性淋巴瘤多中心Ⅲ期临床研究
宋腾①张会来①王华庆②李静敏①克晓燕③曹军宁④黄慧强⑤张伟京⑥朱军⑦范云⑧冯继锋⑨
目的:评价注射用盐酸苯达莫司汀单药治疗利妥昔单抗治疗失败的B细胞惰性淋巴瘤的有效性和安全性。方法:2010年4月至2013年4月,全国8个研究中心入组100例利妥昔单抗治疗失败的B细胞惰性淋巴瘤患者,接受苯达莫司汀单药治疗(120 mg/m2,d1、2,每21天1个周期,最多8个周期)。主要终点指标为总反应率(ORR),次要终点指标包括疾病控制率(DCR)、无进展生存(PFS)、总生存(OS)及安全性评估。结果:全组100例患者,中位年龄为56(28~74)岁,共计化疗447个周期,中位4(1~8)个周期。93例患者完成至少2个周期治疗,可评价疗效。15例(16.1%)获得完全缓解(CR),52例(55.9%)获得部分缓解(PR),22例(23.7%)稳定(SD),4例(4.3%)进展(PD),ORR为72%,DCR为95.7%。中位随访时间26.6(2~48.4)个月,59例(63.4%)出现疾病进展,中位PFS为8.53个月(95%CI:6.518~10.542),1年PFS率(40.6±5.3)%。48例(48%)出现3/4级不良事件,3/4级白细胞减少、中性粒细胞减少、血小板减少发生率分别为26%、24%和11%。结论:苯达莫司汀治疗利妥昔单抗耐药的B细胞惰性淋巴瘤客观缓解率较高,骨髓抑制为最常见不良反应,系二线治疗惰性B细胞淋巴瘤的新选择。
盐酸苯达莫司汀 利妥昔单抗耐药 非霍奇金淋巴瘤 疗效 安全性
惰性非霍奇金淋巴瘤(indolent non-Hodgkin's lymphoma,iNHL)是一类生长缓慢的淋巴系统肿瘤,主要包括慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、滤泡性淋巴瘤(FL)、边缘区淋巴瘤(MZL)等[1]。其病程特点为周期性反复,部分可转变为侵袭性淋巴瘤[2-3]。近些年来,抗CD20单克隆抗体—利妥昔单抗(rituximab,美罗华)的使用,彻底改变了惰性B细胞淋巴瘤的治疗模式,美罗华单药或联合化疗不仅能提高患者近期缓解率,而且能显著延长远期生存[4-5]。但仍有部分患者对美罗华治疗无反应或有效后进展,对于此类患者,目前临床上尚缺乏有效的治疗方案。
苯达莫司汀(bendamustine)是一种双功能基烷化剂,主要通过烷化作用导致DNA单链及双链交联,干扰DNA的功能与合成,发挥抗肿瘤作用。2008年美国食品和药物管理局(FDA)批准苯达莫司汀用于慢性淋巴细胞白血病及惰性B细胞非霍奇金淋巴瘤的治疗[6]。本临床研究通过单组、多中心研究来评估苯达莫司汀单药治疗利妥昔单抗耐药的B细胞惰性非霍奇金淋巴瘤(B-iNHL)的疗效和安全性。
1 材料与方法
1.1 入组标准
组织学证实为B细胞惰性淋巴瘤,除外CLL/SLL患者;利妥昔单抗治疗后疾病进展或接受利妥昔单抗治疗未缓解的患者;年龄18~75周岁;ECOG评分≤2分;预计生存期3个月以上;至少有1个可测量病灶(最长径>1.5 cm,短径>1.0 cm);入组前2周内骨髓造血功能正常,包括:血红蛋白(Hb)≥8.0 g/dL,中性粒细胞绝对计数(ANC)≥1.5×109/L,血小板计数(PLT)≥80×109/L[与淋巴瘤侵袭有关的异常可接受范围:白细胞计数(WBC)≥3.5×109/L,PLT≥50×109/L];肝肾功能基本正常;女性患者未妊娠、不哺乳,用药期间及12个月内有效避孕,男性用药期间及12个月内其配偶不怀孕;愿意参加本项临床试验并签署知情同意书。
1.2 排除标准
转化为侵袭性淋巴瘤的患者;3b级滤泡性淋巴瘤;有中枢神经系统(CNS)疾病病史;同时合并他肿瘤或有肿瘤既往史的患者,不包括非黑色素瘤的皮肤癌或宫颈原位癌;治疗前4周内使用其他抗肿瘤治疗的患者;治疗前4周内有规律服用皮质类固醇的患者,除非剂量相当于≤20 mg/d强的松;治疗前4周内接受大手术的患者。
1.3 方法
1.3.1 治疗方案入组患者接受苯达莫司汀(山东蓝金生物工程有限公司)单药治疗,120 mg/m2,d1、2,21天为1个周期,给药时间不少于60 min,至少2个周期后评价疗效。若治疗有效可最多接受8个周期治疗,直至疾病进展或不良反应无法耐受。出现4级血液学毒性或临床意义高于2级(包含2级)的非血液学毒性时,应延缓用药;当非血液学毒性降低至小于1级(包含1级)和/或血细胞计数改善(ANC≥1× 109/L,PLT≥75×109/L),减量恢复使用(4级血液学毒性或3级以上非血液学毒性,减量至90 mg/m2;若再发生,则减量至60 mg/m2)。
1.3.2 疗效及安全性分析每2个周期后行影像学检查,按WHO标准[7]评价疗效,分为完全缓解、部分缓解、疾病稳定和疾病进展。主要有效性指标为治疗2、4、6、8周期末的客观缓解率(ORR,CR+PR),次要有效性指标为疾病控制率(DCR,CR+PR+SD),以及无进展生存(PFS)、总生存(OS)。PFS定义为首次给药至疾病进展、复发或任何原因引起死亡的时间。中断治疗、改变治疗方案或缺失进展记录的,在末次病情评估后截止。OS定义为首次给药至因任何原因死亡或末次随访的时间。治疗结束后每3个月随访1次,并行相应检查。安全性评价包括实验室异常和不良事件,根据常见的不良反应事件评价标准(NCI-CTC3.0)进行分级。根据意向性分析原则,主要分析人群包括接受过治疗、且具有治疗后评价数据的所有入组患者。安全性分析人群包括至少接受过一次治疗的和至少存在一次安全性评价的入组患者。
1.4 统计学处理
采用SAS9.2软件统计分析,用极限估计法(Kaplan-Meier法)进行生存分析。P<0.05为差异具有统计学意义。
2 结果
2.1 患者临床资料
2010年4月至2013年4月,全国8个淋巴瘤诊疗中心共入组100例患者。患者中位年龄为56(28~74)岁,其中男55例。Ann Arbor分期:Ⅰ期3例(3.1%),Ⅱ期14例(14.4%),Ⅲ期37例(38.1%),Ⅳ期43例(44.3%),缺失3例。伴有B症状者22例(22%),骨髓受累者7例(7%)。MZL共21例(21%),按亚型分类,MALT淋巴瘤13例,脾边缘区淋巴瘤3例,淋巴结边缘区淋巴瘤4例,缺失1例;FL共70例(70%),其中滤泡Ⅰ级24例,滤泡Ⅱ级35例,滤泡Ⅲ级10例;其他类型9例(9%)。患者中位病程22(11.0~48.5)个月,既往中位治疗次数3(1~8)次,经3次以上治疗的有33例(33%)。10例使用利妥昔单抗单药治疗,其他治疗模式见表1。
2.2 近期疗效
所有患者共计化疗447个周期,中位4(1~8)个周期。不及4个周期的占32%,主要原因包括无法耐受的不良反应(16例)、疾病进展(4例)和撤回知情同意(12例),仅8例患者治疗达8个周期。93例患者完成了至少2个周期治疗,可评价疗效,其中15例(16.1%)达到CR,52例(55.9%)PR,22例(23.7%)稳定,4例(4.3%)进展,ORR为72.04%(95%CI:62.92~81.16),DCR为95.70%(95%CI:91.58~99.82)。统计学分析显示,患者年龄、性别、B症状、体质状态、LDH水平、病理类型及给药剂量与近期疗效无关(P>0.05)。晚期患者ORR高于早期患者(72.5%vs. 41.2%),差别有统计学意义(P<0.05)。苯达莫斯汀使用6个周期的ORR高于第2、4个周期(81.1%vs. 58.0%vs.78.5%),这说明随着治疗周期延长,疗效呈递增趋势。FL 70例,其中CR 12例,PR 38例,SD 13例,PD 4例,ORR为71.43%,较高于MZL(ORR 52.4%),但差异无统计学意义(P>0.05)。见表2。

表1 患者既往抗肿瘤治疗情况Table 1Previous therapies of patients

表2 入组患者临床特征与疗效分析n(%)Table 2Analysis of clinical characteristics and efficacy of the patients

表2 入组患者临床特征与疗效分析(续表2)n(%)Table 2Analysis of clinical characteristics and efficacy of the patients(continued)
2.3 生存情况
随访至2015年1月,中位随访时间26.6(2~48.4)个月,59例(63.44%)患者出现疾病进展,中位PFS为8.53(95%CI:6.518,10.542)个月,1年PFS率(40.6±5.3)%,仅6例患者因病情进展死亡,由于随访时间较短,未获得总生存结果(图1)。

图1 苯达莫斯汀单药治疗利妥昔单抗耐药B-iNHL患者Kaplan-Meier生存曲线Figure 1Kaplan-Meier curves for progression-free survival in patients who received bendamustine
2.4 安全性评估
治疗期间,97例患者出现了不良反应,主要为骨髓抑制、胃肠道反应、皮疹、乏力和感染等。胃肠反应发生率42%,以恶心、呕吐为主。皮疹发生率18%,Ⅲ级皮疹3例。感染12%,包括2例肺感染、8例上呼吸感染、1例牙周感染、1例尿路感染和2例皮肤带状疱疹感染,多为轻度。3/4级不良反应发生率为48%,以血液系统多见,主要为白细胞减少(26%)、中性粒细胞减少(24%)、血小板减少(11%),经对症治疗多可好转;非血液系统少见,主要有恶心、呕吐(3%),皮疹(3%),乏力(2%)等。8例患者(8%)出现严重不良事件,包括5例重度骨髓抑制,1例肺感染,1例上消化道出血和1例药物性肺损伤,除上消化道出血和药物性肺损伤与试验药物无关外,其余均为严重不良反应(表3)。
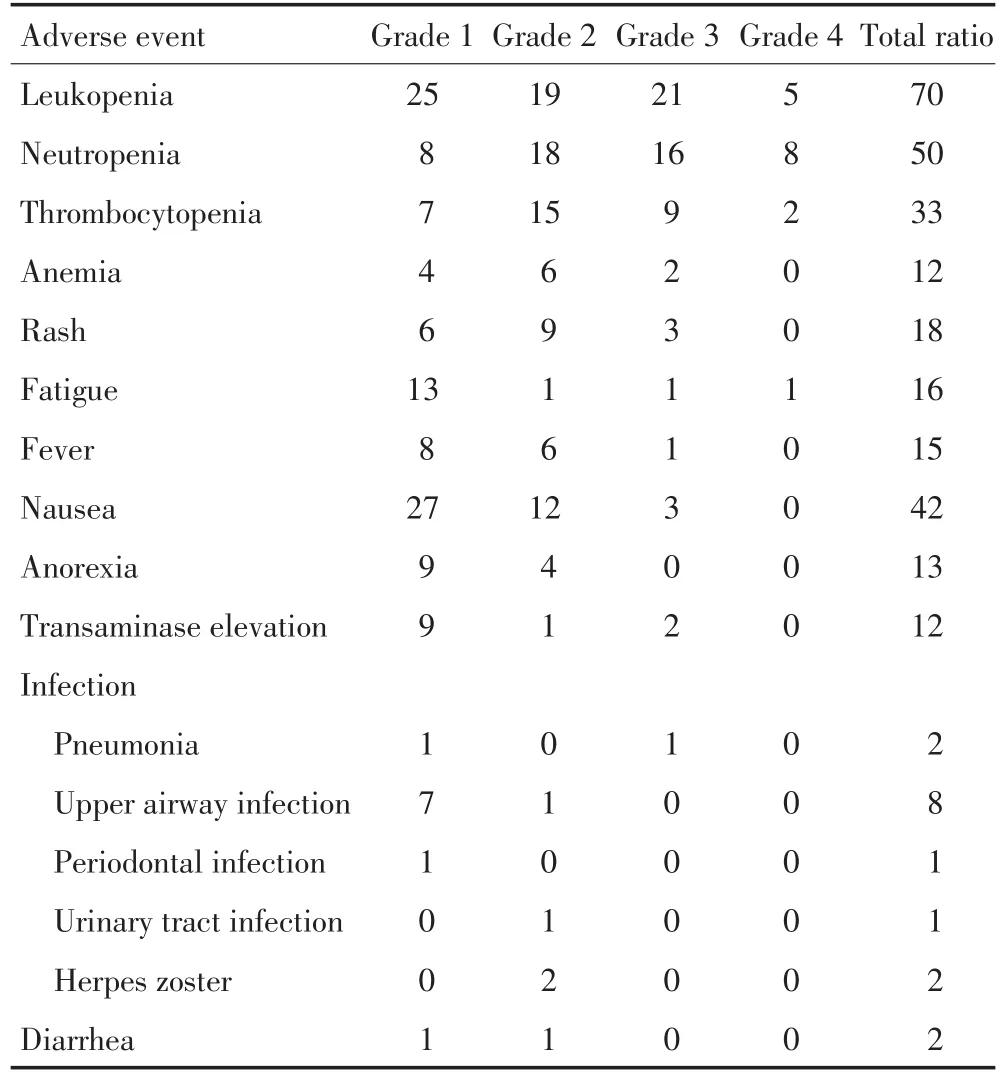
表3 入组患者不良反应分析例Table 3Adverse events by severity grade
3 讨论
苯达莫司汀是一种含有氮芥基团和苯并咪唑环的双功能氮芥衍生物,兼具烷化剂和抗代谢的双重作用机制,特殊的结构使其有别于普通烷化剂,可通过干扰DNA合成、激活DNA损伤应激反应、诱导细胞凋亡、诱导细胞有丝分裂紊乱等机制发挥抗肿瘤作用[8-10]。临床研究表明,其单独或联合用药治疗恶性淋巴瘤、慢性淋巴细胞白血病、多发性骨髓瘤和乳腺癌等实体肿瘤,疗效确切,不良反应少,安全性高[11-13]。
2010年,Cheson等[14]报道了苯达莫司汀单药治疗利妥昔单抗难治的B-iNHL的疗效,该研究入组161例患者,中位年龄61(31~84)岁,病理类型主要为FL(68%),CLL/SLL(20%)和MZL(11%)。入组患者接受苯达莫司汀单药,连续6~8个周期的治疗,总有效率76%,其中CR/CRu 23%,中位随访25.3个月,中位PFS 9.7个月,中位缓解时间(DOR)达10个月,疗效显著。此外,对于烷化剂耐药的患者,苯达莫司汀有效率为59%,也有一定克服耐药的作用。随后,Kahl等[15]也获得了相似的结果,在100例利妥昔单抗耐药的B-iNHL患者中,该药总有效率为75%,中位PFS 9.3个月,中位DCR 9.2个月。FL患者ORR为74%(CR/CRu 20%,PR 54%),SLL为71%,MZL为81%。这说明苯达莫司汀对不同病理亚型的B-iNHL疗效有所差异,但无统计学差异。国内的一项单中心研究入组25例患者,苯达莫司汀总有效率为76%,FL患者17例,ORR为82.3%,疗效较高,至随访结束,中位PFS为9个月[16]。本研究开展的此项全国多中心、单臂研究入组了100例B-iNHL患者,共计化疗447个周期,中位4个周期。93例患者可评价疗效,ORR为72.04%,DCR为95.70%,其中CR 15例,PR 52例,SD 22例,PD 4例,FL患者的疗效较高于MZL(ORR:71.43%vs.52.4%),但差异无统计学意义。除疾病分期外,统计分析显示患者临床特征与近期疗效无关。中位随访时间26.6(2~48.4)个月,63.44%患者出现疾病进展,中位PFS为8.53个月,1年PFS率(40.6±5.3)%,疗效尚可。本组患者疾病缓解持续时间稍短,考虑与治疗周期数较少,患者依从性较差,疾病晚期及既往治疗次数较多等有关。
安全性方面,治疗期间药物不良反应较多,但均为预期不良反应。3/4级不良反应以血液系统多见,白细胞减少26%、粒细胞减少24%、血小板减少11%。Ujjani等[17]的研究报道,3/4级中性粒细胞减少61%、血小板减少25%、贫血10%,3/4级感染发生率为21%,这表明感染发生率的升高与粒细胞减少发生率升高有关。因此,在使用本药时应定期复查血象,体质虚弱者可给于预防性升血治疗。本研究随访时间较短,入组患者并未发生继发肿瘤。国外一些研究中部分患者出现了继发肿瘤,主要为骨髓增生异常综合征、急性髓系白血病及部分实体瘤[14-15]。因此,苯达莫司汀的远期毒性仍需长时间随访加以明确。
总之,本研究显示苯达莫司汀单药治疗利妥昔单抗耐药的B-iNHL的客观缓解率、疾病控制率较高,不良反应多可耐受,但缓解时间稍短,与国外一些大型研究结果相似。最近一些研究发现苯达莫司汀联合方案可延长疾病缓解时间。Robinson等[18]采用BR方案(苯达莫司汀联合利妥昔单抗)治疗复发难治B-iNHL,ORR为92%,中位PFS达23个月,且耐受性良好,3/4级白细胞减少约36%,血小板减少约9%。一项日本的研究也采用BR方案获得了更高的疗效,ORR为94%,CR为71%(其中FL,ORR为95%,CR为80%),中位PFS为17.95个月,3/4级白细胞减少42%[19]。此外,多项研究报道Bcl-2抑制剂、PI3K抑制剂CAL-101、新型抗CD20抗体如GA101和ofatumumab、来那度胺等联合苯达莫司汀在体外均有较好的协同作用。因此,无论单药或是联合新型靶向药物,苯达莫司汀可成为二线治疗惰性B细胞淋巴瘤新的选择。
[1]Campo E,Swerdlow SH,Harris NL,et al.The 2008 WHO classification of lymphoid neoplasms and beyond:evolving concepts and practical applications[J].Blood,2011,117(19):5019-5032.
[2]Lunning MA,Vose JM.Management of indolent lymphoma:where are we now and where are we going[J].Blood Rev,2012,26(6):279-288.
[3]Montoto S,Fitzgibbon J.Transformation of indolent B-cell lymphomas[J].J Clin Oncol,2011,29(14):1827-1834.
[4]Marcus R,Imrie K,Solal-Celigny P,et al.Phase III study of RCVP compared with cyclophosphamide,vincristine,and prednisone alone in patients with previously untreated advanced follicular lymphoma[J].J Clin Oncol,2008,26(28):4579-4586.
[5]Sousou T,Friedberg J.Rituximab in indolent lymphomas[J]. Semin Hematol,2010,47(2):133-142.
[6]Hoy SM.Bendamustine:a review of its use in the management of chronic lymphocytic leukaemia,rituximab-refractory indolent non-Hodgkin's lymphoma and multiple myeloma[J].Drugs,2012,72(14):1929-1950.
[7]Cheson BD,Horning SJ,Coiffier B,et al.Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas.NCI Sponsored International Working Group[J].J Clin Oncol,1999,17(4):1244-1253.
[8]Leoni LM,Bailey B,Reifert J,et al.Bendamustine(Treanda)displays a distinct pattern of cytotoxicity and unique mechanistic features compared with other alkylating agents[J].Clin Cancer Res,2008,14(1):309-317.
[9]Beeharry N,Rattner JB,Bellacosa A,et al.Dose dependent effects on cell cycle checkpoints and DNA repair by bendamustine[J]. PLoS One,2012,7(6):e40342.
[10]Leoni LM,Hartley JA.Mechanism of action:the unique pattern of bendamustine-induced cytotoxicity[J].Semin Hematol,2011,48(1):S12-S23.
[11]Gil L,Kazmierczak M,Kroll-Balcerzak R,et al.Bendamustinebased therapy as first-line treatment for non-Hodgkin lymphoma[J].Med Oncol,2014,31(5):944-951.
[12]Knauf WU,Lissitchkov T,Aldaoud A,et al.Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia:updated results of a randomized phaseⅢtrial[J].Br J Haematol,2012,159(1):67-77.
[13]Wang WW.Clinical trials progress of bendamustine in the treatment of cancer[J].Chin J Biomed Eng,2013,19(5):420-423.[王文雯.苯达莫司汀治疗肿瘤的临床试验研究进展[J].中华生物医学工程杂志,2013,19(5):420-423.]
[14]Cheson BD,Friedberg JW,Kahl BS,et al.Bendamustine produc-es durable responses with an acceptable safety profile in patients with rituximab-refractory indolent non-Hodgkin lymphoma[J]. Clin Lymphoma Myeloma Leuk,2010,10(6):452-457.
[15]Kahl BS,Bartlett NL,Leonard JP,et al.Bendamustine is effective therapy in patients with rituximab-refractory,indolent B-cell non-Hodgkin lymphoma:results from a Multicenter Study[J]. Cancer,2010,116(1):106-114.
[16]Min Q,Wang HQ,Qian ZZ,et al.Bendamustine hydrochloride in patients with rituximab-refractory indolent B-cell non-Hodgkin's lymphoma[J].Chin J Clin Oncol,2014,41(19):1239-1243.[闵琦,王华庆,钱正子,等.注射用盐酸苯达莫司汀单药治疗利妥昔单抗耐药的B细胞惰性淋巴瘤[J].中国肿瘤临床,2014,41(19):1239-1243.]
[17]Ujjani C,Cheson B.Efficacy of bendamustine in rituximab-refractory indolent B-cell non-Hodgkin lymphoma:review of a pivotal trial[J].Future Oncol,2011,7(1):9-14.
[18]Robinson KS,Williams ME,van der Jagt RH,et al.Phase II multicenter study of bendamustine plus rituximab in patients with relapsed indolent B-cell and mantle cell non-Hodgkin's lymphoma[J].J Clin Oncol,2008,26(27):4473-4479.
[19]Matsumoto K,Takayama N,Aisa Y,et al.A phaseⅡstudy of bendamustine plus rituximab in Japanese patients with relapsed or refractory indolent B-cell non-Hodgkin lymphoma and mantle cell lymphoma previously treated with rituximab:BRB study[J].Int J Hematol,2015,101(6):554-562.
(2015-09-02收稿)
(2015-10-13修回)
(编辑:郑莉)
Efficacy of bendamustine hydrochloride in patients with rituximabrefractory indolent B-cell non-Hodgkin's lymphoma:results from a phaseⅢmulticenter study
Teng SONG1,Huilai ZHANG1,Huaqing WANG2,Jingmin LI1,Xiaoyan KE3,Junning CAO4,Huiqiang HUANG5,Weijing ZHANG6,Jun ZHU7,Yun FAN8,Jifeng FENG9
1Department of Lymphoma,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China;2Department of Oncology,Tianjin Union Medicine Center,Tianjin 300000,China;3Department of Hematology,Peking University Third Hospital,Beijing 100191,China;4Department of Medical Oncology,Cancer Hospital Affiliated to Fudan University,Shanghai 200032,China;5Department of On cology,Sun Yat-sen University Cancer Center,Guangzhou 510060,China;6Department of Lymphoma and Tumor of Head and Neck,Affiliated Hospital,Academy of Military Medical Sciences,Beijing 100191,China;7Department of Lymphoma,Peking Uniersity Cancer Hospital,Beijing 100142,China;8Department of Oncology,Zhejiang Cancer Hospital,Hangzhou 310022,China;9Department of Oncology,Jiangsu Cancer Hospital,Nanjing 210000,China
Huaqing WANG;E-mail:Huaqingw@163.com
Objective:To evaluate the efficacy and toxicity of single-agent bendamustine in patients with indolent B-cell non-Hodgkin's lymphoma(NHL)refractory to rituximab.Methods:Between April 2010 and April 2013,100 patients with rituximab-refractory indolent B-cell NHL from 8 institutions were enrolled.Bendamustine was administered at 120 mg/m2on days 1 and 2 every 21 days for 6-8 cycles.The primary endpoint was the overall response rate(ORR).The secondary endpoints included disease control rate(DCR),progression-free survival(PFS),overall survival(OS),and safety.Results:One hundred patients with a median age of 56(ranging from 28 to 74)years were recruited in this clinical study.The total number of chemotherapy was 447 cycles,and the median number was 4 cycles.Ninety-three patients could be evaluated for efficacy.Fifteen patients(16.1%)had complete remission(CR),52(55.9%)had partial remission(PR),22(23.7%)had stable disease(SD),and 4(4.3%)had progression disease(PD).The ORR and DCR were 72%and 95.7%,respectively.After a median follow-up of 26.6 months(ranging from 2 to 48.4 months),59 patients(63.4%)had PD.The median PFS was 8.53(95%CI:6.518-10.542)months,and PFS rate for 1 year was(40.6±5.3)%.Forty-eight patients(48%)had 3/ 4 grade adverse events,including leucopenia(26%),neutropenia(24%),and anemia(11%).Conclusion:Single-agent bendamustine produced a high rate of objective responses in patients with rituximab-refractory indolent B-cell NHL and could be one of the new options for second-line treatment of these patients.The most common adverse event is hematologic toxicity.
bendamustine hydrochloride,rituximab-refractory,non-Hodgkin's lymphoma,efficacy,safety

10.3969/j.issn.1000-8179.2015.20.978
①天津医科大学肿瘤医院淋巴瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060);②天津市人民医院肿瘤诊治中心;③北京大学第三医院血液科;④复旦大学附属肿瘤医院肿瘤内科;⑤中山大学肿瘤防治中心,中山大学肿瘤防治中心肿瘤内科;⑥军事医学科学院附属医院淋巴头颈肿瘤科;⑦北京大学肿瘤医院淋巴瘤科;⑧浙江省肿瘤医院肿瘤内科;⑨江苏省肿瘤医院肿瘤内科
王华庆Huaqingw@163.com
宋腾专业方向为肿瘤内科治疗及恶性淋巴瘤的诊疗与基础研究。
E-mail:songteng2013@163.com
