城市废水暴露致食蚊鱼形态雌/雄性化的生物学效应
2015-11-14谢勇平方展强
谢勇平,方展强
(华南师范大学 生命科学学院/广东省高等学校生态与环境科学重点实验室,广东 广州 510631)
随着我国经济的不断发展、现代工业与农业生产的不断进步,我国江河湖泊等地表水的污染日趋突 出,导致污染程度严重,不仅影响城市生态环境,灌溉后也影响农田生态和作物生产。有关废水监测及 治理方法也越来越成为人们关注的焦点。废水中含有大量有毒有害的污染物,目前国家检测废水的排放 标准主要为色度、浊度、化学需氧量(COD)、pH等理化指标,缺少对城市工业废水与城市生活污水中污 染物的毒性指标等进行生物监测,而理化指标只能反映污染物的瞬时浓度,无法反映污染物作用于环境的综合毒性效应和长期效应[1]。为解决这些问题,近 10年来,国内外已广泛运用一些小型鱼类作为指示 生物进行生物监测。如使用斑马鱼(Danio rerio)研究城市污水对其鳃和肝脏组织的毒性作用、对胚胎 和仔鱼的发育毒性影响等[2-6]; 也研究了生活污水对稀有鮈鲫(Gobiocypris rarus)的毒性效应等[7],但这些研究主要以采集生活污水进行室内暴露为主,原因是斑马鱼或稀有鮈鲫都不能在城市周边受污染的溪 流或河涌中存活,而 不能直接投放到野外受污染的水域中进行生物监测的研究。食 蚊鱼(Gambusia affinis)是一种原产北美洲的热带性卵胎生小鱼[8],其入侵性非常强,因体形小、食性杂、繁殖周期短、产仔量 大,已广泛分布于国内各地水域,尤其受污染的城市河涌中也可以生存,因此探讨利用食蚊鱼作为指示 生物,开发其在器官、组织、细胞及基因各级水平作为生物标志物监测城市水环境中可能存在的环境激 素类物质污染的研究具有重要的学术意义和实际应用价值。
近年已经陆续报道关于不同种类的环境内分泌干扰物室内暴露对食蚊鱼的毒性影响及形态性逆转的生物学效应等方面的研究[9-16]结 果,并开展了野外观察实验,发现生存在受城市污水污染的广东东莞寒 溪河的雌性食蚊鱼出现形态雄性化现象,而雄性食蚊鱼则出现形态雌性化趋势[11,17]。由于野外水环境复 杂多变,而且能引起食蚊鱼形态雄性化和雌性化的原因也是多种多样的,例如环境温度的突变[18],溶解 氧改变[19],种群密度变化[20],以及与其他鱼种之间的生存竞争等因素,都可能造成所观察到的性别比例 变化和形态性逆转现象。所以要正确评价与证实东莞寒溪河水中污染物造成食蚊鱼的雌性化和雄性化变 异,在野外实验的基础上,还需要进一步开展相关的室内模拟暴露的验证实验。因此,本课题拟在实验 室条件下控制统一合理的食物、种群密度、温度、溶解氧、pH等条件,排除可能引起性别比例失调和形 态性逆转的因素,研究城市废水室内暴露对食蚊鱼目标基因表达及性形态变异的影响,是否与野外实验 观察的结果相一致,其目的在于探讨利用食蚊鱼出现的性形态逆转及目标基因作为生物标志物监测环境 内分泌干扰物的可行性。
1 材料与方法
1.1 实验材料
1.1.1 仪器与试剂低温高速离心机(Sigma,德国),Nanodrap-1000 型分光光度计(Thermo Fisher Scientific,美国),PCR 仪(Bio-rad,美国),7500 Quantitative Realtime-PCR 仪(ABI,美国),水平 电泳仪(北京六一)。RNAisoPlus(TAKARA,Dalian,China),DNase(RQ1 RNase-Free DNase,Promega,Madison,WI,USA),TAKARA First Strand cDNA Synthesis Kit(TAKARA,Dalian,China),SYBRPremix Ex TaqKit(TAKARA,Dalian,China)。其他生化试剂均为符合实验规格要求国产试剂。
1.1.2 实验鱼实验所用的食蚊鱼(G.affinis)均购买自广州市芳村区花地湾花鸟鱼虫市场。挑选大小 一致、形态正常的雌、雄性食蚊鱼,在实验室水族缸中清水驯养1个月以上,每天死亡率低于0.1%时适 合进行暴露实验。
1.1.3 实验用废水暴露实验用废水均采集自东莞市樟村污水处理厂出水口。出水污水用25 L塑料桶盛 装,采集后置于4℃条件下运回。在实验室大冰箱中冷冻处理,以防水中微生物降解化合物,换水之前 先将结冰的水融化。整个试验过程中用污水处理厂出水原液800 L左右。
1.2 实验方法
1.2.1 室内模拟实验分组与暴露方法暴露实验设置空白组和实验组,空白对照组(C0)采用实验室去 氯自来水,实验组(C1、C2、C3、和C4)设置含10%、40%、60%和80%樟村污水处理厂出水原液的4个 暴露组。不同浓度废水的配制方法以原废水为100%计算,用实验室经曝气的自来水按体积比例相应稀释 成所需要的浓度。同时设置强雄激素组(CMT,甲基睾酮)作为阳性对照。每组设置3个鱼缸重复实验。鱼缸大小为30cm×40cm×45cm,暴露时控制体积为30 L。实验开始时每个缸加入雌鱼20条、雄鱼20 条。同时设置平行组。
1.2.2 实验条件控制严格控制实验条件,实 验期间利用室内空调控制水温为25°C左右,用充气机供氧,通过调节充气量以保证不同浓度废水中的溶解氧一致,溶解氧大于4mg/L,pH在6~8之间。每日早晨、中午、晚上各喂食1次,食料为商业购买的红虫。实验期间用Thermo多道水质监测仪(Thermo Orion,520M-01,Guangzhou,China)监测水质,隔3d换一次水,每次换总体积的1/2,若水质出现异常波动,则 立即换水。
1.2.3 形态学数据采集暴露期间进行雌鱼臀鳍形态学数据采集,先将食蚊鱼冰浴麻醉,拍照之后将食 蚊鱼放回鱼缸继续暴露。
(1)骨骼处理。将实验鱼处死后拍照,再用1%的KOH处理3d,隔天换液,然后仔细地剥去鱼皮及 肉质部分使其只剩下骨骼,用1%的茜素红S染色20min左右,取出清理好骨骼标本,并在莱卡体式显微 镜下拍照[17]。
(2)骨骼形态参数计算。骨骼照片采用图像处理软件“Adobe Photoshop CS4”中的“距离测量工具” 进行相关指标的测定。所测量的指标包括第14/15/16椎肋骨总长(14L/15L/16L)、第14/15/16椎肋骨的投 影长度(14P/15P/16P)、第14/15/16椎肋骨尾部尖端到脊柱的高度(14D/15D/16D)。根据测量的指标计 算P:D的比值(14P:14D / 15P:15D / 16P:16D)。一些研究已经证明,L/P/D值的大小与鱼相应的体长成显 著的正相关关系,所 以在数据处理判定不同采样点样本指标的显著水平时,采 用协方差分析(CO-ANOVA)对数据进行统计分析.[21]。测量和处理的方法如图1所示。
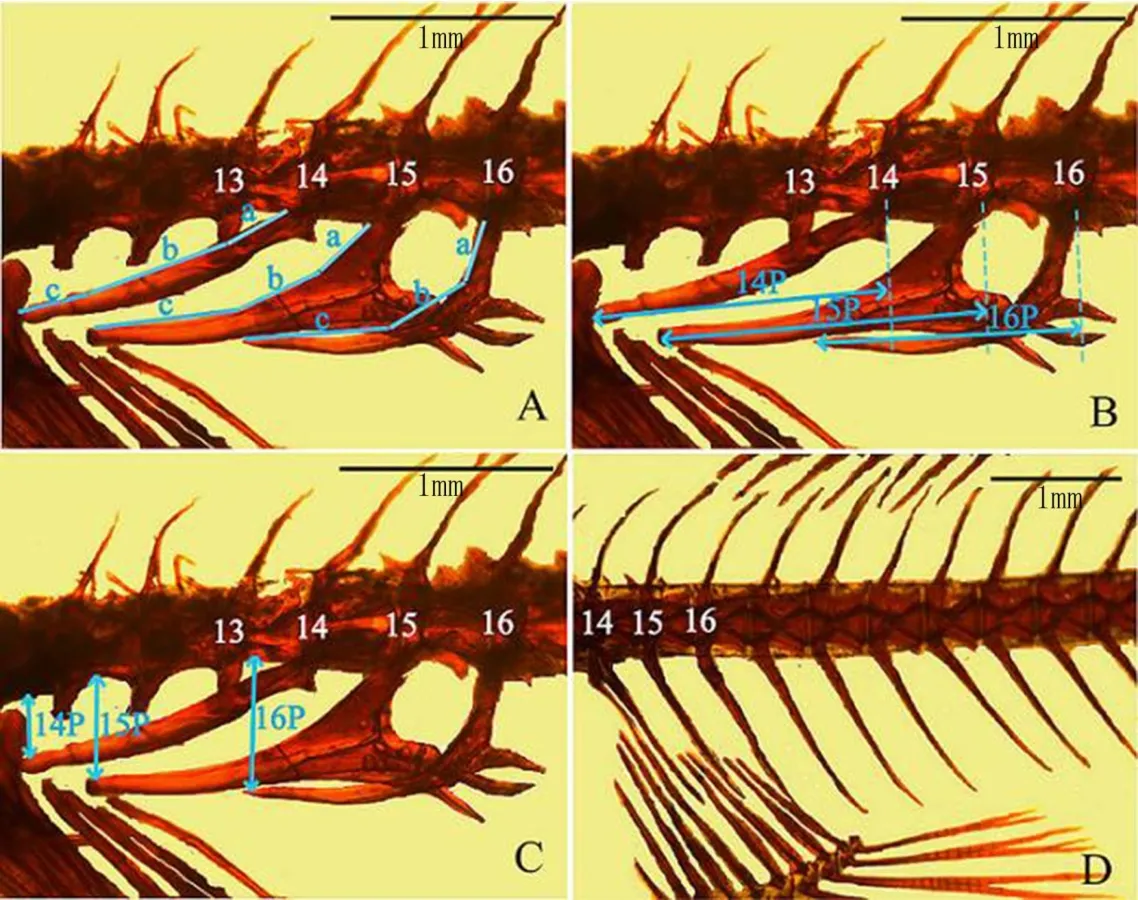
图1 骨骼形态各个参数的测量和计算方法示意图[17]
(3)雌鱼鳍条数据采集的方法 将鱼冰浴麻醉,在莱卡体式显微镜下拍照,用图像处理软件AdobePhotoshop CS4中的距离测量工具进行相关指标的测定(图2)。雌鱼的臀鳍总共有10根鳍条,从左到右 依次为第1~10鳍条,在测量鳍条长度时,为了精细统计,将鳍条长度分为(a+b+c)3段。每一根鳍条的分节数也在图片作处理,以方便肉眼计数统计。
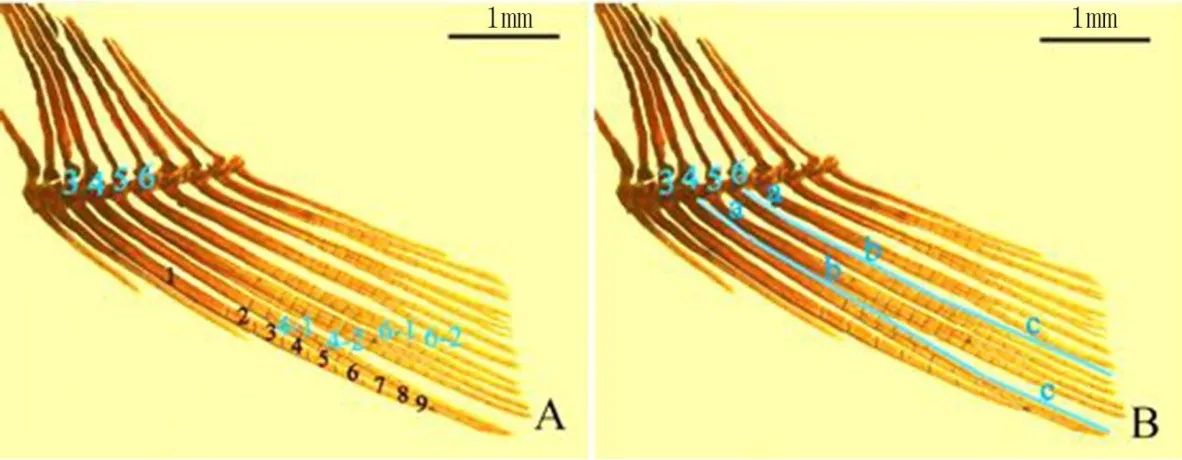
图2 雌鱼雄性化特征之臀鳍延长程度的测量与计算方法示意图[17]
(4)数据处理 所有数据用SPSS16.0 处理,检验显著差异度设置为P<0.05。由于在预实验中发现 参数(雌鱼臀鳍第 3 鳍条分节数,14~16P,14~16D,14~16L)与鱼体长有高度相关性。因此这些参数将结合与之高度相关的体长,利用协方差分析方法(CO-ANOVA)检验不同位点之间的差异性。所有数据表示为:平均数±标准差(mean ± standard deviation)。
1.2.4 分子生物学实验数据采集解剖食蚊鱼小心剪下完整的雌鱼鳍条、取出肝脏等目标器官装入有标 签的离心管,迅速放入液氮中速冻后统一转入-80°C 超低温冰箱中暂存直至RNA 提取试验。提取肝脏 RNA时每个暴露浓度每次至少取出 9 条食蚊鱼,每3条食蚊鱼肝脏合装一个离心管,提取臀鳍 RNA时每个暴露浓度组至少取出 12 条食蚊鱼,每4 条食蚊鱼臀鳍合装一个离心管。RNA 提取、RNA 反转录 cDNA、QRT-PCR 分析方法如下。
(1)引物设计。登录 NCBI网站,找到西部食蚊鱼(Gambusia affinis)的VTGαcDNA、ERαcDNA、ARαcDNA的序列,用Primer primer5 设计与之匹配的Real-time PCR 扩增引物,校对后最终选取的引物 如表1 所示。
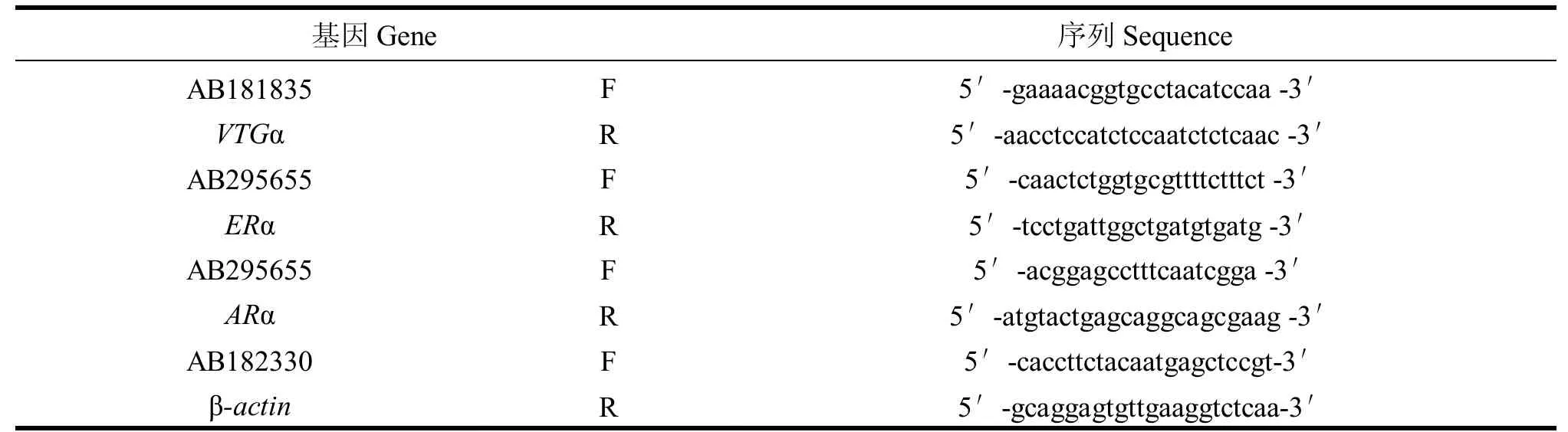
表1 目标基因扩增引物名称及其序列
(2)R NA制备。将肝组织匀浆,臀鳍条则研磨成粉末,分别加入约1 mL的Isoplus RNA(RNAiso Plus)提取液(Takara)进行总RNA提取。R NA提取后进行基因组DNA的去除,并检测RNA浓度及其完整性,保证A260/A280的比值在1.8~2.0(TakaRa)。RNA反转录成cDNA使用TakaRa Code:DRR037 PrimeScript TM RT reagents Kit(Perfect Real Time)产品。RT反应液配置如下:5×PrimeScript Buffer(2 μL),PrimeScript PT Enzyme Mix I(0.5 μL),Random 6 mers(100μmol/L,0.5 μL),Oligo dT Primer(50μmol/L,0.5 μL),Total RNA(1μL),Rnase Free dH2O(5.5 μL),总共10μL。反转录反应条件如下:37℃15min-cDNA 合成),85℃ 5s(酶失活)。
(3)实时荧光定量。使用TakaRa Code:DRR081A SYBR® Premix ExTaq™ Ⅱ(2×)10.0μL,正反向 引物(10μmol/L)各0.8 μL,ROX References DyeⅠ(50 ×)or ROX References DyeⅡ(50 ×)0.4 μL,cDNA模板 2.0μL,H2O(灭菌)6.0μL,总共20.0μL。按照两步法PCR扩增标准程序进行RT-PCR反应。RT-PCR扩增结 果数据的处理采用相对定量法,内参基因选用β actin。通过标准曲线对对照样品待测样品的目的基因及管家基因进行定量,然后根据计算公式求得相对值即为相对表达量。校正值=目的基因定量结果/管家基因 定量结果;相对值=待测样品的校正值/对照样品的校正值。
(4)数据统计与处理。使 用SPSS16.0统计软件对所得数据进行统计学分析。采 用单因素方差分析(one way-ANOVA)法对数据进行差异性分析。用Excel 2003做柱形图。设 置P<0.05时,表示差异显著;当P<0.01 时,表示差异极其显著。
2 结果与分析
2.1 水质控制
水质监测数据为多次测试的结果,温度控制在23.9~25.1℃,pH值严格控制在6.0~7.1,电导值在不 同浓度组有差异,在209.1~352.2μs/cm,溶解氧介于6.99~8.05mg/L(表2)。
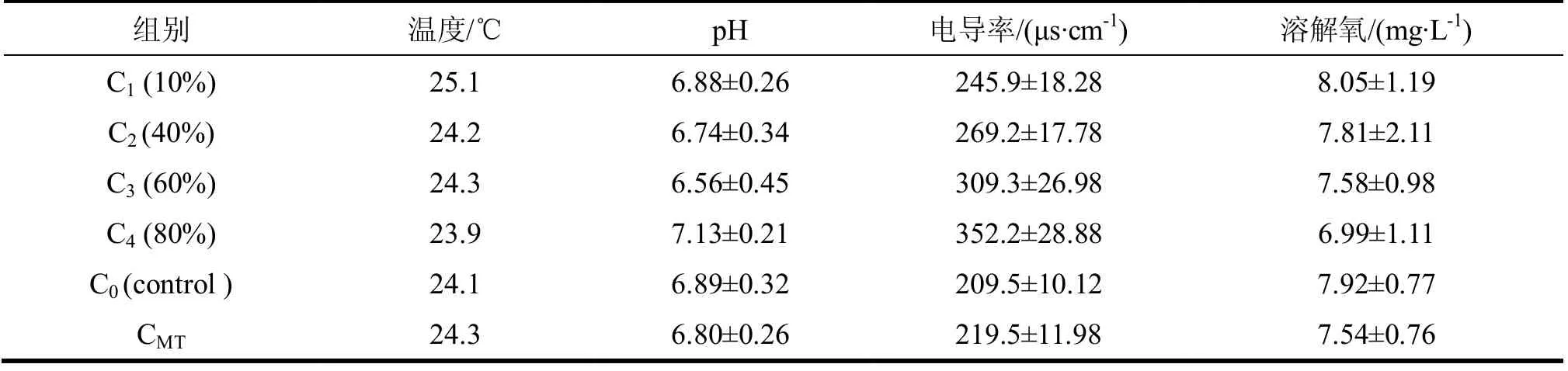
表2 水质理化指标
2.2 污水暴露致食蚊鱼骨骼形态变异
正常的雌性食蚊鱼骨骼第14~16节椎肋骨向尾部方向弯曲,椎肋骨细长,与臀鳍之间没有通过软骨 进行连接(图3-A);正常的雄鱼第14~15根椎肋骨向头部方向弯曲,肋骨粗大,第14根椎肋骨与臀鳍的骨骼通过韧带紧密连接(图3-B)。雌性食蚊鱼经过强雄激素甲基睾酮(MT)暴露后,第14~16根椎肋 骨出现特化,弯曲方向改变,由原来向尾部弯曲的改变成为向头部弯曲,椎肋骨也变厚变粗变硬,甚至增生出与臀鳍骨骼相连接的软骨。臀鳍的第3~5鳍条也相应延长,直至与雄鱼的生殖足类似(图3-C)。经过东莞樟村污水处理厂出水暴露35d后,高浓度暴露组雌鱼在一定程度上出现一些微弱变化,第14~16 椎肋骨的中间部位出现骨骼膨大增生,其椎肋骨向尾部弯曲的程度也较之正常雌鱼的有所变小(图3-D)。至于臀鳍,也出现了第3~5鳍条在一定程度上延长的现象。
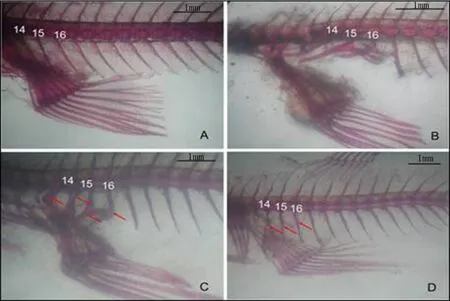
图3 实验鱼的骨骼图
2.3 污水暴露致食蚊鱼目标基因mRNA表达
2.3.1 雌性食蚊鱼目标基因mRNA表达变化暴露实验雌性食蚊鱼臀鳍的ARαmRNA转录水平如图4所 示。以对照组的ARαmRNA转录水平设定为参照值,实验组中60%和80%浓度组臀鳍的ARαmRNA转录水 平呈显著升高,分别达到2.99倍(P<0.001)和1.98倍(P<0.01)。10%和40%浓度组的转录水平则无显著性差 别,其中10%浓度组略为降低(0.78倍,P>0.05),而40%浓度组则稍微升高(1.21倍,P>0.05)。
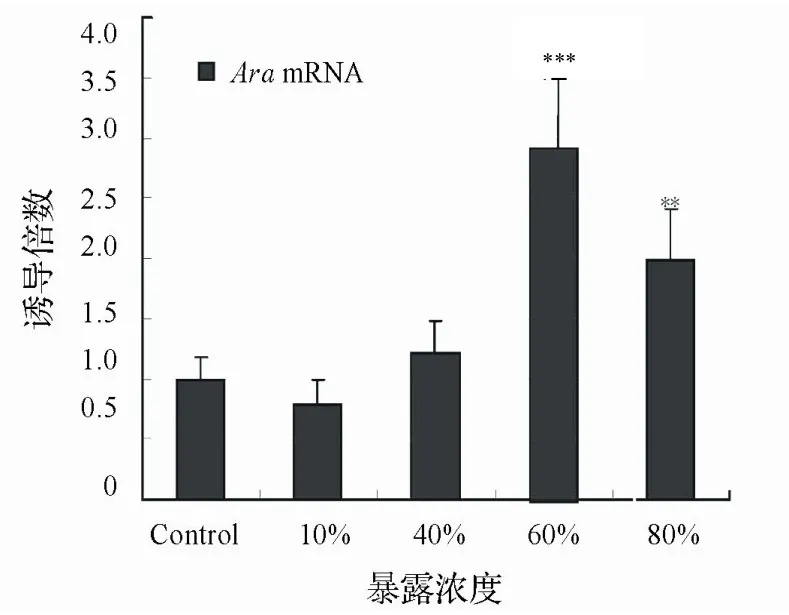
图4 废水暴露致雌性食蚊鱼臀鳍ARαmRNA 转录水平
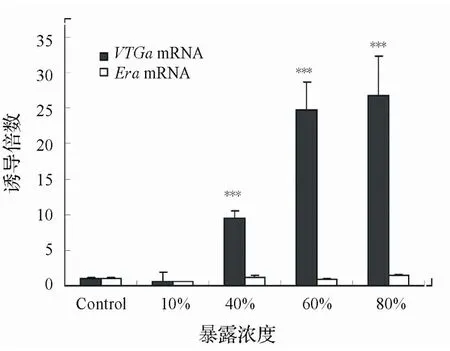
图5 废水暴露致雄性食蚊鱼肝脏VTGαmRNA和ERα mRNA转录水平变化
2.3.2 雄性食蚊鱼目标基因mRNA表达变化用不同浓度的污水处理厂出水对食蚊鱼暴露35d之后检测 了各个浓度组食蚊鱼肝脏中VTGαmRNA和ERαmRNA的转录水平,其结果如图5所示。其中80%浓度组的VTGαmRNA转录水平是清水对照组转录水平的25倍以上(P<0.001),而 60%浓度组和40%浓度组也分别 达到了24.8倍(P<0.001)和9.5倍(P<0.001)。从 整个变化趋势来看,低 浓度10%到高浓度80%,其VTGαmRNA的转录水平随之相应上升,而且呈现良好的线性关系。而ERαmRNA的变化与暴露浓度的变化则无明显的相关性,与对照组的转录水平相比未呈现显著性差异(P>0.05)。
3 讨 论
暴露实验水质的监测结果显示,对照组和实验组的温度和pH 都无明显差异,且控制在一个较小的范围内,说明喂食过程中的食物残渣得到了及时清理,不引起水质变坏,DO 值保持在6.0mg/L以上,表明水中的溶解氧供给足够食蚊鱼正常生活。对照组电导值为 209μs/cm,该值较干净的河水(东莞流溪 河,86.7 μs/cm)[11]略 偏高,其原因是实验用的为自来水,水中有用于消毒的次氯酸钙成分而造成水中 含有大量离子,但这些离子不会影响食蚊鱼的正常生活。污水按不同比例稀释后电导值也呈现一定的变 化趋势,而且变化与稀释比例一致,相关系数为R= 0.982,说明污水处理厂出水含有大量的金属矿质离 子和各类酸根离子,同时也表明本实验对稀释水样操作时工作的严谨性。
雌性食蚊鱼和雄性食蚊鱼的第 14、15、16 根椎肋骨呈现形态与功能相适应的特征,因其在不同性 别中的功能不同而呈现形态上的“二态性”,表现为雄鱼的椎肋骨粗大,向头部弯曲,与臀鳍联系紧密,而雌鱼的这3 根椎肋骨向尾部弯曲,椎肋骨细长且与臀鳍无紧密联系。本暴露实验中,雄激素 MT诱 导后臀鳍出现明显延长直至发展为与雄鱼类似的生殖足,第 14、15、16 根椎肋骨完全改变,基本趋 近于雄性食蚊鱼的椎肋形态,再次验证已经报道的强雄激素可以导致食蚊鱼性逆转的现象[9,22]。同时也与实验室内制浆造纸废水暴露食蚊鱼可以使雌性食蚊鱼性腺出现“卵睾”、臀鳍延长成为生殖足;造纸 废水能诱导出双性鱼的结果相一致[23]。本研究中,废水暴露 35d 后高浓度组的部分雌性食蚊鱼出现臀 鳍轻度延长,骨骼经过处理之后可见第 14、15、16 根椎肋骨开始出现膨大,向后弯曲的角度减小(也即 P:D的比值变小),显示食蚊鱼发生形态雄性化转变。推测在废水暴露过程中,雄激素类物质作用于雌性食蚊鱼,紊乱其体内的雄激素水平,刺激雌性食蚊鱼发生第 14~16 根椎肋骨膨大弯曲,臀鳍延 长等变化。本研究的废水室内暴露实验也验证了野外调查中发现的内分泌干扰效应在食蚊鱼形态特征上的体现[11]。然而,由于暴露实验添加到水中雄激素物质含量较低,此外采用的实验鱼已经完成性分化阶段,实验鱼在一定程度上已经具备抵御外界内分泌干扰物的干扰的能力,因此表现出来的雄激素 效应相对微弱。
雌性食蚊鱼臀鳍的ARαmRNA转录水平升高与水中雄激素物质刺激有关,并 且在一定程度上呈现高 度相关性[24]。雄鱼血液或肝脏中 VTG 则是指示食蚊鱼受到雌激类物质污染时的良好生物标志物[25],而 其mRNA转录水平更是有精确、快速反映暴露水平的特点[26]。本研究在污水处理对雌、雄食蚊鱼暴露的实验中发现,雌鱼臀鳍的ARαmRNA转录水平具有随浓度增大而上升的趋势,对转录水平和浓度数据进 行相关性分析结果发现其相关系数R=0.758,P<0.01。这表明雌鱼臀鳍的ARαmRNA转录水平升高与废 水浓度的增加具有显著性相关,揭示其转录水平的升高可能与高浓度废水中所含有的雄激素类物质浓度的高低有密切关联。而相比之下,雄鱼肝脏中的VTGαmRNA 转录水平的升高与浓度的相关性则更高(R=0.964,P<0.001),进一步表明雄鱼肝脏VTGmRNA这一生物标志物在监测废水雌激素效应中所呈 现的优越性[10]。
本实验结果已经证明,城市废水暴露致雌性食蚊鱼发生形态雄性化转变,并致雌鱼臀鳍ARαmRNA 转录水平显著提升,表现明显的雄激素效应;而城市废水暴露致雄鱼肝脏中的VTGαmRNA 转录水平显著提升,则表现明显的雌激素效应。这一实验结果与东莞寒溪河野外调查发现的雌、雄 激素效应在食蚊鱼骨骼形态特征和目标基因表达上的表现是相一致的,这也表明利用食蚊鱼发生的形态雄性化或形态雌性化转变以及VTGα和ARα目标基因作为生物标志物监测城市受污染河涌中的环境内分泌干扰物是可行的。
[1]郭莉.综合废水和环境水样遗传毒性评价新方法研究[D].大连:大连理工大学,2013.
[2]吴玲玲,陈玲,张亚雷.菲对斑马鱼鳃和肝组织结构的影响[J].生态学杂志,2006,26(5):688-692.
[3]甘海燕.城市生活污水对斑马鱼肝脏组织结构和NF-κB基因表达的影响[J].江西农业大学学报,2013,35(1):179-183.
[4]张青碧,甘仲霖,韩知峡.城市生活污水对水生动物斑马鱼的发育毒性研究[J].现代预防医学,2008,35(23):4568-4569.
[5]刘在平,张松林.城市污水对斑马鱼胚胎的影响[J].生态环境学报,2010,19(12):2911-2915.
[6]梁秋燕,谢勇平,方展强.Zn 2+ 和Cd 2+对斑马鱼早期胚胎发育阶段的单一与联合毒性研究[J].中国水产科学,2012,19(2):283-292.
[7]李莉,马陶武,吴振斌.生活污水对稀有鮈鲫的毒性效应研究[J].水生生物学报,2004,28(1):40-44.
[8]潘炯华,苏炳之,郑文彪.蚊鱼(Gambusia affinis)的生物学特性及其灭蚊利用的展望[J].华南师范学院学报:自然科学 版,1980,(1):117-138.
[9]范俊杰,徐少群,方展强,等.17α-甲基睾酮对食蚊鱼形态雄性化及目标基因表达的影响[J].水产学报,2013,37(1):9-15.
[10]Wen R S,Xie Y P,Wan C X,et al.Estrogenic and androgenic effects in mosquitofish(Gambusia affinis)from municipal effluent contaminated streams in Guangzhou,China[J].Aquatic Toxicology,2013,132-133:165-173.
[11]谢勇平,方展强.利用食蚊鱼目标基因转录水平评价东莞寒溪河雌/雄激素物质污染现状[J].水生生物学报,2013,37(4):691-697.
[12]苏方,谢勇平,方展强.苯并[a]芘和镉暴露对食蚊鱼求偶行为的影响[J].生物学杂志,2013,30(4):5-10.
[13]骆晓燕,谢勇平,方展强.镉(Cd 2+ )暴露对食蚊鱼生长发育的影响[J].天津农业科学,2013,19(10):1-6.
[14]陈文娟,谢勇平,赖静萍,等.城市废水暴露对食蚊鱼肝脏EROD酶活性的影响[J].天津农业科学,2014,20(2):54-59.
[15]钟林燕,谢勇平,张晓婵,等.3,4-苯并芘暴露对食蚊鱼生长发育的毒性影响[J].江西农业学报,2014,26(4):94-97.
[16]范俊杰,黎紫兰,徐少群,等.孕激素暴露致食蚊鱼形态雄性化的生物学效应[J].中国实验动物学报,2014,22(4):31-36.
[17]XieY P,Fang Z Q,Hou L P,et al.Altered development and reproduction in western mosquitofish(Gambusia affinis)found in the Hanxi River,soutern China [J].EnvironmentalToxicology andChemistry,2010,29(11):2607-2615.
[18]Ospina-Alvarez N,Piferrer F.Temperature-dependent sex determination in fish revisited:Prevalence,a single sex ratio response pattern,and possible effects of climate change [J].Plos One,2008,3(7):2837.
[19]陈兆南,谭玲,董亚明,等.溶解氧和气泡对食蚊鱼生存的影响[J].上海师范大学学报:自然科学版,2007,36(2):61-65.
[20]Stefan P W Walker,Loic Thibaut,Mark I McCormick.Density-dependent sex ratio adjustment and the allee effect:Amodel and a test using a sex-changing fish [J].American Naturalist,2010,176(3):312-321.
[21]Rawson C,Lim R P,Warne M S J,et al.The effect of 17β-estradiol on the development of modified hemal spines in early life-stageGambusia holbrooki[J].Arch Environ Contam Toxicol,2006,51:253-262.
[22]Ogino Y,Katoh H,Yamada G.Androgen dependent development of a modified anal fin,gonopodium,as a model to understand the mechanism of secondary sexual character expression in vertebrates [J].FEBS Letters,2004,575:119-126.
[23]Drysdale D T,Bortone S A.Laboratory induction of intersexuality in the mosquitofish,Gambusia affinis,using paper mill effluent[J].Bull Environ Contam Toxicol,1989,43:611-617.
[24]Kiyoaki Sone,Megumi Hinago,Misaki Itamoto,et al.Effects of an androgenic growth promoter 17β-trenbolone on masculinization of Mosquitofish(Gambusia affinis affinis)[J].General and Comparative Endocrinology,2005,143:151-160.
[25]温茹淑,方展强,江世贵,等.剑尾鱼卵黄蛋白原的ELISA检测[J].环境科学研究,2007,20(4):144-149.
[26]黄晔,任华,孙竹筠,等.壬基酚和双酚A对雄性斑马鱼(Danio rerio)卵黄蛋白原mRNA的诱导效应[J].生态毒理学报,2008,3(3):274-279.
