水合物储能技术研究现状
2015-11-14陈秋雄陈运文樊栓狮王燕鸿郎雪梅张雯翔熊文涛温永刚
陈 俊,陈秋雄,陈运文,樊栓狮,王燕鸿,杨 亮,郎雪梅,张雯翔,黄 怡,熊文涛,温永刚
(1深圳市燃气集团股份有限公司,广东 深圳518040;2华南理工大学化学与化工学院,传热强化与过程节能教育部重点实验室,广东 广州510640)
水合物是客体分子与主体水分子在一定温度与压力下形成的类冰状或雪状的固体物质。Hammerschmidt[1]于1934年发现管道堵塞是由气体水合物引起的,并将水合物的研究由科学兴趣引入工业所需要解决的实际问题。经过80年的研究与发展,除了知道水合物的形成和聚集能堵塞管道之外,还发现天然气水合物(俗称“可燃冰”)可以作为一种潜在的清洁能源,天然气水合物的总资源量相当于全球已探明矿物燃料(煤、石油、天然气)的2倍[2],我国南海、青藏高原等地均已探测到水合物;同时,水合物技术的应用涉及到水资源、环保、气候、油气储运、石油化工、生化制药等多个领域,如海水淡化[3]、CO2封存于海底[4]、储运天然气[5]、分离气体混合物[6-8]、蓄冷[9]等。本文将从水合物简介、水合物法储运天然气、水合物法储氢、水合物法蓄冷4个方面介绍水合物法直接或间接储能研究现状,同时针对水合物法储能今后的发展方向提出了些许建议。
1 水合物简介
水分子通过氢键作用在一定温度与压力下形成多面体的笼型孔穴,这些孔穴能围绕并将客体分子包裹在多面体里形成类似于冰状晶体的物质,即目前常说的水合物。客体分子主要是指小分子气体(H2、N2、CO2、CH4、C2H6和C3H8等),除此之外,四氢呋喃(THF)、环戊烷(CP)等也能与水形成水合物。
因为客体分子与主体分子间有范德华力(Van der Waals Force)相互作用才使得水合物结构得以形成和稳定存在。图1为水合物的3种基本结构,分别为Ⅰ型、Ⅱ型和H型[10-11],自然界最常见的水合物有Ⅰ型、Ⅱ型。

图1 水合物3种基本结构[12]Fig.1 Three hydrate unit crystal structures[12]
2 水合物法储运天然气
目前,国内外储运天然气的方式有管道运输、储气罐、地下储气库、高压管束、压缩天然气、液化天然气、吸附储运天然气、水合物储运天然气等。表1列出了不同储气方式的优点及缺点。

表1 不同类型的天然气储运方式比较[13-17]Table 1 Natural gas storage by using different methods[13-17]
水合物储运天然气是根据水合物的形成能包裹天然气的特点,将天然气进行储存与运输。水合物储运天然气技术是近些年提出的潜在的储运天然气技术之一。因其储气量大(标准状态下,一体积的固体水合物可以储存180体积的甲烷气体)、工艺比较简单、安全系数高等优点,越来越多的科研工作者针对水合物储运天然气(或纯甲烷)技术进行了相关的研究。
强化水合物储气过程与提高水合物储气量为水合物储运天然气的两个基本研究方向。英国利物浦大学Cooper课题组提出使用“干水”提高天然气水合物储气速率[18-19]。所谓“干水”是指水、疏水硅颗粒、空气在高速搅拌条件下形成的能流动的粉末。“干水”制作过程及其显微照片如图2所示。

图2 (a)干水粉末制作过程;(b)3张干水显微照片(由左至右搅拌速率依次为16450,17500和19000 r/min)[18]Fig.2 (a)Prepared processof free-flowing DW powder.Thepowder is photographed flowing through aaaa funnel;(b)Optical micrographs showing three different batches of DW prepared at differentmixing speeds(left to right:16450,17 500 and 19 000 r/min)[18]
Fan等[20]发现在5.0 MPa与273.2 K下,带十二烷基硫酸钠(SDS)的干水能明显提高甲烷水合物形成动力学过程及甲烷储气量,储气能力达到172.96 m3/m3。Fan等[21]合成的多孔的聚甲基丙烯酸羟乙酯和聚甲基丙烯酸羟乙酯-甲基丙烯酸水凝胶颗粒与干水混合后,可以达到很高的储气能力以及可逆储气能力,在273.20 K和7.5 MPa的压力下,储气量达到了144 cm3/g水。他们认为混合胶体体系的优异可逆性是由于水凝胶颗粒和干水颗粒之间存在的共稳定效应。结果表明增加操作压力和减小颗粒尺寸可以提高储气能力及生成动力学,但是会削弱稳定性和循环能力。除了干水、干凝胶之外,一些导热材料(如泡沫铝等)也可以强化水合物形成过程。Yang等[22]使用了0.03%(质量分数)的十二烷基硫酸钠SDS和泡末铝AF(平均孔径为1000 μm),当温度为273.15 K时,分别在4.2、6.0、8.3 MPa的压力下研究甲烷水合物的生成和生长的动力学行为。结果表明,多孔的泡沫铝在甲烷水合物的初始形成和进一步生长过程中可以促进水合物成核和水合热的移除,从而可以缩短诱导时间,显著地提高水合物形成和生长的速度。
同样,除了动力学研究之外,储气能力研究也关系着水合物法储运天然气技术实现工业化。高表面活性的材料(如活性炭等)研究较多。Zanota等[23]利用湿活性炭储气,认为当水炭质量比为0.71∶1、压力高于6 MPa时,湿活性炭的储气能力比干活性炭提高10%~30%。Liu等[24]的研究表明在湿活性炭中的甲烷储存量较高。如果通过此种方法储存含有相同量甲烷的压缩天然气(compress nature gas,CNG),储存压力可以减小一半,实验的甲烷储存量达到204V/V。最佳的活性炭孔径分布应为1.6~2.4 nm。Wu等[25]研究了3种文献报道的储气量最大的金属有机骨架材料(HKUST-1、PCN-11和PCN-14)的储气机理。这3种材料具有不同的有机交联剂,导致笼状孔隙具有不同的尺寸和几何形状。研究发现开放的金属配位点、气体分子可进入的微小笼子和通道有利于甲烷储存。Lim等[26]使用氧化多壁碳纳米管和THF混合溶液进行气体水合物生成实验,碳纳米管的高比表面可以提高水合物中的气体吸收量,THF溶液可以改善水合物生成时的相平衡条件。结果表明,当氧化多壁碳纳米管质量分数达到0.003%时,水合物生成过程的气体消耗量是最大的,12 h后储气量达到等量纯水的5.2倍。当THF溶液摩尔分数达到5.56%时,水合物生成的相平衡条件是最佳的。氧化多壁碳纳米管的加入并不会影响THF溶液的相平衡条件。
因环境保护意识的增强,目前,一些研究也趋于使用自然界现有的或从自然界提取的物质作为研究对象。Wang等[27]研究甲烷在绿茶(龙井)、乌龙茶(铁观音)、黑茶、静态纯水中形成水合物的储气量。他们发现甲烷水合物在含多元酚和皂苷类茶的浸剂中形成速率能大大的提高(20 min之内达到90%饱和)且储气量达到172V/V。Wang等[28]使用工业造纸的副产品木质素磺化盐作为形成甲烷水合物的促进剂,发现在较快的形成速率的同时,具有较高的储气能力。尤其是木质素磺酸钠在1000 min内,储气能力达到170V/V,储气达到90%以上所需时间仅为30 min,诱导时间大约为8 min。Wang等[29]使用具有多孔结构的绿色可循环生物材料——番茄、茄子和蘑菇进行天然气水合物(nature gas hydrate,NGH)生成的储气实验。研究结果发现,番茄、茄子和蘑菇等材料与纯水相比,可以大大促进气体水合物的生成。其中蘑菇由于具有很大的比表面积,可以使甲烷储气量在500 min后约达到123V/V,是纯水的24倍。这些研究表明,自然界存在或从自然界中提取的物质也可以像活性炭或金属材料等物质一样强化水合物储存天然气的动态过程以及提高储气量。虽然气体储运中使用这些生物材料经济性尚未确定,但确实证明了可再生、绿色环保的生物材料是一个新的、有前景的选择。
除了提高储气量以及强化储气过程研究之外,如何让气体水合物在运输过程中缓慢分解也是研究方向之一。目前,一般是根据水合物形成后在0℃以下水合物分解过程中存在“自保护”现象将水合物运输至目的地。Takeya等[30]研究了253 K条件下,天然气水合物在热力学非稳定条件下稳定超过了3周时间。
20世纪40年代中期,天然气水合物储运技术就引起了专家注意,Miller等[31]对此进行研究并申请了专利。早期的研究者认为,在常压下天然气水合物的大规模储运需要极低的温度(常压下天然气水合物在低于-76℃稳定存在)。这样储运天然气的成本太高,导致其没有实用性。20世纪90年代初,Gudmundsson[32]首先提出在常压下大规模储存和运输NGH时不必冷却到-76℃以下,而只需将其冷却到冰点以下(通常为-15℃),在相当长的时间内NGH都可以稳定存在[33-34],此效应是由于天然气水合物表面形成了冰膜,当冰膜达到足够厚时,就阻止了水合物的进一步分解。目前,大多数学者均认为冰点以下水合物分解缓慢是由于水合物初始分解后产生的水会在未分解水合物表面形成一层冰膜,从而缓解或阻止水合物进一步分解。
Gudmundsson等[35]以年产4.0×108m3(标准状态)天然气、运距为5500 km为计算基准,分别对NGH及LNG储运方式的整个过程费用进行了核算,其中包括生产、运输及气化费用,总费用却比LNG低26%。对于大型气田远距离输送天然气,LNG储运方式更有利。但若输气量不大,则NGH储运方式更具经济优势。Javanmardi等[36]估算了日产4.16×103m3(标准状态)天然气水合物的生产成本大约是$0.00181/MJ。
日本、美国、英国、挪威等对这种潜在的高效储气技术加大了研发力度。日本三菱造船公司已经拥有日产600 t NGH的技术,并获得日本产业技术研究所和大阪大学的支持,目前日本正在同挪威合作,力争在2020年使NGH储运占LNG份额的8%~12%。美国国家天然气水合物研究中心(USGS)已立项以使用表面活性剂为主要技术的调峰储气中试研究项目以及与天然气水合物汽车相关的探索项目。英国BG公司从1996—2000年间成立了Advantica研究中心,重点研究利用NGH方式减少天然气运输成本的问题。中国科学院广州能源研究所自1999年开始研究天然气水合物储运技术以来,先后在降低水合物生成压力、提高水合物生成速度、提高水合物储气量等方面取得了一定进展。图3为水合物储运气体具有代表性的示意图。
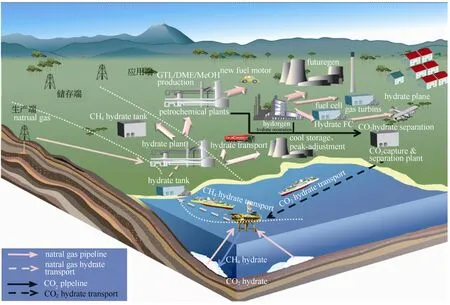
图3 水合物法储运气体示意图Fig.3 Schematic diagram of gas hydrate storage and transportation
图3为水合物法储运CH4与CO2的示意图,通过将开采收集到的CH4气体形成水合物通过轮船运输至陆地进行相关的应用。用户或工厂排放的CO2可以通过形成水合物经过船运至海里进行CO2置换甲烷水合物的开采。这样既实现了资源的利用,又将温室气体CO2封存于海底。
3 水合物法储存氢气
一般认为H2分子较小,能进入水合物笼子,但是不能稳定笼子形成水合物。2002年,Mao等[37]通过拉曼光谱、X-射线光谱等发现Ⅱ型水合物中2个H2占据小笼子、4个H2占据大笼子,并进一步证实当温度为240~249 K、压力为200~300 MPa时,H2储量可达到5.3%(质量分数)。研究人员发现H2-水体系中加入四氢呋喃(THF)后能形成较稳定的H2/THFⅡ型水合物。2004年,Florusse等[38]通过加入THF,可以降低H2水合物的形成条件,形成THF与H2均占据孔穴的水合物,大孔被THF占据,小孔被2个H2分子占据。随后Lee等[39]发现12 MPa时2个H2填充小笼子,当THF浓度低于其化学计量浓度5.56%(物质的量浓度)时储气量更大,物质的量浓度为0.15%时达到最大储气量4.03%(质量分数)。Strobel等[40]研究了13.8 MPa、0.5%~5.56%(物质的量浓度)THF溶液储气量,实验结果却表明,最大H2储量只有1%(质量分数),且在整个测试浓度范围内H2储量没有明显增大。Ogata等[41]探索了85 MPa、277.15 K下两种不同的水合储氢方法:一种是往THF溶液中通入H2后再水合;另一种是先形成THF水合物后再吸附H2,其所获得的最大H2储量只有1.05%(质量分数)。Sugahara等[42]研究了(255±2)K下冰粉和固态THF共存时通入H2(60 MPa)的储气量,当THF物质的量浓度为0.5%时获得最大储气量3.4%(质量分数),拉曼光谱和粉末X-射线衍射结果显示小笼子中只有一个H2,H2对大笼子的占有率是THF浓度的函数。对H2/THF二元水合物相平衡研究很多,但其水合速率的动力学研究甚少。Nagai等[43]发现低温、高压、细小的THF水合物颗粒能加快H2/THF二元水合物的生成,SDS对其无促进效果,并且在最优条件下10 g样品所获得的最大H2储量为0.25%(质量分数)。Zhang等[44]往H2-水体系中引入与水不互溶的环戊烷(CP),研究了2.7~11.1 MPa、280.7~283.7 K H2/CP二元水合物的相图,其分解温度高于H2/THF二元水合物。Deng等[45]在275.15 K下往CP水合物粉末中通入H2,10~18 MPa时获得的最大储氢量为0.27%(质量分数)。Strobel等[46]首次报道了环己酮与H2形成Ⅱ型水合物,其氢气孔穴占有率低于H2/THF水合物。Tsuda等[47]研究了呋喃和四氢噻吩(THT)与H2形成水合物的相图,首先在270 K下形成呋喃或THT水合物后压碎,再通入H2。与H2/THF二元水合物相平衡曲线相比,H2/THT和H2/呋喃分别左移2 K和0.5 K。形成的呋喃或THT水合物吸附H2只需3 h,而THF水合物需要10 h;41.8 MPa、275.1 K时它们的储氢量均为0.6%(质量分数),与同等条件下THF储气量相当。Zhang等[48]研究了H2与烃类气体混合时的储气量,结果表明,H2与丙烷混合时储氢量最大,120 MPa、270 K时储氢量为0.33%(质量分数)。Abbondondola等[49]将50 g、250目的冰粒置于272.2 K、0.38 MPa丙烷中,3天后将温度压力设为263 K、0.12 MPa,随后通入氢气(0.67 MPa或1.5 MPa),放置2~4天,储氢量分别是0.02%和0.04%(质量分数)。
半笼型水合物也是研究较多的一类用于储氢的水合物,它是由季铵盐与水形成的,其中卤素原子取代水分子以氢键与周围其它水分子形成笼型结构,同时季铵盐离子占据四个空笼,一些小的分子可以进入其它孔穴。半笼型水合物在常温常压下即可形成[50]。四丁基溴化铵(TBAB)是研究最多的半笼型水合物。Hashimoto等[51]证实TBAB/H2半笼型水合物稳定性优于THF-H2水合物,其小笼子孔穴占有率低于THF-H2水合物,这意味着其储氢量更低。Arjmandi等[52]研究了0.60%(物质的量浓度)和4.0%(物质的量浓度)TBAB溶液形成TBAB-H2水合物的相平衡,认为水合物的稳定性随TBAB浓度的增大而提高。Shimada等[53]发现不同浓度TBAB溶液所形成的半笼型水合物结构有所差异。Treuba等[54]探索了压力、TBAB浓度和水合物形成方法对TBAB/H2半笼型水合物生成速率和储气量的影响,认为高压和高浓度加快其生成,在16 MPa、281.15 K时3.7%(物质的量浓度)TBAB和2.6%(物质的量浓度)TBAB溶液H2储量分别是0.046%(质量分数)和0.031%(质量分数)。Sakamoto等[55]研究了四丁基氟化铵(TBAF)/H2半笼型水合物相图,发现这是室温下最稳定的水合物,但储氢量低于THF/H2水合物。Deschamps等研究了四丁基氯化铵(TBAC)和四丁基溴化磷(TBAC)水合物,得出各种半笼型水合物的稳定性为:TBAF/H2>TBAC/H2>TBAB/H2>TBPB/H2。
1987年Ripmeester等[56]首次发现了H型水合物。Strobel等[57]证实H2可以和大分子[如甲基叔丁基醚(MTBE)、甲基环己烷(MCH)、2,2,3-三甲基丁烷(2,2,3-TMB)和1,1-二甲基环己烷(1,1-DMCH)等]形成二元H型水合物,H2填充其中的小笼子。当H2占据小和中笼子、大分子占据大笼子时其储氢量与二元II型水合物相比增大40%。Duarte等[58]报道了H2与MTBE、MCH、DMCH等液态烃形成H型水合物的相平衡数据,当温度在269~275 K、平衡压力为60~100 MPa时,DMCH相对较容易形成水合物,在274.7 K时平衡压力为60 MPa。图4为不同类型含H2水合物的相图。

图4 不同类型含H2水合物的相图[59]Fig.4 Phase diagram of different types of hydrate containing H2[59]
2012年,Lu等[60]发现H2中混入N2在一定条件下也能形成水合物,H2即能占据大孔也能占据小孔。Matsumoto等[61]研究甲烷与氢气二元体系形成水合物的热力学稳定性,他们发现,H2中加入少量的甲烷与纯H2相比,能大大降低水合物的形成条件;同时,他们也认为从能量密度角度考虑,研究H2+CH4水合物比H2+THF更具有意义。
4 水合物法蓄冷
正常的水蓄冷、冰蓄冷、熔融盐蓄冷分别有着储热密度不高、蓄冷温度过低、易老化失效等一些缺点。而水合物蓄冷克服了这些缺点,有望成为最有前景的蓄冷方式。目前水合物法蓄冷研究目的是为了应用于空调等制冷的设备。其原理是根据水合物形成与分解过程中放热与吸热过程实现蓄冷功能。
自从2005年JFE公司(日本)表明笼型水合物浆大规模用于空调系统的可行性后[62],国内外对水合物蓄冷技术进行了广泛的研究。目前对水合物蓄冷进行研究的主要有法国、日本、中国等国家。研究内容主要包括:水合物形成温度压力相图、水合物浆传热特性、水合物浆在管道内的流动情况、不同冷剂的配比、找寻高制冷性能系数(COP)的最佳组合。蓄冷介质主要有CO2、四丁基溴化铵(TBAB)、过氧化苯甲酸叔丁酯(TBPB)等。
Oyama等[63]指出有A与B两种不同类型的TBAB水合物,A与B类型水合数分别为26与38,A型分解焓为193 kJ/kg,B型分解焓为200 kJ/kg。Douzet等[64]对TBAB用间接循环制冷进行了实验研究,水合物生成器200 L,水合物储罐高2.5 m、体积约为2 m3,罐内固体体积分数可达40%~50%,通过稀释,在管内流动的水合物体积分数降为20%,回路长度约为100 m。他们提出了一种用于预测罐内水合物数量和分布的模型。Clain等[65]使用Ostwald方法在动态循环回路中对TBPB的流变学特性进行了实验研究。实验回路由内径8 mm、外径10 mm的316 L不锈钢管组成,内部容积为2.97×10-4m3,连接一个220型微泵,回路装有7个热电偶、两个压力表和一个电磁流量计,对水合物分数为0~28.2%的体积流率和压降进行了测量。得到剪切力为100~700 s-1,TBPB浆体表现出非牛顿型特征,同时运用半经验公式Ostwald-de Waele定律,综合考虑水合物浆分数,基于Herschel-Bulkley-type等式,提出了一种经验流变特性模型。Shi等[66]对均相和非均相水合物储罐进行了对比实验,TBAB初始溶液浓度为40%(质量分数),实验装置由两部分组成,一为生成回路,二为制冷回路,得到均相系统的过冷度可由非均相的5.9℃降低到0.5℃,系统COP由1.95~2.50上升到2.00~2.95。
Fournaison等[67]通过示差热分析装置测得CO2-冰水合物分解焓为507 kJ/kg,明显大于冰的熔化焓333 kJ/kg,因此,CO2水合物蓄能也有相关研究。Oignet等[68]对CO2水合物浆的流变特性进行了实验研究,其实验装置包括一个直径273 mm、高度495 mm、壁厚5 mm、耐压3.5 MPa带搅拌的反应器和内径7.74 mm、外径9.52 mm带热管的循环回路组成。得到CO2水合物体积分数为15%的浆体,其内部传热系数为3000 W/(m2·K)。3 MPa、275 K时,CO2浆体成假塑性流体特征,黏度小于10 mPa·s,而且水合物浆体对传热系数的正影响是水对其影响的2.6倍。Jerbi等[69]在带搅拌的反应罐和间接制冷回路中对CO2水合物的流变特性进行了实验研究,反应罐26.47 L、耐压4.5 MPa,回路由内径为7.74 mm、外径为9.52 mm的316 L不锈钢管组成。实验得到当水合物固相体积分数由0增加到22%时,表观系数n减少,非牛顿型特征(n≠1)、剪切稀化(n<1)趋势增加,浆体的表观黏度随着切应力的增加而减少,随着固体分数的增加而增加。因为加入TBAB、TBPB等物质一方面作为蓄冷介质,另一方面其可以缓和水合物的形成条件,因此,针对CO2在加入TBPB+TBAB也有研究。Lin等[70]对TBPB+TBAB+H2O系统在有无CO2条件下形成水合物的热力学特征均进行了实验研究。在混合盐质量分数为0.05%~0.60%的变化范围内,运用DSC技术对水合物分解温度进行了测量,得到半笼型水合物分解温度随TBAB组分的增加而升高,加入CO2会进一步提高分解温度,混合盐质量分数为0.6%,无CO2或CO2压力2COP为0.1 MPa时,TBPB对半笼型水合物的分解焓几乎无影响。提出疏水性部分的结构、大小是影响半笼型水合物最重要的因素,TBAB和TBPB有可能形成混合半笼型水合物(n-C4H9N+)1−x(n-C4H9P+)x·mH2O。
5 展 望
以上综述了近几年水合物法储运天然气、储氢、蓄冷等的研究现状。通过总结分析发现,还有许多未解决的问题以及未完成的相关工作,在此提出起到抛砖引玉的作用,以便后续相关工作人员进行研究。
(1)水合物法储运天然气方面趋向于寻找合适的添加剂,强化水合物形成过程以及增大水合物储气量,同时达到较为温和的储存和运输条件。添加剂寻找的方向为绿色、环保等。水合物法储运天然气需要进行大量的中试实验以便早日实现工业应用。
(2)储氢方面,首先需要降低含H2水合物的形成条件,同时强化H2水合物形成过程,提高H2水合物储气能力。将通过加入THF、TBAB等降低H2水合物形成条件。研究转移至类似于加CH4等来降低水合物形成条件以及提高储能密度。简单而言就是实现氢气廉价、高储能密度、安全的储存和运输。
(3)水合物法蓄冷方面,基础研究偏向于形成稳定的水合物浆液:包括流动时与静止时浆液的稳定性。整个冷能利用的过程对蓄冷体系腐蚀较小、对环境污染少、水合物形成条件较为温和等;找到合适的添加剂使水合物分解焓相对较大,提高其利用效率。
(4)水合物法储运天然气、水合物法储氢与水合物法蓄冷在我国研究均处于实验室阶段,与国外的研究有一定的差距,需要国家以及一些企业资助进行相关方面的研究。同时这三方面研究,尤其是水合物法储运天然气、水合物法蓄冷可进行相关的中试实验,以便早日实现工业应用。
[1]Hammerschmidt E G.Formation of gas hydrates in natural gas transmission lines[J].Ind.Eng.Chem.,1934,26:851-855.
[2]Milkov A V.Global estimates of hydrate-bound gas in marine sediments:How much is really out there?[J].Earth-Science Reviews,2004,66(3):183-197.
[3]Javanmardi J,Moshfeghian M.Energy consumption and economic evaluation of water desalination by hydrate phenomenon[J].Applied Thermal Engineering,2003,23(7):845-857.
[4]Yuan Q,Sun CY,Liu B,et al.Methane recovery from natural gas hydrate in porous sediment using pressurized liquid CO2[J].Energy Conversion and Management,2013,67:257-264.
[5]Hao WF,Wang JQ,Fan SS,et al.Evaluation and analysis method for natural gas hydrate storage and transportation processes[J].Energy Conversion and Management,2008,49(10):2546-2553.
[6]Liu H,Mu L,Liu B,et al.Experimental studies of the separation of C2compounds from CH4+C2H4+C2H6+N2gas mixtures by an absorption-hydration hybrid method[J].Industrial&Engineering Chemistry Research,2013,52(7):2707-2713.
[7]Liu H,Liu B,Lin L C,et al.A hybrid absorption-adsorption method to efficiently capture carbon[J].Nature Communications,2014,5:5147.
[8]Liu H,Mu L,Wang B,et al.Separation of ethylene from refinery dry gas via forming hydrate in w/o dispersion system[J].Separation and Purification Technology,2013,116:342-350.
[9]Song W J,Xiao R,Chong H,et al.Experimental investigation on TBAB clathrate hydrate slurry flows in a horizontal tube:Forced convective heat transfer behaviors[J].International Journal of Refrigeration,2009,32(7):1801-1807.
[10]Chen Guangjin(陈光进),Sun Changyu(孙长宇),Ma Qinglan(马庆兰).Gas Hydrate Science and Technology[M].Beijing:Chemical Industry press,2008.
[11]Sloan ED,Koh CA.Clathrate Hydratesof Natural Gases[M].3rd ed.New York:CRC Press,2008.
[12]Rojas Y,Lou X.Instrumental analysis of gas hydrates properties[J].Asia-Pacific Journal of Chemical Engineering,2010,5(2):310-323.
[13]Wu Hongbo(吴洪波),He Yang(何洋),Zhou Yong(周勇),et al.Comparison and selection of natural gas peak shaving mode[J].Natural Gas and Oil(天然气与石油),2009,27(5):5-9.
[14]Wang Xuejun(王学军),Lin Jingmin(林敬民),Shen Yongliang(沈永良).Investment and economic analysis of hourly peak-shaving by line-packing[J].Gas&Heat(煤气与热力),2003,23(4):225-227.
[15]Wu Chuangming(吴创明).Choice of city natural gas transmission and distribution scheme[J].Gas&Heat(煤气与热力),2004,24(5):279-282.
[16]Xiao D D,Ling Q.Natural gas storage on activated carbon modified by metal oxides[J].J.Porous Mater.,2009(16):27-32.
[17]Sun Li(孙丽),Li Changjun(李长俊),Liao Kexi(廖柯熹),et al.Hydratation technology for storage and transportation of natural gas and prospect of its application[J].Oil&Gas Storage and Transportation(油气储运),2009,28(4):42-44.
[18]Wang WX,Bray CL,Adams D J.Methane storage in dry water gas hydrates[J].Journal of the American Chemical Society,2008,130(35):11608-11609.
[19]Carter B O,Wang WX,Adams D J.Gas storage in“dry water”and“dry gel”clathrates[J].Langmuir,2010,26(5):3186-3193.
[20]Fan SS,Yang L,Wang Y H,et al.Rapid and high capacity methane storage in clathrate hydrates using surfactant dry solution[J].Chemical Engineering Science,2014,106:53-59.
[21]Ding A,Yang L,Fan SS,et al.Reversible methane storage in porous hydrogel supported clathrates[J].Chemical Engineering Science,2013,96:124-130.
[22]Yang L,Fan SS,Wang Y H,et al.Accelerated formation of methane hydrate in aluminum foam[J].Industrial&Engineering Chemistry Research,2011,50(20):11563-11569.
[23]Zanota M,Périer-Camby L,Chauvy F,et al.Improvement of methane storage in activated carbon using methane hydrate[C]//Trondheim:Proceedings of the 5th International Conference on Gas Hydrates,2005.
[24]Liu J,Zhou Y,Sun Y,et al.Methane storage in wet carbon of tailored pore sizes[J].Carbon,2011,49(12):3731-3736.
[25]Wu H,Simmons JM,Liu Y,et al.Metal-organic frameworks with exceptionally high methane uptake:Where and how is methane stored?[J].Chemistry-A European Journal,2010,16(17):5205-5214.
[26]Lim S H,Riffat S B,Park S S,et al.Enhancement of methane hydrate formation using a mixture of tetrahydrofuran and oxidized multiwall carbon nanotubes[J].International Journal of Energy Research,2014,38(3):374-379.
[27]Wang W X,Zeng P Y,Long X Y,et al.Methane storage in tea clathrates[J].Chem.Commun.,2014,50(10):1244-1246.
[28]Wang WX,Huang Z,Chen H R,et al.Methane hydrates with ahigh capacity and a high formation rate promoted by biosurfactants[J].Chem.Commun.,2012,48(95):11638-11640.
[29]Wang W,Ma C,Lin P,et al.Gas storage in renewable bioclathrates[J].Energy Environ.Sci.,2012,6(1):105-107.
[30]Takeya S,Yoneyama A,Ueda K,et al.Anomalously preserved clathrate hydrate of natural gas in pellet form at 253 K[J].The Journal of Physical Chemistry C,2012,116(26):13842-13848.
[31]Miller B,Strong E R.Hydrate storage of natural gas[J].Am.Gas Associ.Mort.,1946,28(2):63-67.
[32]Gudmundsson J S.Method for production of gas hydrate fortransportation and storage:US,5536893[P].1996.
[33]Handa Y P.Composition enthalpy of dissociation and heat capacities in the range 85 to 270 K for clathrate hydrates of methane ethane and propane enthalpy of dissociation of isobutene hydrate as determined by heat-flow calorimeter[J].J.Chem.Thermodynamics,1986,18:915-921.
[34]Finlay B J,Fenchel T.An anaerobic protozoon,with symbiotic methanogens,living in municipal landfill material[J].FEMS Microbiology Letters,1991,85(2):169-179.
[35]Gudmundsson JS.Natural gas hydrate:An alternative to liquefied natural gas[EB/OL].1996.http://ww.ipt.unit.no/~jsp/forskning/hydrater.
[36]Javanmardi J,Nasrifar K,Najibi SH,et al.Economic evaluation of natural gas hydrate as an alternative for natural as transportation[J].Appl.Herin.Eng.,2005,25:1708-1723.
[37]Mao W L,Mao H K,Goncharov A F,et al.Hydrogen clusters in clathratehydrate[J].Science,2002,297:2247-2249.
[38]Florusse L J,Peters C J,Schoonman J,et al.Stable low-pressure hydrogen clusters stored in a binary clathrate hydrate[J].Science,2004,306:469-471.
[39]Lee H,Lee JW,Kim D Y,et al.Tuning clathrate hydrates for hydrogen storage[J].Nature,2005,434:743-746.
[40]Strobel T A,Taylor C J,Hester K C,et al.Molecular hydrogen storage in binary THF-H2clathrate hydrates[J].Journal of Physical Chemistry B,2006,110(34):17121-17125.
[41]Ogata K,HashimotoS,Sugahara T,et al.Storage capacity of hydrogen in tetrahydrofuran hydrate[J].Chemical Engineering Science,2008,63:5714-5748.
[42]Sugahara T,Haag JC,Prasad PS R,et al.Increasing hydrogen storage capacity using tetrahydrofuran[J].Journal of the American Chemical Society,2009,131:14616-14617.
[43]Nagai Y,Yoshioka H,Ota M,et al.Binary hydrogen tetrahydrofuran clathrate hydrate formation kinetics and models[J].AIChE Journal,2008,54:3007-3016.
[44]Zhang JS,Lee JW.Equilibrium of hydrogen plus cyclopentane and carbon dioxide plus cyclopentane binary hydrates[J].Journal of Chemical and Engineering Data,2009,54:659-561
[45]Deng C,Liang D Q,Li D L.Formation of cyclopentane-hydrogen clathratehydrates[J].Petrochemical Technology,2009,38:951-956.
[46]Strobel T A,Hester K C,Sloan E D,et al.A hydrogen clathrate hydratewith cyclohexanone:Structure and stability[J].Journal of the American Chemical Society,2007,129:9544.
[47]Tsuda T,Ogata K,Hashimoto S,et al.Storage capacity of hydrogen in tetrahydrothiophene and furan clathrate hydrates[J].Chemical Engineering Science,2009,64:4150-4154.
[48]Zhang SX,Chen GJ,Ma CF,et al.Hydrateformation of hydrogen plus hydrocarbon gas mixtures[J].Journal of Chemical and Engineering Data,2000,45:908-911.
[49]Abbondondola JA,Fleischer EB,Janda K C.Comparativestudy of hydrogen,argon and xenon uptake into a propane hydrate[J].AIChE Journal,2010,56:2734-2741.
[50]Dyadin Y A,Udachin K A.Clathrate formation in water-peralkylonium salts systems[J].Journalof Inclusion Phenomena,1984,2(1-2):61-72.
[51]Hashimoto S,MurayamaS,Sugahara T,et al.Thermodynamic and raman spectroscopic studies on H2+tetrahydrofuran+water and H2+tetra-n-butyl ammonium bromide+water mixtures containing gas hydrates[J].Chemical Engineering Science,2006,61:7884-7888.
[52]Arjmandi M,Chapoy A,Tohidi B.Equilibrium data of hydrogen,methane,nitrogen,carbon dioxide and natural gas in semi-clathrate hydrates of tetrabutyl ammonium bromide[J].Journal of Chemical and Engineering Data,2007,52:2153-2158.
[53]Shimada W,EbinumaT,Oyama H,et al.Separation of gasmolecule using tetra-n-butyl ammonium bromide semi-clathrate hydrate crystals[J].Jpn.J.Appl.Phys.,2003,42:L129-L131.
[54]Trueba A T,Radovic I,Zevenbergen J F,et al.Kinetics measurements and in situ Raman spectroscopy of formation of hydrogen-tetrabutylammonium bromide semi-hydrates[J].International Journal of Hydrogen Energy,2012,37:5790-5797.
[55]Sakamoto J,Hashimoto S,Tsuda T,et al.Thermodynamic and Raman spectroscopic studies on hydrogen+tetra-n-butyl ammonium fluoride semi-clathrate hydrates[J].Chemical Engineering Science,2008,63:5789-5794.
[56]Ripmeester JA,Tse JS,Ratcliffe CI,et al.A new clathrate hydrate structure[J].Nature,1987,325:135-136.
[57]Strobel T A,Koh C A,Sloan E D.Water cavities of sH clathrate hydrate stabilized by molecular hydrogen[J].J.Phys.Chem.B,2008,112:1885-1887.
[58]Duarte A R C,Shariati A,Peters C J.Phase equilibrium measurements of structure sh hydrogen clathrate hydrates with various promoters[J].Journal of Chemical and Engineering Data,2009,54:1628-1632.
[59]Veluswamy H P,Kumar R,Linga P.Hydrogen storage in clathrate hydrates:Current state of the art and future directions[J].Applied Energy,2014,122:112-132.
[60]Lu H L,Wang JW,Liu CL,et al.Multiple H2occupancy of cages of clathrate hydrate under mild conditions[J].Journal of the American Chemical Society,2012,134(22):9160-9162.
[61]Matsumoto Y,Grim R G,Khan N M,et al.Investigating the thermodynamic stabilities of hydrogen and methane binary gas hydrates[J].The Journal of Physical Chemistry C,2014,118(7):3783-3788.
[62]Mizukami T.Thermal energy storage system with clathrate hydrate slurry[C]//Clathrate Hydrates and Technology Innovations,KEIO University«Global COE Program»International Symposium,Yokohama,2010.
[63]Oyama H,Shimada W,Ebinuma T,et al.Phase diagram,latent heat,and specific heat of TBAB semiclathrate hydrate crystals[J].Fluid Phase Equilib.,2005,234:131-135.
[64]Douzet J,Brantuas P,Michel H.Building of a life size testing unit for air conditioning by using TBAB hydrate slurry as a secondary tow-phase refrigerant[C]//ICGH7,Edinburgh,2011.
[65]Clain P,Delahay A,Fournaison L.Rheological properties of tetra-n-butylphosphonium bromidehydrate slurry f low[J].Chem.Eng.J.,2012(193-194):112-122.
[66]Shi X J,Zhang P.Cold storage by tetra-n-butyl ammonium bromide clathrate hydrate slurry generated with different storage approaches at 40%initial aqueous solution concentration[J].Int.J.Refrig.,2014,42:77-89.
[67]Fournaison L,Delahaye A,Chatti I,et al.CO2hydrates in refrigeration processes[J].Ind.Eng.Chem.Res.,2004(43):6521-6226.
[68]Oignet J,Hoang H M,Delahaye A,et al.Rheological and thermal study of a secondary refrigeration loop by hydrate slurry[C]//ICGH8,Beijing,2014.
[69]Jerbi S,Delahaye A,Oignet J,et al.Rheological properties of CO2hydrate slurry produced in a stirred tank reactor and a secondary refrigeration loop[J].Int.J.Refrig.,2013(36):1294-1301.
[70]Lin W,Dalmazzonea D,Fürst W,et al.Thermodynamic properties of semiclathrate hydrates formed from the TBAB+TBPB+water and CO2+TBAB+TBPB+water systems[J].Fluid Phase Equilib.,2014,372:63-68.
