利用产脂肪酶B的毕赤酵母工程菌生物拆分制备西司他丁关键手性中间体的体系优化
2015-11-11何军邀
郑 磊,何军邀,2,黄 金,王 普
(1.浙江工业大学 药学院,浙江 杭州 310032;2.浙江医药高等专科学校,浙江 宁波 315100)
利用产脂肪酶B的毕赤酵母工程菌生物拆分制备西司他丁关键手性中间体的体系优化
郑 磊1,何军邀1,2,黄 金1,王 普1
(1.浙江工业大学 药学院,浙江 杭州 310032;2.浙江医药高等专科学校,浙江 宁波 315100)
S-(+)-2,2-二甲基环丙烷甲酸(S-(+)-DMCPA)是合成西司他丁的关键手性中间体。构建的毕赤酵母工程菌生产的脂肪酶可高选择性催化外消旋2,2-二甲基环丙烷甲酸乙酯(DMCPE)不对称水解制备S-(+)-DMCPA。对该工程菌产胞外脂肪酶的产酶条件及生物拆分反应条件进行优化,以提高其催化效率。优化获得重组毕赤酵母最佳产酶条件:采用BMMY培养基,培养基初始pH 8.0,500mL摇瓶装50mL培养基,每隔4 h向培养基中补加终体积分数为1%的甲醇。培养192 h后,发酵液中脂肪酶比酶活为4.41 U/L,较优化前提高了90.9%。利用含脂肪酶的发酵上清液进行DMCPE的生物拆分反应,底物浓度为15mmol/L,30℃反应36 h,S-(+)-DMCPA的产率可达43.8%,e.e.值为99.8%。
西司他丁;毕赤酵母;脂肪酶;S-(+)-2,2-二甲基环丙烷甲酸;生物拆分
西司他丁是第一个应用于临床的肾脱氢二肽酶抑制剂,S-(+)-2,2-二甲基环丙烷甲酸(S-(+)-DMCPA)是合成西司他丁的关键手性中间体[1-2]。目前,西司他丁手性中间体主要通过化学法合成,但存在污染大、合成条件苛刻等缺点[3-4]。由于生物催化法具有反应条件温和、立体选择性高和环境污染小等优点,将其应用于药物手性中间体的合成已逐渐成为研究热点[1]。Wang等[5]从土壤中筛选得到可不对称水解2,2-二甲基环丙烷甲腈制备S-(+)-2,2-二甲基环丙烷甲酸的菌株Rhodococcus sp.AJ270,产率达44%,e.e.值为88%。Yeom等[6]利用Rhodococcus erythropolis不对称水解外消旋2,2-二甲基环丙烷甲腈合成S-(+)-DMCPA,产率为45%,e.e.值为81.8%。
笔者所在实验室成员前期采用脂肪酶435催化2,2-二甲基环丙烷甲酸乙酯(DMCPE)不对称水解合成西司他丁关键手性中间体S-(+)-DMCPA[7],当脂肪酶435用量为16g/L、底物DMCPE浓度为65mmol/L时,以pH 7.2的1mol/L H3PO4缓冲液为反应介质,30℃反应64 h,产物的产率和e.e.值分别为45.6%和99.2%。但由于商品脂肪酶价格较高,成为限制其工业化应用的重要因素之一[8],利用微生物产脂肪酶替代商品脂肪酶将成为降低工业化应用成本的途径之一。
脂肪酶广泛存在于动植物和微生物中,由于微生物具有种类多、繁殖快、易发生遗传突变等特点,目前微生物源脂肪酶已成为研究热点。酵母菌是国内外研究最多的微生物之一,且大部分酵母的发酵产物被认为对人体安全无害,因而酵母菌成为脂肪酶的重要来源之一,如来源于皱褶假丝酵母(Candida rugosa)和南极假丝酵母(Candida antarctica)的脂肪酶[9]。脂肪酶B是从南极假丝酵母中分离得到的一种具有高效专一性的脂肪酶[10],目前已被克隆表达于多种宿 主,如 Aspergillus oryzae[11]、Pichia pastoris[12]、Saccharomyces cerevisiae[13]、Escherichia coli[14]和Yarrowia lipolytica[15]。 Liu 等[16]将 C.antarctica ZJB09193中的脂肪酶基因在P.pastoris X33中成功表达,并利用该脂肪酶催化合成维生素A酯。利用基因工程菌表达外源蛋白催化合成药物手性中间体将成为医药工业的研究新方向。
笔者所在实验室成员以Pichia pastoris为宿主菌株,以pPICZaA为表达载体,采用PCR装配法,成功克隆表达了脂肪酶B基因,利用该重组菌产生的胞外脂肪酶可高选择性催化外消旋DMCPE不对称水解制备得到西司他丁关键手性中间体S-(+)-DMCPA。本研究中,笔者通过对该菌株的最佳产酶条件和生物拆分条件进行优化,以期提高该菌株所产脂肪酶的催化效率,进而为后续的深入研究提供依据。
1 材料与方法
1.1 菌种
含脂肪酶B基因的毕赤酵母(Pichia pastoris)菌株(表达载体pPICZaA),由笔者所在实验室成员自行构建、保藏。
1.2 培养基
1.2.1 斜面培养基
酵母粉-蛋白胨-葡萄糖(YPD)培养基(g/L):酵母浸出粉10,蛋白胨20,葡萄糖20,琼脂粉15。
1.2.2 种子培养基
甘油基础缓冲培养基(BMGY)(1 L):无氨基酵母氮源(YNB)13.4g,500×生物素2mL,甘油10g,酵母浸出粉10g,蛋白胨20g,1mol/L pH 6.0磷酸盐缓冲液100mL。
1.2.3 发酵培养基
甲醇基础缓冲培养基(BMMY)(1 L):YNB 13.4g,500×生物素2mL,无水甲醇10mL,酵母浸出粉10g,蛋白胨20g,1mol/L pH 6.0磷酸盐缓冲液100mL。
1.3 培养条件
将保藏菌种划线转接至YPD培养基上活化,30℃恒温培养48 h,将单菌落接种至50mL BMGY培养基,200r/min、30℃振荡培养至600nm的吸光度值OD600为2~6。
以10%的接种量将种子液接入装有50mL BMMY培养基的500mL三角瓶中,200r/min、30℃下,每24 h按培养基体积分数的1%补加无水甲醇,培养96 h后检测发酵液中胞外脂肪酶的酶活。
1.4 产酶条件优化
为了考察毕赤酵母工程菌的最佳产酶条件,分别对装液量、发酵培养基初始pH、补加甲醇浓度、甲醇添加时间间隔和产酶发酵时间进行优化,实验重复3次,每项优化结果都用于后续实验。
1.5 生物拆分DMCPE制备S-(+)-DMCPA的反应条件优化
为了考察重组菌株所产脂肪酶不对称拆分DMCPE制备S-(+)DMCPA的最佳反应条件,采用最佳产酶条件下培养得到的含酶发酵液,分别选取不同反应温度(25~45℃)、底物浓度(10~30mmol/L)和反应时间进行生物拆分反应,气相色谱法(GC)检测得到S-(+)-DMCPA产率和e.e.值。实验重复3次,每项优化结果都用于以后的实验。
1.6 检测方法与酶活力定义
底物DMCPE和产物S-(+)-DMCPA的浓度和e.e.值采用气相色谱法检测,具体测定条件参照文献[16]。
酶活力定义:在30℃下,1min内不对称水解DMCPE生成1 μmol S-(+)-DMCPA所需的酶量,定义为1个酶活单位(U)。
酶活力检测方法:取10mL发酵上清液于50mL锥形瓶中,加入0.02g底物DMCPE,30℃、200r/min反应6 h。反应结束后,加入2倍体积的乙酸乙酯,30℃、200r/min振荡萃取45min,静置分层后取乙酸乙酯相检测产物S-(+)-DMCPA的生成量,计算得到单位体积发酵液的脂肪酶酶活(U/L)。
2 结果与讨论
2.1 产酶条件优化
2.1.1 装液量对产酶的影响
在发酵产酶时,培养基装液量会影响摇瓶内的溶氧水平,进而影响菌体生长和目的蛋白的表达。为了考察装液量对产酶的影响,将种子液接至不同装液量(25、50、75、100和150mL BMMY培养基)的500mL三角瓶中,按发酵培养条件对基因工程菌P.pastoris进行诱导培养,培养96 h后检测发酵液中脂肪酶的酶活,结果如图1所示。
由图1可知:当装液量为50mL时,比酶活达到最大值(2.31 U/L),继续增加装液量,酶活逐渐下降。原因可能是装液量过少会增加发酵过程中发酵液的蒸发损失,使有害代谢物浓度上升,从而影响菌体的生长及脂肪酶的表达。适量增加装液量可部分缓解上述问题,但装液量过多会导致培养基中溶氧水平降低,影响菌体生长和蛋白表达。因此,最佳装液量为500mL三角瓶中装液50mL。
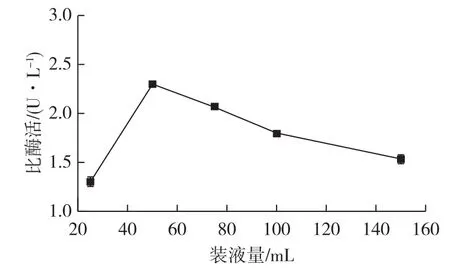
图1 装液量对产酶的影响Fig.1 Effect of loaded volume on enzyme activity
2.1.2 发酵培养基初始pH对产酶的影响
重组毕赤酵母可在pH 3.0~7.0范围内正常生长,但外源蛋白表达的适宜pH随着目的蛋白不同存在很大的差异。考察发酵培养基初始pH对产酶的影响,将种子液接入初始 pH分别为5.0、6.0、7.0、8.0、9.0和10.0的BMMY培养基中,按发酵液培养条件对基因工程菌P.pastoris进行诱导培养,96 h后检测发酵液中脂肪酶的酶活,结果如图2所示。
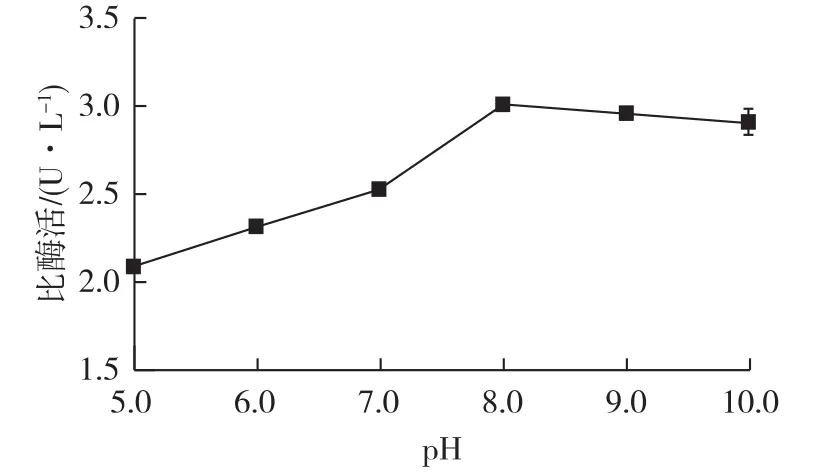
图2 培养基初始pH对产酶的影响Fig.2 Effect of pH on enzyme activity
由图2可知:培养基初始pH为8.0时比酶活最高(3.0 U/L)。当pH低于8.0时,脂肪酶酶活随pH升高明显增加,这可能是由于发酵过程中菌体产生的酸性代谢产物使发酵液酸性增强,从而影响细胞代谢和脂肪酶酶活。当pH高于8.0时,碱性条件会抑制毕赤酵母的生长,从而抑制脂肪酶的表达。故培养基初始pH以8.0为宜。
2.1.3 甲醇体积分数对产酶的影响
发酵培养阶段,甲醇可作为重组毕赤酵母的C源和产酶诱导剂,诱导醇氧化酶(AOX)的合成[17],因此,甲醇体积分数可能会影响胞外蛋白的表达量。按发酵液培养条件对基因工程菌P.pastoris进行诱导培养,每隔24 h按培养基体积分数的0.5%、0.75%、1.0%、1.25%、1.5%和2.0%补加无水甲醇,培养96 h后检测发酵液中脂肪酶的酶活,结果如图3所示。
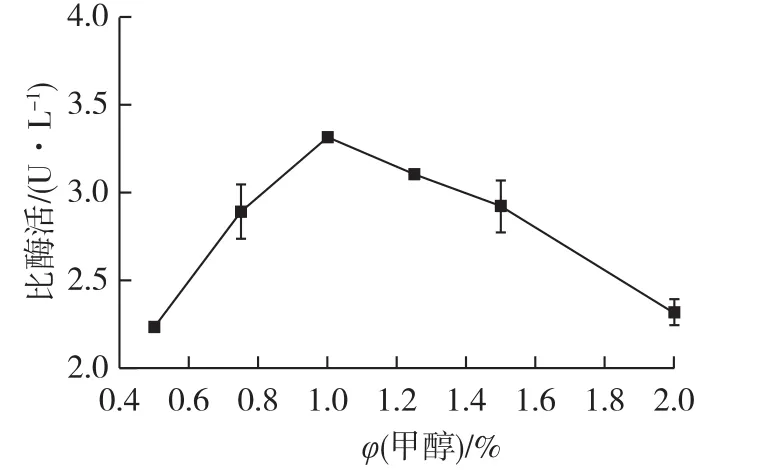
图3 甲醇体积分数对产酶的影响Fig.3 Effect of methanol volume fraction on enzyme activity
由图3可知:当甲醇体积分数为0.5%时,已有胞外脂肪酶的表达,但酶活较低,表明0.5%的甲醇不能有效维持重组毕赤酵母的菌体生长代谢及胞外蛋白表达。随着甲醇体积分数的增加,脂肪酶活力逐渐提高;当甲醇体积分数为1.0%时,脂肪酶比酶活力最高(3.32 U/L);继续提高甲醇体积分数,脂肪酶比酶活力下降迅速,原因可能是甲醇积累抑制了细胞生长[18]。因此选择甲醇的最佳诱导体积分数为1.0%。
2.1.4 甲醇添加时间间隔对产酶的影响
毕赤酵母含有2个AOX基因,分别为AOX1和AOX2,其中AOX1为强启动子,细胞中绝大多数醇氧化酶活力由 AOX1提供[19]。将种子液接入BMMY培养基中,按发酵液培养条件对基因工程菌P.pastoris进行诱导培养,每隔4、8、12和24 h补加甲醇1次,培养96 h后检测发酵液中脂肪酶的酶活,结果如图4所示。
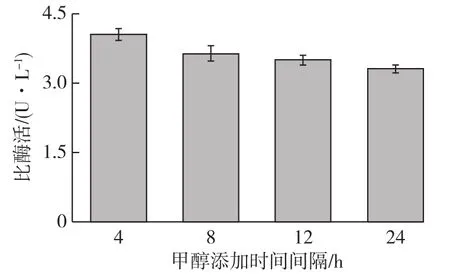
图4 甲醇添加时间间隔对产酶的影响Fig.4 Effects of time interval of adding methanol on enzyme activity
由图4可知:在24 h内甲醇添加总量不变的情况下,甲醇添加时间间隔为4 h时比酶活最高(4.06 U/L),随着添加时间间隔的变大,酶活逐渐下降。这主要是由于重组毕赤酵母对甲醇浓度的瞬间变化较敏感,甲醇浓度频繁波动会导致AOX1活力降低,并可能导致细胞死亡,因此维持发酵液中甲醇浓度相对稳定对提高重组蛋白的诱导表达有重要意义[20-21]。
2.1.5 培养时间对酶活的影响
按发酵液培养条件对基因工程菌P.pastoris进行诱导培养,每隔24 h取样检测发酵液中脂肪酶的酶活,分别培养24、48、72、96、120、144、168、192和216 h,考察培养时间对产酶的影响,结果如图5所示。
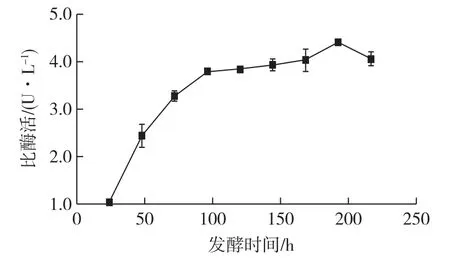
图5 发酵时间对产酶的影响Fig.5 Effect of fermentation time on enzyme activity
由图5可知:随着发酵时间的延长,脂肪酶活力逐渐提高,在192 h时比酶活最高(4.41 U/L),比优化前(2.31 U/L)提高90.9%。192 h后有所下降,推测为菌体密度大、营养缺乏、酵母细胞衰老、表达外源蛋白能力减弱,酵母细胞分泌的蛋白酶积累,降解外源蛋白,从而导致酶活下降[22]。因此,确定最佳发酵时间为192 h。据文献[2]报道,脂肪酶435比酶活为0.92 U/g,因此,每升该发酵液酶活力相当于4.79g脂肪酶435酶活力。
2.2 生物拆分制备S-(+)-DMCPA的条件优化
2.2.1 反应温度对拆分产率和e.e.值的影响
反应温度在手性拆分过程中对酶活力以及对映体选择性具有关键作用。考察不同温度(25、30、35、40和45℃)对产物S-(+)-DMCPA产率和e.e.值的影响,结果如图6所示。
由图6可知:当温度为30℃时,S-(+)-DMCPA产率最高。随着温度升高,产率逐渐下降,这可能是由于高温导致脂肪酶失活。而e.e.值随温度变化不大,均在99%以上。因此最佳反应温度为30℃。
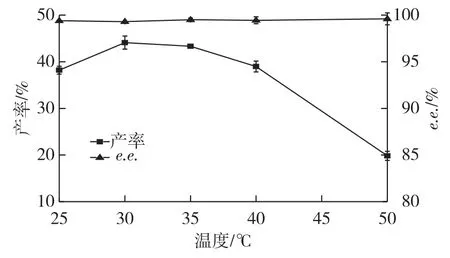
图6 温度对拆分产率和e.e.值的影响Fig.6 Effects of temperature on yield and e.e.value of S-(+)-DMCPA
2.2.2 底物浓度对产率和e.e.值的影响
底物浓度越高,酶与底物接触的几率就越高,反应也越充分;当底物浓度较低时,酶催化反应速度与底物浓度成正比,反应速度随着底物浓度的增加而加快。当底物浓度超过一定值后,反应速度的上升与底物浓度不再成正比,而是逐渐趋向平衡,此时继续增大底物浓度已无意义。为此,考察不同底物浓度(10、15、20、25和30mmol/L)对产物S-(+)-DMCPA产率和 e.e.值的影响,结果如图 7所示。
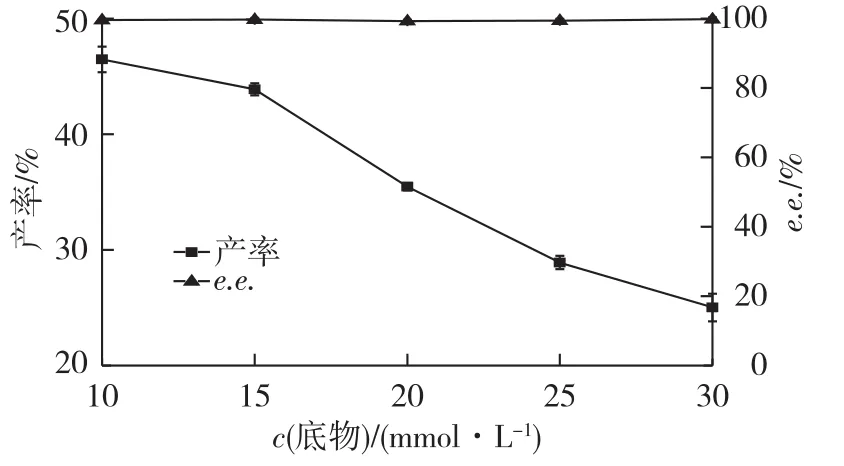
图7 底物浓度对拆分产率和e.e.值的影响Fig.7 Effects of substrate concentration on yield and e.e.value of S-(+)-DMCPA
由图7可知:当底物浓度低于15mmol/L时,S-(+)-DMCPA产率均保持在40%以上,e.e.值为99%以上。继续增加底物浓度,产率降低,综合考虑产率和e.e.值,选择最适底物浓度为15mmol/L。底物浓度高于 Wang等[5]报道的利用 Rhodococcus sp.AJ270不对称水解1mmol/L的2,2-二甲基环丙烷甲腈制备S-(+)-DMCPA,产物e.e.值也优于其报道的88%。
2.2.3 反应时间对产率和e.e.值的影响
为考察反应时间对产率和e.e.值的影响,反应8 h后每隔4 h取样检测,考察产物产率和e.e.值随时间的变化规律,结果如图8所示。
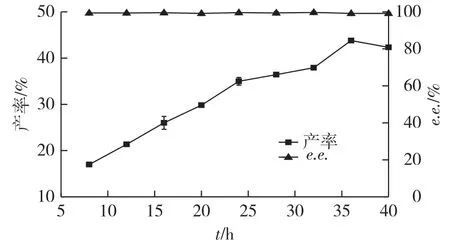
图8 反应时间对产率和e.e.值的影响Fig.8 Effects of time course on yield and e.e.value of S-(+)-DMCPE
由图8可知:S-(+)-DMCPA产率随着时间的延长而增高,e.e.值均在99%以上,36 h时产率最大,为43.8%,产物浓度达6.6mmol/L。继续延长反应时间未能提高产率,综合考虑产率和e.e.值,选择反应时间为36 h。
3 结论
利用工程菌产生的胞外脂肪酶催化外消旋2,2-二甲基环丙烷甲酸乙酯不对称水解合成西司他丁关键手性中间体S-(+)-2,2-二甲基环丙烷甲酸。当500mL三角瓶装液量为50mL,发酵培养基初始pH为8.0,产酶培养过程中每隔4 h向培养基中补加终体积分数为1.0%的甲醇,200r/min、30℃下诱导发酵192 h,酶活可达到4.41 U/L,较优化前(2.31 U/L)提高90.9%。优化获得最佳转化条件:200r/min、30℃、底物浓度15mmol/L、反应36 h,产物S-(+)-DMCPA产率为43.8%,e.e.值为99.8%。
采用重组脂肪酶催化DMCPE不对称水解合成西司他丁关键手性中间体S-(+)-DMCPA,与采用产胞内脂肪酶的全细胞催化相比,以含胞外脂肪酶的发酵上清液直接催化具有预处理简单、反应过程中传质阻力小等优点;与脂肪酶435的催化相比,具有成本低廉的优点。但目前工艺仍然存在菌体产酶周期较长、催化水解的底物浓度较低等缺点,如何缩短菌体培养时间、提高底物浓度及脂肪酶重复利用将会成为后续的研究方向。
[1]刘婧,黄金,钟成刚,等.制备S-(+)-2,2-二甲基环丙烷甲酸的研究进展[J].齐鲁药事,2012(5):283-286.
[2]Liang F Y,Huang J,He J Y,et al.Improved enantioselective hydrolysis of racemic ethyl-2,2-dimethylcyclopropanecarboxylate catalyzed by modified Novozyme 435[J].Biotechnol Bioproc Eng,2012,17(5):952-958.
[3]石晓华,周舞阗,陈新志.2,2-二甲基环丙烷甲酸的合成与拆分[J].高校化学工程学报,2005,19(3):384-387.
[4]郑裕国,沈寅初.手性医药化学品生物催化合成进展与实践[J].生物加工过程,2003,1(2):24-29.
[5]Wang M X,Feng G Q.Enzymatic synthesis of optically active 2-methyl-and 2,2-dimethylcyclopropanecarboxylic acids and their derivatives[J].J Mol Catal B:Enzym,2002,18(4):267-272.
[6]Yeom S J,Kim H J,Oh D K.Enantioselective production of 2,2-dimethylcyclopropane carboxylic acid from 2,2-dimethylcyclopropane carbonitrile using the nitrile hydratase and amidase of Rhodococcus erythropolis ATCC 25544[J].Enzyme Microb Tech,2007,41:842-848.
[7]王普,祝加男,何军邀.脂肪酶Novozyme 435选择性催化 2,2-二甲基环丙烷甲酸乙酯合成S-(+)-2,2-二甲基环丙烷甲酸[J].催化学报,2010,31(6):651-655.
[8]Ranganathan S V,Narasimhan S L,Muthukumar K.An overview of enzymatic production of biodiesel[J].Bioresour Technol,2008,99(10):3975-3981.
[9]何军邀,许江丽,钟成刚,等.酵母脂肪酶的制备及应用新进展[J].生物技术,2011,21(4):93-97.
[10]Hasan F,Shah A A,Hameed A.Industrial applications of microbial lipases[J].Enzyme Microb Technol,2006,39:235-251.
[11]Hoegh I,Patkar S,Halkier T,et al.Two lipases from Candida antrctica:cloning and expression in Aspergillus oryzae[J].Can J Biotech,1995,73:S869-S875.
[12]Larsen M W,Bornscheuer U T,Hult K.Expression of Candida antarctica lipase B in Pichia pastoris and various Escherichia coli systems[J].Protein Expr Purif,2008 62:90-97.
[13]Zhang N Y,Suen W C,Windsor W,et al.Improving tolerance of Candida antarctica lipase B towards irreversible thermal inactivation through directed evolution[J].Protein Eng,2003,16:599-605.
[14]Liu D,Schmid R D,Rusnak M.Functional expression of Candida antarctica lipase B in the Escherichia coli cytoplasm:a screening system for a frequently used biocatalyst[J].Appl Microbiol Biotech,2006,72:1024-1032.
[15]Emond S,Montanier C,Nicaud J M,et al.New efficient recombinant expression system to engineer Candida antarctica lipase B[J].Appl Environ Microbiol,2010,76:2684-2687.
[16]Liu Z Q,Zheng X B,Zhang S P,et al.Cloning,expression and characterization of a lipase gene from the Candida antarctica ZJB09193 and its application in biosynthesis of vitamin A esters[J].Microbiol Res,2012,167:452-460.
[17]Zhao L,Liu Q J,Yan S L,et al.Multimeric immobilization of alcohol oxidase on electrospun fibers for valid tests of alcoholic saliva[J].J Biotechnol,2013,168:46-54.
[18]汪汇慧,金虎,高敏杰.甲醇/山梨醇共混流加诱导改变毕赤酵母生产猪α干扰素过程的代谢产能途径强化发酵性能[J].生物工程学报,2012,28(2):164-177.
[19]Cregg J M,Vedvick T S,Raschke W C.Recent advances in the expression of foreign genes in Pichia pastoris[J].Biotechnology,1993,11(8):905-910.
[20]周祥山,范卫民,张元兴.不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响[J].生物工程学报,2002,18(3):348-351.
[21]余占桥,马青山,赵龙妹.毕赤酵母优化表达外源蛋白策略[J].微生物学通报,2010,37(7):1035-1042.
[22]Gao M J,Zhan X B,Zheng Z Y,et al.Enhancing pIFN-alpha production and process stability in fed-batch culture of Pichia pastoris by controlling the methanol concentration and monitoring the responses of OUR/DO levels[J].Appl Biochem Biotech,2013,171(5):1262-1275.
(责任编辑 管 珺)
Process optimization catalyzed by recombinant Pichia patoris derived lipase B for the synthesis of cilastatin
ZHENG Lei1,HE Junyao1,2,HUANG Jin1,WANG Pu1
(1.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China;2.Zhejiang Pharmaceutical College,Ningbo 315100,China)
S-(+)-2,2-dimethylcyclopropane carboxylic acid (S-(+)-DMCPA) is a key chiral intermediate for the synthesis of cilastatin.A recombinant Pichia patoris can convert racemic ethyl-2,2-dimethylcyclopropane carboxylate(DMCPE)to S-(+)-DMCPA with high enantioselectivity.In order to enhance its catalytic efficiency,the lipase-producing conditions and catalytic conditions were optimized. The optimal conditions for lipase production were as follows:the optimal loaded volume was 50mL/500mL,initial pH of fermentation medium was 8.0.Methanol was added into the medium to a final concentration of 1%(V/V)at every 4 h intervals.Under the optimal conditions,the lipase activity of the recombinant reached 4.41 U/L within 192 h,with an increase of 90.9%compared to the control.The supernatant containing lipase was then used for biocatalytic resolution of DMCPE to S-(+)-DMCPA at 15mmol/L substrate concentration at 30℃ for 36 h.Under above conditions,the best yield of 43.8%was obtained with enantiomeric excess(e.e.)value of 99.8%.
cilastatin;Pichia pastoris;lipase;S-(+)-2,2-dimethylcyclopropane carboxylic acid;biocatalytic resolution
Q815
A
1672-3678(2015)03-0070-06
10.3969/j.issn.1672-3678.2015.03.013
2014-03-26
浙江省科技厅重大科技攻关项目(2010C11040);浙江省级公益性技术应用研究计划(2011C33005);浙江省教育厅科研项目(Y201226056)
郑 磊(1989—),男,浙江杭州人,硕士研究生,研究方向:生物催化与手性合成;王 普(联系人),教授,E-mail:wangpu@zjut.edu.cn
