产花生四烯酸油脂高山被孢霉干法造粒提油及菌粕的重复利用
2015-11-11商静生纪晓俊聂志奎张瑷珲颜佳铖
商静生,纪晓俊,聂志奎,张瑷珲,颜佳铖,张 鑫,黄 和
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
产花生四烯酸油脂高山被孢霉干法造粒提油及菌粕的重复利用
商静生,纪晓俊,聂志奎,张瑷珲,颜佳铖,张 鑫,黄 和
(南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,江苏 南京 210009)
对高产花生四烯酸油脂高山被孢霉干法造粒提油工艺中3个参数及菌粕重复利用进行研究。设计三因素四水平L16(43)正交试验,考察造粒直径、正己烷与菌粕的比例、萃取时间对提油效率及正己烷回收率的影响。结果表明:当含水率20%~25%、造粒直径1.2mm、正己烷的体积与颗粒的质量比20∶1 L/g、萃取时间5 h时,每克干菌体油脂得率0.559 4g,正己烷的回收率达90%。与均质湿法提油相比,分别提高了17.35%和83.67%。用碱性蛋白酶及复合酶(纤维素酶、果胶酶和碱性蛋白酶)处理菌粕,以50%替代氮源(酵母膏)添加到培养基中,发酵周期分别为10 d和7 d。此时,生物量、油脂产量、花生四烯酸产量都达到了最大值,分别为30.33g/L、16.25g/L、8.59g/L(碱性蛋白酶处理);29.77g/L、16.89g/L、7.12g/L(复合酶处理)。其中,复合酶处理菌粕的生产强度可达4.253g/(L·d)、2.413g/(L·d)和1.017g/(L·d),与碱性蛋白酶处理相比,其生产强度分别提高了40.22%、48.49%和18.39%。干法造粒提油是有效的,且酶法处理菌粕的方法有应用前景。
花生四烯酸;高山被孢霉;干法造粒;菌粕;生产强度
花生四烯酸(5,8,11,14-二十碳四烯酸,arachidonic acid,ARA)属于ω-6系列长链多不饱和脂肪酸(PUFAs),是人体中分布最广、含量最高和最活跃的一种必需 PUFAs[1],具有多种生物活性。它是婴幼儿成长过程中大脑和视神经发育不可缺少的物质,因此成为配方奶粉中的重要成分[2];同时也被批准作为营养强化剂应用于特殊膳食及调制乳粉中或作为新资源应用于食品中。另外,它还是前列腺素、环前列腺素和白三烯类等类二十烷酸的直接前体[3]。所以,ARA在促进智力发育、提高人体视力、降低血脂、增强免疫力和抗癌等方面具有重要作用[4],在生物医药、化妆品、功能性食品和保健品等领域具有广泛应用[5-6]。
ARA的传统来源是动物肝脏、猪肾上腺素及蛋黄[7],但动物组织中的ARA含量较低,无法满足日益增长的市场需求[8]。目前,ARA的生产主要采用高山被孢霉发酵,而国内外围绕这方面的研究则主要集中在菌种选育[9]、发酵调控[10]和油脂提取[11]等方面。
传统的微生物油脂提取采取湿法提油和干法造粒提法,其中,湿法提油法又分为均质提油或酶解提油这两种方法,两者的主要区别是破壁的方式不同。均质提油使用胶体磨和高压均质机破壁,酶解提油采用一定浓度的酶解液破壁,两种提油方式在油脂提取过程中都需要加入水分和乙醇来提高萃取剂(正己烷)的提油效率。此方法不仅加大了溶剂的消耗,同时需要高搅拌功率和大体积萃取罐,加大了设备和成本投入。而干法造粒提油在提油前菌体需要干燥到很低的含水量,可在体积较小的萃取罐中操作。
高山被孢霉作为一种产油微生物,在萃取得到微生物油脂后,剩余大多数的菌渣,是微生物细胞及结构的成分,其富含丰富的蛋白质和碳水化合物及少量几丁质微纤维。在全球提倡废弃物充分合理利用的情况下,高山被孢霉菌渣如何合理高效利用是亟待解决的问题。合适的提油方法和菌渣再利用研究是解决此问题的关键。高压均质提油和酶解提油得到的菌渣呈现流体状,残留大量有机溶剂且不易去除[12],没有太大的应用价值或再应用范围存在局限性,一般作为废弃物被填埋,这不仅是对资源的极大浪费,而且还会引起污染——环境富营养化。干法造粒提油在提油阶段不需要水的参与,是有机溶剂与破壁造粒菌体直接接触[13],提油后菌渣呈颗粒状,对菌渣进行简单处理,即可将残留有机溶剂去除,可用于饲料或酶解处理[14]后替代高山被孢霉发酵所用的昂贵酵母膏,不仅节约了生产成本,同时有效利用了资源。因此,本文笔者利用干法造粒提油法来处理高山被孢霉,考察相关的工艺参数及菌渣的重复利用,为综合利用高山被孢霉菌渣奠定基础。
1 材料与方法
1.1 材料
菌种:高山被孢霉(Mortierella alpina)R807[15]。在中国典型培养物保藏中心(CCTCC)保藏,保藏日期2012年4月23日,保藏编号为CCTCC M 2012118。
酶制剂:碱性蛋白酶(200 U/mg),江苏锐阳生物科技有限公司;纤维素酶(>750 U/mg)、果胶酶(>99%),BIOSHARP公司。
试剂:葡萄糖(AR)、琼脂(BR),国药集团化学试剂有限公司;酵母膏(工业级),安琪酵母股份有限公司;玉米浆(工业级),靖江市陈氏工贸发展有限公司;NaNO3(AR),西陇化工股份有限公司;KH2PO4(AR)、MgSO4·7H2O(AR),上海凌峰化学试剂有限公司。
1.2 培养基
PDA培养基:土豆200g,葡萄糖20g,琼脂25g,定容到1 000mL。
种子培养基(g/L):葡萄糖30,玉米浆10,酵母膏2,KH2PO42。
发酵培养基(g/L):葡萄糖 80,酵母膏 10,NaNO33,KH2PO44,MgSO4.7H2O 0.5。
1.3 培养方法
种子接种到PDA培养基斜面上,25℃下培养5~7 d。
液体培养基活化 菌株从斜面接入装液量为20%的250mL的凹槽摇瓶中,25℃下培养2 d。转接入装液量为20%的500mL凹槽种子摇瓶中,25℃下培养1 d。
发酵培养 将活化好的种子以10%的接种量接入500mL的凹槽摇瓶中进行发酵。发酵培养基为用酶解菌粕以0%~100%的质量比替代原始培养基中的酵母膏。
1.4 分析方法
葡萄糖浓度的测定 利用SBA-40C型生物传感仪(山东省科学院生物研究所)测定葡萄糖的质量浓度。
菌丝体干质量(生物量)的测定 量取一定体积的发酵液(V),加入等量的蒸馏水,将混合物抽滤,并用蒸馏水洗涤3次,65℃下烘至恒质量(含水量在4%(质量分数)以下),称质量(m)。
生物量的计算见式(1)。

式中:W为生物量(g/L);m为干菌体质量(g);V为发酵液体积(L)。
生物量的生产强度计算见式(2)。

式中:q为生物量的生产强度(g/(L·d));t为发酵时间(d)。
油脂的测定 称取1g干菌体,加入50mL石油醚,抽提3 h,利用SZF-06GI型粗脂肪测定仪测定。
ARA含量测定[16]称取0.1g干菌体于2mL的离心管中,加入1.5mL色谱纯正己烷和0.2mL 4 mol/L的KOH-甲醇溶液,振荡混匀,静置12min。5 000r/min下离心5min,取0.3mL上清液于1.5mL的离心管中,加入0.5mL去离子水摇匀,5 000r/min下离心3min。取上清液0.08mL于2mL的离心管中,加入0.8mL色谱纯正己烷和少量的无水Na2SO4(吸水作用),取1 μL进样。
ARA质量浓度的计算见式(3)。

式中:H为ARA的质量浓度(g/L);A为ARA在油脂中的含量(%);Y为油脂的质量浓度(g/L)。
ARA生产强度的计算见式(4)。

式中,X为ARA的生产强度(g/(L·d))。
1.5 菌粕预处理
单一碱性蛋白酶处理:称取一定质量的菌粕,用去离子水稀释10倍,调节pH为9.3~9.7之间,加入质量分数2%的碱性蛋白酶,60℃、170r/min下酶解3 h,备用。
混合酶处理:称取一定质量的菌粕,用去离子水稀释10倍,调节pH为4.3~4.7之间。加入质量分数3%的纤维素酶和3%的果胶酶,50℃、170r/min下恒温酶解5 h。调节pH为9.3~9.7,加入质量分数为2%的碱性蛋白酶,60℃、170r/min下酶解3 h,备用。
2 结果与讨论
2.1 干法造粒提油工艺的研究
图1是干法造粒提油工艺。在60℃下发酵液经巴斯德灭菌灭活脂肪酶,降低脂肪酸的氧化。经板框过滤、水洗干燥去除菌体中的水分。粉碎机破壁,加入极少量的水造粒,可使颗粒成型。萃取剂(正己烷)萃取,真空蒸馏得到毛油,剩余的菌渣中含有丰富的蛋白质和碳水化合物,可用作饲料或处理后添加到培养基中。
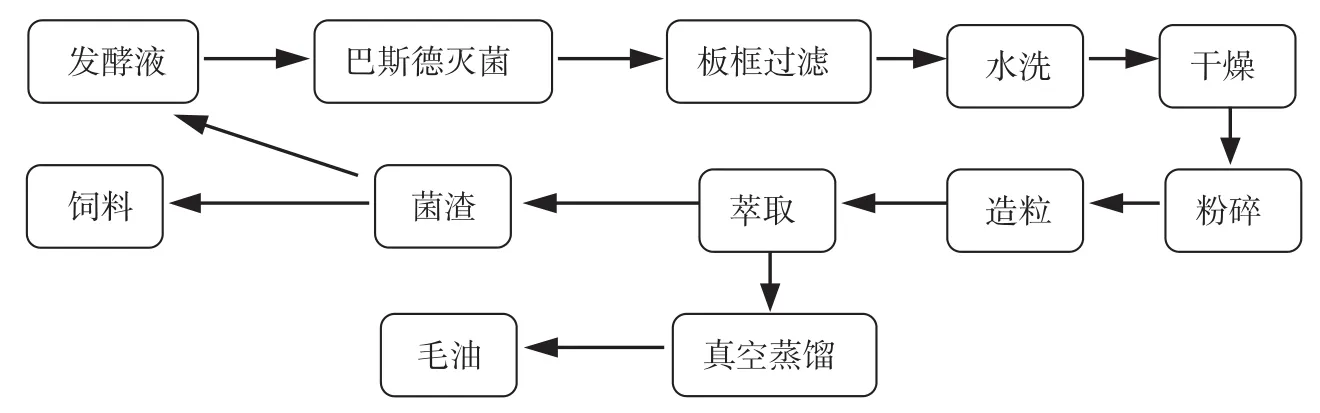
图1 干法造粒提油工艺流程Fig.1 Dry granulation oil extraction process
干法提油过程中首先应控制粉碎菌渣的含水量,反复实验,当含水率为20%~25%(质量分数)时,可得到颗粒均匀、分散良好的菌粒。其次是对各个环节中重要参数的研究,比如造粒直径、萃取剂添加量和萃取时间对提油效率和正己烷回收率的影响。
2.2 干法造粒提油参数的研究
通过L16(43)正交试验来考察造粒直径、正己烷的添加量、萃取时间对单位干菌体油脂得率和正己烷回收率的影响,相关因素的水平设计及试验结果见表1。以单位干菌体得率为优化目标的直观分析结果见表2。

表1 L16(43)正交试验设计方案及试验结果Table 1 Design and results of L16(43)orthogonal experiment

表2 以单位干菌体得率为优化目标的直观分析Table 2 Range analysis of orthogonal experimental results on yeild of per gram dry biomass
菌粒直径大小直接影响正己烷与菌体接触面积和浸润程度。提油过程中,无需搅拌,若菌粒直径太小,颗粒之间的缝隙较小,无法与正己烷完全接触,同时影响菌粒形状,成型的颗粒经长时间浸泡后松散;菌粒太大,减弱正己烷在菌粒中的传质。随着正己烷添加量的增加和萃取时间的延长,传质动力提高,增加单位干菌体的油脂得率,但会降低正己烷的回收率,增加成本。综合表1和表2数据可知:当颗粒直径1.2mm、正己烷的添加量100mL、萃取时间5 h时,正己烷的回收率和单位干菌体的油脂得率最大,分别为90%和0.559 4g。与均质提油的49%和0.476 7g(本实验室数据)相比,提高了83.67%和17.35%。
2.3 菌粕替代发酵实验研究
2.3.1 不同菌粕添加比例对发酵的影响
为了得到最优的菌粕添加比例,将酶解的菌粕以10%~100%的比例替代发酵培养基中的酵母膏,考察发酵结束后生物量、油脂含量和ARA的浓度。图2是两种不同酶解方法下的发酵数据。由图2可知:随着菌粕添加比例的增加,生物量、油脂浓度和ARA浓度呈不规则变化,分析原因可能是菌粕未被完全利用及菌粕中残渣的影响。在菌粕添加比例为50%时,两者生物量、油脂浓度和ARA的浓度都达到最大值,分别为 30.33g/L、16.25g/L、8.59g/L及 29.77g/L、16.89g/L、7.12g/L,发酵周期为10 d和7 d。酶解菌粕中的残渣及氮源含量影响了菌体的代谢速率,较之碱性蛋白酶,复合酶酶解得彻底,残渣量较少,继而发酵周期缩短。较小添加比例,氮源不足;较大添加比例,残渣较多,使不同的添加比例出现不同的发酵结果。

图2 两种酶解菌粕的不同添加比例对生物量、油脂浓度及ARA质量浓度的影响Fig.2 Effects of different proportion of fungal residues hydrolyzed by two methods on biomass,lipids and ARA
2.3.2 酶解方法对发酵强度的影响
菌粕中主要成分为蛋白质类化合物及少量纤维素等,部分物质在水中较难溶解。作为氮源直接添加到培养基中,会降低其利用率或无法被利用。本实验中,笔者研究了两种酶解方法——单一碱性蛋白酶水解和复合酶水解对生物量、油脂浓度和ARA浓度的影响。图3是酶解方式对生物量生产强度、油脂生产强度和ARA生产强度的影响结果。由图3可知:任何添加比例下,复合酶酶解的发酵强度高于单一碱性蛋白酶酶解。生物量、油脂和ARA的最高生产强度可达 4.253g/(L·d)、2.413g/(L·d)和1.017g/(L·d)。与碱性蛋白酶相比,分别提高了40.22%、48.49%和18.39%。
3 结论
通过对高山被孢霉干法造粒提油工艺和菌粕利用的研究,发现此循环工艺是可行的。正交试验结果表明:造粒直径为1.2mm、正己烷的体积与颗粒的质量比为20∶1、萃取时间为5 h,单位干菌体可得油脂0.559 4g,正己烷的回收率可达90%,分别提高了17.35%和83.67%。碱性蛋白酶及纤维素酶、果胶酶、碱性蛋白酶复合酶前处理干菌体,以一定的比例替代氮源(酵母膏),两种处理方式下的发酵周期分别为10 d和7 d,当添加的比例为50%时,生物量、油脂含量和ARA含量都达到最大值,分别为30.33g/L、16.25g/L和8.59g/L;29.77g/L、16.89g/L和7.12g/L。而复合酶处理菌渣发酵生产强度最大,分别为 4.253、2.413和 1.017g/(L·d)。本研究只对干法提油工艺参数中的3种情况进行了优化,而干燥温度、颗粒形态及不同溶剂这些影响条件也值得进一步研究。

图3 酶解方法对发酵强度的影响Fig.3 Effects of different enzymatic methods on producvitity of fermentation
[1]Ji X J,Ren L J,Nie Z K,et al.Fungal arachidonic acid-rich oil:research,development and indstrialization[J].Crit Rev Biotechnol,2014,34(3):197-214.
[2]Birch E E,Garfield S,Hoffman D R,et al.A randomized controlled trial of early dietary supply of long-chain polyunsaturated fatty acids and mental development in term infants[J].Dev Med Child Neurol,2000,42(3):174-181.
[3]Singh G,Chandra R K.Biochemical and cellular effects of fish and fish oils[J].Prog Food Nutr Sci,1988,12(4):371-419.
[4]Gill I,Valivtry R.Polyunsaturated fatty acid:part 1.occurrence,biological activities and applications[J].Trends Biotechnol,1997,15:401-409.
[5]汪志明.花生四烯酸的生产及应用[J].中国食品添加剂,2001(1):30-33.
[6]周正雄,卢英华,班甲,等.微生物发酵法生产花生四烯酸油脂的研究进展[J].生物加工过程,2013,11(4):72-78.
[7]Bajpai P K,Bajpai P,Ward O P.Production of arachidonic acid byMortierella alpina ATCC 32222[J].JInd Microbiol Biotechnol,1991,8(3):179-186.
[8]Chen H,Chang C,Chen C.Optimization of arachidonic acid production by Mortierella alpina Wuji-H4 isolate[J].J Am Oil Chem Soc,1997,74(5):569-578.
[9]Liu X,Zhang H M,Ji X J,et al.An improved sampling protocol for analysis of intracellular metabolites in Mortierella alpina[J]. Biotechnol Lett,2012,34(12):2275-2282.
[10]Peng C,Huang H,Jing M J,et al.Optimization of medium components for biomass and arachidonic acid production by Mortierella alpina ME-1 using response surface methodology[J]. Food Sci,2009,30(13):205-211.
[11]Nisha A,Udaya Sankar K,Venkateswaran G.Supercritical CO2 extraction of Mortierella alpina single cell oil:comparison with organic solvent extraction[J].Food Chem,2012,133(1):220-226.
[12]You J Y,Peng C,Liu X,et al.Enzymatic hydrolysis and extraction of arachidonic acid rich lipids from Mortierella alpina[J]. Bioresour Technol,2011,102(10):6088-6094.
[13]Zhu M,Zhou P P,Yu L J.Extraction of lipids from Mortierella alpina and enrichment of arachidonic acid from the fungal lipids[J].Bioresour Technol,2002,84(1):93-95.
[14]Zheng H L,Gao Z,Ji X J,et al.Lipid production of Chlorella vulgaris from lipid-extracted microalgal biomass residues through two-step enzymatic hydrolysis[J].Bioresour Technol,2012,117:1-6.
[15]丛蕾蕾,纪晓俊,聂志奎,等.花生四烯酸油脂高产菌株的选育[J].生物加工过程,2012,10(5):34-38.
[16]邓中涛,纪晓俊,聂志奎,等.高山被孢霉三阶段培养法高效生产花生四烯酸油脂工艺研究[J].生物加工过程,2013,11(4):8-13.
(责任编辑 荀志金)
Extraction of lipids from arachidonic acid-rich oil producing Mortierella alpina with dry granulation and reusing fungal residues
SHANG Jingsheng,JI Xiaojun,NIE Zhikui,ZHANG Aihui,YAN Jiacheng,ZHANG Xin,HANG He
(State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 210009,China)
Extracting lipids from arachidonic acid-rich oil producing Mortierella alpina with dry granulation and fungal residues reuse methods were developed.The effects of three parameters,including fungal particle diameter,proportion of n-hexane-to-fungal residues and extraction time,on the lipid extraction efficiency and n-hexane recovery rate were investigated through L16(43)orthogonal experiment. When the moisture content of fungal particles was between 20%and 25%,with the aforementimed three parameters being 1.2mm,20∶1 L/g and 5 h,respectively,the lipid and n-hexane recovery yield reached 0.559 4g/g dry biomass and 90%,increased by 17.35%and 83.67%,comparing with the traditionally used homogeneous wet extraction method.Pretreating with alcalase and complex enzyme including cellulose,pectinase and alcalase,fungal residues could be resued to replace the nitrogen source partly forthe growth of M.alpina.When 50%proportion of fungal residues were added into the medium,the fermentation time was 10 d with alcalase pretreatment and 7 d with complex enzyme pretreatment.At the same time,biomass,lipid and ARA content reached 30.33g/L,16.25g/L,8.59g/L(alcalase pretreatment),and 29.77g/L,16.89g/L and 7.12g/L(complex enzymatic pretreatment),respectively. The productivity of fungal residues pretreated with compound enzyme could reach 4.253,2.413 and 1.017g/(L·d),respectively.Comparing with pretreating by alcalase,the productivity increased by 40.22%,48.49%and 18.39%,respectively.Extraction with dry grandation is effective and pretreatment of fungal residue with enzyme is also promising.
arachidonic acid;Mortierella alpina;dry granulation;fungal residues;productivity
TS224.4;Q815
A
1672-3678(2015)02-0024-06
10.3969/j.issn.1672-3678.2015.02.005
2014-03-07
国家高技术研究发展计划(863计划)(2014AA021703);国家自然科学基金(21376002、21476111);江苏省自然科学基金(BK20131405);江苏省高校优势学科建设工程
商静生(1987—),男,河北保定人,硕士研究生,研究方向:生物化工;纪晓俊(联系人),副教授,E-mail:xiaojunji@njtech.edu.cn
