菊糖抗氧化活性及其机理
2015-11-11刘德萍吴平
刘德萍,吴平
(江南大学直属附属医院(无锡市第四人民医院),江苏无锡214062)
菊糖抗氧化活性及其机理
刘德萍,吴平*
(江南大学直属附属医院(无锡市第四人民医院),江苏无锡214062)
通过测定菊糖的还原能力、Fe2+螯合能力,以及DPPH自由基清除能力等方法,评价菊糖的抗氧化能力,并采用Caco-2细胞模型探讨其抗氧化机理。3种抗氧化活性实验结果表明,菊糖具有良好的抗氧化活性。与阳性对照组比较,菊糖对H2O2诱导的Caco-2细胞氧化损伤具有显著的保护作用。当菊糖质量浓度为0.8 mg/mL时,Caco-2细胞中过氧化氢酶、谷胱甘肽还原酶,以及谷胱甘肽过氧化物酶的活力,分别提高了35.8%,47.6%和61.2%。菊糖主要通过提高细胞内抗氧化酶的活力发挥其抗氧化作用。
菊糖;抗氧化活性;Caco-2细胞模型;机制
菊糖,又名菊粉、菊苣多糖,是D-果糖经β(2→1)键连接的链状果聚糖,末端常含有一个葡萄糖基,一般从菊苣或菊芋中提取获得[1]。菊糖作为一种水溶性很好的膳食纤维,具有很多促进人体健康的生理功能。例如,具有低热量、非胰岛素依赖性、非龋齿性等特点,适于糖尿病患者食用;菊糖还可降低血液中胆固醇和甘油三酯的含量,可用来减肥、预防心血管疾病和高胆固醇血症;也可作为双歧杆菌增殖因子,调节肠道功能,预防结肠癌等。此外,菊糖持水性高,可预防便秘,可广泛应用于开发临床营养治疗产品、功能性食品和保健品等[2]。
目前,大量研究结果显示,部分植物多糖如黄芪多糖[3]、大蒜多糖[4-5]等具有清除自由基、抑制脂质氧化及提高抗氧化酶活性的功能。目前,已有部分文献报道菊糖具有抗氧化活性[6-7],但对其抗氧化机理探讨还鲜见报道。国内外营养学研究表明,活性多糖的抗氧化作用主要是清除体内自由基、提高抗氧化酶活性及抑制脂质过氧化等,多数活性多糖的抗氧化机理可能是调控Nrf2-Keap1-ARE信号通路[8]。作者利用3种体外方法和Caco-2细胞模型对菊糖抗氧化功能进行分析,并探讨菊糖抗氧化活性作用机理,为今后菊糖在医药及保健品开发方面的应用提供依据。
1 实验器材
1.1材料与试剂
菊糖ORFTITMHP型,江南大学食品学院提供;磷酸缓冲液、无水乙醇、三氯乙酸、氯化高铁(FeCl3· H2O)、七水合硫酸亚铁、H2O2(体积分数30%)、NaOH,购自国药集团化学试剂有限公司;铁氰化钾,上海试剂一厂产品;DPPH(1,1-二苯基苦基苯肼)、Ferrizine试剂,Sigma公司产品;DMEM培养基、胎牛血清、链霉素、青霉素、非必需氨基酸,美国Gibco公司产品;质量分数0.25%胰酶(含EDTA)、Triton X-100过氧化氢酶(CAT)、谷胱甘肽氧化酶(GSH-Px)、谷胱甘肽还原酶(GSH-Rx),碧云天生物技术研究所研制;其他各种分析纯试剂,国药集团化学试剂有限公司产品。
1.2仪器与设备
722型可见分光光度计,上海精密仪器有限公司制造;UV-2100型紫外可见分光光度计,尤尼柯仪器有限公司制造;AKTATM蛋白质分析纯化系统,瑞士Amersham Bioscences公司制造;J-26XPI型高效冷冻离心机,美国BECKMAN公司制造;细胞培养瓶及培养板,美国Corning公司制品;CO2细胞培养箱、Nano drop 2000型分光光度仪,美国ThermoForma公司制造;细胞刮刀,上海耐思生物公司制品;BIOsafe12型生物安全柜,中国HealForce公司制造;恒温水浴锅,上海精宏实验设备有限公司制造;MS3digital漩涡震荡器、摇床,德国IKA公司制造;U410型超低温冷冻冰箱,美国New Brunswick Scientific公司制造;4000 mini型Image Quant LAS,美国GE公司制造;倒置显微镜,日本OLY MPUS公司制造;台式高速冷冻离心机、PCR仪,德国Eppedorf公司制造。
2 实验方法
2.1还原能力的测定
将菊糖样品配制成质量浓度分别为1、5、10、25、50 mg/mL的溶液,各取出2 mL作为样品待测溶液,分别加入0.2 mol/L pH 6.6的磷酸盐缓冲液2 mL,质量分数10%的铁氰化钾(K3Fe(CN)6)溶液2 mL混匀,50℃水浴中保温20 min,接着加入体积分数10%的三氯乙酸(TCA)溶液2 mL,振荡混匀后离心(1 000 r/min)。再各取去沉淀后的上清液2 mL加入2 mL去离子水和0.4 mL质量分数0.1%的FeCl3溶液,振荡混匀后在50℃水浴下保温10 min,溶液慢慢由黄色变为深蓝色,在波长700 nm下进行比色。样品空白对照为去离子水。测定值取3次平行测定的平均值。
2.2螯合金属离子能力的测定
Fe2+螯合能力测定[10]方法:配制质量浓度分别为1、5、10、25、50 mg/mL的菊糖溶液,从中分别取出0.5 mL样品液,以等体积去离子水代替样品液作空白对照,吸光值为A,所有测定值为3次平均值。配制FeCl2溶液浓度为0.25、0.20、0.15 mmol/L,加入至各质量浓度样品测量吸光值。螯合率按公式(1)计算:

式(1)中,Ac为去离子水吸光值,Ay为加入FeCl2溶液的菊糖样品液吸光值。
2.3DPPH自由基捕获能力的测定
DPPH自由基捕获能力的测定[11]方法:配置0.1 mmol/L DPPH溶液(溶于体积分数95%的乙醇),样品组菊糖质量浓度分别为1、5、10、25、50 mg/ mL,称取不同质量浓度的样品溶于2 mL去离子水中,加入2 mL DPPH溶液,避光反应25 min;阳性对照组为2 mL DPPH溶液加入2 mL去离子水(代替样品),空白组为等体积去离子水和体积分数95%乙醇混合液。在波长517 nm处分别测定吸光值Ai、Aj、A0。清除率按公式(2)计算:

式(2)中,Ai为样品组吸光值,Aj为空白组吸光值,A0为对照组吸光值。
2.4Caco-2细胞培养
将Caco-2细胞培养于含体积分数20%胎牛血清的DMEM培养基中,培养温度37℃,CO2体积分数5%,隔天换一次培养液。本实验中所采用的细胞传代数均为15~55代。Caco-2细胞长满培养瓶底约85%面积时,吸去培养基,加入PBS清洗两次,加入消化液1 mL,消化2~3 min后,吹打至细胞呈单个悬浮状,以1×106个/孔的密度接种到培养板中,隔天换液。当Caco-2细胞铺满培养板底约85%面积时进行各项指标测定。
2.5Caco-2细胞体外氧化损伤模型的建立
按照2.4中Caco-2细胞培养方法,待细胞长至培养板底面积85%左右时,吸去培养基,PBS清洗两次,再加入不含血清的培养基。每孔加入浓度不同的H2O2,使终浓度为0.2、0.4、0.6、0.8、1.0 mmol/ L,作用4 h后检测细胞存活率。每组实验设置3个平行,以无任何处理的Caco-2细胞的存活率作为100%。
2.6细胞存活率检测
采用WST-1法检测细胞存活率,当48孔中Caco-2细胞培养结束后,每孔加入100 μL培养液,再加入10 μL WST-1试剂,培养30 min后于450 nm处测定每孔吸光值。以无任何处理的Caco-2细胞组为对照组,按公式(3)计算细胞存活率

式(3)中,A450为实验组的吸光值,A'450为对照组的吸光值。
2.7菊糖对Caco-2细胞的抗氧化保护作用
待Caco-2细胞长满培养板底85%左右面积时,吸去培养基,用PBS清洗两次,加入不含血清的培养基,接着分为4组进行处理比较。
1)阴性Caco-2细胞对照组(NEG):只加入不含胎牛血清的培养基;
2)阳性Caco-2细胞对照组(POS):在培养基中加入H2O2,终浓度为1 mmol/L;
3)正常Caco-2细胞实验组:加入含有不同质量浓度的菊糖培养基孵育细胞2 h后,吸去旧培养基,接着用PBS清洗,最后加入含H2O2的培养基;
4)加入菊糖的Caco-2细胞对照组:加入含有不同质量浓度菊糖的培养基,细胞孵育6 h,按照WST-1法检测细胞存活率,阴性对照组的细胞存活率为100%。
2.8细胞内氧化还原酶系指标的测定
分别按紫外比色法检测过氧化氢酶、谷胱甘肽还原酶、谷胱甘肽过氧化物酶的活力。
2.9数据处理与统计方法
采用GraphPad Prism○R5 package软件制图,实验数据采用t-test法比较两组间差异。
3 结果与讨论
3.1还原能力
如图1所示,不同质量浓度菊糖样品溶液(1、5、10、25、50 mg/mL)的吸光值在可检测范围内,而且其还原能力随着菊糖质量浓度的增加而增强。

图1 不同质量浓度菊糖还原能力Fig.1 Reduction ability of inulin with various concentrations
3.2螯合金属离子能力
过渡金属离子铁离子是非常强的自由基发生剂,能够催化各种自由基的生成,如羟基自由基和超氧阴离子自由基。金属离子的存在使得捕捉自由基的抗氧剂消耗掉。如图2所示,选取浓度分别为0.15、0.20、0.25 mmol/L的底物FeCl2溶液,在底物FeCl2溶液浓度为0.15 mmol/L时,Fe2+螯合率大约在4.5%~10%;底物FeCl2溶液浓度为0.20 mmol/L时,Fe2+螯合率大约在15.8%~17.8%;底物FeCl2溶液浓度为0.25 mmol/L时,Fe2+螯合率约在16.8%~21.7%。随着菊糖浓度增加,二价铁离子的螯合能力逐渐增强,且随着底物浓度的增加,同一质量浓度菊糖的二价铁离子的螯合能力也逐步增强。
3.3DPPH自由基的捕获能力
DPPH·(1,1-二苯基苦基苯肼自由基)是一种合成的稳定的有机自由基,主要用来测定酚类物质和食品的抗氧化活性,多糖的抗氧化活性测定也可以采用此方法。此变化与抗氧化剂抗氧化能力及其数量呈定量关系。

图2 不同质量浓度菊糖对金属离子的螯合能力Fig.2 Metal ions chelating activityof inulin with various concentrations
如图3所示,伴随着菊糖质量浓度逐渐增加,DPPH自由基清除率逐步增加,提示随着菊糖质量浓度增加,菊糖抗氧化能力逐渐增强。当菊糖质量浓度达到60 mg/mL时,DPPH自由基清除率最高可达31.2%;当质量浓度为5 mg/mL时,清除率为4.9%。

图3 不同质量浓度菊糖对DPPH自由基的捕获能力Fig.3 DPPH free radical scavenging activity of inulin with various concentrations
3.4H2O2诱导Caco-2细胞氧化损伤模型
Caco-2细胞模型是近20年来国内外广泛采用的研究药物小肠吸收的体外模型。它具有培养相对简单、结果重复性好及应用范围较广的优点。Caco-2细胞来源于人体的直肠癌,结构与功能与人小肠上皮细胞相似,含有与小肠刷状缘上皮相关的酶类,且与人体正常小肠上皮转运系统及酶类相似。由图4可知,0.2~1.0 mmol/L浓度范围的H2O2作用4 h后对Caco-2细胞具有显著的毒性作用,导致Caco-2细胞存活率降低;也可以发现Caco-2细胞存活率与H2O2浓度呈现负相关,在H2O2浓度为1.0 mmol/L时,Caco-2细胞存活率为51.5%,损伤程度较大。为突显菊糖的抗氧化活性保护作用,选择浓度为1.0 mmol/L的H2O2作用于Caco-2细胞的氧化损伤模型。如果用大于浓度1.0 mmol/L的H2O2作用于Caco-2细胞,导致Caco-2细胞存活率更低,作为一种抗氧化保护剂,抗氧化保护能力是有限的。

图4 不同浓度H2O2对Caco-2细胞存活率的影响Fig.4 Effect of H2O2with different concentrations on the viability of Caco-2 cells
3.5菊糖对Caco-2细胞氧化损伤的保护
为探讨菊糖对H2O2诱导损伤的Caco-2细胞的保护作用,实验中菊糖与Caco-2细胞共同孵育6 h。由图5可知,与对照组相比,经过0.2~0.6 mg/mL菊糖处理的Caco-2细胞,细胞存活率均在86%左右,存活率虽有所下降但无显著差异(p>0.05);但经过0.8~1.2 mg/mL菊糖处理的Caco-2细胞存活率出现下降趋势,随着质量浓度增加,存活率下降,表现出细胞毒性作用(p<0.05)。菊糖对Caco-2细胞抗氧化保护作用的双重性:低质量浓度时,菊糖有一定的抗氧化活性,对细胞具有抗氧化保护作用,但质量浓度超过一定的程度,可能也会使细胞机能和形态发生改变,从而导致Caco-2细胞死亡。在一定质量浓度范围内会随着质量浓度增加抗氧化保护能力逐渐增强,但达到顶峰时,继续增加菊糖的质量浓度,那将会导致对Caco-2细胞的致死作用强于抗氧化保护作用。故在研究菊糖的抗氧化机理时,选用0.2~0.8 mg/mL质量浓度的菊糖对Caco-2细胞进行抗氧化保护。

图5 不同质量浓度菊糖对Caco-2细胞存活率的影响Fig.5Effects of inulin with different concentrations onthe viability of Caco-2 cells
3.6菊糖对过氧化氢酶活力的调节
从图6可知,与阴性对照组比较,只加入H2O2的Caco-2细胞中,过氧化氢酶活力降低。与阳性对照组比较,加入0.2~0.8 mg/mL的菊糖处理后再加入H2O2的Caco-2细胞中,过氧化氢酶的活力分别提高了7.8%、15.9%、24.7%和35.8%。0.4~0.8 mg/ mL 3组与阳性对照组比较,过氧化氢酶活力显著提高(p<0.05);与阴性对照组相比,无显著性差异;只接受0.8 mg/mL菊糖处理组,过氧化氢酶活力稍降低,无显著性差异。

图6 不同质量浓度菊糖对过氧化氢酶活力的影响Fig.6 Effects of inulin with different concentrations oncatalase activity
3.7菊糖对谷胱甘肽还原酶活力的调节
从图7可以得知,与阴性对照组比较,只加入H2O2的Caco-2细胞中GSH-Rx酶活力降低。与阳性对照组比较,加入0.2~0.8 mg/mL的菊糖处理后再加入H2O2的Caco-2细胞中,GSH-Rx酶活力分别提高了10.5%、31.6%、33.5%及37.6%。0.4~0.8 mg/ mL 3组与阳性对照组比较,过氧化氢酶活力显著提高(2<0.05);与阴性对照组相比,无显著性差异;只接受0.8 mg/mL菊糖处理组,GSH-Rx酶活力稍提高,无显著性差异。

图7 不同质量浓度菊糖对谷胱甘肽还原酶活力的影响Fig.7Effects of inulin with different concentrations onglutathione reductase(GSH-Rx)activity
3.8菊糖对谷胱甘肽过氧化物酶活力的调节
从图8可以得知,与阴性对照组比较,只加入H2O2的Caco-2细胞中GSH-Px活力降低。与阳性对照组比较,加入0.2~0.8 mg/mL的菊糖处理后再加入H2O2的Caco-2细胞中,GSH-Px酶活力分别提高了1.9%、8.4%、29.7%及100.1%。0.6~0.8 mg/mL两组与阳性对照组比较,过氧化氢酶活力显著提高(p<0.05);与阴性对照组相比,无显著性差异;只接受0.8 mg/mL菊糖处理组,无显著性差异。
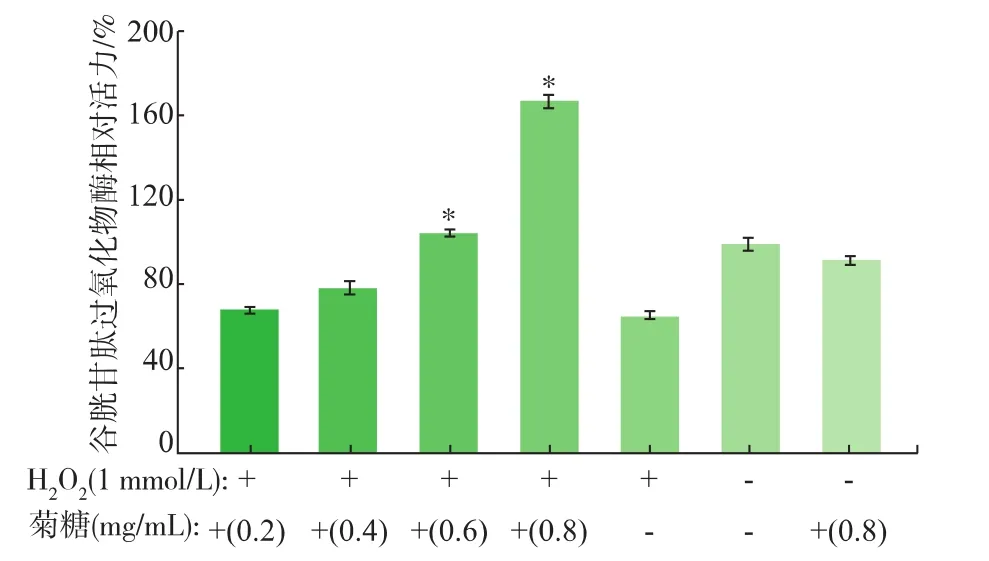
图8 不同质量浓度菊糖对谷胱甘肽过氧化物酶活力的影响Fig.8 Effects of inulin with different concentrations on glutathione peroxidase(GSH-Px)activity
4 结语
通过测定菊糖对铁离子的还原能力、DPPH自由基清除能力及金属离子螯合能力,证实了菊糖具有一定的抗氧化活性,而且随着菊糖质量浓度增大抗氧化活性逐渐增强。以Caco-2细胞为体外氧化损伤模型,探讨菊糖对H2O2诱导损伤细胞内抗氧化酶活力的调节。实验结果显示,菊糖可通过提高细胞内的过氧化氢酶、谷胱甘肽还原酶及谷胱甘肽过氧化物酶活力,从而实现抗氧化保护作用。
菊糖是一种天然碳水化合物,对人体有特殊的生理功能,目前己被世界上多个国家批准为食品营养增补剂。日本厚生省批准菊糖为特定保健食品,美国食品和药物管理局批准菊糖为公认的安全级配料,欧洲则把它作为控制人血液胆固醇水平的功能性甜味剂广泛应用。我国对菊糖的研究始于20世纪90年代,在很长一段时间内停留在实验室阶段。因此,下一阶段有必要开展其生理活性与临床应用研究,如保护脏器氧化损伤、降低粪臭素、影响下丘脑神经元以及菊糖过敏症等,为其在消化、内分泌、心血管疾病,以及肿瘤等的临床防治提供理论依据。
[1]乌日娜,朱轶霞,于永奇,等.菊芋的研究性状及开发潜力[J].草业科学,2013,30(8):1295-1300.
WU Rina,ZHU Yixia,YU Yongqi,et al.Study on status and exploiting potential of helianthus tuberosus[J].Pratacultural Science,2013,30(8):1295-1300.(in Chinese)
[2]Reza K,Mohammad H,Mehran G,et al.Application of inulin in cheese as prebiotic,fat replacer and texturizer:A review[J]. Carbohydrate Polymers,2015,119:85-100.
[3]苏兰利,吕元,程波,等.黄芪多糖浸泡种蛋对雏鸡免疫器官抗氧化性能的影响[J].河南农业科学,2013,42(12):133-135.
SU Lanli,LV Yuan,CHENG Bo,et al.Effects of a stragalus polysaccharides on antioxidant activity of chicken by soaking fertilized eggs[J].Journal of Henan Agriical Science,2013,42(12):133-135.(in Chinese)
[4]叶雪芳,崔志英.大蒜多糖的作用功效[J].广东饲料,2012,21(1):27-30.
YE Xuefang,CUI Zhiying.The effects of polysaccharides from Allium sativum L[J].Guangdong Feed,2012,21(1):27-30.(in Chinese)
[5]邵金华,李涛,杨佳.微波辅助大蒜多糖的提取及其抗氧化活性的研究[J].浙江农业学报,2013,25(4):868-872.
SHAO Jinghua,LI Tao,YANG Jia.Studyon microwave-assisted extraction ofgarlic polysaccharideand its antioxidantactivity[J]. Acta Agricuhurae Zhejiangensis,2013,25(4):868-872.(in Chinese)
[6]杨振,杨富民.菊粉对油脂抗氧化研究[J].食品工业科技,2009,30(6):119-121.
YANG Zhen,YANG Fumin.Study on the antioxidant ability of inulin[J].Science and Technology of Food industry,2009,30(6):119-121.(in Chinese)
[7]仝瑛.菊芋菊糖的提取纯化、抗氧化活性及菊糖复合饮料工艺研究[D].西安:西北大学,2010:53-57.
[8]陈荣,王学亮,徐环环,等.抗氧剂抗氧化活性研究进展[J].菏泽学院学报,2013,35(5):44-49.
CHEN Rong,WANG Xueliang,XU Huanhuan,et al.A review on antioxidant activity of antioxidants[J].Journal of Heze University,2013,35(5):44-49.(in Chinese)
[10]Saiga A,Tanabe S,Nishimura T.Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J].Journal of Agriculture and Food Chemistry,2003,51(12):3661-3667.
[11]Rivero-Perez M D,Perez-Magarino S,Gonzalez-San M L.Role of melanoidins in sweet wines[J].Analytica Chimica Acta,2002,458(1):169-175.
Studies on the Antioxidant Activity of Inulin and Its Mechanism
LIU Deping,WU Ping*
(Affiliated Hospital of Jiangnan University,Wuxi 214000,China)
The antioxidant activity of inulin was evaluated by the studies of the reduction ability,Fe2+-chelating activity and DPPH free radical scavenging activity.The mechanism of its antioxidant activity was investigated using the Caco-2 cell monolayer model.Three different antioxidant activity assays showed that inulin exhibited good antioxidant activity.A significant protective effect of inulin on H2O2induced oxidative stress in Caco-2 cells was observed in comparison with the positive controls.With the treatment of 0.8 mg/mL insulin,the activities of superoxide dismutase,catalase and glutathione peroxidase were increased by 35.8%,47.6%,and 61.2%,respectively.The antioxidant activity of inulin takes effect mainly by activing the intracellular antioxidant enzymes.
Inulin,antioxidant activity,the Caco-2 cell monolayer model,mechanism
TS 201.4
A
1673—1689(2015)09—1002—06
2015-03-23
刘德萍(1962—),女,吉林长春人,主管护师,主要从事营养护理及临床实践研究。E-mail:23368058@qq.com
吴平(1981—),女,江苏南通人,工学硕士,主治医师,主要从事临床营养治疗及研究。E-mail:wuping_1981@163.com
