电针对大鼠急性痛风性关节炎抗炎机制研究*
2015-11-11李跃兵李铁浪曾序求
李跃兵 张 泓 李铁浪 曾序求
(湖南中医药大学针灸推拿学院,湖南 长沙410208)
电针对大鼠急性痛风性关节炎抗炎机制研究*
李跃兵 张 泓 李铁浪 曾序求
(湖南中医药大学针灸推拿学院,湖南 长沙410208)
目的 研究电针治疗急性痛风性关节炎的作用机制。方法 SD大鼠40只,随机分为空白对照组、模型组、电针组、双氯芬酸钠组,每组10只,空白对照组常规喂养,其余各组采用尿酸钠溶液注射法建立痛风性关节炎大鼠模型。造模前2 d,空白对照组与模型组予以生理盐水灌胃,双氯芬酸钠组予以双氯芬酸钠溶液灌胃,电针穴位组施以电针,各组均实验前后测量大鼠踝关节周径;蛋白印迹法、荧光定量PCR法检测肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)的蛋白和基因表达。结果 与空白对照组比较,模型组大鼠踝关节肿胀程度明显增加,滑膜组织中TNF-α、IL-8蛋白和基因表达显著升高(P<0.01);与模型组比较,电针组和双氯芬酸钠组可明显减轻模型大鼠踝关节肿胀程度,抑制TNF-α、IL-8的蛋白和基因表达(P<0.05或P<0.01);与电针组比较,双氯酚酸组差异无统计学意义(P>0.05)。结论 电针具有良好的抗急性痛风性关节炎作用,能够抑制TNF-α、IL-8基因和蛋白表达,以减轻组织的炎性损伤。
痛风性关节炎 电针 TNF-α IL-8
痛风是由长期嘌呤代谢障碍、血尿酸增高引起的一种代谢性风湿病。急性痛风性关节炎为痛风的典型表现形式[1],是由于尿酸盐沉积在关节囊、滑囊、软骨、骨质和其他组织中引起关节剧烈的红、肿、热、痛和功能障碍等症状的疾病。随着人民生活水平的提高,此病发生率有逐年上升的趋势。以往治疗此病常用非甾类抗炎药,但由于副作用大,不良反应多,临床使用常受限制。电针治疗痛风性关节炎疗效可靠[2],可明显减轻大鼠踝关节肿胀,减轻异物肉芽肿及局部软骨组织的破坏,改善关节软骨及滑膜组织的结构,抑制骨胶原纤维大量增生[3],但其治病机理不明。本研究基于电针对肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)的蛋白和基因表达的影响,探讨电针治疗急性痛风性关节炎的作用机制。
1 材料与方法
1.1 实验动物 健康成年SD大鼠,湖南中医药大学动物实验中心提供(清洁级),40只,雄性,体质量180~200 g。分笼饲养于湖南中医药大学动物中心实验室,饲养温度24~26℃,湿度50%~70%。
1.2 药物与试剂 双氯芬酸钠(昆明制药集团股份有限公司,批号:国药准字J20140017),尿酸钠晶体(美国Sigma公司,CASNumber:1198-77-2),戊巴比妥钠 (江苏恒瑞医药股份有限公司产品,批号:WS20130112),核蛋白提取试剂盒(thermo公司,批号:M10058),S-PRabbitHRPKit(DAB)兔Streptavidin-HRP试剂盒 (武汉博士德生物科技有限公司),TNF-α、IL-8mRNA引物 (上海捷瑞生物工程有限公司),TNF-α、IL-8抗体(Ancam公司)。
1.3 仪器 旋涡振荡器(XW-80A),上海青浦泸西仪器厂;手握式电动匀浆机(F6-10),德国FLUKO;低温冷冻离心机(3K15),美国Sigma公司;移液器(Pipetman),吉尔森P型移液器;Real-time检测仪 (ABI-7500),ABI;电泳仪 (miniprotean 3cell),BIORAD公司;电转仪(PS-9),大连竞迈科技有限公司;酶标仪(MK3),芬兰雷勃酶标仪;水浴锅(HI1210),Leic公司;暗匣(AX-Ⅱ型),粤华医疗器械,HM-6805-Ⅰ型经穴治疗仪(恒明牌);0.35mm×13mm毫针(华佗牌)等。
1.4 模型制备 疾病动物模型为病理性动物模型[4],选用1%戊巴比妥钠(江苏恒瑞医药股份有限公司,批号:WS20140112)腹腔注射麻醉,由大鼠右踝关节后侧,6号注射针针口斜面与胫骨成45°夹角插入跟腱内侧直至踝关节腔,将配制好的质量浓度为2.5 g/100mL尿酸钠溶液100μL注入关节腔内,空白对照组用生理盐水同法注射,以关节囊对侧鼓胀为注入标准。
1.5 分组与干预 40只SD大鼠随机分为4组,每组10只。空白对照组按20mL/kg予以生理盐水灌胃,每日1次,连续2周;模型组,造模前2 d开始,按20mL/kg予以生理盐水灌胃,每日1次,连续2周;电针组,造模前2 d开始,参照《实验针灸学》[5]取右侧足三里、三阴交,毫针直刺,平补平泻,进针后接经穴治疗仪,电压9V,电流强度1~3mA,频率1.5~2Hz,疏密波,强度以大鼠局部皮肤肌肉微颤为度,留针20min,每日1次,连续2周;双氯芬酸钠组予双氯芬酸钠(生理盐水溶解、稀释)灌胃(1mg/kg),每日1次,连续2周。
1.6 标本采集及检测 1)大鼠踝关节周径测量。采用绕线法测量以标记笔标记大鼠右后肢踝关节,测量时,以自制丝线与右后肢红圈重叠,然后在同一测量尺(最小刻度0.1 cm)上测量其长度,重复3次,取均值即为关节周径。2)滑膜组织TNF-α、IL-8mRNA表达测定。提取滑膜组织mRNA,紫外分光光度计鉴定后逆转录[6]。TNF-α/IL-8反应体系:cDNA分别为2μL,20× SYBRGreen PCRMasterMix为32.5μL;去离子水分别为14.5μL;总体积50μL;95℃预变性10min;95℃变性15 s;退火延伸45 s,共40个循环。3)滑膜组织TNF-α、IL-8蛋白表达测定。采用蛋白印迹法[7](Western blot)提取滑膜组织的总蛋白,取含30μg总蛋白进行变性凝胶电泳。电转至硝酸纤维素膜上,用脱脂奶粉封闭,分别与特异性抗大鼠抗体孵育(TNF-α1∶500;IL-8 1∶10),充分洗涤孵育,以HRP偶联抗大鼠抗体,用ECL化学发光,X光片曝光显影:以计算机扫描图像进行分析,测定灰度值,即为蛋白的表达量,每个实验重复3批不同的样本。
1.7 统计学处理 采用SPSS19.0统计软件。计量资料以(±s)表示,采用单因素方差分析,多组间的两两比较采用LSD-T检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组痛风性关节炎大鼠踝关节肿胀程度比较见表1。与空白对照组比较,模型组大鼠踝关节肿胀程度明显增加(P<0.01);与模型组比较,电针组及双氯芬酸钠组大鼠踝关节肿胀程度明显减轻(P<0.05);电针组和双氯芬酸钠组之间差异无统计学意义 (P>0.05)。
表1 各组痛风性关节炎大鼠踝关节肿胀程度比较(cm,±s)
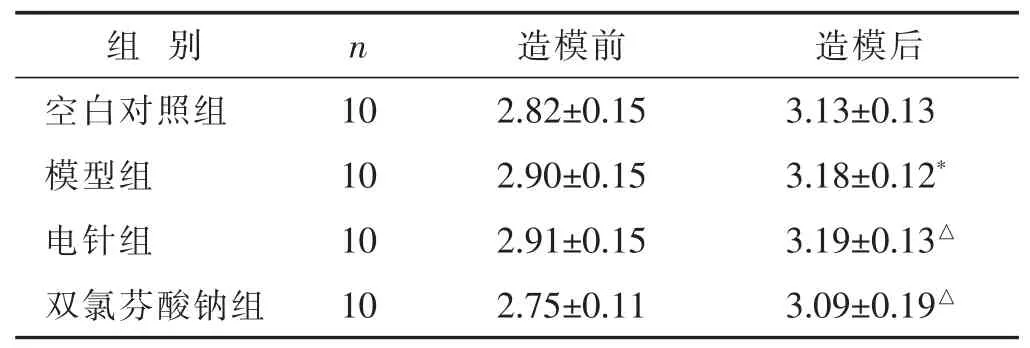
表1 各组痛风性关节炎大鼠踝关节肿胀程度比较(cm,±s)
与空白对照组同时期比较,*P<0.01;与模型组同时期比较,△P<0.05,△△P<0.01。下同。
组别 n 造模前 造模后空白对照组 10 2.82±0.15 3.13±0.13模型组 10 2.90±0.15 3.18±0.12*电针组 10 2.91±0.15 3.19±0.13△双氯芬酸钠组 10 2.75±0.11 3.09±0.19△
2.2 对痛风性关节炎大鼠踝关节滑膜组织TNF-α mRNA、IL-8mRNA表达的影响 见表2。与空白对照组比较,模型组大鼠踝关节滑膜组织TNF-αmRNA、IL-8mRNA表达显著升高(P<0.01);与模型组比较,电针组及双氯芬酸钠组TNF-αmRNA、IL-8mRNA的表达明显降低(P<0.01);电针组和双氯芬酸钠组之间差异无统计学意义(P>0.05)
表2 各组痛风性关节炎大鼠踝关节滑膜组织TNF-mRNA、IL-8mRNA及TNF-α、IL-8蛋白表达水平比较(±s)
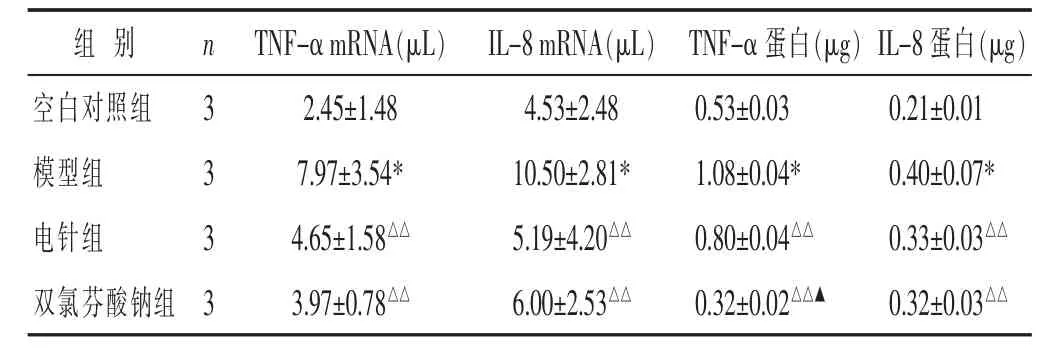
表2 各组痛风性关节炎大鼠踝关节滑膜组织TNF-mRNA、IL-8mRNA及TNF-α、IL-8蛋白表达水平比较(±s)
与电针组比较,▲P<0.01。
组 别 n TNF-αmRNA(μL) IL-8mRNA(μL) TNF-α蛋白(μg)IL-8蛋白(μg)空白对照组 32.45±1.48 4.53±2.48 0.53±0.03 0.21±0.01模型组 37.97±3.54* 10.50±2.81* 1.08±0.04* 0.40±0.07*电针组 34.65±1.58△△ 5.19±4.20△△ 0.80±0.04△△ 0.33±0.03△△双氯芬酸钠组 33.97±0.78△△ 6.00±2.53△△ 0.32±0.02△△▲ 0.32±0.03△△
2.3 对痛风性关节炎大鼠踝关节滑膜组织TNF-α、IL-8蛋白表达的影响 见表2。空白对照组大鼠踝关节滑膜组织有少量TNF-α、IL-8蛋白表达,与空白对照组比较,模型组大鼠滑膜组织TNF-α、IL-8蛋白表达明显增加(P<0.01);与模型组比较,电针组和双氯芬酸钠组TNF-α、IL-8蛋白表达明显减少 (P<0.01),电针组和双氯芬酸钠组之间比较,TNF-α蛋白表达双氯芬酸钠组低于电针组(P<0.01),IL-8蛋白表达差异无统计学意义(P>0.05)。
3 讨 论
急性痛风性关节炎属中医“湿热痹”范畴,常因饮食不节伤及脾胃,脾失健运而湿浊内生,或平素体虚感受湿热之邪,邪气壅于经络,痹阻气血经脉,并滞留于关节筋骨,从而出现关节疼痛、肿大、活动不利等症状。本病属正虚邪实之候,治疗应从脾肾入手,采用补虚泻实法。《针灸甲乙经》云“足下热痛不能久坐,湿痹不能行,三阴交主之”。三阴交位于脾经,又为足三阴经交会穴,有清热健脾利湿;而足三里为胃经的要穴,有补益肝肾之功效。
急性痛风性关节炎是原发性痛风最常见的首发症状,好发于下肢关节。目前研究认为,急性痛风性关节炎为尿酸钠结晶体在关节及周围组织沉积所引起的急性炎症反应[8-10]。尿酸钠沉积于滑膜细胞,与滑膜液中的IgG结合,被白细胞及滑膜细胞吞噬,促使这些细胞释放组胺,凝血因子,补体及花生四烯酸等物质花生四烯酸通过环氧化酶和脂氧化酶两条途径分别生成前列腺E2及白三烯,后者刺激TNF-α、IL-8产生,进而引起局部血管扩张,通透性增加、渗出、水肿、白细胞聚集、发热等炎症反应。TNF-α、IL-1β是炎症网链中的一级细胞因子,而IL-8是由TNF-α、IL-1β诱导的二级前炎症细胞因子[11]。大量实验研究发现[12],在尿酸钠导致痛风性关节炎的实验模型中检测出TNFmRNA高表达,由于TNF可增强中性粒细胞的活性而使IL-1释放,所以TNF在尿酸钠结晶沉积中发挥重要作用,因此,TNF-α、IL-8作为炎症反应趋化因子和激活因子在急性痛风性关节炎的发生和发展过程中起着重要作用,并与疾病的进展及预后密切相关。本研究结果显示,与空白对照组大鼠比较,模型组大鼠踝关节肿胀程度仍明显增加,电针及双氯芬酸钠可明显减轻模型大鼠踝关节肿胀程度,同时TNF-α、IL-8基因及蛋白表达水平明显低于模型组,说明电针能够抑制大鼠炎症细胞因子基因及蛋白表达,减轻局部炎症,发挥抗炎作用。
综上所述,电针治疗急性痛风性关节炎疗效肯定,为其在临床的应用提供了科学依据。
[1]葛军波,徐永健.内科学[M].北京:人民卫生出版社,2013:855-857.
[2]Gao W,Tang X,Chen Z,et al.Effects of Acupuncture on CCL2and CXCL8 Expression and the Subset of uNK Cells in Rats with EmbryoImplantation Failure[J].Evid Based Complement Alternat Med,2013,doi:10.1155/2013/678390.
[3]Pierobon D,Bosco MC,Blengio F,et al.Chronic hypoxia reprograms human immature dendritic cells by inducing aproinflammatory phenotype and TREM-1 expression[J].Eur J Immunol,2013,43(4):949-966.
[4]黄火高,孙运峰,胡明,等.大鼠急性痛风性关节炎模型的建立及特点[J].军事医学科学院院刊,2005,29(6):538-542.
[5]郭义,方剑乔.实验针灸学[M].北京:中国中医药出版社,2012:26-27.
[6]吴勉华,王新月.中医内科学[M].北京:中国中医药出版社,2012:372-375.
[7]黄敬群,孙文娟,王四旺,等.尿酸钠致急性痛风性关节炎模型大鼠与槲皮素的抗炎作用[J].中国组织工程研究与临床康复,2012,16(15):2815-2819.
[8]Lyseng-Williamson KA.Canakinumab:a guide to its use in acute goutyarthritis flares[J].Bio Drugs,2013,27:401-406.
[9]Busson N,Ea HK.The mechanisms of inflammation in gout and pseudogout(CPP-induced arthritis)[J].Reumatismo,2012,63:230-237.
[10]Lu F,Liu L,Yu DH,et al.Therapeutic effect or hizoma dioscoreae nipponicae on gouty arthritis based on the SDF-1/ CX-CR4 and p38 mark pathway:An in vivo and in vitro study[J].Phytother Res,2013,10:1002.
[11]Martinon F.Signaling by ROS drives inflammasome activation[J].Eur J Immunol,2010,40:616-619.
[12]Schorn C,Frey B,Lauber K,et al.Sodium overload and water influx activate the NALP3 inflammasome[J].J Biol Chem,2011,286:35-41.
Mechanism Study of Electroacupuncture in Rats with Acute Gouty Arthritis
LI Yuebing,ZHANG Hong,LI Tielang,et al. College of Acupuncture&Moxibustion and Tui-na,Hunan University of Chinese Medicine,Hunan,Changsha 410208,China
Objective:To study the mechanism of action of electric acupuncture treatment in acute gouty arthritis.Methods:40 Wistar rats were randomly divided into the blank control group,the model group,the electric acupuncture group,the diclofenac sodium group with 10 rats in each group.Regular feeding was used in the blank control group,the remaining groups on uric acid sodium solution injections gouty arthritis rat model was established.Made 2 days before the mold and blank control group and model group give saline lavage,diclofenac sodium group diclofenac sodium solution to fill the stomach,electric acupuncture meridians to electric acupuncture group,each group were measured before and after the experiment rats ankle weeks diameter;Protein imprinting method,fluorescence,the protein and gene(quantitative PCR method to detect TNF-(expression of IL-8.Results:Compared with blank control group,model group rats ankle swelling degree increased significantly.The TNF-α and the IL-8 protein and gene expressions were significantly higher(P<0.01).Compared with model group,the curative group and diclofenac sodium group can obviously reduce the model rats ankle.The TNF-α and IL-8 protein and gene expressions were inhibited remarkably(P<0.05,P<0.01).Compared with electric acupuncture group,there was no statistically significant difference double phenolic acid group(P>0.05).Conclusion:The curative effect of electric acupuncture in acute gouty arthritis can inhibit TNF-α and IL-8 gene and protein expressions in order to alleviate the inflammatory tissue damage.
Gouty arthritis;Electric acupuncture;TNF-α;IL-8
R245.9+7
A
1004-745X(2015)05-0781-03
10.3969/j.issn.1004-745X.2015.05.010
2015-01-03)
湖南省教育厅科学基金项目(14C0855)
