硫酸铜与氢氧化钠溶液反应的实验探究
2015-11-09凌一洲
凌一洲
摘要:实验探究了硫酸铜与氢氧化钠溶液的反应,发现加入反应物的顺序不同可产生不同的结果。设计了两个趣味实验,对实验中产生的异常现象作了推测并验证。结果表明,在氢氧化钠溶液中加入少量硫酸铜溶液时,主要生成氢氧化铜沉淀;反之,则主要生成碱式硫酸铜沉淀。
关键词:硫酸铜;氢氧化钠;溶液反应;实验探究
文章编号:1005–6629(2015)9–0039–03 中图分类号:G633.8 文献标识码:B
1 引言
硫酸铜与氢氧化钠溶液的反应是中学化学常见的反应,人教版九年级教材中就有在氢氧化钠溶液中滴加硫酸铜溶液,生成氢氧化铜,加热后分解成氧化铜的实验[1]。但从文献[2,3]中发现,硫酸铜与氢氧化钠溶液的滴加顺序不同,生成的产物也不同,只有在较小浓度的氢氧化钠溶液中滴加2%的硫酸铜溶液,或在2%的硫酸铜溶液中滴加较大浓度的氢氧化钠溶液,才能生成氢氧化铜,否则随反应物浓度不同生成碱式硫酸铜或四羟基合铜酸钠。本文依据这个原理,设计了几个探究实验。
2 探究实验一
探究实验一采用将硫酸铜溶液注入氢氧化钠溶液中的方法,探究少量硫酸铜与大量氢氧化钠反应的结果。
2.1 试剂与仪器
(1)实验试剂:12%的硫酸铜溶液、10%的氢氧化钠溶液。
(2)实验仪器:铁架台、铁夹、针筒、胶水滴管、50mL螺口瓶、试管、烧杯、酒精灯。
2.2 实验装置
在螺口瓶中加入约45mL氢氧化钠溶液。将胶水滴管与针筒连接(如图1),并吸取约5mL硫酸铜溶液。搭建铁架台,并将针筒固定在铁架台上(如图2)。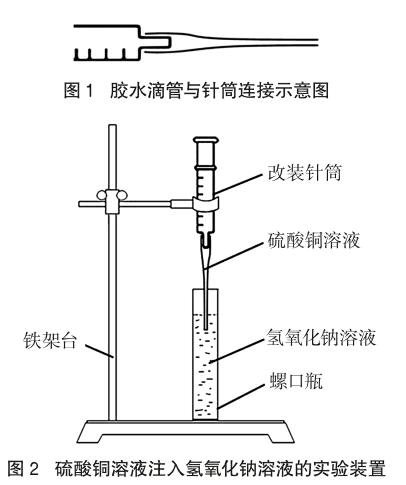
2.3 实验内容
将针筒活塞缓慢向下压,将硫酸铜溶液缓慢注入氢氧化钠溶液中。实验时室温13℃。
2.4 实验结果
随着硫酸铜溶液的注入,螺口瓶内出现蓝色固体。当硫酸铜溶液以较快速度注入时,固体颗粒较小,当硫酸铜溶液以较慢速度注入时,蓝色固体从胶水滴管口逐渐“生长”出来,并随着硫酸铜溶液的增加而增大。
盖上螺口瓶盖子,振荡数次后,蓝色沉淀颜色不变。取少量沉淀到试管中加热,蓝色沉淀很快变黑。
3 探究实验二
实验二采用将氢氧化钠溶液注入硫酸铜溶液中的方法,探究少量氢氧化钠与大量硫酸铜反应的结果。
3.1 试剂与仪器
与2.1相同。
3.2 实验装置
实验装置将实验一中氢氧化钠溶液换为硫酸铜溶液、硫酸铜溶液换为氢氧化钠溶液即可(如图3)。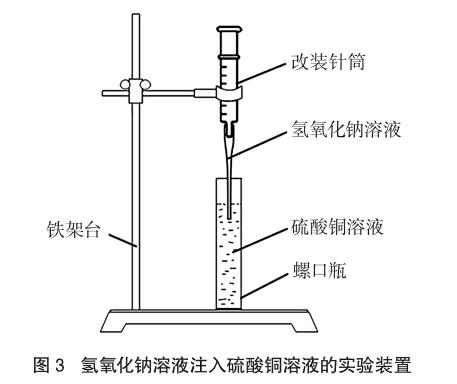
3.3 实验内容
将针筒活塞缓慢向下压,将氢氧化钠溶液缓慢注入硫酸铜溶液中。实验时室温13℃。
3.4 实验结果
注入氢氧化钠溶液后,螺口瓶内出现蓝色固体。随着氢氧化钠溶液的增加,蓝色固体体积不断扩展。振荡数次后蓝色固体很快变得松散,静置后,固液分层,沉淀颗粒较细,且显现出较浅的蓝绿色(如图4)。
取少量沉淀加热至沸腾,沉淀颜色继续变浅,且由蓝绿色变为浅绿色。
4 实验结果讨论
注入反应物的顺序不同,会引起反应物浓度的不同。
实验一的反应发生时,氢氧化钠过量而硫酸铜不足量,混合生成深蓝色的氢氧化铜沉淀,振荡后结构不易松散,加热即分解为黑色氧化铜沉淀: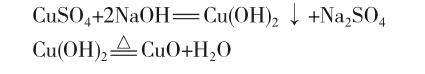
实验二的反应发生时,硫酸铜过量而氢氧化钠不足量,生成颜色较浅的碱式硫酸铜(实际生成的是碱式硫酸铜与氢氧化铜的复合物)沉淀,振荡后结构立即松散,加热不易分解:
4CuSO4+6NaOH=Cu4(OH)6SO4↓+3Na2SO4
因此,硫酸铜与氢氧化钠反应时,反应物浓度不同对生成物影响很大。
5 异常现象探究
5.1 实验一中异常现象
5.1.1 异常现象
在实验一中,如果加入的硫酸铜很少,振荡螺口瓶后,部分沉淀溶解,静置后瓶内溶液呈蓝色。
5.1.2 分析与推测
当氢氧化钠过量时,生成的氢氧化铜与氢氧化钠继续反应,生成不同于氢氧化铜与硫酸铜的新物质——四羟基合铜酸钠。
5.1.3 推测的检验
取少量蓝色溶液,加入铝粉反应,产生气体。反应结束后,蓝色溶液变为无色,瓶底和液面上出现夹杂红色的黑色固体。取出固体,加入盐酸后,红色固体不溶解,黑色固体溶解,溶液变蓝。因此,加入铝粉后生成了氧化铜和铜,原蓝色为四羟基合铜酸钠溶液。
5.2 实验二中异常现象
5.2.1 异常现象
在实验二中,绝大部分沉淀振荡后变得松散,且颜色变为浅蓝绿色,但是仍有少量亮蓝色沉淀粘在螺口瓶瓶底,且颜色不变(如图4瓶底深色固体)。在清洗螺口瓶时,发现瓶底亮蓝色沉淀较难洗去。
5.2.2 分析与推测
在实验二反应进行时,固体生成物从胶水滴管口一直延伸到瓶底。由于氢氧化钠浓度较高,密度较大,部分氢氧化钠顺着固体生成物直接落入瓶底,使瓶底形成较高浓度的氢氧化钠。这时再与硫酸铜反应,反应条件已经不是硫酸铜过量了,而可能是氢氧化钠过量。实验二中难以洗去的沉淀颜色与实验一中沉淀生成条件相似,且颜色相似,推测该沉淀为氢氧化铜沉淀。
5.2.3 推测的检验
将瓶底沉淀刮下后放入试管,加少量水后加热。蓝色沉淀很快变成黑色氧化铜。
因此,瓶底蓝色沉淀是氢氧化铜,这个异常现象验证了硫酸铜溶液浓度大时生成碱式硫酸铜,氢氧化钠溶液浓度大时生成氢氧化铜的结论。
6 趣味实验设计
6.1 趣味实验一
准备8%的硫酸铜溶液和20%的氢氧化钠溶液,先将氢氧化钠溶液倒入试管中,再用滴管沿试管壁加入硫酸铜溶液。由于氢氧化钠密度大,沉在试管底,硫酸铜与氢氧化钠交界处生成氢氧化铜,硫酸铜浮在氢氧化铜上。氢氧化铜固体下端与高浓度氢氧化钠接触,部分生成蓝色四羟基合铜酸钠溶液,因此,试管内最终会由上到下分为硫酸铜、氢氧化铜、四羟基合铜酸钠、氢氧化钠四层。
轻轻振荡后,上层硫酸铜与氢氧化钠混合,生成碱式硫酸铜,瓶内会出现由上到下蓝绿色沉淀、浅蓝色沉淀、亮蓝色沉淀、深蓝色溶液的分层。
6.2 趣味实验二
在氢氧化钠溶液中注入硫酸铜溶液时,生成颜色鲜艳的亮蓝色固体。根据注入硫酸铜速度快慢的不同,生成固体的形态也各不相同(如图5)。
因此,可以在烧杯中装入氢氧化钠溶液,在不同位置(如:在液面上直接滴加、伸入液面下某一位置滴加等),用不同注射仪器(如:带有胶水滴管的针筒、胶头滴管、吸管等),以不同速度注入硫酸铜溶液,可以形成不同形态的蓝色固体,创作属于自己的“水下世界”。
参考文献:
[1]胡美玲主编.义务教育课程标准实验教科书·化学(九年级上册)[M].北京:人民教育出版社,2006:28.
[2]李红萍,丁未.硫酸铜与氢氧化钠溶液反应条件探究[J].化学教学,2014,(2):49~50.
[3]陆江岚.氢氧化钠与硫酸铜定量反应的研究[J].教学仪器与实验,2013,(6):28~29.
