HPLC法测定藏药仁青芒觉胶囊中西红花苷—I和西红花苷—Ⅱ的含量
2015-11-09杨博涵朱旭江
杨博涵 朱旭江
【摘要】目的:建立仁青芒觉胶囊中西红花的含量测定方法。方法:采用HPLC法,用光电二极管阵列检测器(DAD),流动相为甲醇-水(50∶50),流速1.0ml/min,检测波长440nm,柱温25℃,对西红花苷-Ⅰ、西红花苷-Ⅱ进行定量测定。结果:西红花苷-Ⅰ在0.0336~0.4987μg范围内呈良好的线性关系,r=0.9999,加样回收率为97.43%,RSD=2.18%;西红花苷-Ⅱ在0.0129~0.1818μg范围内呈良好的线性关系,r=0.9998,加样回收率为99.75%,RSD=1.53%结论:该方法操作简便、专属性、重现性好,可有效地控制仁青芒觉胶囊的质量。
【关键词】仁青芒觉胶囊;HPLC;西红花苷-Ⅰ;西红花苷-Ⅱ
【中图分类号】R284.1【文献标志码】A【文章编号】1007-8517(2015)20-0016-03
HPLCdeterminationofcrocin-Ⅰandcrocin-ⅡinRenqingMangjuecapsules
YANGBohan1ZHUXujiang*
1.TianjinInstituteofMedicalandPharmaceuticalSciences,Tianjin300020,China;2.GansuInstituteforDrugControl,Lanzhou730070,China
Abstract:ObjectiveTosetupthequalitystandardofRenqingMangjuecapsules.MethodsThecontentofcrocin-Ⅰandcrocin-ⅡweredeterminedbyHPLC,whichconductedwithaDADdetectorandthedetectionwavelengthsetat440nm.ThecolumnwasC18(4.6mm×250mm,5μm)withmobilephaseconsistedofmethanol-water(50:55)andtheflowratewas1.0ml·min-1.Thecolumntemperaturemaintainedat25℃.ResultsHPLCdeterminedthatcrocin-Ⅰwasinrangefrom0.0336to0.4987μg,whichpresentedagoodlinearrelationship(r=0.9999).Theaveragerecoverywas97.43%,RSDwas2.18%.HPLCdeterminedthatcrocin-Ⅱwasinrangefrom0.0129to0.1818μg,whichpresentedagoodlinearrelationship(r=0.9998).Theaveragerecoverywas99.75%,RSDwas1.53%.ConclusionThemethodissimpleinoperation.Theresultsareaccurate,reliableandgoodinreproducibility.ThemethodcaneffectivelycontrolthequalityofRenqingMangjuecapsules.
Keywords:RenqingMangjuecapsules;HPLC;crocin-Ⅰ;crocin-Ⅱ
仁青芒觉始载于《盘德琼乃》,是藏族验方。仁青芒觉胶囊由毛诃子、蒲桃、西红花、木香、丁香、朱砂、马钱子等药材组成的复方制剂,具有清热解毒,益肝养胃,明目醒神,愈疮,滋补强身的功效。其现行标准为国家食品药品监督管理局标准(YBZ07062005-2010Z),含量测定项为检查没食子酸的含量,但处方中多味药材含有没食子酸,故该法的专属性不强。仁青芒觉胶囊处方组成比较复杂,含量测定存在一定难度,导致该药含量测定研究报道较少[1-3]。处方中的西红花为鸢尾科植物番红花(CrocussativusL.)的干燥柱头,系贵重药材,具有活血化瘀,清热解毒,解郁安神的作用,且仁青芒觉胶囊为保密处方,处方量不明确。为了保证用药的有效性,试验采用高效液相色谱法建立了仁青芒觉胶囊中西红花苷-I和西红花苷-Ⅱ的含量测定方法,该法操作简便、结果准确,可用于产品内在质量的控制。
1仪器与试药
1.1仪器Waterse2695高效液相色谱仪(Waters2998DAD检测器,Empower色谱工作站,美国Waters公司);MettlerAE240电子天平(瑞士梅特勒);SartoriusR200D电子天平(德国赛多利斯公司);KH-500DE超声波清洗器(昆山禾创超声仪器有限公司);HGC-24A氮吹仪(天津市恒奥科技发展有限公司)。
1.2试药西红花苷-I(批号:111588-200501)和西红花苷-Ⅱ(批号:110589-201304,含量92.4%)均购自中国食品药品检定研究院;仁青芒觉胶囊(批号:100501、120001、130101)由甘肃省某藏药企业提供。甲醇(色谱纯,德国默克Merck公司);水为超纯水,其余试剂均为分析纯。
2方法
2.1色谱条件色谱柱:资生堂CAPCELLPAKC18(4.6mm×250mm,5μm),WatersSymmetryC18(4.6mm×250mm,5μm),ThermoscientificBDSHYPERSILC18(4.6mm×250mm,5μm);流动相:甲醇-水(50:50);流速:1ml/min;柱温:25℃;检测波长:440nm。
2.2溶液的制备
2.2.1对照品溶液的制备精密称取西红花苷-Ⅰ对照品8.28mg,至50ml棕色量瓶中,加稀乙醇稀释至刻度,作为西红花苷-Ⅰ对照品储备液。精密称取西红花苷-Ⅱ对照品8.20mg,至50ml棕色量瓶中,加稀乙醇稀释至刻度,作为西红花苷-Ⅱ对照品储备液。分别精密吸取西红花苷-Ⅰ对照品储备液5ml和西红花苷-Ⅱ对照品储备液2ml至50ml容量瓶中,加稀乙醇稀释至刻度,制成混合对照品溶液。
2.2.2供试品溶液的制备取装量差异项下的本品内容物,研细,取约0.5g,精密称定,置50ml棕色量瓶中,加稀乙醇适量,置冰浴中超声处理(功率200W,频率60KHz)30min,放至室温,加稀乙醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.2.3阴性供试品的制备按照供试品溶液的制备方法,分别制备缺西红花的阴性供试品溶液。
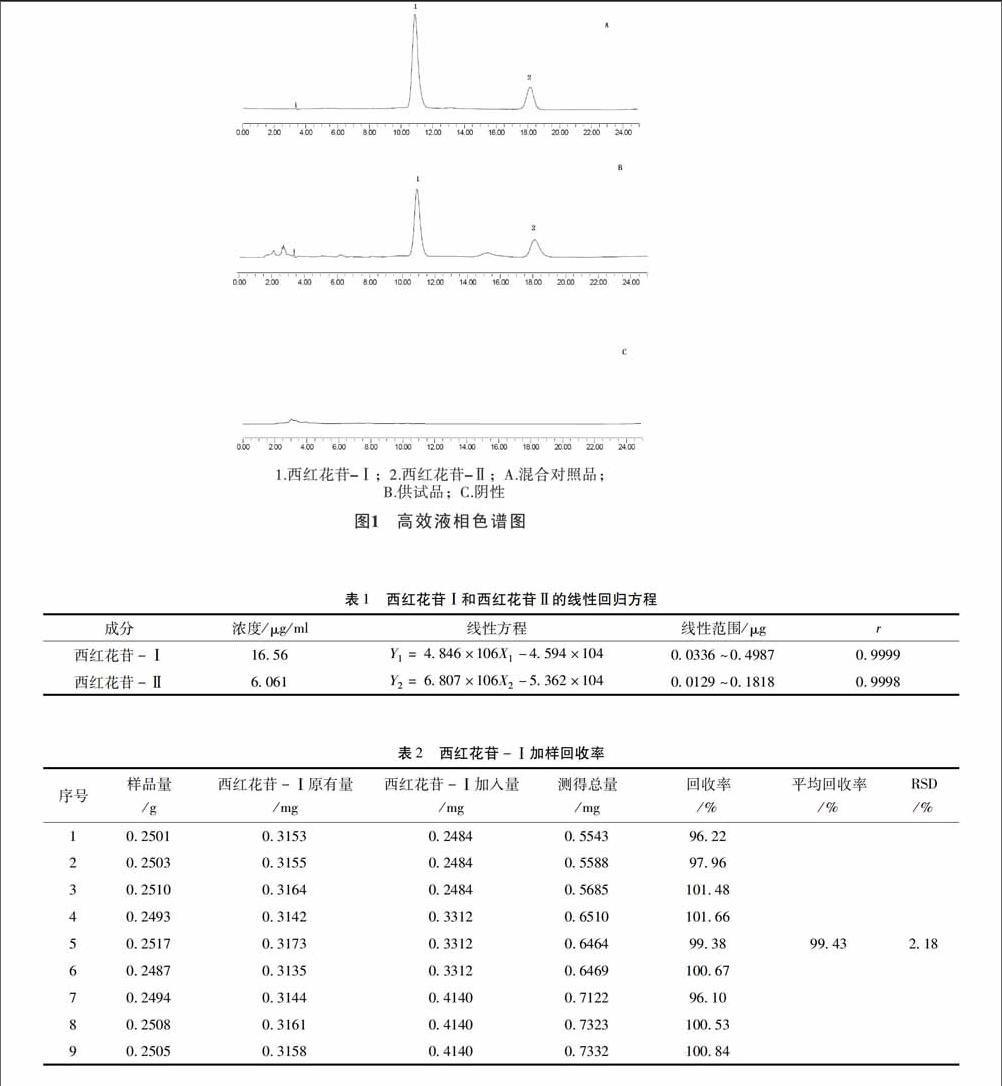
2.2.4样品的测定按“2.1”项下色谱条件,分别精密吸取对照品溶液、供试品溶液及阴性供试品溶液各5~10μl,注入液相色谱仪,测得液相色谱图,结果见图1。结果表明,西红花苷-Ⅰ、西红花苷-Ⅱ色谱分离良好,且阴性对测定结果无干扰。
2.3方法学考察
2.3.1线性关系的考察取“2.2.1”项下混合对照品溶液,按“2.1”项的色谱条件,分别进样2、4、8、10、14、18、22、26、30μl,测定西红花苷-Ⅰ、西红花苷-Ⅱ的峰面积,以进样对照品质量(μg)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,计算回归方程,结果见表1。结果表明,西红花苷-Ⅰ和西红花苷-Ⅱ在线性范围内呈良好的线性关系。
表1西红花苷Ⅰ和西红花苷Ⅱ的线性回归方程
2.3.2精密度实验精密吸取同一份供试品溶液10μl,注入液相色谱仪,连续进样6次,测定峰面积积分值,西红花苷-Ⅰ和西红花苷-Ⅱ的RSD分别为0.5%和0.4%,结果表明进样精密度良好。
2.3.3稳定性试验取同一供试品溶液(批号:130001)分别在0、2、4、6、8、24h,按“2.1”项的色谱条件各进样1次,记录峰面积积分值,西红花苷-Ⅰ和西红花苷-Ⅱ的RSD分别为1.4和1.3%,表明供试品溶液在24h内基本稳定。
2.3.4重复性试验取同一批供试品(批号:130001)6份,按“2.2.2”项下方法处理,“2.1”项的色谱条件测定含量。结果西红花苷-Ⅰ和西红花苷-Ⅱ的RSD分别为0.98%和1.02%。
2.3.5加样回收率精密量取西红花苷-Ⅰ对照品储备液(0.1656mg/ml)1.5、2.0、2.5ml各3份和西红花苷-Ⅱ对照品储备液(0.06061mg/ml)0.8、1.0、1.2ml各3份,置50ml棕色量瓶中,溶剂采用氮吹仪吹干,再分别精密称取已知含量同一批号(批号:130001,西红花苷-Ⅰ含量1.2605mg/g;西红花苷-Ⅱ含量0.4376mg/g)的供试品9份,按“2.2.2”项下方法制备供试品溶液,依法测定,计算西红花苷-Ⅰ和西红花苷-Ⅱ的回收率。结果见表2、表3。
表2西红花苷-Ⅰ加样回收率
表3西红花苷-Ⅱ加样回收率
序号 样品量
/g 西红花苷-Ⅱ原有量
/mg 西红花苷-Ⅱ加入量
/mg 测得总量
/mg 回收率
/% 平均回收率
/% RSD/%
99.751.53
2.4样品测定结果按供试品溶液的制备方法和测定方法,对样品进行制备和测定,分别精密吸取对照品溶液与供试品溶液各10μl,按“2.1”项下色谱条件进样分析,按外标法以峰面积计算样品中西红花苷-Ⅰ和西红花苷-Ⅱ含量,测定3批供试品的含量,结果见表4。
表4仁青芒觉胶囊含量测定结果
3讨论
3.1提取方法的选择参考中国药典[4]及有关文献[5-6],提取溶剂选定为稀乙醇。西红花苷文献报道较多[7-8],大多采用超声提取方法。西红花苷为水溶性类胡萝卜素类成分,分子中具有多个共轭双键,导致其稳定性差,且对温度非常敏感[9]。研究对供试品在冰浴中和常温下超声处理方法进行了对比研究。结果表明,冰浴比常温提取所测得的西红花苷-Ⅰ和西红花苷-Ⅱ峰面积略高,故采用冰浴超声提取作为仁青芒觉胶囊中西红花苷-Ⅰ和西红花苷-Ⅱ的提取方法。
3.2超声时间的选择根据预实验的结果,供试品制备采用冰浴中分别超声(功率200W,频率60KHz)20、25、30、40、50min,依法测定峰面积,结果表明,超声提取30min时的测定值略高,故选择提取时间为30min。
3.3测定波长的选择对西红花苷-Ⅰ和西红花苷-Ⅱ进行全波长扫描,结果在440nm波长处有最大吸收,故选择440nm作为测定波长。
3.4方法适用性试验取同一批样品按供试品溶液的制备方法进行制备,分别采用三种品牌的色谱柱测定,西红花苷-Ⅰ和西红花苷-Ⅱ测得含量的RSD分别为1.92%和1.56%,结果无明显差别,说明该方法适用性较好。
3.5小结样品各批次间西红花苷-Ⅰ和西红花苷-Ⅱ的含量差异较大,说明现行的质量标准不能控制产品质量,使各批样品的投料量存在差异。实验采用HPLC法同时测定仁青芒觉胶囊中西红花苷-Ⅰ和西红花苷-Ⅱ的含量,此法方便可靠、重现性好,为仁青芒觉胶囊的质量控制与评价提供了参考资料。参考文献
[1]田薇,陈朝晖.薄层色谱法检查仁青芒觉胶囊中乌头碱、士的宁的限量[C].甘肃省化学会成立六十周年学术报告会暨二十三届年会论文集,2003,419.
[2]马宁,朱旭江,杨锡,等.仁青芒觉胶囊质量标准研究[J].中国中医药信息杂志,2014,21(6):72-75.
[3]房少新,赵利平.藏药仁青芒觉中微量元素的测定[J].光谱实验室,2013,30(2):916-919.
[4]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010.
[5]周素娣,仲惠娟.HPLC测定西红花提取物及其片剂中各西红花苷含量[J].药物分析杂志,1998,18(3):159-162.
[6]李彬,周素娣,周锦祥.中药西红花指纹图谱研究[J].海峡药学,2005,17(3):83-85.
[7]尼珍,阿萍,格桑索朗.HPLC法测定藏药二十五味珍珠丸中西红花苷Ⅰ的含量[J].药物分析杂志,2011,31(1):151-153.
[8]缪玉山,黄根林,倪冲,等.反相高效液相色谱法对不同来源西红花药材中西红花苷-1、苷-2的定量分析[J].中国药学杂志,2002,22(11):654-656.
[9]付小梅,王峥涛.西红花苷-Ⅰ的稳定性研究[J].食品科学,2012,33(5):71-73.:
(收稿日期:2015.07.10)