桂花酶解物中酚类物质及其抗氧化活性研究
2015-11-07李红领李春阳曾晓雄刘晓林南京农业大学食品科技学院江苏南京20095江苏省农业科学院农产品加工所江苏南京2004徐州林泉绿色食品饮料厂江苏徐州227
李红领,李春阳,曾晓雄,刘晓林(.南京农业大学食品科技学院,江苏南京20095;2.江苏省农业科学院农产品加工所,江苏南京2004;.徐州林泉绿色食品饮料厂,江苏徐州227)
桂花酶解物中酚类物质及其抗氧化活性研究
李红领1,2,李春阳2,*,曾晓雄1,刘晓林3
(1.南京农业大学食品科技学院,江苏南京210095;2.江苏省农业科学院农产品加工所,江苏南京210014;3.徐州林泉绿色食品饮料厂,江苏徐州221711)
运用LC-MS/MS对桂花酶解物中的酚类物质进行研究,发现桂花酶解物中含有36种酚类物质,包括单咖啡酰基奎宁酸、咖啡酸4-O-葡萄糖苷、5-O-对香豆酰基奎宁酸、4-O-对香豆酰基奎宁酸、木犀草素-7-O-6″-丙二酰基葡萄糖苷、麦角甾苷、异麦角甾苷等物质。抗氧化活性研究发现,桂花酶解物浓度大于0.8 mg/mL时,对ABTS+、DPPH·自由基清除率达90%以上,均显著高于芦丁(p<0.05),略低于Trolox;桂花酶解物的还原力为3.0左右,显著高于芦丁的1.0左右(p<0.05),稍高于Trolox;桂花酶解物的TEAC和ORAC值分别为648.66 μmol Trolox/g和813.53 μmol Trolox/g,均显著高于芦丁(p<0.05);桂花酶解物的ABTS+、DPPH·自由基清除能力和还原力与总酚含量均呈显著的线性正相关。
桂花酶解物,LC-MS/MS,抗氧化活性,总酚
桂花(Osmanthus fragranslour)系木犀科木犀属植物,原产于我国西南部,十大传统花卉之一,是著名的观赏及芳香植物,主要包括金桂、丹桂、银桂等品种。我国的传统食品如桂花糕、桂花酒和桂花茶等,一直深受人们的喜爱,所以一些学者对桂花的抗氧化活性功能进行了较为深入的研究,发现桂花具有体内外抗氧化活性功能的基础是含有丰富的黄酮和多酚类物质。田成等[1]发现桂花果实多酚溶液还原力明显高于VC溶液,对羟自由基、亚硝酸根离子的最大清除率分别为96.3%和65.4%,并对猪油有较好的抗氧化作用;靳熙茜等[2]发现桂花多酚类物质能显著抑制亚油酸的氧化进程;施余杰等[3]发现,在体外,桂花中的齐墩果酸和熊果酸可显著抑制α-葡萄糖苷酶活性;岳淑梅等[4]从桂花中分离出的三萜类物质可以显著降低小鼠血清中的TC、TG和LDL-C含量,具有显著的降血脂作用;吴如娥等[5]发现桂花的乙醇萃取物可以明显提高人体血浆中的GSH、GPX活性,降低SOD活性,并具有抗听损,抗疲劳的保健功能。
本文对桂花酶解物清除ABTS+、DPPH·自由基能力、总抗氧化能力(TEAC)和氧化自由基清除能力(ORAC)、还原力等体外抗氧化能力进行了系统的研究,并对桂花酶解物中的酚类物质成分及酚类物质含量与体外抗氧化活性的关系进行了初步研究,以期为开发具有抗氧化活性桂花汁饮品提供理论基础。
1 材料与方法
1.1材料与仪器
金桂采摘于江苏溧阳市芳之林生态园区;果胶酶NCB-PE40(30000 IU/g、50℃、pH4.8)、纤维素酶AE80(20000 IU/g、55℃、pH4.8)、木聚糖酶NCBX50(58000 IU/g、50℃、pH5.5)湖南尤特尔公司;铁氰化钾、三氯乙酸、三氯化铁、无水乙醇国药集团化学试剂有限公司;HPD100大孔树脂河北宝恩吸附材料有限公司;荧光素钠、AAPH标准品阿拉丁试剂有限公司;没食子酸、芦丁、DPPH、Trolox、ABTSSigma公司;液相用甲醇为色谱级。
FDU-1200真空冷冻干燥机东京理化/EYELA;TriStar LB 941微孔板式多功能分析仪Berthold Technologies;752S紫外可见分光光度计上海棱光技术有限公司;高效液相色谱与质谱联用仪Agilent 1100 HPLC/MS(SL) 美国Agilent公司。
1.2实验方法
1.2.1桂花酶解物的制备金桂采摘后放置在10℃条件下预冷2 h,再-21℃条件下速冻1 h,于4℃条件下贮藏备用。以5 g金桂为原料,料液比为1∶20,果胶酶、木聚糖酶、纤维素酶以3∶1∶2比例复配而成的复合酶添加量为1.0‰,然后在酶解温度45℃、pH3.5的条件下酶解120 min,0.45 μm微滤后得桂花酶解物。
1.2.2LC-MS/MS条件桂花酶解物经HPD100大孔树脂吸附后,先用去离子水洗脱糖、蛋白等杂物后,再用50%乙醇洗脱,收集洗脱液[6]。洗脱液过0.22 μm滤膜后,由自动进样器进样10 μL,流速0.6 mL/min,柱温35℃,采用Zorbax SB-C18反相色谱柱(4.6 mm× 250 mm,5 μm),DAD检测器,检测波长为280 nm。流动相A:含1.0%醋酸的水;流动相B:含1.0%醋酸的甲醇。
洗脱条件:采用梯度洗脱。以流动相B的含量来表示为:0~5 min,5%~20%;5~15 min,20%~25%;15~20 min,25%~30%;20~25 min,30%~35%;25~30 min,35%~38%;30~35 min,38%~40%;35~40 min,40%~42%;40~45 min,42%~45%;45~50 min,45%~48%; 50~55 min,48%~50%;55~60 min,50%~55%;60~65 min,55%~60%;65~75 min,60%~75%;75~80 min,75%~80%;80~85 min,80%~83%;85~90 min,83%~85%;90~95 min,85%~20%;95~100 min,20%~5%;100~110 min,5%。
质谱条件:雾化器N230(psi);干燥氮气N210(psi);毛细管温度为350℃,ESI-:3.0 kV,测定范围:m/z 100~1000[7]。
1.2.3抗氧化测定方法
1.2.3.1总抗氧化能力(TEAC) 总抗氧化能力的测定参照ABTS法[8],IC50为对ABTS+自由基清除率达到50%时的样品浓度。Trolox的IC50除以样品的IC50作为样品的总抗氧化力(TEAC)。
1.2.3.2DPPH·自由基清除率的测定DPPH的测定采用Molyneux等[9]的比色法,略有改进,所用的DPPH·溶液的浓度为用无水乙醇配制的0.1 mmol/L,避光4℃保存,现用现配。IC50为对DPPH自由基清除率达到50%时的样品浓度。
1.2.3.3还原力还原力的测定采用黄仁术等[10]方法,IC50是还原力为0.5时的样品浓度。
1.2.3.4氧化自由基清除能力(ORAC)的测定在96孔微孔板中加入200 μL稀释200倍后的酶解桂花汁待测液,然后用12道移液器进行2倍系列稀释;同时加入不同浓度的Trolox和芦丁标准品。再在每孔中加入50 μL 0.4 μmol/L荧光素钠混合,37℃反应15 min后,向每孔中加入50 μL 60 mmol/L的AAPH,选择激发波长485 nm,吸收波长535 nm,立即在微孔板式多功能分析仪中测定荧光强度,连续测定100 min[11-12]。
实验所得的各微孔反应的荧光强度数据采用积分法计算荧光衰退曲线下面积(Area under curve,AUC)。ORAC值由样品梯度浓度抗氧化保护面积(AUC样品-netAUC)曲线与Trolox标准品梯度浓度抗氧化保护面积(AUCTrolox-netAUC)曲线的斜率比得出,ORAC值以Trolox当量表达,即μmol Trolox/g。
1.2.4桂花含水量的测定称取一定质量鲜桂花,在-21℃、真空度为100 Pa的条件冻干,至质量为恒重;桂花含水量(%)=(冻干前质量-冻干后质量)×100/冻干前质量
1.2.5总酚含量测定方法总酚含量的测定参考Yao等[13]的方法,结果以每克桂花(干重)含有的总酚(以没食子酸计)含量计,即mg/g。
1.2.6数据处理根据量效关系方程Y=Bottom+(TOP-Bottom)/(1+10^((LogEC50-X)×HillSlope)),其中TOP和Bottom分别代表测量值的最大与最小值;EC50为半抑制浓度;HillSlope描述的是曲线倾斜度。利用GraphPad prism5.0软件对实验数据进行非线性拟合,得到拟合曲线和IC50值[14-15]。每组实验均重复三次,显著性检验(p<0.05)利用软件SAS 8.2来完成。
2 结果与分析
2.1桂花酶解物中的酚类物质
桂花酶解物经过大孔树脂纯化后,再经反相高效液色谱柱分离,得到36个峰(见图1),每个峰对应的一级和二级质谱数据见表1。
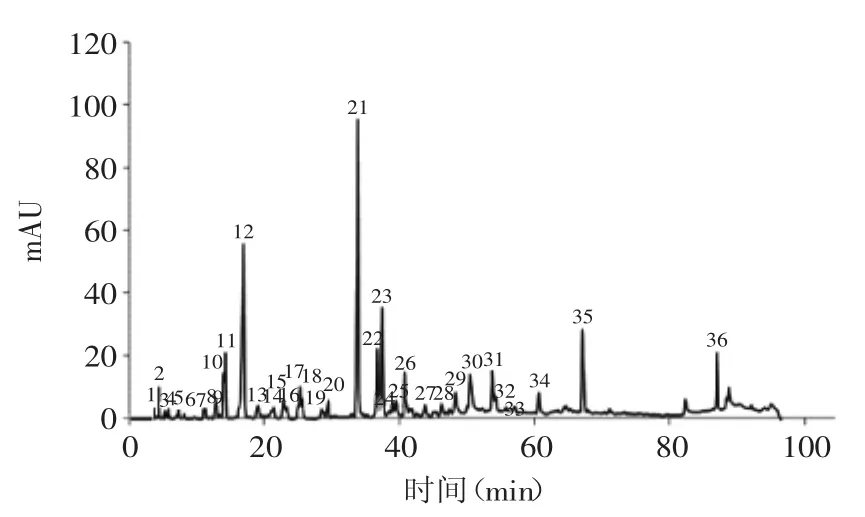
图1 桂花酶解物的反相高效液相色谱图Fig.1 HPLC chromatogram of hydrolysates from Osmanthus fragranslour

表1 桂花酶解物中酚类物质在负离子模式下的一级和二级质谱数据Table 1 MS data for phenols of hydrolysates from Osmanthus fragranslour
峰1的分子离子峰[M-H]-为m/z 352.8,二级质谱碎片Y0*m/z 191.2,其他特征离子如m/z 179.1,m/z 173.1和m/z 135.2,均与已报道的单咖啡酰基奎宁酸的离子碎片相符[16],故推测峰1为单咖啡酰基奎宁酸。峰2的分子离子峰[M-H]-为m/z 533.0,二级质谱碎Y0*为m/z 287.1,与已报道的木犀草素-7-O-6″-丙二酰基葡萄糖苷的离子碎片相符[17],故推断峰2可能为木犀草素-7-O-6″-丙二酰基葡萄糖苷。峰20的分子离子峰[M-H]-为m/z 623.4,二级质谱碎片Y0*为m/z 461.2,与已报道的麦角甾苷和异麦角甾苷相符,推测峰20可能为麦角甾苷或异麦角甾苷[16]。
通过一级和二级质谱数据可以看出,分子离子峰[M-H]-和Y0*均相同的有8组,分别为色谱峰4与5,7、8与13,9与10,16与17,18与19,21与22,23、29与34和30与31,而且每组内的物质均含有相同的其他特征离子碎片,表现出了相似的质谱裂解方式,推测这8组内的物质可能为同分异构体,如峰7、8与13的分子离子峰[M-H]-均为m/z 341.0,二级质谱碎片Y0*也均为m/z 187.7,推测三者中有咖啡酸4-O-葡萄糖苷或为咖啡酸4-O-葡萄糖苷的同分异构体[16]。分子离子峰[M-H]-相同,Y0*不同的有3组,分别是峰11与12,14与15和25与26,在质谱裂解过程中,Y0*的不同体现出了同分异构体的不同质谱裂解方式。如峰14与15,其分子离子峰[M-H]-均为m/z 337.0,然后峰14失去一个对香豆酰基得到Y0*m/z 190.8,峰15同时失去一个对香豆酰基和一个H2O分子,得到Y0*m/z 172.8,其他特征碎片也分别与已报道的5-O-对香豆酰基奎宁酸和4-O-对香豆酰基奎宁酸的离子碎片相符[18],推测峰14和15分别为5-O-对香豆酰基奎宁酸和4-O-对香豆酰基奎宁酸。综上所述,桂花酶解汁物中共含有11组同分异构体的酚类物质。
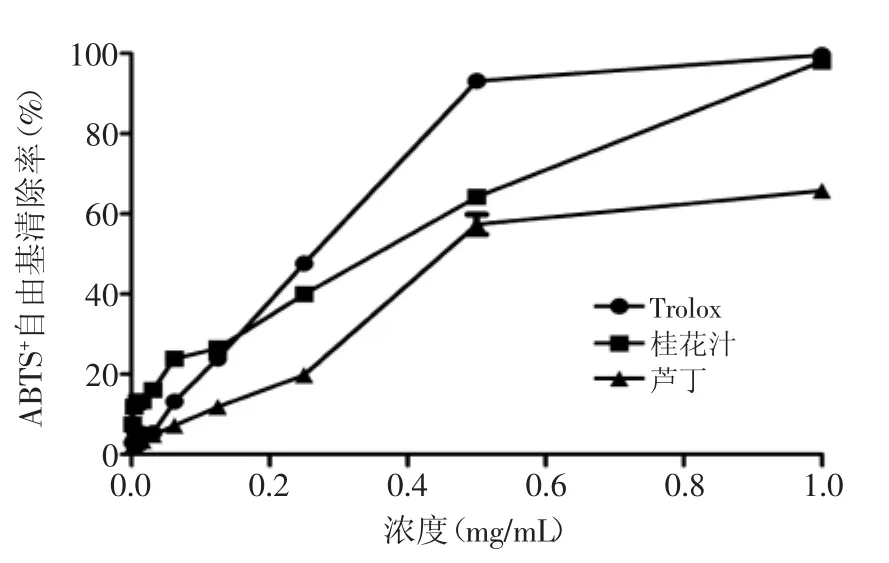
图2 不同浓度Trolox、桂花酶解物和芦丁对ABTS+自由基的清除率Fig.2 Scavenging activity of different concerntrations of Trolox,hydrolysates from Osmanthus fragranslour and Rutin on ABTS+free radical
2.2桂花酶解物的抗氧化能力
2.2.1清除ABTS+自由基能力由图2可知,在低浓度区域(浓度<0.125 mg/mL),对ABTS+自由基清除率大小的顺序为:桂花酶解物>Trolox>芦丁,但是清除率都较低,最大不超过30%;在中等浓度区域(0.125 mg/mL<浓度<0.5 mg/mL),三者对ABTS+自由基的清除率都急剧增加,由曲线斜率可以看出,清除率增加的速率大小顺序为:芦丁>Trolox>桂花酶解物,浓度为0.5 mg/mL时,清除率较高,最低不小于50%;在高浓度区域(浓度>0.5 mg/mL),Trolox和芦丁对ABTS+自由基的清除率都趋于达到平衡,而桂花酶解物则呈现直线升高的趋势,最终达到与Trolox相当的水平,二者对ABTS+自由基的清除率都达到90%以上,并显著高于芦丁(p<0.05)。根据量效方程,对Trolox、桂花酶解物和芦丁的ABTS+自由基清除率数据进行非线性拟合,得到拟合曲线的决定系数(R2)分别为0.9972、0.9652、0.9947,拟合结果显著,IC50值分别为0.2341、0.3609、0.4231 mg/mL。根据1.2.3.1中所述方法计算总抗氧化能力(TEAC),桂花酶解物显著高于芦丁(p<0.05),分别为(648.66±20.36)、(553.30± 14.48)μmol Trolox/g。
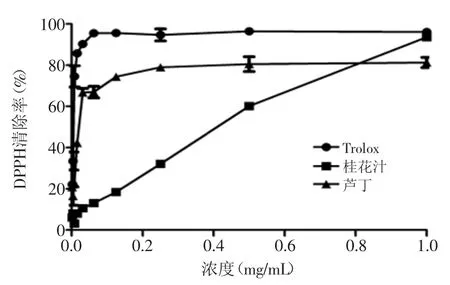
图3 不同浓度Trolox、桂花酶解物和芦丁对DPPH·自由基的清除率Fig.3 Scavenging activity of different concerntrations of Trolox,hydrolysates from Osmanthus fragranslour and Rutin on DPPH·free radical
2.2.2清除DPPH·自由基能力由图3可知,在浓度小于0.125 mg/mL时,Trolox和芦丁对DPPH·自由基的清除率急剧升高,在浓度大于0.125 mg/mL时,清除率趋于平衡;而桂花酶解物则随着浓度的不断升高,对DPPH·自由基的清除率一直保持线性增加趋势,在浓度为0.8 mg/mL时,超过芦丁,在浓度为1.0 mg/mL时,达到与Trolox同样的水平,清除率达到96%,显著高于芦丁(p<0.05),此时芦丁清除率只有78%。根据量效方程,对Trolox、桂花酶解物和芦丁的DPPH·自由基清除率数据进行非线性拟合,得拟合曲线的决定系数(R2)分别为0.9827、0.9974、0.9695,拟合结果显著,IC50值分别为0.0058、0.2701、0.0162 mg/mL。
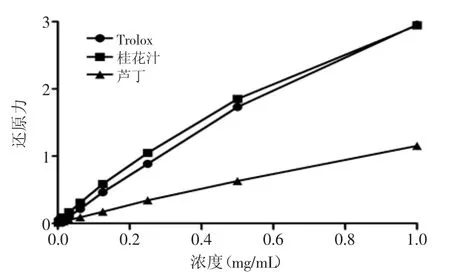
图4 不同浓度Trolox、桂花酶解物和芦丁的还原力Fig.4 Reducing powers of different concerntrations of Trolox,hydrolysates from Osmanthus fragranslour and Rutin
2.2.3还原力由图4可知,随着浓度的不断升高,三者的还原力大小也在急剧升高。在各个相同浓度梯度的条件下,桂花酶解物的还原力稍高于Trolox,显著高于芦丁(p<0.05)。在终浓度1.0 mg/mL时,桂花酶解物和Trolox的还原力接近于3.0,而芦丁的只有1.0左右。根据量效方程,对Trolox、桂花酶解物和芦丁的还原力数据进行非线性拟合,得拟合曲线的决定系数(R2)分别为0.9994、0.9974、0.9999,拟合结果显著,IC50值分别为0.1119、0.0857、0.2287 mg/mL。
2.2.4氧化自由基清除能力(ORAC) 图5为5种梯度浓度Trolox与阳性对照(-AAPH)与阴性对照(+AAPH)的荧光衰变曲线,图6、图7分别为桂花酶解物和芦丁的4种梯度浓度的荧光衰变曲线。从图5~图7可以看出,随浓度的增加,样品抗氧化保护面积(AUC样品-netAUC)增加。根据1.2.3.4所述方法,计算Trolox、桂花酶解物和芦丁的抗氧化保护面积曲线斜率,计算得到桂花酶解物的ORAC值为(813.53±27.59)μmol Trolox/g,显著高于芦丁为(699.29±41.23)μmol Trolox/g(p<0.05)。

图5 Trolox的荧光衰减曲线Fig.5 The fluorescence absorption curve of Trolox
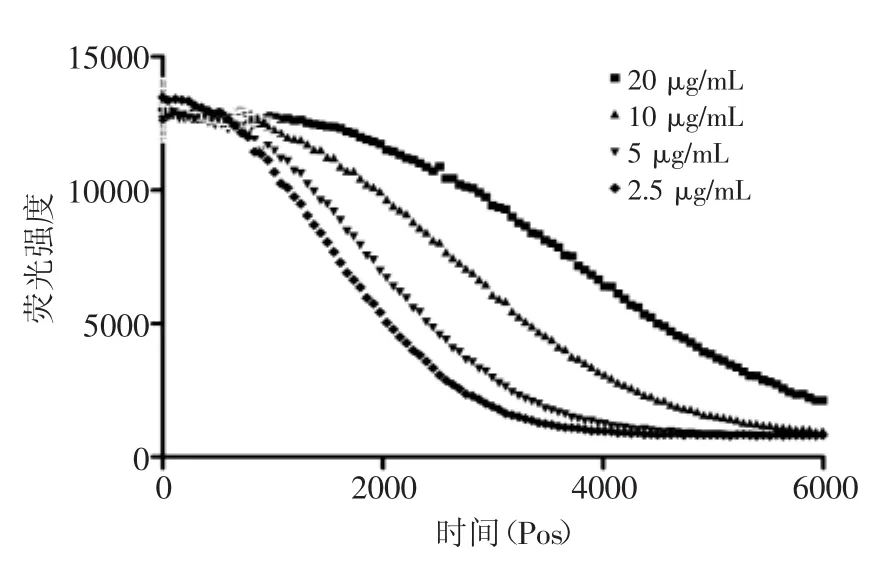
图6 芦丁的荧光衰减曲线Fig.6 The fluorescence absorption curve of Rutin
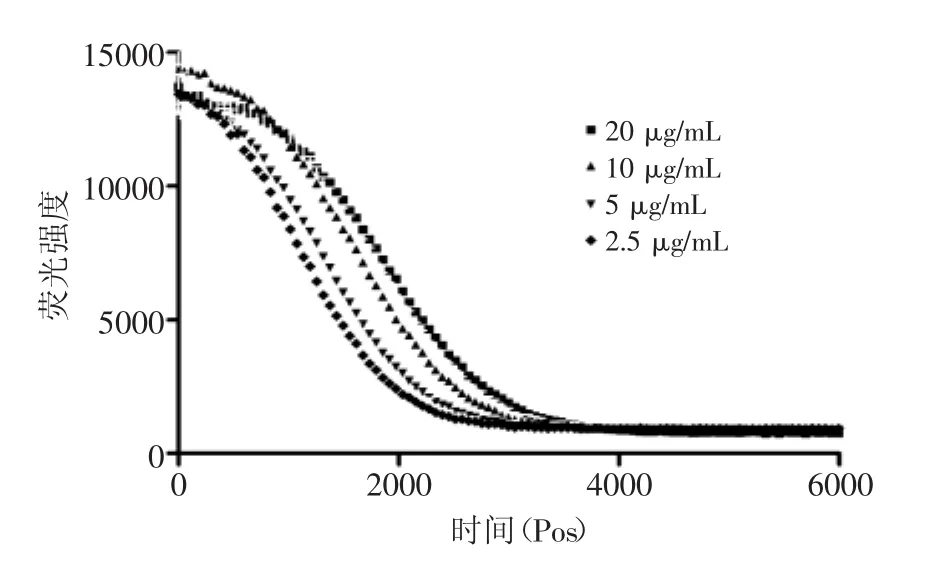
图7 桂花酶解物的荧光衰减曲线Fig.7 The fluorescence absorption curve of hydrolysates from Osmanthus fragranslour
2.3抗氧化活性与桂花酶解物中总酚含量的相关性
测得桂花含水量为85.32%±0.32%,酶解物中的总酚含量为(18.02±0.24)mg/g,ABTS+、DPPH·自由基清除率和还原力与总酚含量的线性关系见表2。

表2 ABTS+、DPPH·自由基清除率、还原力与总酚含量的线性关系Table 2 Correlation between scavenging activity of ABTS+,DPPH·free radical and Reducing powers and Total polyphenolics
由表2中回归方程决定系数R2和p值可知,回归模型显著。ABTS+、DPPH·自由基清除率和还原力都与桂花酶解物中的总酚含量呈显著的线性正相关,表明桂花酶解物的抗氧化活性与其所含的酚类物质有关。
3 结论
通过LC-MS/MS研究发现,桂花酶解物中含有36种酚类物质,包括单咖啡酰基奎宁酸、咖啡酸4-O-葡萄糖苷、5-O-对香豆酰基奎宁酸、4-O-对香豆酰基奎宁酸、木犀草素-7-O-6″-丙二酰基葡萄糖苷、麦角甾苷、异麦角甾苷等物质。桂花酶解物对ABTS+、DPPH·自由基的清除能力、还原力、ORAC值、TEAC值显著高于芦丁(p<0.05),具有一定的抗氧化活性,适于开发具有抗氧化活性的桂花饮品。桂花酶解物的ABTS+、DPPH·自由基清除率和还原力与总酚含量均呈显著的线性正相关,表明多酚类物质在酶解桂花汁抗氧化活性中具有重要作用。
[1]田成.桂花果实多酚的超声波提取及抗氧化活性研究[J].食品科学,2012,32(24):106-110.
[2]靳熙茜,汪海波.桂花总黄酮提取及其体外抗氧化性能研究[J].粮食与油脂,2009(11):42-45.
[3]施余杰.桂花有效成分体外α-葡萄糖苷酶活性及药动因素研究[D].开封:河南大学,2013.
[4]岳淑梅,王金梅,康文艺.桂花三萜类成分及降血脂作用的研究[J].中国实验方剂学杂志,2013,19(24):126-128.
[5]吴如娥.桂花萃取物对游乐区场所劳工抗氧化能力提升对听损及疲劳症候减少之研究[D].台湾:中华医事科技大学,2011.
[6]李春阳,冯进.蓝莓叶多酚与蓝莓果渣多酚提取物抗氧化活性研究[J].食品工业科技,2013(7):56-60.
[7]冯进,李敏,曾晓雄,等.大孔树脂纯化蓝莓叶多酚及其组成分析[J].食品科学,2013,34(10):86-91.
[8]Bhattacherjee A,Ghosh T,Sil R,et al.Isolation and characterisation of methanol-soluble fraction of Alternanthera philoxeroides(Mart.)-evaluation of their antioxidant,α-glucosidase inhibitory and antimicrobial activity in in vitro systems[J].Natural product research,2014,28(23):2199-2202.
[9]MolyneuxP.Theuseofthestablefreeradical diphenylpicrylhydrazyl(DPPH)for estimating antioxidant activity[J].Songklanakarin J Sci Technol,2004,26(2):211-219.
[10]黄仁术,易凡,何惠利,等.金荞麦(-)-表儿茶素抗氧化活性研究[J].食品科学,2014(15):26.
[11]Thaipong K,Boonprakob U,Crosby K,et al.Comparison ofABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis,2006,19(6):669-675.
[12]Kevers C,Sipel A,Pincemail J,et al.Antioxidant Capacity of Hydrophilic Food Matrices:Optimization and Validation of ORAC Assay[J].Food Analytical Methods,2014,7(2):409-416.
[13]Yao F,Huang Z,Li D,et al.Phenolic components,antioxidant enzyme activities and anatomic structure of longan fruit pericarp followingtreatmentwithadenylatetriphosphate[J].Scientia Horticulturae,2014,180:6-13.
[14]Kis E,Rajnai Z,Ioja E,et al.Mouse Bsep ATPase assay:a nonradioactive tool for assessment of the cholestatic potential of drugs[J].Journal of Biomolecular Screening,2008,14(1):10-15.
[15]Khan R A,Khan M R,Sahreen S,et al.Assessment of flavonoids contents and in vitro antioxidant activity of Launaea procumbens[J].Chem Central J,2012,6(1):43.
[16]Lin L Z,Harnly J M.Identification of the phenolic components of chrysanthemum flower(Chrysanthemum morifolium Ramat)[J]. Food Chemistry,2010,120(1):319-326.
[17]Zhang W B,Wang Z C,Zhang L Y.Determination of 10 caffeoylquinic acids and 22 flavonoids in chrysanthemum samples by ultra-high performance liquid chromatography-diode array detection-tandemmassspectrometry[J].ChineseJournalof Analytical Chemistry,2013(12):14.
[18]Clifford M N.Hierarchical scheme for LC-MSn identification of chlorogenic acids[J].J Agric Food Chem,2003,51(10):2900-2911.

图3 食用油样品色谱图Fig.3 Separation chromatogram of edible oil sample
3 结论
采用高效液相色谱-荧光检测法,运用凝胶色谱技术,建立了食用油中10种荧光增白剂迁移量的检测方法。各组分检出限均可小于0.1 mg/kg;系列浓度曲线相关系数均>0.997;回收率范围在62.6%~99.3%之间,相对标准偏差范围在2.9%~11.0%之间。本方法检测限低、线性关系良好、精密度和准确度高,可满足国内外相关法规中荧光增白剂迁移量的检测要求。
参考文献
[1]罗磊,乔辉,吴立峰.影响荧光增白剂在塑料中增白效果因素的研究[J].塑料,2006,35(4):80-84.
[2]董金狮.食品包装与食品安全[J].今日印刷,2013,25(3):10-14.
[3]Commission Regulation(EU)No 10/2011 on plastic materials and articles intended to come into contact with food[S].(EU)No 10/2011.
[4]中华人民共和国卫生部中国国家标准化管理委员会.GB 9685-2008食品容器、包装材料用添加剂限量标准[S].北京:中国标准出版社,2008.
[5]姜莉,巫书刚,张庆辉,等.纸张中荧光增白剂含量测定的研究[J].上海染料,2011,39(4):40-43.
[6]Mario de los Santos,Ramon Batlle,Jesus Salafranca,et al. Subcriticalwateranddynamicsonication-assistedsolvent extraction of fluorescent whitening agents and azo dyes in paper samples[J].Journal of Chromatography,2005,1064(2):135-141.
[7]郭盛,黄德义,佘集峰,等.纸质食品包装材料中荧光增白剂迁移规律的研究[J].中华纸业,2012,23(16):29-32.
[8]杨扬.造纸过程水及纸产品中荧光增白剂的定量分析[J].国际造纸,2013,32(3):43-47.
[9]罗冠中,刘祥,汪晓冬,等.荧光分光光度法测定生活用纸制品中的荧光增白剂[J].中国测试,2009,35(4):68-71.
[10]冼燕萍,郭新东,罗海英,等.固相萃取-超高效液相色谱分离测定洗涤用品中4种荧光增白剂[J].色谱,2013,31(2):162-169.
[11]赵承礼,向仕学.荧光分光光度法测定餐具洗涤剂中荧光增白剂[J].中国卫生检验杂志,1998,8(5):263-266.
[12]谭曜,王群威,许迪明,等.塑料制品中荧光性增白剂定性定量测定方法的建立[J].塑料工业,2011,39(6):52-55.
[13]Iliano B,Oudar A M,Gossele J.Separation of optical brighteners for plastics and migration into water and olive oil[J]. Deutsche Lebensmittel-Rundschau,1995,91(7):205-208.
[14]焦艳娜,丁利,朱绍华,等.高效液相色谱-荧光检测法测定食品接触材料塑料制品中荧光增白剂[J].色谱,2013,31(1):83-87.
[15]邓凯芬,任佳丽,彭湘莲,等.ASE/HPLC测定纸塑包装中荧光增白剂VBL[J].食品与机械,2012,28(3):96-100.
Study on the phenolics of hydrolysates from Osmanthus fragranslour and its antioxidant activity
LI Hong-ling1,2,LI Chun-yang2,*,ZENG Xiao-xiong1,LIU Xiao-lin3
(1.College of Food Science and Technology,Nanjing Agriculture University,Nanjing 210095,China;2.Institute of Farm Product Processing,Jiangsu Academy of Agriculture Science,Nanjing 210014,China;3.Beverage Factory of Organic Foods in Linquan,Xuzhou 221711,China)
The present study investigated the phenolics of hydrolysates of Osmanthus fragranslour by LC-MS/ MS.The research results demonstrated that hydrolysates of Osmanthus fragranslour contained 36 varities of phenolics,including Caffeyolquinic acid,Caffeic acid 4-glucoside 4-O-p-coumaroylquinic acid,5-O-pcoumaroylquinic acid,Luteolin-7-O-6″-malonylglucoside,Acteoside,Isoacteoside etc.This study also evaluated the antioxidant activity of hydrolysates of Osmanthus fragranslour,Trolox and Rutin.It showed that scavenging activity of ABTS+and DPPH·free radical and reducing power of hydrolysates from Osmanthus fragranslour reached 90%and were slightly lower than Trolox,but significantly higher than Rutin(p<0.05),when the concentration was greater than 0.8 mg/mL.The values of TEAC and ORAC of hydrolysates from Osmanthus fragranslour were 648.66 μmol Trolox/g and 813.53 μmol Trolox/g and significantly higher than Rutin(p<0.05).It was observed that the scavenging activity of ABTS+and DPPH·free radical and reducing power of hydrolysates from Osmanthus fragranslour had a significantly positive correlation with the contents of polyphenolics.
hydrolysates from Osmanthus fragranslour;LC-MS/MS;antioxidant activity;total polyphenolics
TS201.1
A
1002-0306(2015)24-0085-06
10.13386/j.issn1002-0306.2015.24.009
2015-04-20
李红领(1990-),男,硕士研究生,研究方向:功能性食品,E-mail:2013108070@njau.edu.cn。
李春阳(1966-),男,研究员,研究方向:营养与活性物质,农产品精深加工,E-mail:lichunyang968@126.com。
江苏省农业科技自主创新资金(CX(14)2120);江苏省苏北科技专项资金(富民强县)项目(BN2014088);2014年中央财政农业技术推广资金项目(TG(14)113)。
