伏马菌素B1胶体金免疫层析快速检测试纸条的研制
2015-11-07任文洁黄志兵李燕萍苏保伟季艳伟南昌大学食品科学与技术国家重点实验室南昌大学中德联合院江西南昌330047
任文洁,黄志兵,许 杨,李燕萍,涂 追,苏保伟,季艳伟(南昌大学食品科学与技术国家重点实验室,南昌大学中德联合院,江西南昌330047)
伏马菌素B1胶体金免疫层析快速检测试纸条的研制
任文洁,黄志兵*,许杨,李燕萍,涂追,苏保伟,季艳伟
(南昌大学食品科学与技术国家重点实验室,南昌大学中德联合院,江西南昌330047)
目的:为制备一种快速检测玉米中伏马菌素B1(FB1)胶体金免疫层析试纸条。方法:采用碳化二亚胺法合成检测抗原FB1-BSA,柠檬酸三钠还原法制备胶体金溶液,辛酸-饱和硫酸铵法对抗FB1单克隆抗体腹水进行纯化,将金标抗体喷于金标垫,检测抗原FB1-BSA(T线)和羊抗鼠二抗(C线)喷涂于硝酸纤维素膜(NC膜)。结果:得到的单克隆抗体效价为1.28×105。该试纸条的NC膜喷涂的检测抗原浓度为200 μg/mL,羊抗鼠二抗浓度为1.0 mg/mL,喷涂量分别为0.74 μL/cm,试纸条灵敏度为20 ng/mL,检测时间只需5 min,试纸条于4℃至少可保存12个月。结论:采用制备的试纸条对玉米实际样品进行检测,检测结果与高效液相和酶联免疫吸附法检测结果相一致,说明该试纸条适合现场快速检测伏马菌素B1。
快速检测,胶体金免疫层析,伏马菌素B1,玉米
真菌毒素污染一直是全球食品安全领域研究的热点之一[1]。伏马菌素(Fumonisins,FBs)是一类主要由串珠镰刀菌产生的水溶性毒素,大多存在于玉米及其制品中。当前有28种不同的伏马菌素被报道,其中伏马菌素B1是FBs中毒性最强的主要组分,占总量的70%~80%[2]。研究表明,FB1的主要毒性有神经毒性、致癌性、致突变性等,能诱发人类多种疾病[3],1993年国际癌症研究中心(IARC)将FB1列为2B类致癌物质[4]。瑞士制定了食品中伏马菌素的限量标准为1 mg/kg;2014年7月国际食品法典委员会(CAC)将玉米当中伏马菌素的限量定为4 mg/kg;我国尚未制定食品中伏马菌素的限量标准。目前,FB1的检测方法主要包括仪器检测方法[5]和酶联免疫吸附(ELISA)检测方法[6],这些检测方法不适合现场快速检测。胶体金免疫层析法具有简便、快速、无需特殊设备等优点[7-8],现已被广泛应用于医学和食品安全等领域的现场快速检测[9]。
目前,已有采用较多胶体金免疫层析试纸条快速检测FB1的报道[10-15],有的文献虽然报道的检测FB1试纸条的灵敏度为5 ng/mL,然而,当FB1浓度达到20 ng/mL时,试纸条的检测线(T线)的颜色尚未完全消失,且未对试纸条的各主要参数进行优化,试纸条的稳定性也未涉及[10]。本文旨在制备出快速检测FB1的胶体金免疫层析试纸条,并对影响试纸条性能的各主要参数进行优化,可以实现产业化,对于食品中FB1污染的快速筛查和防控具有重要意义。
1 材料与方法
1.1材料与仪器
玉米样品购自本地市场并保存于实验室;FB1等真菌毒素标准品、牛血清白蛋白(BSA)、氯金酸(HAuCl4·3H2O)、柠檬酸三钠、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCA)美国Sigma公司;抗FB1单克隆抗体由本实验制备;甲醇(色谱纯)、硫酸铵等分析纯,国药集团化学试剂有限公司;硝酸纤维素膜(Vivid 170,Sartorius CN140,Millipore135,Vivid 90,Sartorius CN 95,whatman prima 40,whatman AE99)和羊抗鼠IgG二抗上海杰一生物技术有限公司;PriboFast®FB1酶联免疫检测试剂盒新加坡Pribolab公司。
Ultrospec-4300紫外可见光分光光度仪瑞典Pharmacia公司;Multiskan FC酶联免疫检测仪、Multfuge X1R低温高速离心机美国Thermo公司;超纯水制备仪美国Millipore公司;XYZ 3000平台系统及试纸条切刀美国Biodot公司;H-600透射电镜日本Hitachi公司;MA磁力搅拌加热器德国Electromantle公司;Waters 510高效液相色谱仪和2475型荧光检测器美国Waters公司。
1.2实验方法
1.2.1检测抗原(FB1-BSA)的合成和单克隆抗体(McAb)纯化采用碳化二亚胺法合成检测抗原[16]。取1 mg FB1标品和4 mg BSA分别溶于1 mL的1×PBS,两者混匀后加入溶度为20 mg/mL新配制的1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCA)水溶液0.2 mL,在25℃的水平摇床上反应2 h(反应过程中补加0.2 mL 20 mg/mL的新配制的EDCA水溶液),静置20 min后,在4℃冰箱中1×PBS(0.1mol/L磷酸盐缓冲液)透析72 h,测其浓度,分装于-20℃冻存。抗FB1单克隆抗体按照文献[17]方法由本实验室制备,并采用辛酸-饱和硫酸铵法对单克隆抗体进行纯化[16]。经超滤除去盐离子后的检测抗原(FB1-BSA),用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)进行分析,对其偶联比进行测定。采用间接酶联免疫(ELISA)方法对单克隆抗体进行评估,并确定最佳包被抗原浓度和抗体工作稀释度。
1.2.2胶体金溶液和金标抗体的制备采用柠檬酸三钠还原法制备胶体金[10],并采用透射电镜(TEM)测定胶体金颗粒大小及分散情况,同时计算胶体金颗粒的平均直径。采用pH梯度实验法确定最适pH和蛋白梯度实验法确定最适抗体量[18],然后制备金标抗体。磁力搅拌下,用1%碳酸钾将胶体金溶液调整为最适pH,将用超纯水稀释100倍的FB1单克隆抗体逐滴加入胶体金溶液,继续搅拌30 min。然后加入原体积10%的BSA(10%,w/v),继续搅拌15 min。将已经标记好的胶体金10000 g、4℃离心30 min,吸取上清,将沉淀的金标抗体用金子稀释液(含10%蔗糖、1.0% BSA、0.1%PEG-2000、2.5%海藻糖及0.02%叠氮钠的0.01 moL/L pH 7.4的PBS)复溶4℃保存。
1.2.3胶体金探针合成的最适pH和最适抗体量的确定采用pH梯度实验法。取8个5 mL的三角瓶,分别加入3 mL的胶体金溶液,依次加入10、12、14、16、18、20、24、28 μL的碳酸钾溶液,每个瓶子加入2 μg的单克隆抗体进行标记、离心。测胶体金探针制备所得的上清的OD值,与参比(只采用超纯水将相同量的单克隆抗体稀释相同倍数,该抗体未与胶体金标记)相比较,得最适pH。采用蛋白梯度实验法。取8个5 mL的三角瓶,分别加入3 mL的胶体金溶液、20 μL的碳酸钾溶液,依次加入0.8、1、1.2、1.4、1.6、1.8、2.0、2.2 μg的单克隆抗体,进行标记、离心。测胶体金探针制备所得的上清的OD值,与参比(只采用超纯水将相同量的单克隆抗体稀释相同倍数,该抗体未与胶体金标记)相比较,得最适抗体量。
1.2.4硝酸纤维素膜(NC膜)的选择选择Vivid 170,Sartorius CN140,Millipore135,Vivid 90,Sartorius CN 95,whatman prima 40,whatman AE99,共七种不同的NC膜。将各种NC膜分别组成试纸条,然后进行空白样品的测定,观察各膜上检测线及质控线的颜色强度和溶液在NC膜上的迁移速度,最终确定最适NC膜。
1.2.5FB1-BSA与金标抗体量的确定检测线上FB1-BSA的量设定为200、300、400 μg/mL共3组,每组中胶体金垫上金标抗体的量分别为10、12和14 μL/cm。根据检测线的形态、检测线颜色强度等确定最适的检测抗原与金标抗体的量。
1.2.6试纸条的组装及检测原理将浓度为200 μg/mL检测抗原(T线)和浓度为1.0 mg/mL羊抗鼠二抗(C线)按照0.74 μL/cm的量喷涂于硝酸纤维素膜(NC膜)、喷有金标抗体探针(14 μL/cm)的胶体金垫、样品垫和吸水垫一次黏贴到PVC底板上,切成试纸条。
试纸条检测原理概述为:当样品中FB1浓度小于1 mg/mL时,FB1先与金标抗体结合,多余的金标抗体也会与T线上的检测抗原结合,故T线和C线均显红色,结果为阴性,采用“-”表示;当样品中FB1浓度大于等于1 mg/mL时,FB1先与金标抗体完全结合,此时没有剩余的金标抗体,T线上的检测抗原不能与金标抗体结合,故T线不显红色,C线显红色,结果为阳性,采用“+”表示。
1.2.7试纸条的灵敏度、特异性和稳定性(n=3) FB1标准品用PBS梯度稀释成0、5、10、20、30、50 ng/mL,取100 μL滴于样品垫上,5 min左右观察结果。使检测线颜色完全消失的标准品浓度则可认为是该试纸条使用时最容易、最准确的判定浓度。将脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、赭曲霉毒素(OTA)和黄曲霉素B1(AFB1)四种真菌毒素分别配制为浓度为5、50 ng/mL,然后采用制备好地试纸条,分别测定上述两个浓度下的各种真菌毒素的显色情况,判断试纸条的特异性。将组装好的试纸条真空封装,置于4℃保存,每隔3个月检测一次,每组2条,分别为0、20 ng/mL标准品浓度,判断试纸条的稳定性。
1.2.8三种方法检测谷物中FB1的比较实验分别用高效液相色谱法、ELISA法和试纸条三种方法对玉米样品中的伏马菌素(B1)进行测量,每个样品测定3次,对其结果进行比较。高效液相色谱法按文献[16]进行样品处理和测定,取1 g的玉米样品,加入5 mL甲醇-水(3∶1),振荡15 min,4000 g离心10 min,取2.5 mL上清液过强阴离子交换柱(SAX-SPE柱)后,邻苯二甲醛(OPA)衍生1 min,取20 μL进样测定;ELISA法按商品化的PriboFast®FB1ELISA试剂盒说明书进行操作,取20 g玉米样品,加入100 mL 70%的甲醇,振荡5 min,3000×g离心5 min,取上清液50 μL,加入700 μL样品稀释液稀释,取100 μL上样测定;试纸条的样品处理和测定,取1 g的玉米样品,加入5 mL 1×PBS,振荡15 min,4000×g离心10 min,取上清液1 mL,稀释10倍,取100 μL滴于样品垫上进行检测。
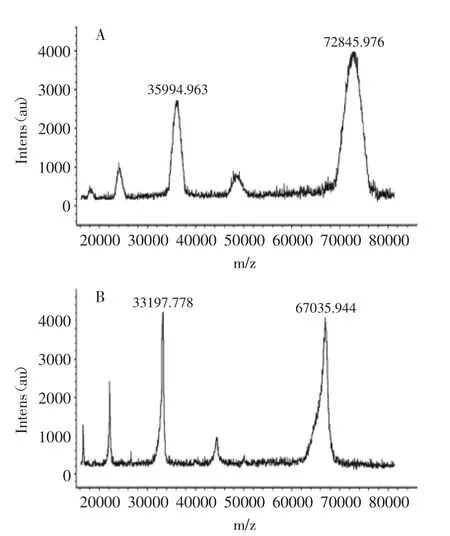
图1 FB1-BSA(A)和BSA(B)的MALDI-TOF-MS图谱Fig.1 MALDI-TOF-MS spectrum of FB1-BSA(A)and BSA(B)
2 结果与分析
2.1纯化后抗体效价的测定
伏马菌素属于半抗原物质,FB1分子量约为721[17],必须先将半抗原和大分子物质结合后,才具有免疫原性。由图1 MALDI-TOF-MS仪器分析图可知,FB1-BSA的Mw为72845,BSA的Mw为67035,偶联比约为(72845-67035)/721≈8。根据分子量的改变并结合紫外可见光谱扫描的方法确定FB1与BSA偶联成功。腹水抗体中成分复杂,非特异性抗体的杂蛋白较多,其中的杂蛋白等成分可能会在检测时影响单克隆抗体特异性、敏感度和生物活性,因此对腹水抗体进行纯化是必要的。使用EPOCH微孔板分光光度计直接测定抗体的蛋白浓度,纯化后单抗蛋白含量为1.25 mg/mL。间接非竞争ELISA方法测定FB1抗体效价为1∶128000(见表1)。
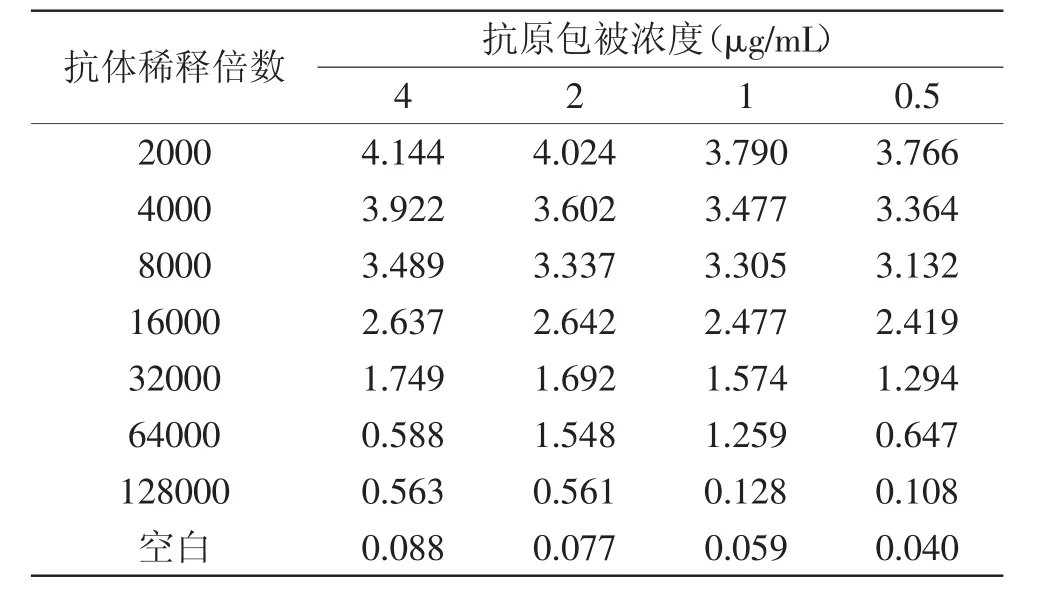
表1 间接非竞争ELISA实验结果Table 1 The detection results of indirect ELISA
2.2胶体金溶液的制备及鉴定
采用柠檬酸三钠还原法制备胶体金溶液如图2(A)所示,所得胶体金溶液呈红色,澄清均匀,4℃存放7个月无明显变化,说明所得胶体金溶液比较稳定;胶体金溶液的紫外扫描电镜结果见图2(B),显示胶体金紫外最大吸收峰为525 nm,峰面积比较小,说明胶体金溶液的粒径分布比较均匀;胶体金颗粒电镜观察结果见图2(C),照片显示胶体金颗粒分布比较均匀,无异形颗粒。统计图片中胶体金颗粒的直径,绝胶体金颗粒的粒径在20~30 nm之间,平均粒径约25 nm。

图2 胶体金溶液的制备及鉴定Fig.2 Preparation and identification of gold colloid solution
2.3金标探针的鉴定
标记后的胶体金探针溶液如图3(A)所示,其颜色为红色,澄清透亮,其电镜照片见图3(B),可见其颗粒分布较均匀,颗粒周围有明显的蛋白晕环,说明标记效果较好。

图3 金标探针的鉴定Fig.3 Identification of gold nanoparticle-McAb probe
2.4胶体金探针合成的最适pH
胶体金溶液的pH和单克隆抗体的投入量是制备胶体金探针的关键,它们不仅影响胶体金探针的稳定性,对试纸条的灵敏度和稳定性也有很大的影响。图4结果显示,当加入1%碳酸钾的量在12.5~20 μL的范围内,上清中的抗体量比较少,表示标记成功,测胶体金溶液的pH为6.5,且当碳酸钾的量为20 μL时,制备的胶体金探针更稳定,故选择加入1%碳酸钾的量为20 μL。

图4 胶体金探针合成的最适pHFig.4 Optimum pH of gold nanoparticle-McAb probe
2.5胶体金探针合成的最适抗体量
胶体金溶液的单克隆抗体的投入量也是制备胶体金探针的关键。图5显示,当FB1单克隆的量大于1 μg时,上清中的抗体量趋于稳定,为了保证探针的灵敏度,故选取1 μg为最低稳定蛋白量,通常还要在最低稳定蛋白量的基础上再增加20%为制备胶体金探针的合适量[19],因此选择1.2 μg/mL为最适抗体量。
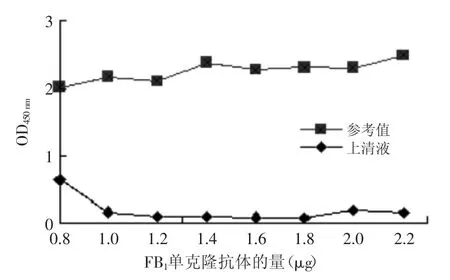
图5 胶体金探针合成的最适抗体量的确定Fig.5 Optimum quantity of McAb of gold nanoparticle-McAb probe
2.6NC膜的选择
检测线(T)和控制线(C)均划在NC膜上,免疫反应在此反应,因此NC膜也是试纸条表征的关键因素之一。图6显示了不同NC膜上检测线和质控线的情况,由图6可知Sartorius CN 140和Sartorius CN 95膜上检测线和质控线的形态和颜色最好,Sartorius CN 140膜的线更集中些,故选择Sartorius CN 140膜为本实验最适的NC膜。

图6 不同NC膜制备的试纸条的比较Fig.6 Comparing of different NC membranes in ICG
2.7检测抗原(FB1-BSA)与金标抗体量的确定
从图7中可以看出,质控线(C线)的形态均良好,且颜色强度适中。比较检测线(T线),随着检测抗原和金标抗体的量增大,检测线的颜色逐渐增强,但考虑小分子物质试纸条检测的竞争性原理,为提高检测的灵敏度,故选择了检测抗原相对较少的200 μg/mL、金标抗体14 μL/cm的组合为最适组合。

图7 检测抗原与金标抗体量的确定Fig.7 Confirming the quantity of FB1-OVAand McAb of gold nanoparticle-McAb probe
2.8胶体金试纸条的灵敏度
FB1标准品溶液浓度分别为0、5、10、20、30、50 ng/mL,平行测定3次。其试纸条检测灵敏度的结果如图8所示。随着FB1浓度的增加,检测线的颜色强度逐渐变弱,当FB1浓度大于20 ng/mL时,肉眼可见检测线颜色完全消失,呈阳性。因此,确定该试纸条检测灵敏度为20 ng/mL。
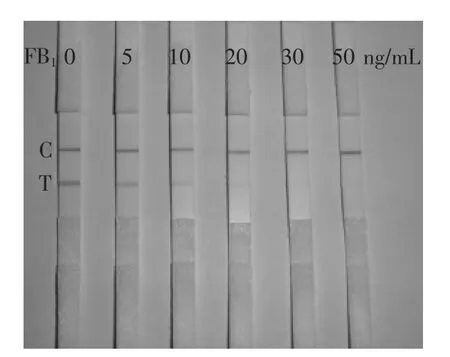
图8 胶体金免疫层析快速检测试纸条的灵敏度Fig.8 The sensitivity of the ICG
2.9胶体金试纸条的稳定性
每组试纸条测试3次,间隔3个月。从图9可以看出,3~12月之间,试纸条处于稳定的状态,试纸条检测线和控制线颜色和灵敏度无明显变化,背景清晰;因此,确定该试纸条可在4℃,密闭的条件贮存12个月。

图9 胶体金免疫层析快速检测试纸条的稳定性Fig.9 Stability of gold colloid test strip
2.10胶体金试纸条的特异性
采用制备好地试纸条,将测定液中分别只含DON、ZEN、OTA、AFB1和FB1平行测定3次,由图10可以看出,4种真菌毒素在两个不同浓度下,均显示两条明显的红线,说明这四种真菌毒素和金标记的FB1抗体不与NC膜上的检测抗原发生竞争反应,说明该单抗与其他真菌毒素无交叉反应。而FB1在低浓度或高浓度下,T线显色明显有区别,说明该试纸条对FB1具有较高的特异性。

图10 胶体金试纸条的交叉反应Fig.10 Cross reactivity of the test strip with other toxins
2.11实际样品的测定

图11 实际玉米样品的检测Fig.11 Detection of fumonisin B1with immunochromatographic strip maize samples
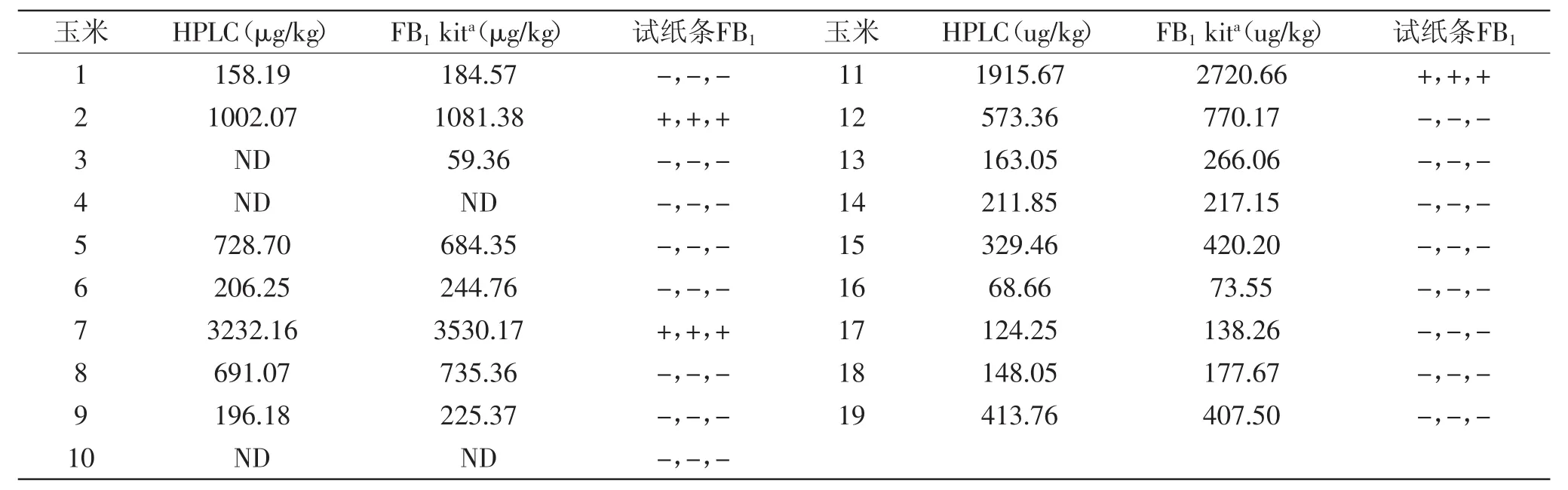
表2 三种检测方法检测实际玉米样品的比较(n=3)Table 2 Comparison of the three detection methods to detect the FB1in corn samples(n=3)
由图11和表2可知,试纸条的检测结果和高效液相、ELISA的检测结果一致,在实际样品的检测中可以先采用试纸条对样品进行大规模的初步筛查,确定阳性样品,然后采用HPLC等方法对相关样品进行定量分析,既能节约检测时间,还可以节约检测成本,故说明该试纸条具有较好的实用性。
3 结论
本实验将标记好的金标抗体按照14 μL/cm喷于金标垫上,200 μg/mL的检测抗原FB1-BSA(T线)和1.0 mg/mL的羊抗鼠二抗(C线)按照0.74 μL/cm喷涂于硝酸纤维素膜(NC膜),然后组装成试纸条,该试纸条检出限为20 ng/mL,检测时间只需5 min,试纸条稳定性可达12个月无需专业人员和仪器,可直接目测其结果,特别适合现场快速检测。
[1]Maragos C M,Busman M.Rapid and advanced tools for mycotoxin analysis:a review[J].Food Addit Contam Part A,2010,5(27):688-700.
[2]Shier W T,Abbas H K,Karam M A,et al.Fumonisins:abiogenic conversions of an environmental tumor promoter and common food contaminant[J].J Toxicolo Toxin Reviews,2003,22(4):591-616.
[3]Voss K A,Riley R T,Waes J G.Fumonisin B1induced neural tube defects were not increased in LM/Bc mice fed folatedeficient diet[J].Mol Nutr Food Res,2014,58:1190-1198.
[4]International Agency for Research on Cancer(IARC),Fumonisin B1[J].IARC,2002,82:301-366.
[5]钱鸣蓉,吴俐勤,章虎,等.液相色谱-串联质谱法测定牛奶中伏马菌素FB1和FB2及其水解代谢物[J].分析化学,2012,40(5):757-761.
[6]许杨,邹龙,刘师文,等.伏马菌素B1单克隆抗体制备及化学发光免疫检测方法的建立[J].分析化学,2012,40(11):1735-1739.
[7]李淑群,曹碧云,常化仿,等.胶体金免疫层析法快速检测牛奶、奶粉、饲料中的三聚氰胺.分析化学,2013,41(7):1025-1030.[8]黄艳梅,刘道峰,赖卫华,等.集成免疫磁珠富集和免疫层析的黄曲霉毒素M1快速检测法[J].分析化学,2014,42(5):654-659.
[9]DzantievBB,ByzovaN,UrusovA,etal.Immunochromatographic methods in food analysis[J].Trends in Anal Chem,2014,55:81-93.
[10]Venkataramana M,Navya K,Chandranayaka S,et al. Development and validation of an immunochromatographic assay for rapid detection of fumonisin B1from cereal samples[J].J Food Sci Technol,2014,9(51):1920-1928.
[11]Wang S,Quan Y,Lee N,et al.Rapid determination of fumonisin B1in food samples by enzyme-linked Immunosorbent assay and colloidal gold immunoassay[J].J Agric Food Chem,2006,54(7):2491-2495.
[12]Shiu C M,Wang J J,Yu F Y.Sensitive enzyme-linked immunosorbent assay and rapid one-step immunochromatographic strip for fumonisin B1in grain-based food and feed samples[J].J Sci Food Agric,2010,90(6):1020-1026.
[13]Li Y S,Zhou Y,Lu S Y,et al.Development of a one-step test strip for rapid screening of fumonisins B1,B2and B3in maize[J].Food Control,2012,24(1-2):72-74.
[14]Wang Y K,Shi Y B,Zou Q,et al.Development of a rapid andsimultaneousimmunochromatographicassayforthe determination of zearalenone and fumonisin B1in corn,wheat and feedstuff samples[J].Food Control,2013,31(1):180-188.
[15]Wang Y K,Yan Y X,Ji W H,et al.Rapid simultaneous quantification of zearalenone and fumonisin B1in corn and wheat by lateral flow dual immunoassay[J].J Agric Food Chem,2013,61(21):5031-5036.
[16]刘师文,何庆华,邹龙,等.谷物中伏马菌素B1酶联免疫分析法的建立[J].食品科学,2010,31(18):350-354.
[17]Kohler G,Milstein C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975,256(5517):495-497.
[18]Xu Y,Huang Z B,He Q H,et al.Development of an immunochromatographic strip test for the rapid detection of deoxynivalenol in wheat and maize[J].Food Chem,2010,119(2):834-839.
[19]李岩松.玉米中伏马菌素免疫学快速筛查方法的研究[D].长春:吉林大学,2011.
Development of an immunochromatographic test strip for the rapid detection of fumonisin B1
REN Wen-jie,HUANG Zhi-bing*,XU Yang,LI Yan-ping,TU Zhui,SU Bao-wei,JI Yan-wei
(State Key Laboratory of Food Science and Technology,Sino-Germany Joint Research Institute,Nanchang University,Nanchang 330047,China)
Objective:An immunochromatographic test strip(ICG)had been developed for rapid detection of fumonisin B1residues in maize samples.Methods:For this purpose,FB1coupled to bovine serum albumin(BSA)via the modified EDCA method was prepared as capture antigen.The colloidal gold was prepared by the reduction of tetrachloroauric(III)acid trihydrate with citric acid trisodium salt.Results:Using an antibody purified by the ammonium sulfate precipitation,and a titer of the antibody was about 1.28×105by ELISA.The ICG was composed of NC membrane,sample pad,probe pad(colloidal gold-monoclonal antibody probes for FB1and absorbent pad.Moreover,the sensitivity,specificity and stability of the ICG were also detected.A total of 0.74 μL/cm of FB1-BSA(200 μg/mL)and the goat anti-mouse IgG antibody(1.0 mg/mL)were sprayed onto the NC membrane as the test(T line)and control lines(C line),respectively.The sensitivity of the test strip was 20 ng/mL.The test could be accomplished within 5 min.The stability of the ICG was about 12 months at 4℃. Conclusion:Analysis of FB1in maize samples revealed that data obtained from the ICG were in good agreement with those obtained from HPLC and ELISA.The results demonstrated that the ICG could be used as qualitative tool for rapid screening of FB1on-site.
rapid detection;immunochromatographic strip test;fumonisin B1;maize
TS201.1
A
1002-0306(2015)24-0058-06
10.13386/j.issn1002-0306.2015.24.003
2015-03-20
任文洁(1989-),女,在读硕士研究生,研究方向:真菌毒素的检测,E-mail:renwenjie0818@qq.com。
黄志兵(1975-),男,博士,研究方向:食品安全快速检测,E-mail:hzbchem@163.com。
江西省高等学校科技落地计划(KJLD12052);江西省科技厅项目(20121BBG70059);国家自然科学基金项目(31160308)。
