杜仲子与杜仲皮的毒性比较研究
2015-11-05胡存华黄玉珊孙朝越杨贤建
胡存华,黄玉珊,王 霞,孙朝越,罗 婷,杨贤建
杜仲子与杜仲皮的毒性比较研究
*胡存华,黄玉珊,王 霞,孙朝越,罗 婷,杨贤建
(井冈山大学医学院,江西,吉安 343009)
目的 研究杜仲子的毒性大小,及其与杜仲皮的毒性比较,为其进一步开发利用提供依据。方法 通过小鼠的急性毒性实验、骨髓微核实验、精子畸形实验、大鼠的慢性毒性实验来研究杜仲子的毒性大小和与杜仲皮的毒性比较。结果 小鼠的急性毒性实验中,给药组都无小鼠死亡;小鼠骨髓微核实验及精子畸形实验中,杜仲子和杜仲皮与正常组对比在统计学中无差异。大鼠的慢性毒性实验中,杜仲子及杜仲皮可以影响食物利用率、血常规和肝功能,还可以影响肝、脾、睾丸、卵巢的脏体系数;对大鼠脏器进行病理组织学检查,未见明显异常。杜仲子与杜仲皮的毒性比较无差异。结论 杜仲子和杜仲在急性毒性实验、骨髓微核实验、精子畸形实验中显示无毒性;在慢性毒性实验中,杜仲子和杜仲会影响食物利用率、血常规和肝功能,也会影响肝、脾、睾丸、卵巢生长,有慢性毒性。但杜仲子与杜仲皮的毒性无差异。
杜仲子;杜仲皮;急性毒性;慢性毒性;毒性比较
杜仲自古以皮入药而著称。早在二千年前,我国第一部药物学专著《神农本草经》就记载了杜仲皮的神奇药效,久服轻身耐老,称“杜仲味辛平,补中、益精气、坚筋骨”,主治“腰膝痛,除阴下痒湿、小便馀沥”,并把杜仲列为中药上品[1]。杜仲以皮入药,资源受限,现为中药二级保护品种,为此在不断地开发替代品。杜仲子提取物富含α-亚麻酸,具有抗过敏、降血脂、降血压,预防脑血管疾病和冠心病等作用,它是宝贵的药用和食用新资源[2],但其毒性尚不明确。为更好地开发和利用杜仲子,本研究将对其毒性和杜仲皮比较来展开研究。
1 材料
1.1 试剂和药品
井冈山产杜仲子(带种壳),杜仲皮(井冈山大学医学院生药室鉴定),Giemsa染液,甲醇,HE染液,环磷酰胺(都为北京雷根生物技术有限公司产品)。
1.2 动物
SPF级昆明种小鼠、SD大鼠,湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2011-0003。
1.3 仪器
S-L250中药材粉碎机,RE-2000A旋转蒸发仪(郑州亚荣仪器有限公司),数显恒温水浴锅(国华电器有限公司),生物显微镜(国华电器有限公司),分析天平(上海岛韩实业有限公司)。
2 方法与结果
2.1 方法
2.1.1 杜仲子和杜仲皮水煎液的制备
取经过初步粉碎后的药物,加8倍的蒸馏水浸泡1 h后,煎煮30 min,倒出煎液;再加4倍的蒸馏水,煎煮20 min,重复后面步骤1次;合并3次煎液,四层纱布过滤后,用旋转挥发仪蒸干成浸膏状待用。用蒸馏水配成以下所需的药物浓度(生药浓度)[3]。
2.1.2 小鼠急性毒性实验
昆明种小鼠40只,雌雄各半,体重18~22 g。动物购进后,先适应性喂养3 d,然后分成两组开始实验,于实验前禁食16 h,不限饮水。根据最大耐受剂量法[4-6],杜仲子、杜仲皮水煎液剂量设置为20 g/kg,即取1 g/mL的杜仲子、杜仲水煎液灌胃容量均为20 mL/kg,累积剂量为20 g/kg。记录动物的中毒表现及死亡情况,连续观察14 d,实验结束解剖动物进行大体观察。按毒性分级标准评价受试物的急性毒性强弱。
2.1.3 小鼠骨髓微核试验
昆明种小鼠60只,雌雄各半,体重25~30 g。按体重随机分为6组,每组10只。第1组为正常组(阴性对照组),第2组为阳性对照组,给环磷酰胺0.04 g/kg,第3组为杜仲皮组10 g/kg,第4~6组为杜仲子水煎液剂量组,剂量分别为10、5、2.5 g/kg。各药物都用蒸馏水配制,杜仲子水煎液浓度分别为1、0.5、0.25 g/mL,杜仲皮水煎液浓度分别为1 g/mL,环磷酰胺浓度为40 mg/mL,灌胃剂量都为10 mL/kg[7]。根据30 h给受试物法[4-6],各组分别间隔24 h给予两次药物,于第二次灌胃6 h后颈椎脱臼处死小鼠,取股骨,用1 mL生理盐水冲出骨髓液,离心收集骨髓液,常规涂片。涂片干燥后放入甲醇中固定5~10 min。将固定好的涂片放入Giemsa染液应用液中染色10~15 min。立即用pH = 6.8的磷酸盐缓冲液(磷酸盐缓冲液配制方法为:将磷酸二氢钾4.5 g和磷酸二氢钠11.81 g,加至1000 mL蒸馏水中。)冲洗、晾干、阅片。每鼠计数多个高倍视野下1000个左右的嗜多染红细胞,记录含微核细胞数、微核发生率(微核数与嗜多染红细胞比值),每鼠记数至少10~20个高倍视野下的嗜多染红细胞和成熟红细胞,计算嗜多染红细胞与成熟红细胞的比值。
2.1.4 小鼠精子畸形实验
雄性昆明种小鼠48只,体重25~35 g。随机分为6组,每组8只。分组及给药同小鼠骨髓微核实验,每天灌胃给药1次,连续5 d,于第35 d进行颈椎脱臼处死小鼠,解剖后取两侧副睾,放入有盛有l mL生理盐水的小烧杯中,用眼科剪将副睾纵向剪2~3刀,静止1~2 min,轻轻摇动。用四层擦镜纸过滤,吸取滤液涂片。空气干燥后,用甲醇固定5 min,干燥,用1.5%伊红染色l h,用水轻冲,干燥,镜检[4-6]。每鼠计数多个高倍视野下1000条左右的精子,计数各组精子畸变数及畸变类型,计算精子畸变率(%),畸变率为畸形精子与正常精子的比例。
2.1.5 大鼠慢性毒性实验
选用SD大鼠100只,雌雄各半,体重120~140g,饲养室温度:20~25 ℃。相对湿度:40%~70%。按体重随机分为5组,每组20只,雌雄各半。根据中药的人体推荐用量,杜仲子设15、7.5、3.75 g/kg三个剂量组,分别相当于人用剂量的100、50、25倍,另设一个杜仲皮7.5 g/kg剂量组和一个正常组(阴性对照组,给予蒸馏水)。用蒸馏水将杜仲子水煎液配制成1.5、0.75、0.375 g/mL,杜仲皮水煎液配成0.75 g/mL按10 mL/kg的体积给大鼠灌胃,阴性对照组给等量的蒸馏水,每天灌胃1次。大鼠单笼饲养,自由饮水和进食。每周称重1次,称饲料剩余量2次。每天观察动物的一般状况、有无中毒表现和死亡。实验结束处死大鼠,进行指标检测,观察指标如下[3,8]:
每周进食量、每周体量、计算总的食物利用率(每摄入100克饲料的体重增长克数)。
血常规指标:白细胞计数、中性粒细胞百分比、淋巴细胞百分比、单核细胞百分比、嗜酸性性粒细胞百分比、嗜碱性粒细胞百分比、红细胞数、平均红细胞体积、血红蛋白、血小板。
血液生化指标:天门冬氨酸转氨酶、丙氨酸转氨酶、总蛋白、球蛋白、总胆固醇、甘油三酯、尿素氮、肌酐、葡萄糖。
脏体系数:实验结束前称体量,处死动物后,取肝、肾、脾、睾丸、卵巢称湿重,计算相应的脏体系数。脏体系数的计算方法为脏器重量/体重×100。
病理组织学检查:实验结束处死动物,取心、肺、肝、肾、脾、胃、十二指肠、睾丸、卵巢等脏器进行病理组织学检查。
2.1.6 统计学方法
用统计软件SPSS19.0进行统计分析,统计数据以±表示,先做正态性及方差齐性检验:> 0.05 时,满足正态性和方差齐性,继续做单因素方差分析。方差分析采用LSD 和Dunnett 法比较组间差异。< 0.05表示差异有统计学意义。< 0.01表示差异有统计学显著性意义。
2.2 结果
2.2.1 小鼠急性毒性实验
杜仲子水煎液20 g/kg剂量给小鼠灌胃给药1次,观察15 d,未出现中毒症状和死亡。根据毒性分级标准,杜仲子属于无毒级。对照品杜仲皮水煎液按照同样的方法试验,结果也是属于无毒级。杜仲子和杜仲皮的急性毒性无差异。
2.2.2 小鼠骨髓微核试验
杜仲子水煎液剂量分别为10、5、2.5 g/kg,给药两次后,微核发生率和嗜多染红细胞与成熟红细胞的比值,与正常组比较无差异,说明杜仲子水煎液在此剂量下无致骨髓细胞突变作用。杜仲皮水煎液按照剂量为10 g/kg,同样也无致骨髓细胞突变作用。而阳性对照药物环磷酰胺有明显的致突变作用。杜仲子和杜仲皮的无致突变作用无差异。具体结果见表1。

表1 杜仲子及杜仲皮对骨髓微核发生率的影响(`x ± s, n =10)
注:**< 0.01,与正常组比较
2.2.3 小鼠精子畸形实验
杜仲子水煎液剂量分别为10、5、2.5 g/kg,给药5 d后,精子畸变率与正常组比较无差异,说明杜仲子水煎液在此剂量下无生殖细胞毒性。杜仲皮水煎液按照剂量为10 g/kg,同样也无生殖细胞毒性。而阳性对照药物环磷酰胺有明显的至精子畸形作用。杜仲子和杜仲皮的无生殖细胞毒性无差异。具体结果见表2。
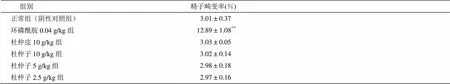
表2 杜仲子及杜仲皮对小鼠精子畸变率的影响(`x ± s, n = 8)
注:**< 0.01,与正常组比较。畸变类型包括胖头,无钩,香蕉形,尾折叠,双尾,双头。其中以无钩居多
2.2.4 大鼠慢性毒性实验
2.2.4.1 食物利用率
杜仲子低剂量组第1周可以增加食物利用率,但杜仲子高剂量组第2周以后对于雌、雄鼠都可以降低食物利用率。杜仲皮组对食物利用率无影响。具体结果见表3和表4。
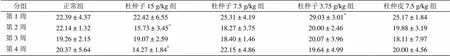
表3 杜仲子及杜仲皮对雄性大鼠食物利用率的影响(`x ± s, n =10,g/100 g饲料)
注:< 0.05,与正常组比较

表4 杜仲子及杜仲皮对雌性大鼠食物利用率的影响(`x ± s,n = 10,g/100 g饲料)
注:杜仲子高剂量组第三周有一只大鼠体重明显下降。*< 0.05,与正常组比较
2. 2.4.2 血常规指标
杜仲子高剂量组与正常组比较可以提高红细胞平均体积,其它无差异。杜仲子中剂量组可以升高白细胞、淋巴细胞,降低嗜碱性粒细胞、血红蛋白、红细胞压积。杜仲子低剂量组可以升高白细胞、淋巴细胞、嗜酸性粒细胞,降低嗜碱性粒细胞。杜仲皮组可以升高淋巴细胞。具体结果见表5。

表5 杜仲子及杜仲皮对大鼠血常规的影响(`x ± s,n = 20)
注:*< 0.05,与正常组比较
2. 2.4.3 血液生化指标
杜仲子高剂量组有2例丙氨酸转氨酶、天门冬氨酸转氨酶明显升高,杜仲子中剂量组普遍天门冬氨酸转氨酶升高,杜仲子低剂量组有1例天门冬氨酸转氨酶明显升高,杜仲皮组普遍丙氨酸转氨酶、天门冬氨酸转氨酶升高,其它与正常组比较无差异。杜仲子各剂量组及杜仲皮组对血液中总蛋白、球蛋白、总胆固醇、甘油三酯、尿素氮、肌酐、葡萄糖无影响。具体结果见表6。

表6 杜仲子及杜仲皮对大鼠肝功能指标的影响(`x ± s,n = 20)
注:&为每组中有几例异常,导致标准差过大。*< 0.05,与正常组比较
2. 2.4.4 脏体系数
杜仲子高剂量组可以升高脾的脏体系数,降低卵巢的脏体系数。杜仲子中剂量组可以降低睾丸和肾的脏体系数。杜仲子低剂量组可以降低肝、卵巢、睾丸的脏体系数。杜仲皮组可以降低肝、肾、睾丸、卵巢的脏体系数,雌鼠有一例脾肿大。结果见表7。

表7 杜仲子及杜仲皮对大鼠脏体系数的影响(`x ± s,n =10,脏器重量/体重×100)
注:&杜仲皮组雌鼠有一例脾肿大。*< 0.05,**< 0.01,与正常组比较
2. 2.4.5 病理组织学检查
对大鼠心、肺、肝、肾、脾、胃、十二指肠、睾丸、卵巢等脏器进行病理组织学检查,未见明显异常。
3 讨论
我国传统上对杜仲资源的利用,主要是杜仲皮的医疗保健方面的开发利用[9]。因其资源的减少,有研究者在不断地寻找替代品。我们可以从药效、毒性等各方面来研究杜仲子是否可以替代,对杜仲子的研究开发和利用,能使杜仲的整体价值得到更充分的体现。
对于药物毒性的评价,我们主要从急性毒性、慢性毒性、骨髓毒性、生殖毒性等方面来进行。本研究正是通过以上几个方面的典型实验来研究杜仲子的毒性,并且与已经入药的杜仲皮的毒性进行比较。从研究的结果来看,杜仲子在急性毒性实验、骨髓微核实验和精子畸形实验中都未显示出毒性;在慢性毒性实验中杜仲子会影响食物利用率、血常规和血生化,也会影响肝、脾、睾丸、卵巢生长以及脏器系数;但杜仲子和杜仲皮的毒性比较无差异。从毒性方面来评价,杜仲子可以代替杜仲皮入药。
对于杜仲子是否可以代替杜仲皮入药,或在某些方面代替杜仲皮入药,这需要从药效、毒性、药动学等各方面全方位的评价。就毒性比较而言,我们也应进一步地做更长期的毒性实验,这些都有待于作进一步的研究。
参考文献:
[1] 杜云虹.《隋书.经籍志》研究[M]. 济南: 山东大学出版社, 2012: 20-22.
[2] 赵文红,范青生,肖小年,等. 杜仲籽油研究开发现状与利用展望[J]. 中国油脂, 2006, 31(3): 66-68.
[3] 原海晓. 神来片功能及毒理研究[D]. 广州:南方医科大学, 2007: 35-38.
[4] 刘月凤,龚朋飞,袁慧,等. 杜仲提取物的急性毒性试验研究[J]. 陕西农业科学, 2009, 55(3): 52-52,60.
[5] 辛欣,范青生,罗眼科,等. 杜仲籽油可食用性研究[J]. 中国油脂, 2007, 32(4): 15-19.
[6] 杜红岩,李钦,傅建敏,等. 杜仲雄花茶的食品安全性毒理学[J]. 中南林业科技大学学报:自然科学版, 2008, 28(2): 91-94.
[7] 周细根,梁生林,胡存华,等.樟树子水提液对小鼠的镇痛作用研究[J]. 井冈山大学学报:自然科学版,2014,35(4): 96-98.
[8] 刘月凤,陈建文,龚朋飞,等.杜仲提取物的亚慢性毒理学研究[J]. 时珍国医国药,2006,17(11): 2185-2187.
[9] 马希汉,张康健.中国杜仲近代认识史上的四次飞跃[J]. 中成药, 2011,33(8): 1393-1396.
A TOXICITY COMPARATIVE STUDY OFSEED AND BARK
*HU Cun-hua, HUANG Yu-shan, WANG Xia, SUN Chao-yue, LUO Ting, YANG Xian-jian
(School of Medicine, Jinggangshan University, Ji’an, Jiangxi 343009, China)
Objective: To comparatively study the toxicity ofseed and bark, provide the basis for its further utilization. Methods: By acute toxicity test, bone marrow of mice micro nuclear test, sperm deformity and chronic toxicity experiments, the toxicity ofseed and bark was compared. Results: There were no dead mice in acute toxicity experiment and no significant difference betweenseed and bark in bone marrow micro nuclear test. In chronic toxicity experiments,seed and bark affectedthe utilization rate of food, the routine blood and liver function, and the organ coefficient of the liver, spleen, testis and ovary, but there were no obvious abnormalities in histologic examination.Conclusion: Three were no significant difference in toxicity betweenseed and bark.
seed;bark; acute toxicity; chronic toxicity; toxicity comparison
1674-8085(2015)01-0095-05
R285.5
A
10.3969/j.issn.1674-8085.2015.01.020
2014-11-17;修改日期:2014-12-27
国家科技支撑计划项目子课题项目(2012BAC11B02-6)
*胡存华(1972-),女,江西万安人,副教授,硕士,主要从事中药药理及毒理研究(E-mail:602642563@qq.com);
黄玉珊(1976-),女,江西吉安人,副教授,博士,主要从事病理学及循证医学研究(E-mail:3218680@qq.com);
王 霞(1979-),女,江西抚州人,讲师,硕士,主要从事病理学研究(E-mail:18815828@qq.com);
孙朝越(1970-),男,江西吉安人,讲师,硕士,主要从事病理学研究(E-mail:532166213@qq.com);
罗 婷(1981-),女,江西吉安人,讲师,硕士,主要从事药理学研究(E-mail:25263636@qq.com);
杨贤建(1990-),男,江西南昌人,井冈山大学医学院2010级药学专业本科生(E-mail:362473751@qq.com).
