超高压处理对浓缩乳清蛋白80加工性质和蛋白结构的影响
2015-11-05孙颜君李志刚莫蓓红郑远荣石春权焦晶凯刘振民
孙颜君,李志刚,莫蓓红,郑远荣,石春权,朱 培,焦晶凯,刘振民,*
(1.乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海200436;2.江南大学食品学院,江苏无锡214000)
超高压处理对浓缩乳清蛋白80加工性质和蛋白结构的影响
孙颜君1,李志刚2,莫蓓红1,郑远荣1,石春权1,朱培1,焦晶凯1,刘振民1,*
(1.乳业生物技术国家重点实验室,光明乳业股份有限公司乳业研究院,上海200436;2.江南大学食品学院,江苏无锡214000)
研究了超高压处理(300MPa和600MPa,10min)对浓缩乳清蛋白80加工性质和蛋白结构的影响。结果表明,300MPa和600MPa处理10min后,浓缩乳清蛋白80的ΔE值显著增加(p<0.05),明度值(L*)、a*和b*也发生不同程度变化;600MPa处理样品D50值较对照样品增加了22.13倍;此研究中的超高压处理条件主要影响了浓缩乳清蛋白80的起泡性和乳化性,对溶解性并未有显著影响(p>0.05);结合聚丙烯酰胺凝胶电泳和圆二色谱分析,300MPa和600MPa处理10min只是改变了蛋白的二级结构,但对乳清蛋白的分子量影响不显著。
超高压,浓缩乳清蛋白80,加工性质,蛋白结构
浓缩乳清蛋白(Whey protein concentrate,WPC)是将干酪排放的乳清经膜分离、浓缩和喷雾干燥后制成的产品,WPC中蛋白质占干物质比例为35%~80%,具有较好的加工性质,如凝胶性、溶解性、持水性、起泡性和乳化性等,广泛用于食品加工中[1]。不同产品加工中,所需的WPC加工特性也不同,如酸奶和再制奶酪加工中,需要WPC具有较好的凝胶特性;乳粉加工中,需要WPC具有较好的溶解性和粉体流动性等。国内食品加工中所用的WPC多为进口,国外对产品改性技术形成壁垒,因此研究探索新的WPC改性技术有一定的生产意义。
超高压(High hydrostatic pressure,HHP)作为一种新兴的非热处理加工技术,广泛应用于食品加工中。HHP除了可以杀灭食品中微生物,延长产品货架期外,还可以用作蛋白的改性。Lee等[2]研究了HHP对1%(w/v)乳清蛋白分离物(Whey protein isolate,WPI)溶液的影响,处理压力为690MPa,处理时间为5~30min,随着处理时间的延长,WPI的溶解性降低。Lim等[3]对比研究了HHP对WPC35和制作切达干酪排放的新鲜乳清的影响,HHP条件为300、400MPa,处理时间为15min,300MPa处理15min能够显著提高产品起泡性和泡沫稳定性。目前,乳制品加工中,使用最多的为WPC80,而关于HHP对WPC80的改性研究还尚未有报道。本研究探索了超高压处理对WPC80蛋白结构和加工性质的影响,以期为国内WPC80的生产和应用提供一定的参考。
1 材料与方法
1.1材料与仪器
浓缩乳清蛋白WPC80新西兰恒天然集团提供;福临门玉米胚芽油中国粮油食品集团;磷酸氢二钠、磷酸二氢钠、十二烷基磺酸钠均为分析纯,国药集团化学试剂有限公司。
台式色差仪Colorflex EZ美国Hunterlab公司;激光粒度分析仪Mastersizer3000英国马尔文仪器有限公司;分光光度计SP-754PC上海光谱仪器有限公司;高速剪切分散机IKAT25德国IKA公司;超高压处理设备FPG7100英国STANSTED FLUID POWER(SFP)有限公司;EPS301电泳仪美国GE healthcare公司;MOS-450型圆二色光谱仪法国Bio-Logic公司。
1.2实验方法
1.2.1超高压处理实验配制5%(w/w)WPC80溶液,在室温下搅拌1h,置于4℃冰箱冷藏14h,使样品充分溶解。取冷藏后样品采用超高压处理,每次处理量为300g。处理之前先将样品置于超高压舱体保持5min,以使样品温度与舱体设置温度相同。处理条件为:处理压力为300MPa,保压时间为10min,温度为25℃,升压速率10MPa/s,采用瞬间泄压方式;处理压力为600MPa,保压时间为10min,温度为25℃,其中升压速率10MPa/s,采用瞬间泄压方式。未经过超高压处理的样品作为对照样品。将对照与超高压处理后的样品在4℃下储藏待用。
1.2.2色度测定采用色差仪来测定超高压处理前后WPC80溶液颜色的变化,仪器使用前先用白板进行校正。将样品置于室温下1h后,分别测定各样品的L*,a*和b*值,L*表示明度值,L*越大表明样品透明度越高;a*值表示样品的红绿色度,-a*代表绿色度,+a*代表红色度;b*表示样品的蓝黄度,-b*代表偏蓝色程度,+b*代表偏黄色程度。HHP处理样品的L*,a*和b*值与对照样品比较计算ΔE值,ΔE为与对照样品比较色差变化,计算公式为ΔE=(ΔL*2+Δa*2+Δb*2)1/2。每个样品重复测定三次并取其平均值作为结果。
1.2.3粒径分析采用马尔文激光粒度分析仪Mastersizer3000测定粒径分布。去离子水为分散相,搅拌速率为2000r/min,样品的折射率设置为1.56,水相的折射率为1.33。记录测定结果中的D[4,3]、D[3,2]和D50值。每个样品测定三次,并取平均值作为最终测定结果。
1.2.4溶解性测定溶解性测定参考孙颜君等[4]的方法,取1.2.1制备的WPC80溶液10g于50mL的离心管中,在室温下(25℃)4400r/min离心10min,取离心前原样液和离心后上清液5g分别置于预先恒重(105℃,5h恒重)的平板上,再将平板于105℃下烘干4h左右至样品恒重,最后所有平板取出后置于干燥器冷却至室温。分别计算上清液和原样液的固形物质量分数,则溶解性计算公式为:
溶解性(%)=上清液中固形物质量分数/原样液中固形物质量分数×100
1.2.5起泡性分析起泡性的测定参考Nicorescu等[5]的方法并略加改进。取100mL 5%的WPC溶液于100mL量筒中,采用IKA T25高速剪切机11200r/min剪切2min,记录剪切后溶液增加的体积,WPC的起泡力(Foaming Capacity,FC)计算公式为:

将样品在室温下放置30min,记录泡沫体积变化,计算泡沫稳定性(Foaming Stability,FS)。
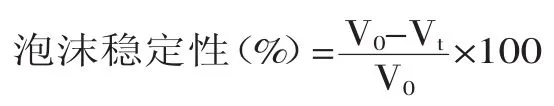
式中,V0为剪切完成时泡沫体积(mL);Vt为静置30min后泡沫的体积。
1.2.6乳化性分析参考Khanitta等[6]的方法略加改进。采用浊度法测定乳化能力(Emulsifying ability index,EAI)和乳化稳定性(Emulsifying stability index,ESI)。取40mL质量分数为5%WPC80和10mL玉米胚芽油于100mL烧杯中,并用IKA25高速剪切机12400r/min处理2min。处理完成后立即移取10μL乳状液于5mL浓度为0.1mol/L磷酸缓冲液中(含有质量分数0.1%的SDS),将样品与缓冲液在漩涡混合器充分混匀后采用分光光度计在500nm处测定吸光度值。浊度值计算公式为T=2.303A/l,其中A为500nm处的吸光度值,l为比色皿的宽度(1cm),乳化能力(EAI)计算公式为:
EAI=2TD/10000CΦ
式中,T为浊度值;D为稀释倍数;Φ为乳状液中玉米胚芽油的质量分数;C为形成乳状液前蛋白的质量浓度(g/mL);EAI的单位为m2·g-1。
将剪切后样品于室温下放置20min后用上述方法测定吸光度并计算浊度值,则乳化稳定性(ESI)计算公式为:
ESI=TΔt/ΔT
式中,T为剪切处理后样品的浊度值;Δt为20min;ΔT为20min内浊度的变化,ESI单位为min。每个样品重复测定三次,取平均值作为最终测定结果。
1.2.7圆二色谱测定采用MOS-450测定WPC80蛋白二级结构的变化。取1.2.1制备WPC80溶液用去离子水稀释,至蛋白浓度为0.2g/L。测定条件:波长扫描范围190~250nm,每隔1nm扫描一次,扫描速度为100nm/min,分辨率为0.1nm,比色皿宽度为0.1cm,累计扫描3次,将CD值换算成氨基酸残基平均椭圆度(mean residue ellipticity,MRE,[θ])。通过DICHROWER软件中的K2D方法可以分别计算出蛋白中的α-螺旋、β-折叠、β-转角和无规则卷曲结构。
1.2.8聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析采用还原性SDS-PAGE测定WPC80溶液中蛋白分子量。分离胶和浓缩胶的质量分数分别为12%和5%,将对照和超高压处理后样品稀释适当倍数后与2×样品缓冲液以1∶1比例进行混合,沸水浴加热5min,离心后取10μL上样。将EPS301电泳仪的电压设置为50V,待样品进入分离胶后调节压力为150V进行分离。电泳结束后,将凝胶置于考马斯亮蓝R250溶液中染色2h,然后用脱色液摇床脱色过夜至背景清晰。
蛋白凝胶采用AlphaEase FC凝胶成像系统进行拍照,并用其自带的AlphaEase FC分析软件进行分析。通过对比样品的条带和Marker来确定WPC80中的分子量。
1.2.9数据分析每组实验重复测定3次,最后结果以均值+标准方差(mean+SD)表示。采用SPSS 18.0软件对实验结果在p<0.05水平上的显著性进行分析。
2 结果与分析
2.1超高压处理对WPC80溶液色泽的影响
通过色差仪比较超高压处理后样品的颜色变化。

表1 超高压处理对WPC80溶液色泽的影响Table 1 Effect of HHP treatment on the color of WPC80 solutions
由表1可知,随着压力的增加,ΔE的值显著增加(p<0.05);明度值L*先由67.56降低至59.09后又增加至69.26;300MPa处理样品的-a*值与对照样品相比显著增加(p<0.05),但与600MPa样品差异不显著(p>0.05);对照样品的b*值最高,与之相比,300MPa处理的样品b*降低为0.93。这表明超高压处理后,WPC80溶液的颜色发生了变化。本研究的结论与Gervilla等[7]的结果不同,Gervilla等比较了不同压力和温度对羊奶的色泽的影响,结果发现随着压力由100MPa增加至500MPa,L*值显著降低(p<0.05),且-a*值和b*值都显著增加,L*值的降低是由于高压处理后酪蛋白胶束分散,从而增加了亮度[8]。本研究中WPC80体系与羊奶不同,因此,超高压处理后对样品色泽的影响机理还需要进一步的研究。
2.2粒径测定结果
超高压处理后对样品粒径的影响如图1和图2,其中D[3,2]为体积表面平均直径,D[4,3]为体积平均直径,D[4,3]代表所聚集的颗粒的体积,聚集和絮凝等变化对其影响较大[9]。由图1可知,600MPa处理样品D[3,2]值显著增加(p<0.05),300MPa处理样品D[4,3]值显著降低(p<0.05)。D50为大于或者小于此粒径所占的百分比都为50%,可用来表示粒径的分散程度。由图2可知,600MPa处理样品D50显著增加(p<0.05),与对照样品相比,粒径增加了22.13倍,这是因为超高压处理后,乳清蛋白中球状蛋白分子内部空腔受到压缩,从而影响蛋白的粒径结构,且受压缩的程度与蛋白类型和超高压处理压力有关[10]。Iordache等[11]研究表明,超高压处理还会导致蛋白变性,这是因为天然的蛋白结构打开,维持蛋白质相互之间平衡的作用力被打破,疏水中心的稳定性降低,从而蛋白结构发生重排。一旦球状蛋白分子伸展到一定程度,分子间会发生聚合,疏水基团被破坏,最终形成较大的粒径及其粒径分布。
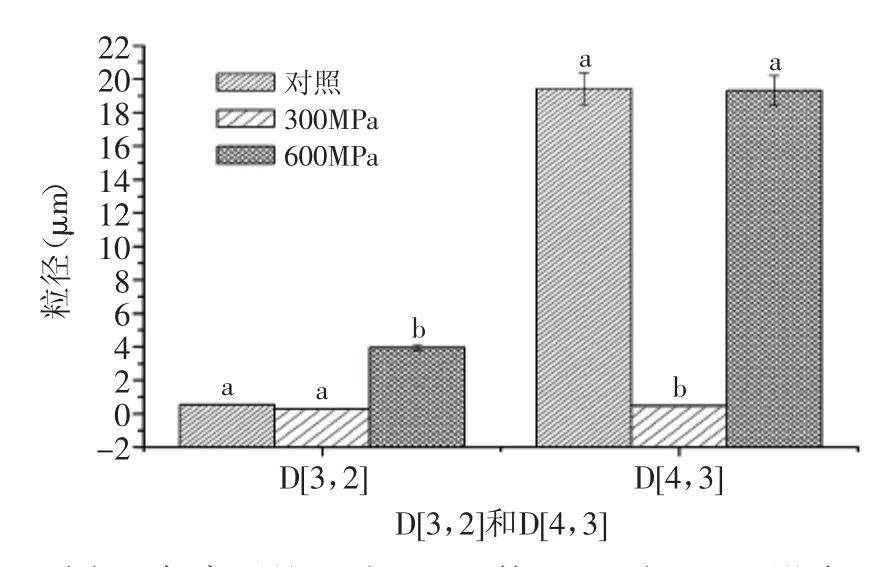
图1 超高压处理对WPC80的D[3,2]和D[4,3]影响Fig.1 Effect of HHP treatment on the D[3,2]and D[4,3]of WPC80

图2 超高压处理对WPC80溶液的D50影响Fig.2 Effect of HHP treatment on the D50 of WPC80 solutions
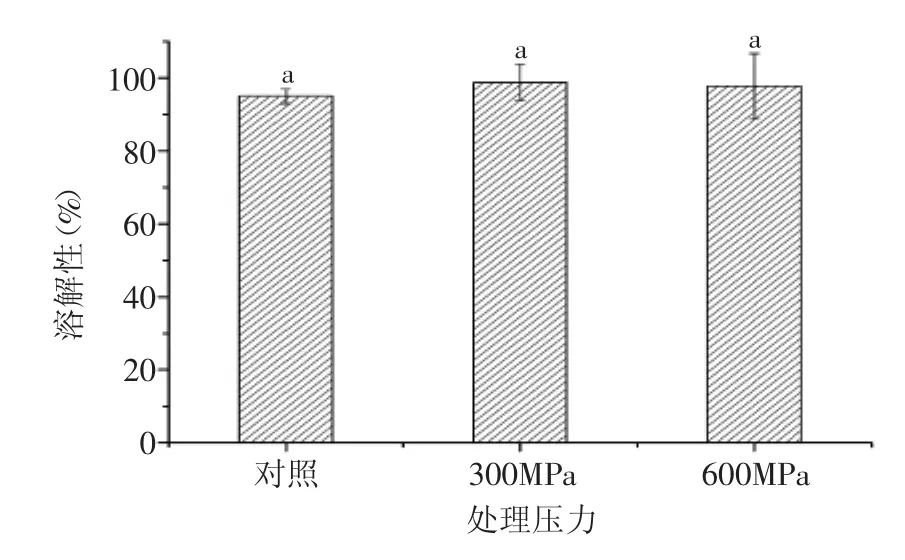
图3 超高压处理对WPC80溶解性影响Fig.3 Effect of HHP treatment on the solubility of WPC80
2.3超高压处理对WPC80溶解性的影响
WPC80在食品加工中有广泛的应用,其中溶解性是最重要的考虑因素,因为只有蛋白溶解后才能提供其较好的起泡性和乳化性等。本研究中所用的WPC80为商业化产品,本身具有较好的溶解性,约为94.92%。由图3可知,与对照样品相比,不同超高压处理后对WPC80的溶解性没有显著影响(p<0.05)。乳清蛋白的溶解性还受到pH的影响,这是因为溶剂的pH会影响蛋白所带的静电荷分布和构象,通常在等电点处蛋白的溶解性最小[12]。
Lee等[2]研究表明超高压处理会降低WPI的溶解性,其研究中所用的超高压处理条件为690MPa,处理时间分别为5、10、20、30min。结果发现随着处理时间的延长,溶解性下降,这表明过度的高压处理会一定程度降低蛋白的溶解性。
2.4超高压处理对WPC80起泡性的影响
在实际生产中,当乳清蛋白作为低脂冰激凌配料使用时,如果提高乳清蛋白的起泡性,可以提高冰激凌膨胀率,且生产出的冰激凌质地较好,与常规脂肪含量的冰激凌有相似的口感。超高压压力和处理时间是影响蛋白起泡性的两个重要参数,由图4可知,在300和600MPa下处理10min后,WPC80溶液的泡沫稳定性显著下降(p<0.05);与对照样品相比,300MPa处理后WPC80溶液起泡性降低了40.07%,600MPa处理后起泡性降低了21.6%。这与Ibanoglu等[13]的研究结果不同,Ibanoglu等研究表明在一定范围内,随着超高压处理压力和时间的增加,WPI的起泡性增加,这是因为超高压处理后增加了蛋白分子的弹性,且高压处理后蛋白分子会部分展开,增加了蛋白的表面疏水性[2],分子表面的疏水性基团使蛋白在空气和水的界面保持稳定,因此表面疏水性的提高能够提高泡沫稳定性[14]。

图4 超高压处理对WPC80起泡性的影响Fig.4 Effect of HHP treatment on the foaming ability of WPC80
乳清蛋白的起泡能力与原料中的脂肪含量相关,这是因为具有表面活性的极性脂肪会与蛋白竞争吸附于空气和水的界面[15],但与蛋白比较,脂肪粘弹性较差,不足以克服气泡内部的压力,因此泡沫膨胀会迅速的破碎,从而导致了较差的起泡性。
2.5超高压处理对WPC80溶液乳化性的影响
乳化性是反映蛋白质在油水界面保持乳状液体系稳定的能力,通常由乳化能力(EAI)和乳化稳定性(ESI)来表示。由图5可知,300MPa和600MPa超高压处理后,WPC80的EAI随着压力的增加而上升,但300 MPa处理后,ESI急剧下降了23.74%。蛋白形成稳定乳状液的能力与能够被包裹的蛋白表面积有关[16],表面疏水性(影响蛋白在油水界面的吸附)和分子弹性(影响蛋白结构的展开和与其他蛋白的相互作用)对于乳化性影响较大[17]。
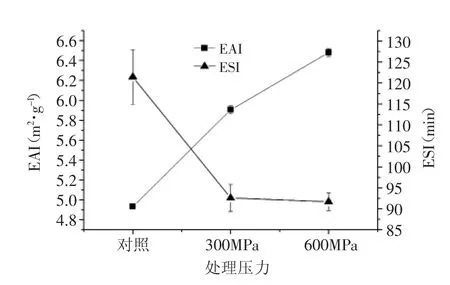
图5 超高压处理对WPC80乳化性的影响Fig.5 Effect of HHP treatment on the emulsifying of WPC80
超高压处理后,蛋白分子中包裹的疏水性分子基团外露,且在油相中定相重排,这样能够增加蛋白分子的表面积,从而提高蛋白的界面性质,提高了乳化能力。
通常来说,乳化稳定性与界面的连续性有关,不会随着时间而变化。如果乳状液有合适的pH和净电荷数量,这样在相互接近的液滴之间会形成保护屏,从而延迟絮凝的速率,形成较为稳定的乳状液[18]。本研究中,对照样品的pH为7.0,此pH下乳清蛋白带有净负电荷,蛋白分子之间相互排斥而延迟了絮凝,从而具有较好的乳化稳定性。超高压处理会打破乳清蛋白分子之间的静电力平衡,形成的乳状液的稳定性下降。
2.6超高压处理对WPC80蛋白分子量的影响
图6为超高压处理对WPC80 SDS-PAGE电泳结果。由图6可知,与条带1(对照)比较,2~5的蛋白条带没有明显差异,这表明超高压处理并未显著改变蛋白分子量。这与Lim等[3]的结果不同,Lim等研究了超高压处理(400MPa,15min)对WPC35蛋白分子量的影响,结果发现,α-乳白蛋白(α-Lactalbumin,α-La)和β-乳球蛋白(β-lactoglobulin,β-Lg)的浓度明显增加,中等分子量的蛋白聚合区域条带较为明显,且出现了分子量约为55ku的蛋白条带,大分子量蛋白没有发生改变。
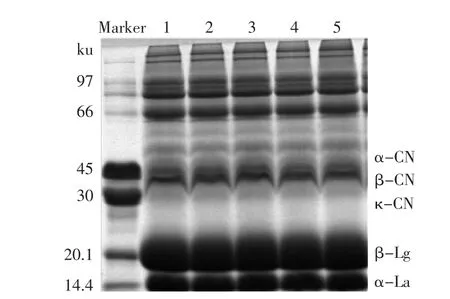
图6 超高压处理对WPC80蛋白分子量的影响Fig.6 Effect of HHP treatment on the molecular weight of WPC80
Tedford等[19]也报道了超高压和温度共同作用对β-Lg结构的影响,观察到β-Lg在二级和三级水平上均出现了不可逆转的破坏。超高压处理后,通过二硫键结合形成的β-Lg的聚合物结构被破坏,形成了较小的蛋白。因此,超高压处理后对乳清蛋白结构的影响,不仅与超高压处理压力、时间和温度有关,还与乳清蛋白中各种蛋白本身的结构有关,如乳清蛋白变性程度等。
2.7超高压处理对WPC80中蛋白二级结构的影响
圆二色光谱可以用来测定蛋白的二级结构,蛋白质在圆二色光谱远紫外区的负槽(205~235nm波长范围)内形状与主链构象密切相关,由图7可知,对照样品在约为209nm和222nm处有负槽,300MPa和600MPa处理后样品在195nm处有负槽。典型的α-螺旋在209nm和222nm左右有两个负槽;β-折叠在215nm处有一个负槽[20]。这表明超高压处理后样品中,α-螺旋结构减少,形成了无规则卷曲结构。通过DICHROWER软件中的K2D方法计算出了各类型二级结构的含量(表2)也验证了此结果,由表2可知,超高压处理后α-螺旋、β-折叠和β-转角结构显著降低(p<0.05),大部分蛋白结构转化为无规则卷曲结构。有研究表明压力为100~200MPa时,蛋白质结构变化是可逆的,一旦压力超过300MPa,蛋白质会发生氢键断裂,产生不可逆的变性[21]。超高压处理主要是破坏蛋白质的三级、四级结构的非共价键,而对共价键作用较小,不同压力对蛋白质结构的影响也不同[22]。

图7 圆二色光谱测定WPC80溶液的二级结构Fig.7 Determination of the secondary structure of the WPC80 protein by circular dichroism
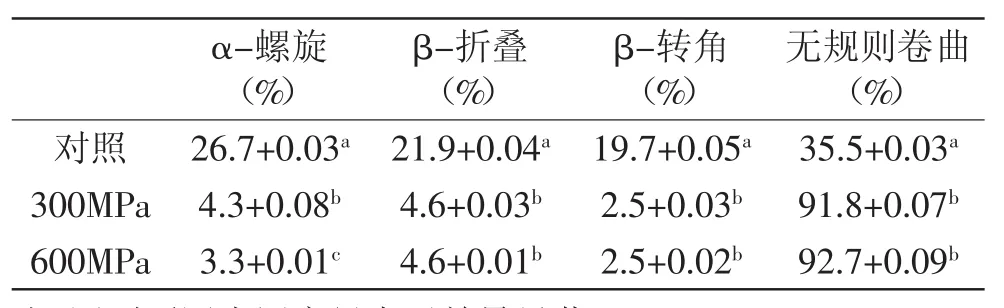
表2 超高压处理对WPC80蛋白二级结构的影响Table 2 Effect of HHP treatment on the protein secondary structure of WPC 80
3 结论
通过超高压(300MPa和600MPa处理10min)对WPC80进行改性处理,随着压力的增加,ΔE的值显著增加(p<0.05),这表明WPC80溶液的颜色发生了变化;超高压处理主要影响了WPC80的起泡性和乳化性,对WPC80的溶解性并没有显著影响;SDS-PAGE研究结果表明超高压处理并不会显著改变蛋白的分子量;由圆二色谱分析结果可以看出,超高压处理后α-螺旋、β-折叠和β-转角结构显著降低(p<0.05),大部分蛋白结构转化为无规则卷曲结构。
[1]Dissanayake M,Kelly A L,Vasiljevic T.Gelling properties of microparticulated whey proteins[J].Journal of Agricultural and Food Chemistry,2010,58:6825-6830.
[2]Lee W,Clark S,Swanson B G.Functional properties of high hydrostatic pressure treated whey protein[J].Journal of Food Processing Preservation,2006,30:488-501.
[3]Lim S Y,Swanson B G,S Clark.High hydrostatic pressure modification of whey protein concentrate for improved functional properties[J].Journal of dairy science,2008,91:1299-1307.
[4]孙颜君,刘鹭,李红娟,等.超声波处理对乳蛋白浓缩物加工特性的影响[J].中国乳品工业,2013,41(3):12-15.
[5]Nicorescu I,Loisel C,Vial C,et al.Combined effect of dynamic heat treatment and ionic strength on properties of whey protein foam part II[J].Food Research International,2008,41:980-988.
[6]Khanitta M,Syed S H.Emulsification mechanisms and characterizations of cold,gel-like emulsions produced from texturized whey protein concentrate[J].Food Hydrocolloids,2009,23(7):1837-1847.
[7]Gervilla R,Ferragut V,Guamis B.High hydrostatic pressure effects on color and milk-fat globule of ewe’s milk[J].Journal of Food Science,2001,66(6):880-885.
[8]Johnston D E,Austin B A,Murphy R J.The effects of high pressuretreatmentofskimmilk[J].HighPressureand Biotechnology,1992,24:243-247.
[9]Arzemi C,Martinez K,Zemap P,et al.Comparative study of high-intensity ultrasound effects on food protein functionality[J]. Journal of Food Engineering,2012,108:463-472.
[10]Considine T,Patel H A,Anema S G,et al.Interaction of milk proteins during heat and high hydrostatic pressure treatments[J].Innovative of Food Science and Emergency Technology,2007,8:1-23.
[11]Iordache M,Jelen P.High pressure microfluidization treatmentofheatdenaturedwheyproteinforimproved functionality[J].Innovative of Food Science and Emergency Technology,2003,4:367-376.
[12]Pelegrine D H G,Gasparetto C A.Whey proteins solubility as function of temperature and pH[J].Lebensm Wiss Technol,2005,38:77-80.
[13]Ibanoglu E,Karatas S.High pressure effect on foaming behavior of whey protein isolate[J].Journal of Food Engineering,2001,47:31-36.
[14]Pittia P,Wilde P J,Husband F A,et al.Functional and structural properties of β-lactoglobulin as affected by highpressure treatment[J].Journal of Food Science,1996,61:1123-1128.
[15]Fennema O R.Food Chemistry,3rd ed[M].New York:Marcel Dekker Incompany,1996:382-383.
[16]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidity technique[J].Journal of Agricultural and Food Chemistry,1978,26:716-723.
[17]Monahan F J,McClements D J,Kinsella J E.Polymerization of whey proteins in whey protein-stabilized emulsions[J].Journal of Agriculture and Food Chemistry,1993,41:1826-1829.
[18]Klemaszewski J L,Kinsella J E.Sulfitolysis of whey proteins:Effects of emulsion properties[J].Journal of Agriculture and Food Chemistry,1991,39:1033-1036.
[19]Tedford L A,Kelly S M,Price N C,et al.Combinated effects of thermal and pressure processing on food protein structure[J]. Food and Bioproducts Processing,1998,76:80-86.
[20]Sun C,Yang J,Wu X,et al.Unfolding and refolding of bovine serum albumin induced by cetylpyridinium bromide[J]. Biophysical Journal,2005,88:3518-3524.
[21]苏丹,李树军,赵凤敏,等.超高压对大豆蛋白结构和功能性质影响研究进展[J].包装与食品机械,2009,27(5):111-115.
[22]董新红,赵谋明,蒋跃明.超高压技术在蛋白质食品加工中的应用[J].食品工业与科技,2012,33(2):451-453.
Effect of high hydrostatic pressure treatment on the functionality and protein structure of whey protein concentrate80
SUN Yan-jun1,LI Zhi-gang2,MO Bei-hong1,ZHENG Yuan-rong1,SHI Chun-quan1,ZHU Pei1,JIAO Jing-kai1,LIU Zhen-min1,*
(1.State Key Laboratory of Dairy Biotechnology,Dairy Research Institute,Bright Dairy and Food Co.,Ltd.,Shanghai 200436,China;2.The School of Food Science and Technology,Jiangnan University,Wuxi 214000,China)
The effects of high hydrostatic pressure processing(HHP)(300MPa and 600MPa,10min)on the protein structure and functionality of whey protein concentrate80(WPC80)were evaluated.The results showed that a decrease of△E value,and a fluctuation of L*,a*and b*values occurred in color for high pressure treatments.Comparing to the control,the particle size(D50)of 600 MPa treated samples increased by 22.13 times.The HHP treatments did not affect solubility of WPC80(p>0.05).However,the foaming and emulsifying ability of WPC80 treated at 300 or 600 MPa for 10 min were changed significantly(p<0.05).From the bands of sodium dodecyl sulfate-polyacrylamide gel electrophoresis,HHP treatment did not change the molecular weight of the protein significantly.The results of circular dichroism spectroscopy showed that the secondary structure of protein was changed for the HHP treatment.
high hydrostatic pressure;WPC80;functionality;protein structure
TS201.1
A
1002-0306(2015)12-0078-06
10.13386/j.issn1002-0306.2015.12.008
2014-10-30
孙颜君(1988-),女,硕士研究生,研究方向:乳品科学与加工。
刘振民(1974-),男,博士,教授级高工,研究方向:乳制品研究与开发。
闵行区科技项目(2013MH088)。
