静压力对人牙周膜干细胞骨向分化能力的影响
2015-11-05马小杰刘文佳杨振华李彦浇
马小杰,刘文佳,杨振华,申 琳,李彦浇,金 钫
(第四军医大学口腔医院军事口腔医学国家重点实验室:1.正畸科;2.组织工程中心,陕西西安 710032)
正畸牙移动是一个复杂的细胞生物学过程,主要依赖于机械刺激下牙槽骨的改建,而牙槽骨的应力改建则是成骨和破骨动态平衡的结果。已有研究证实,牙周组织在正畸牙移动过程中发挥了重要的作用[1]。
牙周膜干细胞(peridotal ligament stem cells,PDLSCs)是来源于牙周组织的干细胞,具有很强的自我更新和多向分化能力;在体外刺激下可分化为成骨细胞、成纤维细胞、成软骨细胞、脂肪细胞等,是牙周组织再生与修复的种子细胞[2-3]。有研究证实,在正畸牙移动过程中,牙周膜干细胞的分布范围更广,且数量明显增加;提示PDLSCs与正畸牙移动过程中的牙周组织改建密切相关[4]。
正畸牙移动过程中破骨细胞性骨吸收是保证牙齿移动的关键,因此应力作用下破骨细胞的分化以及PDLSCs与破骨细胞之间的关系一直是研究的热点[5]。已有研究证明,在正畸牙移动过程中,PDLSCs自身成骨能力发生变化的同时还可以诱导单核/巨噬细胞分化为破骨细胞,其中 OPG/RANKL/RANK轴发挥了重要的作用[6]。体内外实验均已证明,OPG和RANKL是破骨细胞分化的重要调节因子,OPG作为RANKL的假受体,可通过竞争性的结合RANKL而抑制破骨细胞的分化[7]。
力学刺激是维持细胞生存和生长的重要细胞外刺激,在骨骼的发育、形成、改建中起重要作用[8]。在正畸牙移动过程中,PDLSCs可通过特定的“机械-生化”信号传导途径对力作出反应[9]。大量文献证实,体外培养的hPDLSCs在各种机械刺激作用下,其增殖、分化等一系列生物学特性均会发生改变[10-11]。目前已研制出了多种体外细胞应力加载装置,按其加载性质的不同分为:基底形变加载装置、流体剪切力加载装置、离心力加载装置和空气液体传导静压力加载装置[12]。
hPDLSCs是正畸牙移动的关键因素,并有文献报道,hPDLSCs同时表达OPG和RANKL;提示hPDLSCs可能通过OPG/RANKL/RANK发挥其调节骨改建的作用。故本实验采用体外静压力加载装置模拟压力侧hPDLSCs的受压环境,并从基因和蛋白水平检测 hPDLSCs受压后表达OPG和RANKL的变化,以探讨单纯压力环境对hPDLSCs骨向分化能力的影响;进而为临床正畸治疗提供一定的参考意见。
1 材料和方法
1.1 主要材料、试剂和仪器
α-MEM(Gibco,美国);胎牛血清(杭州四季青生物技术有限公司);1000 U/mL青霉素、1000 U/mL 链霉素(Invitrogen,Cadsbad,美国);胰蛋白酶(Hyclone,美国);谷氨酰胺(GIBCO,美国);β-甘油磷酸钠、地塞米松、抗坏血酸(Sigma,美国);茜素红(上海化学试剂采购供应站);ALP染色试剂盒(上海碧云天);ALP活性检测试剂盒(南京建成);Teizol Reagent(Lift Technologes,美国);逆转录试剂盒、RT-PCR试剂盒(TaKaRa,日本);二氧化碳恒温孵箱(Forma,美国);荧光倒置相差显微镜和照相系统(OLYMPUS,日本);酶标仪(Tecan,奥地利);FACS Aria流式细胞仪(BD,美国);超净工作台(苏州净化设备厂);低温高速离心机(Heraeus,德国);6 孔培养板(Falcon,美国)。
1.2 hPDLSCs的分离、培养和鉴定
1.2.1 hPDLSCs分离培养
选取因正畸减数而新鲜拔除的人健康第一前磨牙,立即用PBS冲洗洁净后,用手术刀片刮取根中1/3牙周膜组织,加入I型胶原酶,37℃下消化30 min,使用含10 mL/L胎牛血清的α-MEM培养基终止消化,800 r/min离心 6 min,加入少量α-MEM吹打混匀后,接种于6孔板内;在37℃、50 mL/L CO2和饱和湿度条件下培养,每隔3~4 d换液,直至有细胞从组织块边缘爬出,并每天用倒置相差显微镜观察细胞形态。
原代培养至细胞汇合达80%时采用有限稀释法分选hPDLSCs,并进行常规传代培养。然后取第一代细胞,用α-MEM制成细胞密度为1000/mL的单细胞悬液后,取1 mL接种于10 mL的培养皿,常规条件下进行培养;3~4 d换液,连续培养14 d后,甲苯胺蓝染色,并计算其克隆形成率。
1.2.2 hPDLSCs分化能力鉴定
取第3代hPDLSCs以1×105/mL的密度接种于6孔板,常规条件下培养至细胞生长达80%时,更换为成骨诱导液(含10 mmol/L β-甘油磷酸钠、50 μg/mL 维生素 C、1 ×10-8mol/L 地塞米松、10 mL/L胎牛血清的α-MEM)和成脂诱导液(含0.5 mmol/L IBMX、1 μmol/L 地塞米松、10 mg/L 胰岛素、200 μmol/L吲哚美辛、100 mL/L胎牛血清的α-MEM)继续培养,分别于诱导培养7、14 d后,取成骨诱导组细胞进行ALP染色和茜素红染色,于诱导培养21 d后,取成脂诱导组细胞进行油红O染色;然后一并置于光学显微镜下进行观察并拍照。
1.3 压力对hPDLSCs表达OPG和RANKL的影响
1.3.1 实验分组和压力刺激
取第4代hPDLSCs以1×106/mL的密度接种于6孔板,常规条件下培养至细胞铺满孔板底90%时,按不同加载力值将细胞随机分为0(对照组)、20、100、200 kPa组。然后将各组细胞置于压力加载装置内分别给予相应的静压力刺激;持续加压6 h后,取各组细胞进行以下检测。
1.3.2 RT-PCR 检测 hPDLSCs中 OPG 和 RANKL mRNA的表达
根据 GenBank中人来源的 OPG、RANKL和β-actin的基因序列,采用 Primer Premier 5.0 软件遵循引物设计的一般原则筛选上、下游引物(表1),并由上海生工生物工程公司进行引物合成。取不同压力连续刺激6 h后的各组细胞,用Trizol裂解细胞并提取总RNA;用酶标仪对各组RNA进行定量分析后,以相应引物逆转录合成cDNA。然后以cDNA为模板、β-actin为内参,用RT-PCR仪扩增各目的基因(总反应体系为20 μL,反应条件严格按试剂盒说明)。最后根据仪器所测得的Ct值,采用2-ΔΔCt法计算出各组 OPG、RANKL mRNA的相对表达量。

表1 引物序列
1.3.3 West-blots 检测 hPDLSCs OPG 和 RANKL蛋白的表达
取不同压力连续刺激6 h后的各组细胞,用蛋白裂解液裂解细胞(-20℃反复冻融3次)后分别转移至1.5 mL的 EP管中;超声清洗3次(每次5~10 s)后,10000 r/min离心15 min取上清,并采用BCA或G250蛋白定量试剂盒测定其蛋白浓度,按所测蛋白浓度计算样品与Nacl的体积,并将其混合后,再加入1/5的5×loading buffer置于95℃水中煮5 min。配制聚丙烯酰胺凝胶,并取20 μL蛋白样品进行SDS-PAGE(十二烷基硫酸钠一聚)电泳;在冰浴中将细胞蛋白转移至硝酸纤维素膜上(转膜电压为200 mA,2 h)后,用50 g/L脱脂奶粉室温封闭2 h;然后分别滴加 OPG、RANKL一抗(1∶500稀释),4℃过夜;TBST洗膜10 min×3次,滴加过氧化物酶标记的二抗(1∶20000)室温孵育2 h;再次TBST洗膜10 min×3次后,显色,用蛋白凝胶成像系统分析样品中OPG、RANKL蛋白的相对含量。
1.4 统计学分析
2 结果
2.1 hPDLSCs的分离、培养和鉴定
2.1.1 hPDLSC 形态学观察
倒置显微镜下观察可见,原代培养的hPDLSCs呈短梭形或三角形(图1a);传代培养24 h后细胞贴壁,呈长梭形散在分布,3 d后细胞排列成漩涡状,大小不一,核圆居中(图1b)。甲苯胺蓝染色可见有细胞克隆形成,计算得出hPDLSCs克隆形成率为20.6%(图 2)。
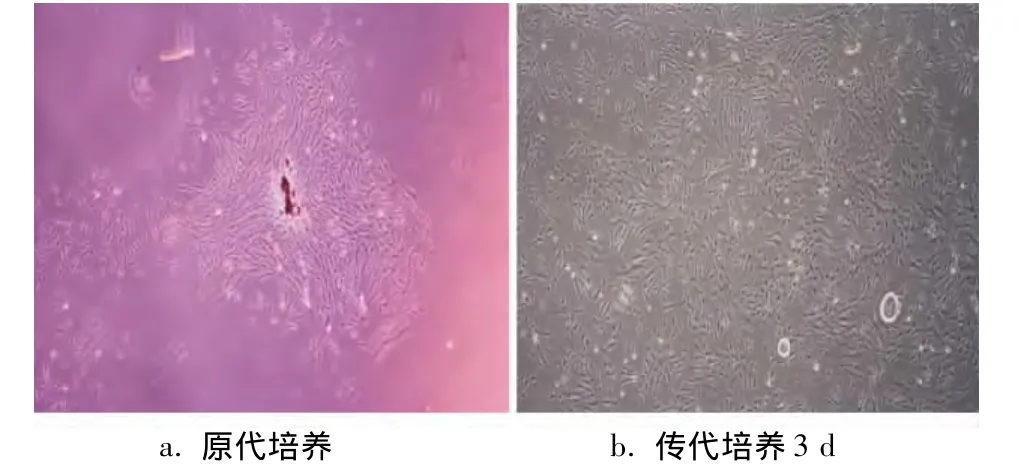
图1 hPDLCs原代及传代培养3 d(倒置相差显微镜,×40)

图2 hPDLSCs甲苯胺蓝染色观察(倒置相差显微镜,×40)
2.1.2 hPDLSCs成骨、成脂分化能力鉴定
hPDLSCs成骨诱导7 d后,ALP染色可见诱导组的染色明显加深(图3a);成骨诱导14 d后,茜素红染色可见诱导组颜色明显加深,并有矿化结节形成(图3b);成脂诱导21 d后油红O染色显示,细胞胞浆内出现脂滴(图3c)。

图3 hPDLSCs成骨、成脂分化能力鉴定(倒置相差显微镜,×200)
2.2 静压力对hPDLSCs表达OPG/RANKL mRNA和蛋白的影响
hPDLSCs经不同压力连续刺激6 h后,RT-PCR检测显示,与对照组相比,当压力值为20 kPa时,RANKLmRNA 的表达量降低(P<0.05),但 OPG mRNA的表达量明显升高(P<0.05),从而使RANKL/OPG的比值明显降低(P<0.05);当压力值为 100 kPa时,RANKL mRNA的表达量明显升高(P<0.05),但OPG mRNA的表达量降低(P<0.05),从而使 RANKL/OPG的比值明显升高(P<0.05);当压力值为200 kPa时,RANKL、OPG mRNA的表达量均明显降低(P<0.05),其中以RANKL mRNA的下降程度更加明显,从而使RANKL/OPG的比值明显降低(P <0.05)(图 4a、b)。
hPDLSCs经不同压力连续刺激6 h后,Western-blot检测显示:与对照组相比,RANK蛋白的表达量在20 kPa时变化不明显(P>0.05),在100 kPa时明显升高(P<0.05),在200 kPa时明显下降(P<0.05);而OPG蛋白的表达量在20 kPa时明显升高(P<0.05),在100 kPa和200 kPa时均明显下降(P<0.05),但在200 kPa时的下降程度不如RANKL明显(图4c)。

图4 不同大小的压力刺激6 h后各组OPG、RANKL mRNA和蛋白表达量的比较
3 讨论
正畸牙齿移动并不是简单的机械移位,而是一个复杂的细胞生物学过程。有文献报道,牙周膜是连接牙齿与牙槽骨的重要组成部分,在正畸牙移动过程中发挥着重要的作用;当矫治力作用于牙齿后,压力侧的牙周膜受压紧缩,间隙变窄,血流量减少,从而形成缺氧和无菌性炎症环境;此时牙槽骨表面出现蚕蚀状吸收陷窝,并启动牙齿移动[1,11]。
hPDLSCs作为牙周膜内的间充质干细胞,在正畸牙移动过程中,不仅其自身成骨能力下降,还可以诱导破骨细胞的生成;提示其在牙周组织的自我更新和牙周炎的修复与再生以及正畸牙移动过程牙槽骨的重塑中发挥了重要作用[13-14]。
目前已证明,护骨素OPG是一种参与骨密度调节的分泌性蛋白,可通过与RANKL结合阻断RANKL与RANK的结合,从而使RANK不能活化,并最终抑制破骨细胞的生成;提示,RANKL和OPG与正畸牙移动过程中破骨细胞的分化、形成和功能密切相关[5-7]。Sampson W 等报道,OPG 和RANKL参与了牙根吸收过程[15];Mustafa等也证实,压力刺激可使牙周膜细胞中RANKL的表达量明显升高,并可促进破骨细胞的生成[16];以上研究结果提示,OPG/RANKL/RANK轴在骨改建、正畸牙移动以及牙根吸收的过程中均发挥了重要作用。
本实验采用细胞液压加载装置在体外模拟hPDLSCs的受压状况,并从基因和蛋白水平检测了不同压力刺激对hPDLSCs表达OPG、RANKL的影响。结果显示:持续加压 6 h后,当压力值为20 kPa时,hPDLSCs表达 RANKL无明显变化,但OPG的表达明显升高;说明在此压力条件下OPG可作为骨保护素阻止了RANKL与RANK的结合,从而抑制了破骨细胞的活化。当压力值为100 kPa时,hPDLSCs表达RANKL量明显升高,而OPG的表达量变化不明显,说明在此压力条件下OPG对破骨细胞分化成熟的抑制作用减弱,而RANKL则在牙周组织内积聚,并诱导破骨细胞的生成、启动压力侧骨吸收。当压力值为200 kPa时,hPDLSCs表达 OPG和 RANKL的量均明显降低,其中以RANKL的下降程度更为明显,从而使 RANKL/OPG的比值降低;提示,压力过大可能会造成hPDLSCs的凋亡增多,细胞功能丧失,从而使骨改建受到抑制。该结果与正畸“最适力”原则相符,即压力过小时,牙齿移动尚不能启动,而压力过大则又会减缓甚至抑制牙齿的移动;从而可为临床矫治提供一定的理论基础和参考。此外,本实验结果还与黄生高等的研究结果一致,但后者只证明了持续静压力作用下RANKL的表达具有力值依赖性,而未对OPG的表达进行检测[17]。鉴于牙齿移动是成骨/破骨的相互协调作用的结果,我们认为同时观察RANKL与OPG比值的变化可能更加合理可信。各体外加力实验研究中RANKL和OPG的表达略有不同,这可能与加压方式以及细胞培养条件不同有关。此外,由于干细胞的自我更新及多向分化能力的研究空间还很大,各种机制相互联系,且错综复杂,因此关于力学因素对牙周膜干细胞的骨向分化能力的影响还有待进一步研究。
[1]彭鹏,王伟.牙周膜在正畸牙移动过程中的生物学行为[J].北京口腔医学,2012,20(6):354 -357.
[2]Seo BM,Miura M,Shi S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149 -155.
[3]Wu Y,Yang Y,Li Y,et al.The osteogenic differentiation of PDLSCs is mediated through MEK/ERK and p38 MAPK signaling under hypoxia[J].Arch Oral Biol,2013,58(10):1357 -1368.
[4]Kim JY,Kim BI,Jue SS,et al.Localization of osteopontin and osterix in periodontal tissue during orthodontic tooth movement in rats[J].Angle Orthod,2012,82(1):107 -114.
[5]Lucas R,Elisabete R,Henrique B,et al.Changes in serum RANKL and OPG with sexual development and their associations with bone turnover and bone mineral density in a cohort of girls[J].Clin Biochem,2014,47(12):1040 -1046.
[6]Kim SJ,Park KH,Kang YJ,et al.Compressive stress induced the up-regulation of M-CSF,RANKL,TNF-expression and the down-regulation of OPG expression in PDL cells via the integrin - FAK pathway[J].Arch Oral Biol,2013,58(6):707-716.
[7]Yamaguchi M.RANK/RANKL/OPG during orthodontic tooth movement[J].Orthod Craniofac Res,2009,12:113 -119.
[8]Liu L,Shao L,Wang J,et al.Extracellular signal-regulated kinase1/2 activated by fluid shear stress promotes osteogenic differentiation of human bone marrow-derived mesenchymal stem cells through novel signaling pathways[J].Int J Biochem Cell Biol,2011,43(11):1591 -1601.
[9]孙传喜,张淋坤,赵志河,等.周期性张应力作用下人牙周膜干细胞Dlx5和Msx2表达的变化[J].四川大学学报(医学版),2011,42(6):823-826.
[10]Zhang C,Li J,Chen Y,et al.Effects of mechanical vibration on proliferation and osteogenic differentiation of human periodontal ligament stem cells[J].Arch Oral Biol,2012,57(10):1395 -1407.
[11]Matsuda N,Yokoyama K,Watanabe M,et al.Role of epidermal growth factor and its receptor in mechanical stress-induced differentiation of human periodontal ligament cells in vitro[J].Arch Oral Biol,1998,43(12):987 -97.
[12]Zhang P,Wu Y,Fang b,et al.Osteogenic response of mesenchymal stem cells to continuous mechanical strain is dependent on ERK1/2-Runx2 signaling[J].Int J Mol Mde,2012,29(6):1083-1089.
[13]Kirschneck C,Proff P,Roemer P,et al.Differentiated analysis of orthodontic tooth movement in rats with an improved rat model and three-dimensional imaging[J].Ann Anat,2013,195(6):539-553.
[14]Houshmand B,Behnia H,Khojasteh A,et al.Osteoblastic differentiation of human stem cells derived from bone marrow and periodontal ligament under the effect of enamel matrix derivativeand transforming growth factor- beta[J].Int J Oral Maxillofac Implants,2013,28(6):e440 -450.
[15]Curl L,Tan CW,Sampson W,et al.A qualitative investigation of RANKL,RANK and OPG in a rat model of transient ankylosis[J].Aust Orthod J,2014,30(2):143 -151.
[16]Tripuwabhrut P,Mustafa M,Mustafa K,et al.Effect of compressive force on human osteoblast-like cells and bone remodelling:an in vitro study[J].Arch Oral Biol,2013,58(7):826-836.
[17]黄生高,张建兴,王明朗,等.持续静压力对人牙周膜细胞RANKLmRNA表达的影响[J].中南大学学报(医学版),2006,31(4):518-522.
