大孔吸附树脂纯化荔枝壳总黄酮的工艺研究
2015-11-04郑韵英韦藤幼钦州学院石油与化工学院广西钦州535099广西大学化学化工学院广西南宁530004
郑韵英,韦藤幼(.钦州学院石油与化工学院,广西钦州535099;.广西大学化学化工学院,广西南宁530004)
大孔吸附树脂纯化荔枝壳总黄酮的工艺研究
郑韵英1,韦藤幼2
(1.钦州学院石油与化工学院,广西钦州535099;2.广西大学化学化工学院,广西南宁530004)
以提纯荔枝壳黄酮类化合物为目的,通过内部沸腾法得到荔枝壳总黄酮提取液,采用大孔吸附树脂对其进行纯化研究。结果得到AB-8树脂最适合纯化荔枝壳总黄酮,而最优纯化工艺为上样液浓度为0.5 mg/mL,用量为24.0 mL;吸附流速为1 mL/min,洗脱液为80%乙醇,洗脱剂用量为30.0 mL,洗脱流速为1 mL/min。在该工艺条件下,荔枝壳总黄酮的吸附量达5.18 mg/g,解吸率为99.0%,荔枝壳总黄酮的含量从31.4%提高到了82.7%,荔枝壳总黄酮回收率达92.1%。采用AB-8大孔吸附树脂纯化内部沸腾法得到的荔枝壳提取液效果较好,且树脂更方便回收与利用。
大孔树脂,内部沸腾法,纯化,荔枝壳总黄酮
荔枝因其有较高营养和经济价值而成为我国食品行业的重要原料以及外贸出口最具竞争力的水果之一。同时各种荔枝加工产品也畅销国内外,比如:荔枝干、荔枝罐头、荔枝汁与荔枝酒等[1]。然而在荔枝加工和消费过程中,荔枝壳通常直接被遗弃,并未得到重视。实际上,荔枝壳含有多种活性成分,如黄酮类、酚酸和多糖类物质[2]。而这些黄酮类生理活性物质,具有很高的药用价值[3]。在《本草纲目》中也早有荔枝壳的记载:“果壳、果核可入药,治鼻衄,疗疝气”。而在日常生活中,也有用荔枝壳煮水服用来解决因为新鲜荔枝果肉吃多而上火的问题。因此,将荔枝壳收集并加以开发研究以提高其利用价值具有重要意义。
目前,国内外对荔枝壳总黄酮研究相对较少,主要集中在提取工艺方面,如杨宝[4]采用响应面分析方法分析了醇提荔枝壳总黄酮的影响,涂华等[5-6]采用超声波和超声波微波双辅助对荔枝壳总黄酮进行了提取,阮尚全等[7]采用了超声波协同酶法提取荔枝壳中总黄酮并对抗氧化性进行了研究。而荔枝壳总黄酮的纯化工艺目前只有涂华等[8]通过乙醇回流提取得到荔枝壳提取液,然后采用D101大孔吸附树脂对其进行纯化,虽然获得较好的总黄酮含量,但含量数据含糊,同时从图中可看出其解吸率稍低,而且纯化前荔枝壳总黄酮提取液的制备时间过长。文献[9-11]提出了一种对天然产物有效成分提取的方法内部沸腾法。该方法提取时间短,提取效率高,溶剂用量少且提取液杂质含量少。而文献[12]中指出该方法提取的提取液对大孔树脂的回收再利用更为有利,而且纯化效果也较好。本实验通过内部沸腾法获得荔枝壳总黄酮提取液,然后采用大孔吸附树脂对其进行纯化,旨在为荔枝壳总黄酮的进一步研究提供参考。
1 材料与方法
1.1材料与仪器
荔枝产地广西灵山,将新鲜荔枝去果肉留果皮,果皮洗净晒干粉碎,过100目分子筛备用;大孔树脂S-8、AB-8、D-101、D-4020和NKA-9南开大学化工厂;芦丁对照品国药集团化学试剂有限公司;无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝西陇化工股份有限公司;以上化学试剂均为分析纯试剂。
SHB-Ⅲ型循环水式多用真空泵郑州长城仪器有限公司;HZS-H型恒温振荡水槽上海市实验仪器总厂;RE-52A型旋转蒸发仪上海亚荣生化仪器厂;PC2501紫外分光光度计日本岛津公司;BPZ-6090LC真空干燥箱上海一恒科学仪器有限公司。
1.2实验方法
1.2.1提取液制备用4 mL 80%的乙醇溶液解吸1.00 g荔枝壳粉末15 min,然后迅速加入85℃20 mL 25%乙醇,提取4 min,减压抽滤,收集提取液;再重复提取一次,合并两次提取液,得到内部沸腾提取液。用旋转蒸发仪将提取液浓缩后置于真空干燥箱内干燥得荔枝壳总黄酮粗产物。称取一定量的粗产物,用蒸馏水溶解并定容于250 mL容量瓶中,摇匀后于波长为510 nm下测定其吸光值,再根据芦丁标准曲线所得的回归方程计算溶液的总黄酮质量浓度从而计算总黄酮含量,然后再计算出提取液中总黄酮含量为31.4%,以纯水为溶剂配制荔枝壳总黄酮质量浓度为1.50 mg/mL的样品液,备用。
1.2.2芦丁标准曲线的制作将芦丁标准品置于105℃烘箱内干燥至恒重。准确称取0.1008 g芦丁标准品于30%乙醇溶液中溶解,定容至250 mL,分别移取0.00、1.00、2.00、4.00、6.00、8.00、10.00 mL芦丁标准溶液于7个25 mL容量瓶中,分别加入30%乙醇溶液,使容量瓶中的溶液体积约为12.5 mL,摇匀后分别加入0.7 mL 5%NaNO2溶液,摇匀,放置5 min,分别加入0.7 mL 10%Al(NO3)3溶液摇匀,放置6 min后分别加入5 mL 4%NaOH溶液,用30%乙醇溶液定容,摇匀后放置10 min。以空白试剂作为参比,在波长为510 nm下测定溶液吸光值,以吸光度为纵坐标,浓度为横坐标,绘制标准工作曲线[13]。
1.2.3树脂的吸附量、吸附率、解吸量及解吸率的测定根据芦丁标准曲线得到总黄酮质量浓度,再根据以下公式计算吸附量、吸附率、解吸量、解吸率[14]和总黄酮回收率。
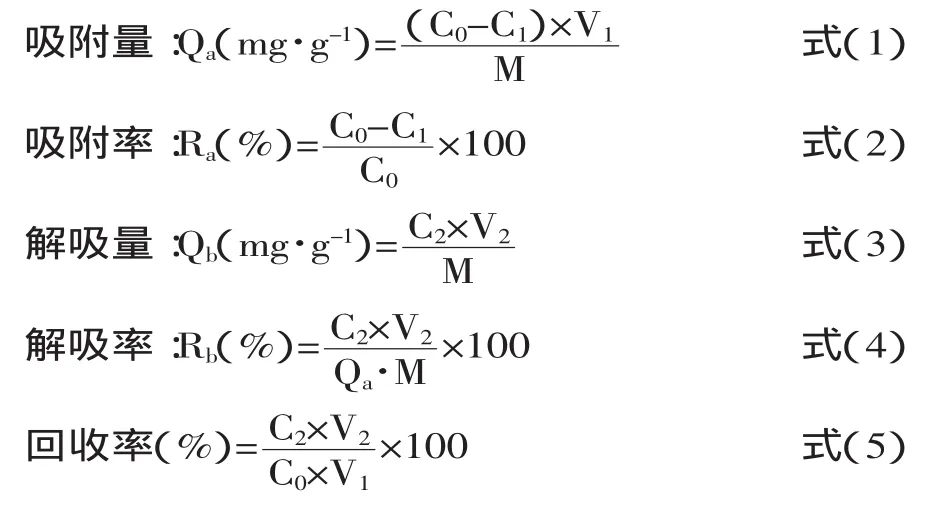
式中:C0为上样液初始质量浓度(mg/mL);C1剩余液质量浓度(mg/mL);C2洗脱液浓度(mg/mL);V1上样液体积(mL);V2洗脱体积(mL);M为干树脂的质量(g)。
1.2.4树脂预处理将树脂浸泡在95%乙醇中24 h装柱,然后用95%乙醇进行清洗至流出乙醇溶液清澈,再用蒸馏水洗尽乙醇至流出液为中性,树脂预处理完毕并保存,用时抽干。
1.2.5静态吸附与解吸实验
1.2.5.1树脂的筛选分别称取预处理过的AB-8、S-8、D-101、D-4020和NKA-9树脂2.00 g置于具塞磨口三角瓶中,加入0.5 mg/mL提取液20 mL,25℃恒温振荡12 h,测定吸附后剩余液中荔枝壳总黄酮的浓度。将吸附平衡的树脂用30 mL 95%乙醇在温度为25℃下振荡解吸12 h,再根据1.2.3的公式计算平衡时各树脂的吸附率和解吸率进而筛选出合适于纯化荔枝壳总黄酮的树脂。
1.2.5.2静态吸附曲线的绘制室温条件下,在50 mL具塞锥形瓶加入预处理好的树脂2.00 g,然后加入20.0 mL 0.5 mg/mL提取液,置于摇床上,以转速为120 r/min振摇12 h,期间每隔30 min吸取上层溶液测定黄酮含量,计算树脂的吸附量,并绘制出树脂静态动力学曲线。
1.2.6动态吸附与解吸实验
1.2.6.1上样液浓度对树脂吸附性能的影响准确称量预处理好的树脂5份各2.00 g,分别加入0.25、0.5、0.75、1.00、1.25 mg/mL提取液各20 mL,室温下置于转速为120 r/min的摇床中振荡360 min,测定树脂的吸附率。绘制上样液浓度对树脂吸附性能的影响曲线。
1.2.6.2吸附流速对吸附效果的影响5份20.0 mL相同浓度的样品液分别以1.00、2.00、3.00、4.00、5.00 mL/min的流速自上而下通过5个AB-8树脂柱,流出液每2 mL收集一管,分别测定每管的总黄酮浓度至流出液中总黄酮浓度为样品液浓度的1/10,即泄露点[15]为止。然后以流出液浓度为纵坐标,流出液体积为横坐标,绘制泄漏曲线。
1.2.6.3上样体积对树脂吸附的影响将浓度为0.5 mg/mL的荔枝壳提取液加入装有2.00 g预处理好的AB-8树脂柱,以1 mL/min的速度经过柱子,然后每2 min收集一管流出液,分别测定其吸光值,计算吸附量,并以吸附量为纵坐标,流出液体液为横坐标,绘制动态吸附曲线,确定上样体积。
1.2.6.4洗脱剂浓度对树脂解吸的影响于2.0 g吸附饱和的树脂中分别加入30 mL浓度为40%、50%、60%、70%、80%、90%、95%的乙醇溶液进行洗脱,收集洗脱液,测定吸光值,计算不同浓度洗脱剂下的解吸率。
1.2.6.5洗脱流速对树脂动态解吸的影响分别将5份已经吸附饱和的树脂2.00 g上柱,加入30 mL 80%乙醇洗脱剂,流速分别设置为1、2、3、4、5 mL/min,每2 mL一管分段收集流出液,测定其吸光值,计算流出液浓度,绘制洗脱流速曲线。
1.2.6.6洗脱剂用量对树脂解吸的影响分别将已经吸附饱和的树脂2.00 g上柱,加入80%乙醇进行洗脱,洗脱速度为1 mL/min,洗脱剂用量分别设置为10.0、15.0、20.0、25.0、30.0、35.0 mL,收集流出液,测定吸光值,计算不同洗脱剂用量的解吸率。
2 结果与分析
2.1标准曲线的确定
根据1.2.2芦丁标准曲线的制作的实验数据,得到溶液中吸光度(A)与芦丁质量浓度(c,mg/mL)的回归方程为:A=9.7154C+0.0028(R2=0.9996),A为吸光度,C为浓度,单位mg/mL。芦丁标准曲线见图1。
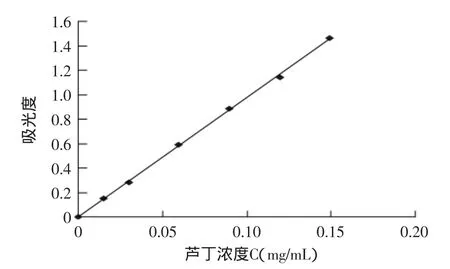
图1 芦丁标准曲线Fig.1 The standard curve of sophorin
2.2静态吸附与解吸实验
2.2.1树脂的筛选通过树脂筛选实验,得到荔枝壳总黄酮的吸附和解吸性能均具有良好纯化效果的树脂见表1。
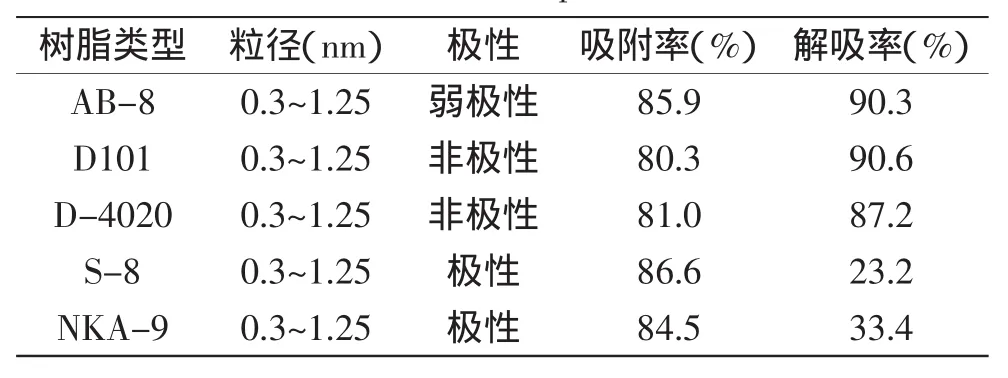
表1 不同树脂对荔枝壳总黄酮的吸附和解吸能力Table 1 The ability of adsorption and desorption of total flavonoids in Litchi Pericarp of different resins
由表1可见,AB-8、S-8、NKA-9三种树脂对荔枝壳总黄酮具有较好的吸附效果,其中S-8树脂的吸附量最高,AB-8树脂吸附量次之,而从解吸率上看,AB-8、D101树脂对荔枝壳总黄酮具有较好的解吸效果,其中D101树脂解吸率最高,AB-8树脂的解吸率次之,而S-8树脂解吸率最低。原因是荔枝壳黄酮类具有一定的极性,但极性不大。根据树脂的吸附特性,极性树脂对极性物质具有较强的吸附能力,非极性树脂对非极性物质有较强的吸附能力[16],而中性树脂兼有以上两种能力。所以弱极性和极性的树脂对荔枝壳总黄酮具有较好的吸附效果。而在洗脱的过程中,可能是因为S-8树脂靠氢键作用于荔枝壳总黄酮分子,比较难洗脱下来,所以解吸率较低。而非极性和弱极性的树脂吸附物质主要靠分子间的范德华力,况且D101树脂的孔径和比表面积的疏水性较强,所以富集在树脂表面的荔枝壳总黄酮很容易被洗脱,而弱极性的AB-8树脂也具有疏水性,所以D101和AB-8树脂的解吸率较高。综合各树脂的吸附能力与解吸能力等各方面原因,选择AB-8树脂纯化荔枝壳总黄酮较为适合。
2.2.2静态吸附时间曲线由图2可知,在0~120 min的范围内吸附较快,120~210 min吸附过程逐渐变慢之后趋于平稳。AB-8树脂对荔枝壳总黄酮的吸附量会随着时间变化而变化,210 min时间后吸附达到平衡。树脂的静态吸附特性与工业生产率相关,而从AB-8树脂对荔枝壳总黄酮的吸附平衡时间上看,吸附达到平衡的时间不长,可为荔枝壳中总黄酮的工业应用提供理论基础。
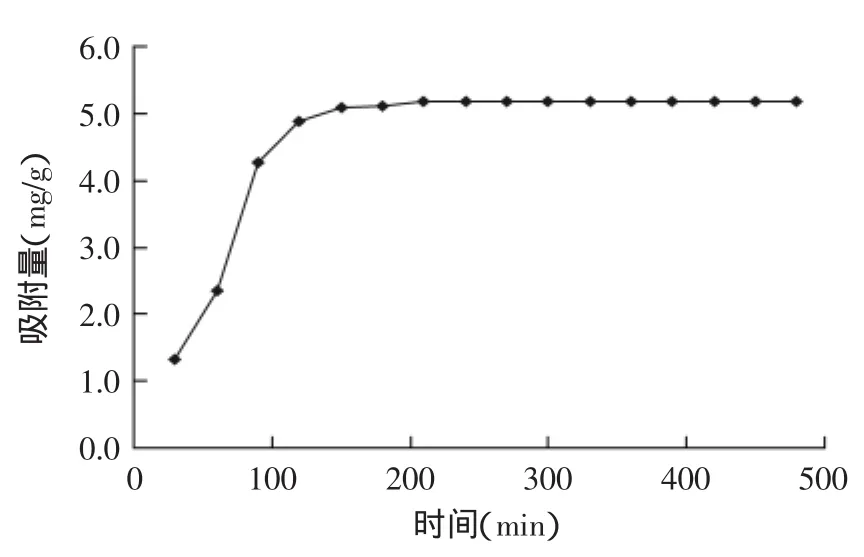
图2 AB-8树脂静态吸附时间曲线Fig.2 The static adsorption curve of AB-8 resin
2.3动态吸附与解吸工艺研究
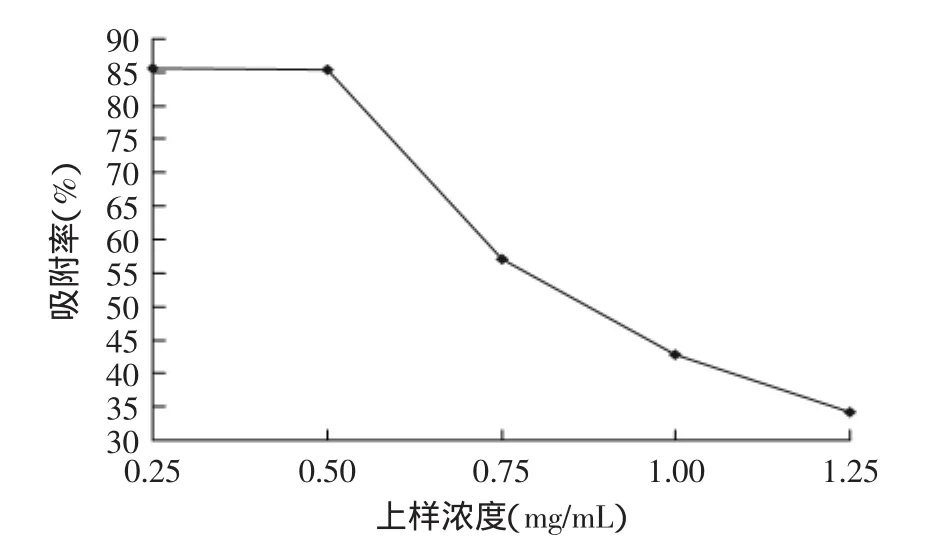
图3 上样液浓度对AB-8树脂吸附性能的影响Fig.3 Effect of sample concentration on adsorption capacity of AB-8 resin
2.3.1上样液浓度的确定由图3可知,上样液浓度在0.25~0.5 mg/mL时,树脂吸附率变化较小,当浓度超过0.5 mg/mL后,树脂的吸附率便呈下降趋势。只因在等温条件下,吸附量q是温度和提取液中吸附质(荔枝壳总黄酮)浓度的函数,即q=f(T,C),荔枝壳总黄酮浓度低时,吸附容易达到平衡且吸附率高,但是吸附量少;而在荔枝壳总黄酮浓度适中时,吸附量与浓度的1/N方成正比,吸附率与吸附量均高;而荔枝壳总黄酮浓度高时,随着吸附液浓度的增大,而吸附量减少,吸附率也随之减少[17]。所以,上样液浓度最佳为0.5 mg/mL。
2.3.2吸附流速的确定由图4可知,吸附流速为1 mL/min时,约需10 mL才出现泄露点,而吸附流速为5 mL/min时,只需约4.5 mL就出现了泄漏点,树脂的吸附过程主要是有效成分在树脂柱中的粒扩散和膜扩散过程,吸附流速慢,有利于荔枝壳中黄酮类化合物在AB-8树脂柱中的粒扩散和膜扩散,促使黄酮类化合物充分吸附到树脂表面和孔内[18]。因此,选择吸附流速为1 mL/min。
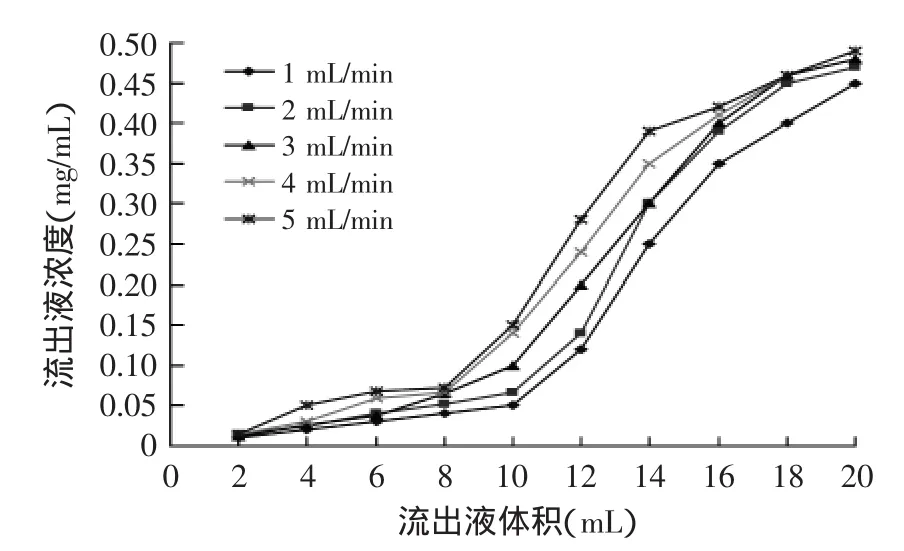
图4 吸附流速对AB-8树脂动态吸附性能的影响Fig.4 Effect of adsorbentvelocities on adsorption capacity of AB-8 resin
2.3.3上样体积的确定由图5可知,当流出液体积从2.0~10.0 mL时,树脂吸附较快,吸附量也随之增加,流出液体积从10.0~24.0 mL,树脂吸附量变化缓慢,24.0 mL以后树脂吸附量基本保持不变,此时吸附达到平衡。选择上样体积为24.0 mL为宜。在等温条件下,荔枝壳总黄酮的质量浓度较小时,有利于其在树脂孔径内扩散,所以荔枝壳总黄酮溶液流过树脂的体积小时,树脂的吸附比较快,而随着荔枝壳总黄酮质量浓度增加,使溶质分子附着在树脂上的吸附密度增大,从而使树脂有效孔径变小,导致了扩散传质阻力的增加[19-20],所以随着树脂荔枝壳总黄酮溶液流过树脂的体积的增加,树脂吸附量也变得缓慢直至吸附饱和。
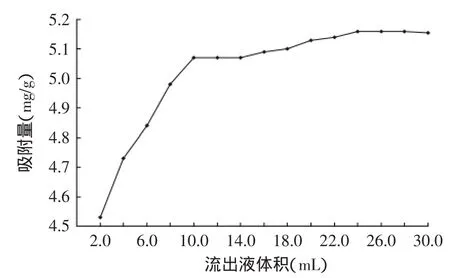
图5 AB-8树脂动态吸附曲线Fig.5 The dynamic adsorption curve of AB-8 resin
2.3.4洗脱剂浓度的确定由图6可见,随着乙醇浓度的增大,解吸率也逐渐升高,当乙醇达到80%时,总黄酮含量最高,解吸率最大,80%之后随着乙醇浓度的增大,解吸率呈降低的趋势,原因可能是因为80%乙醇的极性与荔枝壳黄酮类化合物的极性相近,根据有机化合物相似相溶的原理,80%的乙醇较易溶解树脂上吸附的荔枝壳黄酮类化合物。因此,选用80%乙醇作为洗脱剂。
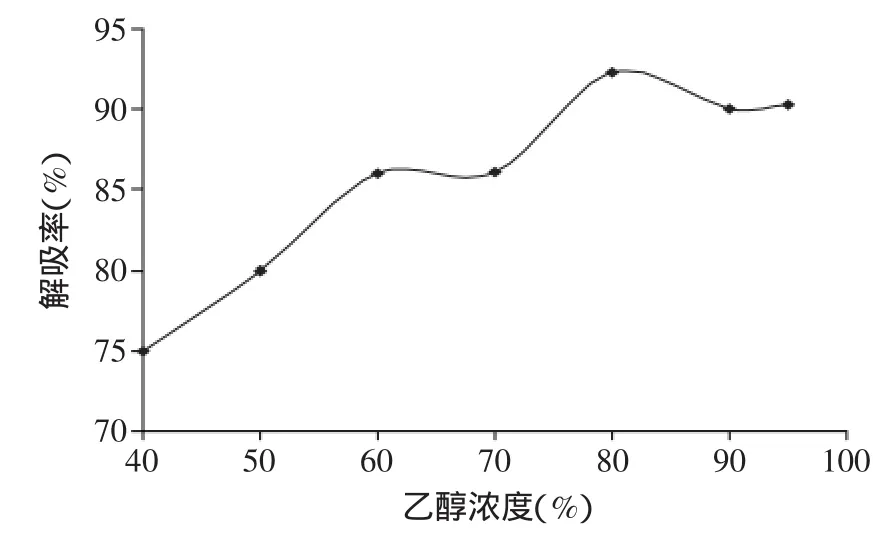
图6 不同洗脱剂浓度的解吸效果Fig.6 The effect of different elution agent concentration of desorption
2.3.5洗脱流速对树脂动态解吸的影响由图7可知,当洗脱流速为1 mL/min时,洗脱峰值相对集中且明显,没有拖尾现象,洗脱效果较好,而随着流速的加快,泄漏点出现较快,解吸不够充分。流速过快,洗脱剂对吸附在树脂上的荔枝壳总黄酮分子未能充分作用,将其从树脂上洗脱下来,解吸性能不能充分发挥。因此,选择洗脱流速为1 mL/min。
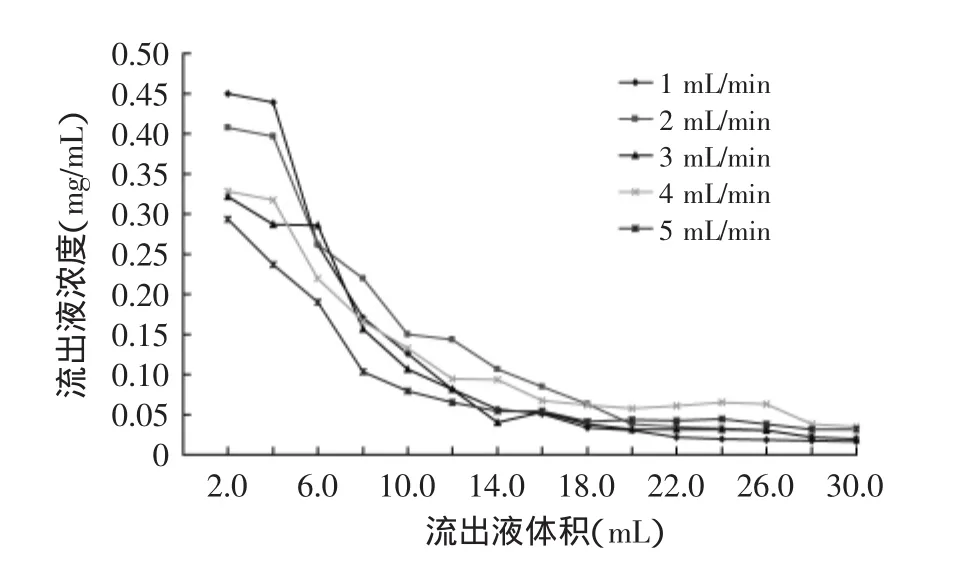
图7 洗脱流速对AB-8树脂动态解吸性能的影响Fig.7 Effect of elution flow rate on adsorption capacity of AB-8 resin
2.3.6洗脱剂用量的确定由图8可知,解吸率随着洗脱剂用量的增加而逐渐提高,当洗脱剂用量达到30.0 mL时,解吸基本达到平衡,再增加乙醇用量解吸率提高不明显,从乙醇用量、成本及时间效率等方面考虑,选择洗脱剂用量为30.0 mL。
2.4验证实验
准确称取处理好的大孔树脂2.00 g,加入0.5 mg/mL样品液24.0 mL,以1 mL/min的流速过柱,收集流出液,测定吸光度值,计算吸附率,加入30.0 mL 80%乙醇溶液以1 mL/min进行洗脱,收集洗脱液,测定吸光度值,计算解吸率。进行三次平行实验,求取平均值。从而验证树脂纯化工艺的可行性及稳定性。结果见表2。
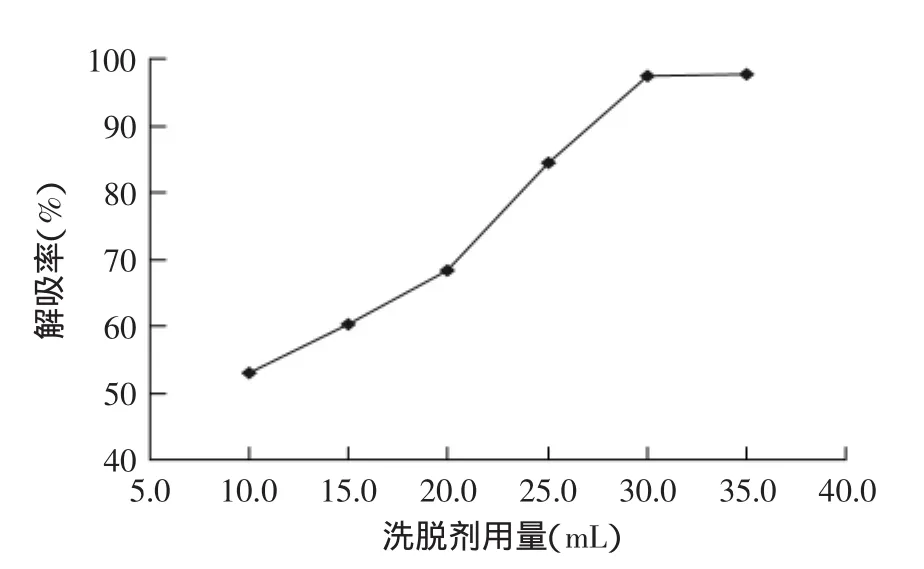
图8 洗脱剂用量对树脂解吸性能的影响Fig.8 The influence of eluent consumption on desorption
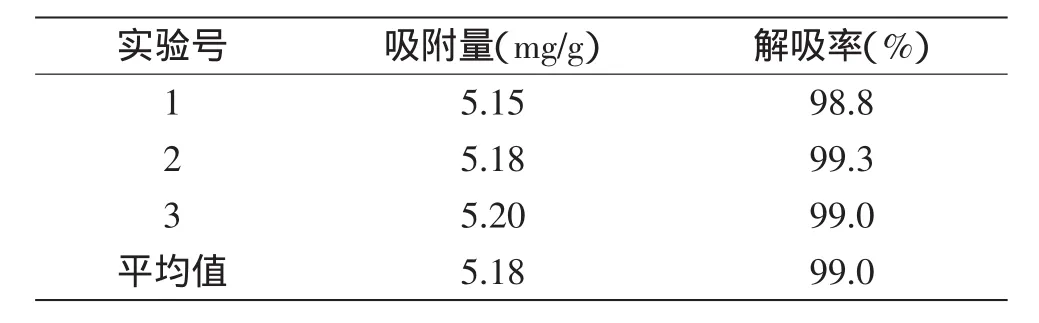
表2 验证实验Table 2 Verification test
由表2可以得知,AB-8树脂纯化荔枝壳总黄酮的吸附量达到5.18 mg/g,解吸率为99.0%。而且吸附与解吸的现象较为稳定,具有可行性。在该条件下,荔枝壳总黄酮的含量为82.7%,荔枝壳总黄酮回收率达92.1%。而回收的树脂颜色较浅,残留物少,用蒸馏水清洗后,基本上可以得到较白的树脂,很方便树脂的再利用。
3 结论
该实验研究利用了大孔吸附树脂对内部沸腾法强化提取的荔枝壳总黄酮进行了纯化,通过静态吸附解吸实验,筛选出AB-8大孔吸附树脂较为适合纯化荔枝壳总黄酮有效成分。进而采用AB-8大孔吸附树脂进行动态吸附解吸实验,得到纯化荔枝壳总黄酮有效成分的最优条件为:以0.5 mg/mL 24.0 mL样品液上柱,吸附流速为1 mL/min,吸附达到平衡后,用30.0 mL浓度为80%乙醇溶液进行洗脱,洗脱流速为1 mL/min。在该工艺条件下,荔枝壳总黄酮的吸附量达5.18 mg/g,解吸率为99.0%,荔枝壳总黄酮回收率达92.1%,含量为82.7%,荔枝壳总黄酮含量约为纯化前的2.6倍。同时通过对树脂外观的观察,可以看出树脂上残留杂质非常少,颜色较浅,方便回收再利用。由此可见,AB-8大孔吸附树脂纯化内部沸腾法获得的荔枝壳总黄酮工艺是有效的,可为荔枝壳的进一步研究提供理论基础,同时,从树脂的回收与利用的角度,推介一种天然产物有效成分的纯化工艺。
[1]胡卓炎,余小林,余恺,等.荔枝加工研究现状与展望[J].中国热带农业,2010(4):37-40.
[2]杨宝,赵谋明,李宝珍,等.荔枝壳活性成分提取工艺条件研究[J].食品与机械,2004,20(6):28-30.
[3]罗艺萍.黄酮类化合物的药理活性研究进展[J].亚太传统医药,2010,6(4):126-128.
[4]杨宝,赵谋明,李宝珍,等.荔枝壳黄酮类物质的醇提工艺[J].食品与发酵工业,2005,31(4):144-146.
[5]涂华,陈碧琼,张燕军.超声波提取荔枝壳总黄酮的工艺研究[J].安徽农业科学,2011,39(14):8350-8352.
[6]涂华,陈碧琼,周锡兰.超声波微波双辅助提取荔枝壳总黄酮工艺优化[J].湖北农业科学,2013,52(12):2880-2882.
[7]阮尚全,宋秋菊,何慧蓉,等.超声波协同酶法提取荔枝壳中总黄酮及抗氧化性[J].四川师范大学学报:自然科学版,2014,37(4):574-578.
[8]涂华,陈碧琼,周锡兰.荔枝壳总黄酮大孔树脂纯化工艺研究[J].安徽农业科学,2012,40(15):8738-8739,8781.
[9]Chen Xiao-guang,Wei Teng-you,Peng Meng-wei,et al. Optimization,Kinetics,and Thermodynamics in the extraction Process of Puerarin by Decompressing Inner Ebullition[J]. Industrial&Engineering Chemistry Research(Ind.Eng.Chem. Res),2012,51:6841-6846.
[10]陈晓光,韦藤幼,彭梦微,等.丹参酚酸B减压内部沸腾法提取的动力学及相关热力学研究[J].高校化学工程学报,2011,25(6):961-965.
[11]韦藤幼,王飞,刘晓辉,等.内部汽化渗漉提取植物有效成分的方法[P].中国:CNCN200610035486,2006-12-20.
[12]彭梦微,韦藤幼,陈晓光,等.大孔树脂纯化穿心莲内部沸腾提取液的工艺研究[J].中成药,2012,34(1):172-175.
[13]郑韵英,童张法,韦滕幼.内部沸腾法提取银叶树叶中总黄酮的研究[J].广西大学学报:自然科学版,2013,38(3):527-531.
[14]赵芳春,赵兵,黄云祥.大孔吸附树脂纯化芦笋皂苷工艺优化[J].食品工业科技,2012,33(18):248-252.
[15]李晨,姜子涛,李荣.大孔吸附树脂纯化樱桃叶中总黄酮的研究[J].食品科技,2012,37(9):212-217.
[16]何彦峰,杨仁明,胡娜,等.大孔吸附树脂纯化枸杞总黄酮的研究[J].食品工业科技,2012,33(18):274-278.
[17]单方方.牡丹叶总黄酮的分离纯化及抗氧化性研究[D].河南:河南科技大学,2011.
[18]陈丛瑾,黄克瀛,李姣娟,等.大孔吸附树脂分离纯化香椿叶总黄酮的研究[J].离子交换与吸附,2008,24(4):335-344.
[19]Chen W D,Dong X Y,Sun Y.Analysis of diffusion models for protein adsorption[J].J Chromatography A,2002,962:29-40.
[20]宋应华,朱家文,陈葵,等.红霉素在大孔树脂上的吸附动力学研究[J].高校化学工程学报,2008,22(1):23-27.
Purification technology research of total flavonoids in Litchi Pericarp by macroporous resin
ZHENG Yun-ying1,WEI Teng-you2
(1.College of Petroleum and Chemical Engineering,Qinzhou University,Qinzhou 535099,China;2.School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China)
In order to purify of total falconoids in Litchi Pericarp,the Litchi Pericarp extraction was obtained by inner boiling method.And the purification research of the Litchi Pericarp extraction was carried out by macroporous resin,The results showed that the best macroporous resin was AB-8 to purify total flavonoids in Litchi Pericarp.And the optimal purification process of sample concentration was 0.5 mg/mL,the amount was 24.0 mL;the adsorption velocity of 1 mL/min,the elution concentration of 80%ethanol solution,and the elution volume was 30.0 mL,the elution flow rate was 1 mL/min.Under the process conditions,the adsorption amount of flavonoids from Litchi Pericarp was 5.18 mg/g,the desorption rate was 99.0%,the content of total flavonoids in Litchi Pericarp increased from 31.4%to 82.7%.The recovery rate of total flavonoids as 92.1%.AB-8 macroporous resin purified extractions by inner ebullition method could effectively improve the purification effect was good.And the resin was recovered and utilized more convenient.
macroporous resin;inner boiling;purification;total flavonoids in Litchi Pericarp
TS255.1
B
1002-0306(2015)18-0271-05
10.13386/j.issn1002-0306.2015.18.046
2014-12-19
郑韵英(1983-),女,硕士,实验师,研究方向:精细化工,E-mail:zhengyunying921@126.com。
广西高校科学技术研究项目(2013LX158)。
