煎饼发酵面糊中酵母菌的鉴定及保护剂配方的优化
2015-11-04唐明礼何余堂惠丽娟渤海大学化学化工与食品安全学院渤海大学粮油科学与技术研究所辽宁锦州121013
唐明礼,王 勃,刘 贺,何余堂,惠丽娟,马 涛(渤海大学化学化工与食品安全学院,渤海大学粮油科学与技术研究所,辽宁锦州121013)
煎饼发酵面糊中酵母菌的鉴定及保护剂配方的优化
唐明礼,王勃,刘贺,何余堂,惠丽娟,马涛*
(渤海大学化学化工与食品安全学院,渤海大学粮油科学与技术研究所,辽宁锦州121013)
从煎饼发酵面糊中分离筛选出具有当地特色及自然发酵煎饼风味的酵母菌菌株。其中Y8生长迅速且耐酸性强,采用VITEC-2 compact微生物鉴定仪对其进行鉴定,并对其制备冻干菌发酵剂的保护剂进行筛选和优化。结果表明,煎饼发酵面糊中酵母菌为酿酒酵母菌,保护剂优化配方:甘油4.0%、海藻糖1.3%、脱脂乳12.7%,在此优化条件下,酿酒酵母菌的存活率可达82%,为传统食品的连续化、工业化生产提供依据。
酵母菌,鉴定,保护剂,配方优化
煎饼是我国传统食品之一,深受国人喜爱。制作过程中沿用自然发酵面糊进行生产,造成产品质量不稳定,难于实现标准化工业生产。
直投式发酵剂是对优势菌种进行高密度培养,然后进行真空冷冻干燥制成的高活性菌体产品,具有菌种保质期长、活性高、接种量少、产品质量稳定等优点,广泛应用于面包、泡菜、发酵奶制品等食品工业中[1-3]。冻干过程可导致冰晶的形成、细胞膜通透性的改变、敏感蛋白的变性与失活等,从而导致微生物的死亡。通过添加多糖、羟基化合物、蛋白质、聚合物等保护剂能够降低结晶率、提高最大冻结浓缩液的玻璃化转变温度,提高冻干菌的存活率[4-7]。国内采用VITEC-2 compact微生物鉴定仪对菌种的鉴定及酵母菌冷冻干燥保护剂方面的研究鲜有报道,王华等[8]对热带假丝酵母进行了保护剂配方的优化研究,在最佳条件下,热带假丝酵母的存活率可达82.7%。
酵母菌冻干发酵剂具有含菌量高、活力强、体积小等优点,可减少煎饼等传统发酵食品的生产成本,提高产品的食用安全性,有利于煎饼的工业化及连续化生产。目前,关于酵母菌的冻干保护剂发面的研究以及VITEC-2 compact微生物鉴定仪对菌种鉴定方面的研究比较少。
本文对煎饼发酵面糊中的酵母菌进行鉴定,通过单因素实验和响应面法优化保护剂配方,以期为煎饼产品工业化生产奠定基础。
1 材料与方法
1.1材料与仪器
酵母菌由实验室分离保藏;海藻糖、甘氨酸、聚乙二醇分析纯,国药集团化学试剂有限公司;甘油食品级,连云港友进食品添加剂技术开发有限公司;脱脂乳食品级,黑龙江完达山乳业股份有限公司;乳糖分析纯,天津市化学试剂工厂;葡萄糖分析纯,天津市天利化学试剂有限公司;蔗糖食品级,龙舟南华糖业有限公司;硫酸锰分析纯,天津市致远化学试剂有限公司;YEPD培养基北京奥博星生物技术有限责任公司;YST鉴定卡片法国梅里埃。
VITEC-2 compact微生物鉴定仪法国梅里埃;FreeZone台式真空冷冻干燥机上海珂淮仪器有限公司;Biofuge Stratos高速冷冻离心机美国THERMO;GMSX-280型手提式压力蒸汽灭菌器北京市永光明医疗仪器有限公司;SW-CJ-2FD型无菌操作台苏州安泰空气技术有限公司;DHP-9082型电热恒温培养箱上海一恒科学仪器有限公司;HH-6型数显恒温水浴锅金坛市鑫鑫实验仪器厂;AR224CN型电子天平奥豪斯仪器(上海)有限公司制造;MDF-382E(CN)型超低温冰箱日本三洋。
1.2实验方法
1.2.1菌株的生长曲线将分离的菌株以2%(v/v)的接种量接种于250 mL的液体培养基中,在28℃恒温培养箱中培养,每2 h取出培养液,以未接种的培养基为空白对照。分别在波长660 nm处测量吸光值,以时间为横坐标,菌液吸光度为纵坐标,观察菌株的生长曲线。
1.2.2菌株的耐pH实验将酵母菌接入YEPD液体培养基中,将培养基的pH分别调为2.5、3、3.5、4和4.5。按2%接种量接入活化好的酵母菌,以时间为横坐标,菌液吸光度为纵坐标,观察酵母菌的生长曲线。考察各菌株对pH的耐受性。
1.2.3VITEC-2 compact微生物鉴定仪对酵母菌的鉴定酵母菌菌种在4℃的条件进行保藏,测试前将YEPD固体培养基上的单菌落悬浮于0.45%的灭菌生理盐水中,并用浊度仪确定浊度为1.8~2.2,将YST卡片插入此菌悬浮液中进行鉴定。YST卡片首先进入填充仓进行填充,使菌悬液进入卡片试剂中,填充完成将卡片放入切片分装仓,仪器进行自动切片、封装,将卡打入孵育仓,此后仪器每15 min自动读卡检测一次,检测完毕后将自动打印报告单。
1.2.4工艺流程斜面菌株→活化→扩大培养→离心浓缩→制备菌悬液→活菌计数→加入保护剂→预冻→真空冷冻干燥→产品→活菌计数。
1.2.5单一保护剂的制备与选择将保护剂按照表1中相应的浓度进行配制,在121℃、15 min的条件下灭菌备用。以生理盐水为对照,测定冻干前后活菌数,计算存活率。
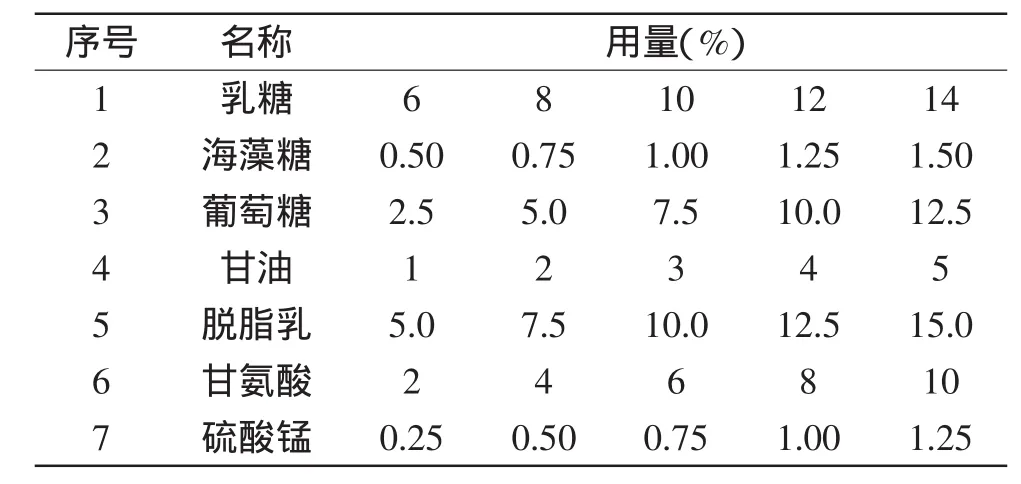
表1 保护剂的种类与用量Table 1 The type and amount of protective agent
1.2.6菌体的培养与收集将斜面上的菌株接种至含有YEPD液体培养基的三角瓶中,28℃静置培养12 h,将10 mL菌液加入到100 mL YEPD液体培养基中进行扩培,使培养液的含菌量达到108CFU/mL。将培养液以8000 r/min、4℃的条件下离心10 min,弃去上清液,以一定量的无菌生理盐水清洗菌泥。
1.2.7真空冷冻干燥在无菌的条件下,菌液与保护剂的比例为1∶1条件混合,保护剂与酵母菌悬液平衡时间为30 min,-70℃预冻2 h,之后进行真空冷冻干燥。冷冻干燥的参数:220 Pa、-50℃。
1.2.8冻干前后活菌数的计算将酵母菌离心后的悬浮液和冻干后的菌粉梯度稀释,平板计数法记录菌落数[9]。
1.2.9存活率的计算实验结果以存活率表示,分析真空冷冻干燥对酵母菌的影响[10-11]。
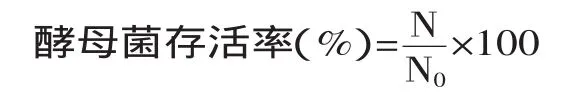
式中,N:真空冷冻干燥后酵母菌的数量;N0:真空冷冻干燥前酵母菌的数量。
1.2.10响应面分析在单因素实验结果的基础之上,采用Box-Behnken实验设计方案,以甘油、海藻糖、脱脂乳为考察变量,分别以X1、X2、X3表示,以存活率Y为响应值,因子编码及各自变量水平见表2。

表2 实验因素水平及编码Table 2 Code and level of factors chosen for the trials
1.3数据处理
应用Design Expert 8.0.6软件进行数据处理,p<0.05认为具有显著差异。
2 结果与分析
2.1菌株的生长曲线

图1 酵母菌的生长曲线Fig.1 Growth curve of yeast
从煎饼发酵面糊中分离筛选11种酵母菌,分别对其编号为Y1~Y11。图1为煎饼发酵面糊中典型酵母菌的生长曲线,0~2 h内5株酵母菌生长较缓慢,菌体需要一定时间来自身的生理机能以适应新环境,此阶段为缓慢期;在2~14 h内所有菌株适应新环境后,细胞开始旺盛生长,生长速率达到最大值,菌株进入对数生长期,OD值持续上升,Y8的OD值较大,生长迅速,最大可达2.12。
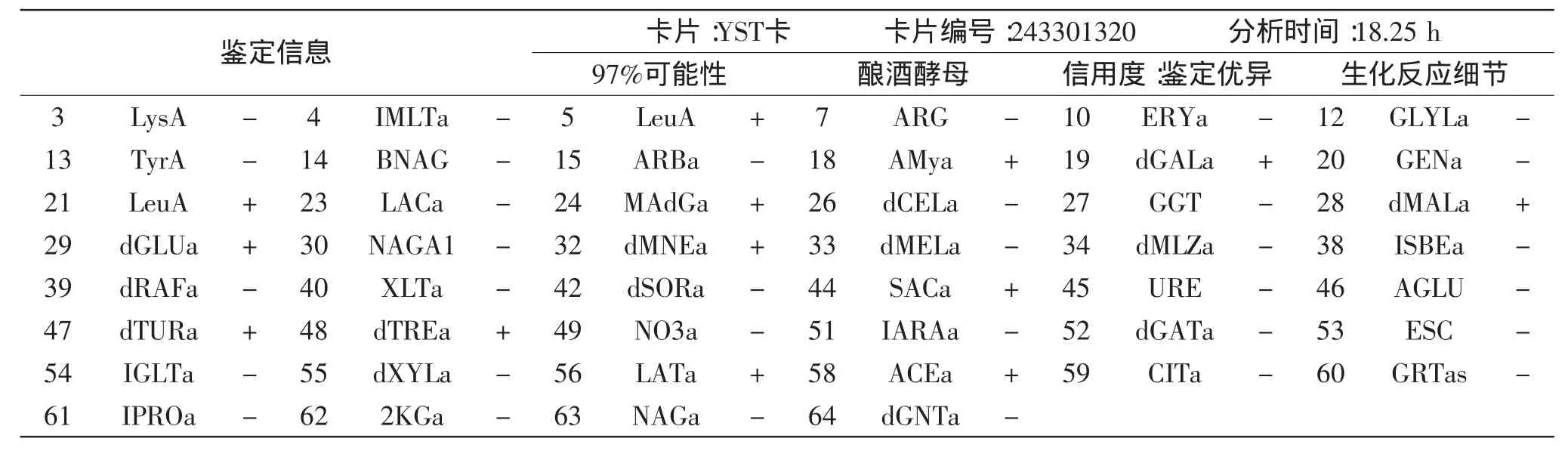
表3 VITEC-2 compact微生物鉴定仪对酵母菌的鉴定Table 3 VITEC-2 compact microbial identification system for identification of yeasts
2.2菌株的耐pH实验
对于煎饼发酵剂的选择不能仅立足于功能特性,要具备适应不同环境的能力。由于煎饼面糊是由酵母菌和乳酸菌共同发酵,发酵过程中乳酸菌会使面糊的pH降低,所以对酵母菌进行耐酸性筛选。图2为pH对酵母菌的影响,随pH增加,酵母菌生长迅速,较低pH时,所有酵母菌生长受到抑制,Y8菌株表现出良好的耐受性,故选取Y8作为直投式发酵剂菌株,用于煎饼的连续化生产。
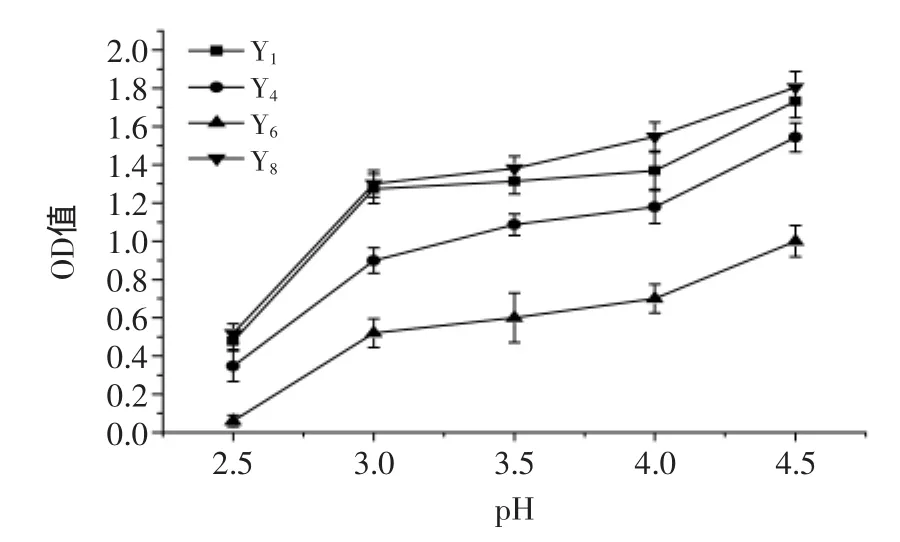
图2 pH对酵母菌的影响Fig.2 The effect of pH on yeast
2.3VITEC-2 compact微生物鉴定仪对煎饼发酵面糊中酵母菌的鉴定
表3为VITEC-2 compact微生物鉴定仪对酵母菌的鉴定结果。使用浊度仪将酵母菌的菌悬液浊度调为1.96,经过18.25 h的鉴定,鉴定结果为酿酒酵母菌,可能性百分比为97%。
2.4单一保护剂对酿酒酵母菌冻干存活率的影响
若将酵母菌直接进行冷冻干燥,将近93%的菌体直接死亡,因此应选择能提高菌种冷冻干燥过程存活率的冷冻保护剂。单一保护剂对酿酒酵母菌的保护作用见表4,在没有添加保护剂时,酿酒酵母菌的存活率只有7.2%,添加保护剂后,酿酒酵母菌的存活率均有不同程度的增加,说明保护剂对酿酒酵母菌具有一定的保护作用。
甘油对酵母菌的保护作用最佳,最大存活率的可达64%,甘油通过与结合水发生水化作用,增加溶液的粘度,可防止冰晶的形成,故提高了酿酒酵母在冷冻干燥过程中的存活率[12]。其次是海藻糖和脱脂乳,其作用效果与王华和曾小群等研究者相似[8,10]。糖类对的保护作用是冻干过程可取代水分子与磷脂双分子层的极性基团形成氢键,防止了磷脂双分子层的相变,保护了细胞膜的完整性[13]。Lodato等[14]也认为酵母菌处于高温、脱水、冷冻等环境胁迫条件下,海藻糖对酵母菌具有较好的保护作用。脱脂乳的保护作用是脱脂乳中含有乳糖,同时乳中的胶体物质也提高了玻璃化转变温度[15]。甘氨酸对酵母菌的保护作用不明显。基因位点筛选和基因分析显示当酿酒酵母菌受到高渗环境胁迫时,细胞内会增强甘油和海藻糖的的代谢,这两种代谢也被称为渗透保护剂代谢[16-17]。尽管各保护剂对酵母菌具有一定的保护作用,但保护作用有限,故选用甘油、海藻糖和脱脂乳三种保护剂进行复配实验,以期得到较好的存活率。
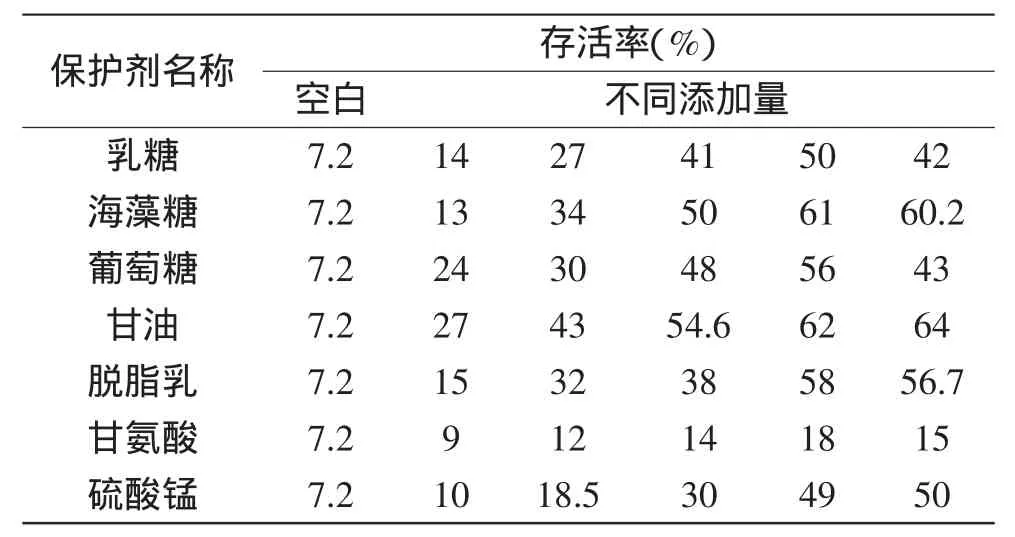
表4 单一保护剂对酿酒酵母菌冻干存活率的影响Table 4 The effect of a single protective agent on survival rate of Saccharomyces cerevisiae
2.5模型的建立及显著性检验
表5列出酿酒酵母菌冻干存活率的实测值及预测值。
利用Design Expert软件对表5中的数据进行多元回归分析,得到甘油(X1)、海藻糖(X2)、脱脂乳(X3)的二次回归方程为:Y=82.40+1.95X1+5.26X2-0.24X3-0.65X1X2-0.75X1X3+0.58X2X3-5.26X12-4.79X22-4.79X32。并对该模型进行方差分析及模型系数显著性检验,见表6、表7。
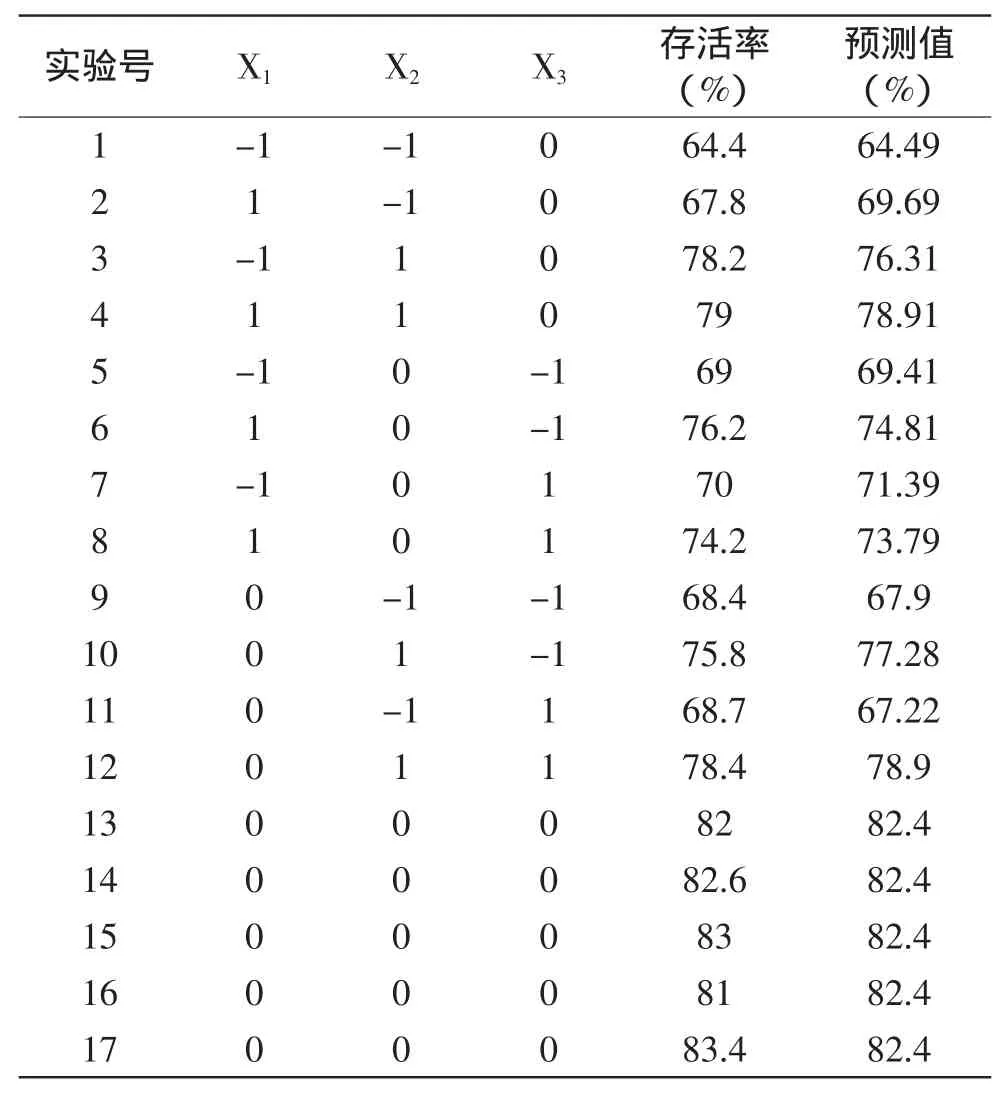
表5 实验设计及其结果Table 5 Experimental designs and results

表6 真空冷冻干燥对酿酒酵母菌存活率回归模型的方差分析结果Table 6 Analysis of variance for regression equation of Saccharomyces cerevisiae survival rate of vacuum freeze-drying
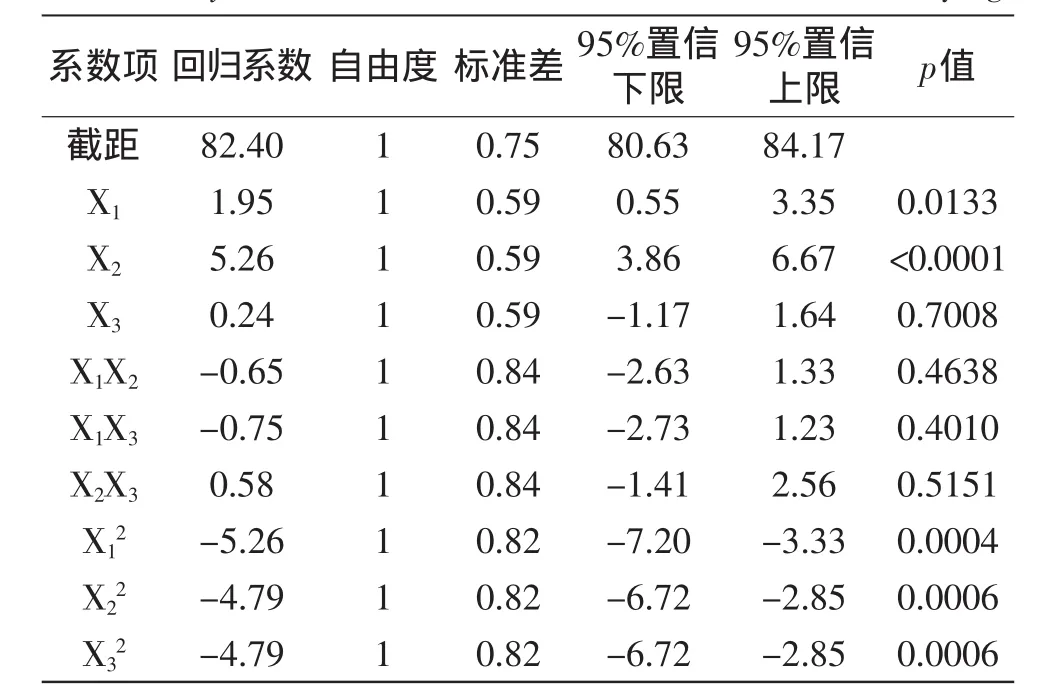
表7 回归方程系数显著性检验Table 7 Test of significance for regression coefficient of Saccharomyces cerevisiae survival rate of vacuum freeze-drying
由表6方程回归模型方差分析(ANOVA)可得,F=23.83>F0.01(9,4)=14.66,p为0.0002,表明模型方程极显著。失拟项p=0.0562>0.05,不显著。模型的校正决定系数(R2adj)为0.9278,说明该模型能解释92.78%响应值的变化,该方程与实际拟合的较好,能有效反映酿酒酵母菌存活率与甘油、海藻糖、脱脂乳之间的关系,因此所得的方程能预测响应值随各参数的变化规律。
从表7的回归方程系数显著性检验可知,一次项中X1(p<0.05)的偏回归系数显著,X2(p<0.01)的偏回归系数极显著,说明甘油和海藻糖对酿酒酵母菌的存活率影响显著,X3(p>0.05)的偏回归系数不显著,说明脱脂乳对酿酒酵母菌的存活率影响不显著。交互项的交互作用对存活率影响不显著。综合上述分析得知,各因素对响应值的影响程度为X2(海藻糖)>X1(甘油)>X3(脱脂乳)。
2.6保护剂对酿酒酵母菌存活率的响应面分析

图3 甘油、海藻糖及其相互作用对酿酒酵母菌存活率的响应面和等高线图Fig.3 Response surface plot and its contour plot showing the effects of glycerin,trehalose and their mutual interactions on Saccharomyces cerevisiae survival rate
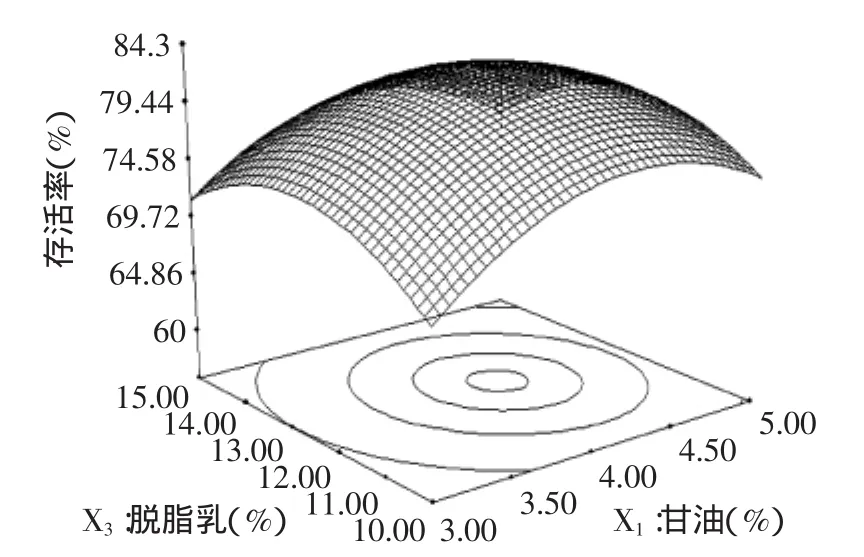
图4 甘油、脱脂乳及其相互作用对酿酒酵母菌存活率的响应面和等高线图Fig.4 Response surface plot and its contour plot showing the effects of glycerin,skim milk and their mutual interactions on Saccharomyces cerevisiae survival rate
图3~图5为Design-Expert软件对回归方程构建响应面分析图。图3为脱脂乳12.5%,甘油和海藻糖对酿酒酵母菌存活率的影响,根据等高线可看出固定海藻糖含量,在甘油3%~4.1%范围内,酿酒酵母菌的存活率与甘油的用量成正比,在4.1%~5%范围内,存活率与甘油的用量成反比,固定甘油用量,在1%~1.38%范围内,酿酒酵母菌存活率与海藻糖用量成正比。图4为海藻糖1.25%,甘油和脱脂乳对酿酒酵母菌存活率的影响,根据等高线可看出,在甘油含量3%~5%,脱脂乳10%~12.5%时,固定甘油含量,酿酒酵母菌存活率随脱脂乳含量的增加而增加。图5为甘油含量4%,海藻糖和脱脂乳对酿酒酵母菌存活率的影响,固定脱脂乳含量,在海藻糖含量1%~1.4%时,酿酒酵母菌存活率随海藻糖含量的增加而增加,在1.4%~1.5%含量时,酿酒酵母菌存活率随海藻糖含量的增加而降低。
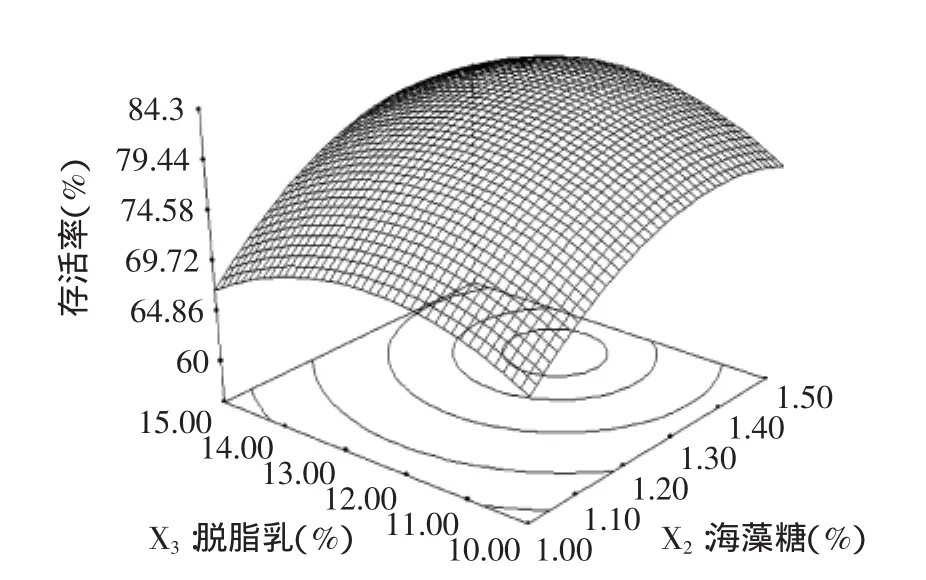
图5 海藻糖、脱脂乳及其相互作用对酿酒酵母菌存活率的响应面和等高线图Fig.5 Response surface plot and its contour plot showing the effects of trehalose,skim milk and their mutual interactions on Saccharomyces cerevisiae survival rate
2.7酿酒酵母菌保护剂最佳配方的确定
在选取的各范围内,根据回归模型通过Design Expert软件分析优化得出,酿酒酵母菌保护剂最佳配方为甘油4.0%、海藻糖1.3%、脱脂乳12.7%,在此优化条件下,酿酒酵母菌的存活率可83%。为证实实验结果,用实验中得到的最佳配方重复实验3次并取平均值,酿酒酵母菌存活率可达82%,与预测值基本一致,说明该方程与实际情况拟合的较好,充分验证了模型的正确性。
3 结论
通过发酵面糊中酵母菌的生理及耐受性实验,Y8酵母菌具有良好的生长特性及耐受性,采用VITEC-2 compact微生物鉴定仪对其鉴定结果为酿酒酵母菌。通过单因素实验,海藻糖、脱脂乳、甘油三种保护剂对冻干过程酿酒酵母保持活性效果较好;通过响应面法得到复合保护剂配方:甘油4.0%、海藻糖1.3%、脱脂乳12.7%,在此优化条件下,酿酒酵母菌的存活率可达82%,为煎饼等传统食品的工业化生产奠定了基础。
[1]刘冬梅,李理,梁世中,等.直投式酸奶发酵剂研究进展[J].中国乳品工业,2005,33(1):29-33.
[2]李家鹏,张学刚,乔晓玲,等.响应面法优化植物乳杆菌冷冻干燥保护剂配方的研究[J].食品科学,2008,29(6):146-150.
[3]吴荣荣,张柏林.直投式酸奶发酵剂的发酵工艺及其优化[J].食品科学,2006,27(2):178-181.
[4]Jagannath A,Raju P S,Bawa A S.Comparative evaluation of bacterial cellulose nata as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J].LWT-Food Science and Technology,2010,43(8):1197-1203.
[5]Strasser S,Neureiter M,Geppl M,et al.Influence of lyophilization,fluidized bed drying,addition of protectants,and storage on the viability of lactic acid bacteria[J].Journal of Applied Microbiology,2009,107(1):167-177.
[6]Schoug A,Olsson J,Carlfors J,et al.Freeze-drying of Lactobacillus coryniformis Si3—effects of sucrose concentration,cell density,and freezing rate on cell survival and thermophysical properties[J].Cryobiology,2006,53(1):119-127.
[7]Streeter J G.Effect of trehalose on survival of Bradyrhizobium japonicum during desiccation[J].Journal of Applied Microbiology,2003,95(3):484-491.
[8]王华,贺金梅.中心组合设计优化热带假丝酵母菌冷冻干燥保护剂[J].食品科学,2013,34(1):244-247.
[9]中华人民共和国卫生部.GB 4789.15-2010食品安全国家标准食品微生物学检验霉菌和酵母计数[S].2010.
[10]曾小群,潘道东,包红燕,等.干酪乳杆菌冻干保护剂研究[J].中国食品学报,2013,13(1):44-50.
[11]YANG C,ZHU X,FAN D,et al.Optimizing the Chemical CompositionsofProtectiveAgentsforFreeze-drying Bifidobacterium longum BIOMA 5920[J].Chinese Journal of Chemical Engineering,2012,20(5):930-936.
[12]Li-li P,Ning L,Ying-hua Z,et al.The Research Development of Cryoprotector of Lactic Acid Bacteria and its Protective Mechanism[J].Guangzhou Food Science and Technology,2005,1:147-149.
[13]Crowe J H,Hoekstra F A,Crowe L M.Anhydrobiosis[J]. Annual Review of Physiology,1992,54(1):579-599.
[14]Lodato P,De Huergo M S,Buera M P.Viability and thermal stability of a strain of Saccharomyces cerevisiae freeze-dried in different sugar and polymer matrices[J].Applied Microbiology and Biotechnology,1999,52(2):215-220.
[15]Jagannath A,Raju P S,Bawa A S.Comparative evaluation of bacterial cellulose as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J].LWT-Food Science and Technology,2010,43(8):1197-1203.
[16]Cronwright G R,Rohwer J M,Prior B A.Metabolic control analysis of glycerol synthesis in Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology,2002,68(9):4448-4456.
[17]Ando A,Tanaka F,Murata Y,et al.Identification and classification of genes required for tolerance to high-sucrose stress revealed by genome-wide screening of Saccharomyces cerevisiae[J].FEMS Yeast Research,2006,6(2):249-267.
Identification of yeast in fermented pancake batter and optimization formulations of protection agent
TANG Ming-li,WANG Bo,LIU He,HE Yu-tang,HUI Li-juan,MA Tao*
(College of Chemistry,Chemical Engineering and Food Safety,Bohai University,Grain and Oil Science and Technology Institute of Bohai University,Jinzhou 121013,China)
Yeast strain with local characteristics and naturally fermented pancake flavor were isolated and screened from pancake fermented batter,Y8had rapid growth and strong acid resistance,which was identified by VITEC-2 compact microbial identification system and prepared freeze-dried bacteria ferment whose protective agent was screened and identified.The results showed that yeast of fermented pancake batter was Saccharomyces cerevisiae,optimized formulation of cryoprotectant was glycerin 4.0%,trehalose 1.3%,skim milk 12.7%.Under these conditions,the survival rate of Saccharomyces cerevisiae could reach 82%,the study provided support for continuous and industrial production of traditional foods.
yeast;identification;protective agent;formulation optimization
TS201.1
A
1002-0306(2015)18-0219-05
10.13386/j.issn1002-0306.2015.18.035
2014-12-05
唐明礼(1988-),男,在读硕士研究生,研究方向:农产品加工与贮藏,E-mail:707334794@qq.com。
马涛(1962-),男,教授,研究方向:粮油与植物蛋白工程,E-mail:1040732408@qq.com。
