耐热乳酸菌的筛选及其β-半乳糖苷酶性质分析
2015-11-04李梦菲孙庆惠杨洪江工业微生物教育部重点实验室天津市工业微生物重点实验室天津科技大学生物工程学院天津300457天津双联科鑫生物科技有限公司天津300403
李梦菲,孙庆惠,张 彦,杨洪江,*(.工业微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457;.天津双联科鑫生物科技有限公司,天津300403)
耐热乳酸菌的筛选及其β-半乳糖苷酶性质分析
李梦菲1,孙庆惠1,张彦2,杨洪江1,*
(1.工业微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457;2.天津双联科鑫生物科技有限公司,天津300403)
本研究从鸡粪样品中分离高产β-半乳糖苷酶的耐热乳酸菌,经16S rRNA序列鉴定,分离得到的6株菌株均为罗伊氏乳杆菌(Lactobacillus reuteri)。初步分析分离菌株所产β-半乳糖苷酶,其最适pH均为6.5。热稳定性实验发现,菌株MF1567产生的β-半乳糖苷酶在55℃温育1 h,仍保持51.2%的酶活力。分析菌株MF1567的β-半乳糖苷酶氨基酸序列和蛋白质结构,发现该菌株中β-半乳糖苷酶LacZ存在22个氨基酸替代,其二级结构α-螺旋的比例较高(26.5%)。结果显示,蛋白质一级和二级结构的改变可能是该酶具有较好耐热性的原因。
乳酸菌,β-半乳糖苷酶,耐热,氨基酸序列
乳糖是乳及乳制品中特有的糖类,是人体正常代谢和生长发育的能量来源之一。人体摄入乳糖后,存在于小肠粘膜绒毛膜表面的β-半乳糖苷酶(betagalactosidase,EC3.2.1.23)将乳糖水解成葡萄糖和半乳糖,从而被人体吸收利用。当人体缺乏β-半乳糖苷酶或酶活力较低时,乳糖不能被消化吸收,滞留在肠道,从而导致人体出现肠胀气、肠痉挛、腹泻等症状,称为乳糖不耐症(Lactose Intolerance,LI)[1]。我国β-半乳糖苷酶缺乏的发生率为75%~95%,在0~6岁儿童中的发生率为47%,而且发生率随儿童年龄的增加而上升[2-3]。利用β-半乳糖苷酶水解乳糖的能力生产低乳糖乳制品能有效消除人体对乳糖的不耐受症状,是目前β-半乳糖苷酶在食品工业中最主要的用途[4]。
1998年我国食品添加剂标准委员会正式确定β-半乳糖苷酶为食品添加剂新品种,β-半乳糖苷酶进入工业化生产阶段。微生物由于具有生长迅速、代谢效率高等特性,而成为商品β-半乳糖苷酶的主要来源。在实际工业生产中,利用热稳定的中性β-半乳糖苷酶生产低乳糖乳制品不仅能有效防止微生物污染,还能缩短生产周期。然而,商业化的产酶菌株必须是美国FDA认定的GRAS(generally regarded as safe)安全菌株。乳酸菌(lactic acid bacteria,LAB)作为公认的食品级微生物,其产生的β-半乳糖苷酶被认为具有工业应用潜力。目前,人们已筛选出多株产β-半乳糖苷酶的乳酸菌菌株,如嗜热链球菌(Streptococcus thermophilus)、卷曲乳杆菌(Lactobacillus crispatus)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii ssp.bulgaricus)和乳酸乳球菌(Lactococcus lactis)等[5]。然而,大多数乳酸菌合成的β-半乳糖苷酶都不具有热稳定性。异源表达卷曲乳杆菌(Lactobacillus crispatus)β-半乳糖苷酶基因,获得的重组β-半乳糖苷酶在50℃温育30 min后几乎失去全部活力[6]。嗜酸乳杆菌(Lactobacillus acidophilus)R22合成的β-半乳糖苷酶已被证明可用于乳品工业,但该酶仅在4℃最稳定,也不具有热稳定性[7]。
鸡肠道中有着丰富的微生物菌群,乳酸杆菌是鸡肠道中的优势菌群,成熟的鸡肠道中大约70%的微生物是乳酸杆菌[8-9]。此外,禽类的正常体温略高于其他动物,因此本文选择从鸡粪样品中筛选能够产生耐热β-半乳糖苷酶的乳酸菌,对高产酶的耐热菌株进行了鉴定,对其酶学性质进行了测定,并对其β-半乳糖苷酶编码基因进行了同源性分析,以期为β-半乳糖苷酶的应用奠定基础。
1 材料与方法
1.1材料与仪器
新鲜鸡粪从北京周边地区的3个养鸡场采集新鲜鸡粪样品共11份;邻硝基苯β-D-半乳吡喃糖苷(ONPG,超纯级)、β-巯基乙醇(生化级) 北京鼎国生物技术有限公司;5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal) Promega公司;乳糖分析纯,北京奥博星生物技术有限公司;PCR缓冲液(超纯级)、Taq DNA聚合酶(超级纯)、三磷酸碱基脱氧核苷酸(dNTPs,超级纯) 上海生工生物工程有限公司;Z-buffer(pH7.0) 磷酸氢二钠16.68 g,磷酸二氢钠5.64 g,氯化钾0.745 g,硫酸镁0.246 g,用双蒸水溶解,定容到1000 mL,使用前加β-巯基乙醇2.7 mL;分离、纯化培养基(g/L)蛋白胨10,牛肉膏8,酵母浸粉4,乳糖20,乙酸钠5,柠檬酸三铵2,硫酸镁0.2,磷酸二氢钾2,Tween-80 1 mL,硫酸锰0.05,琼脂15,pH5.0;乳糖-MRS(L-MRS)培养基(g/L) 蛋白胨10,牛肉膏8,酵母浸粉4,乳糖20,乙酸钠5,柠檬酸三铵2,硫酸镁0.2,磷酸二氢钾2,Tween-80 1 mL,硫酸锰0.05,pH6.4。
752紫外光栅分光光度计上海精密科学仪器有限公司;TDA-8002型水浴锅天津市中环实验室电炉有限公司;电热恒温培养箱赛默世尔科技公司;PCR基因扩增仪美国BIO-RAD公司;pH计Mettler-Toledo公司。
1.2实验方法
1.2.1产β-半乳糖苷酶耐热乳酸菌的分离分别称取不同鸡粪样品1 g至盛有9 mL灭菌生理盐水的试管中,充分振荡混匀后,放入50℃水浴锅中温育2 h。将热处理的鸡粪样品液稀释至10-3,取稀释度为10-1、 10-2、10-3的菌悬液各100 μL涂布在含有20 mg/mL X-gal的分离培养基上,35℃培养至长出菌落。挑取蓝色菌落、编号并进行纯化。
将纯化的单菌落接种至含有5 mL L-MRS液体培养基的试管中,35℃静置培养10 h后转接二级种子,二级种子经35℃静置培养12 h后转接至L-MRS发酵培养基(100 mL/250 mL),接种量均为1%。取1 mL各菌株的发酵液至试管中,加入3 mL Z-buffer,混匀后加入80 μL氯仿,充分振荡后在50℃温育2 h,在37℃分别测定温育前后的β-半乳糖苷酶活力。
1.2.2β-半乳糖苷酶活力的测定β-半乳糖苷酶活力的测定方法主要参考文献的方法进行[10-11]。取1 mL发酵液至试管中,加入3 mL Z-buffer,混匀后加入80 μL氯仿充分振荡,在37℃水浴条件下加入800 μL ONPG(4 mg/L)并开始计时,观察溶液变成黄色时,立即加入1 mL 1 mol/L Na2CO3终止反应,12000 r/min离心3 min,取上清液测定OD420。
β-半乳糖苷酶活力单位(U)定义为:在实验条件下以1 μmol/min的速率释放邻硝基酚(ONP)所需的酶量。
计算公式:β-半乳糖苷酶活力(U/g)=(OD420×f× V)/(4.5254×t×m),其中:f为粗酶液稀释倍数;V为反应体积(mL);4.5254为420 nm处1 μmol/mL ONP的吸光度,即ONP标准曲线的斜率;t为反应时间(min);m为1 mL发酵液中的菌体干重(g)。
相对酶活力(%)定义为:以不同条件下测定的最大酶活力为100%,不同条件下测定的酶活力与最大酶活力的比率。
1.2.3分离菌株的分子鉴定收集35℃静置培养12 h的菌体细胞,按参考文献的方法提取细菌基因组DNA[12],作为扩增16S rRNA基因的DNA模板。用PCR方法扩增高产β-半乳糖苷酶菌株16S rRNA基因,引物为27f(5’AGAGTTTGATCCTGGCTCAG 3’)和1492r(5’GGTTACCTTGTTACGACTT 3’)[13]。PCR产物进行DNA序列测定,并在NCBI网站上利用BLAST软件对所得的DNA序列进行同源性比对,在GenBank中选择嗜热链球菌(Streptococcus thermophilus)、乳明串珠菌(Leuconostoc lactis)、双歧杆菌(Bifidobacterium)和多株乳酸杆菌(Lactobacillus)作为参比菌株,用MEGA 5.0软件构建系统发育树,分析高产β-半乳糖苷酶菌株的进化地位[14]。
1.2.4β-半乳糖苷酶酶学性质测定
1.2.4.1β-半乳糖苷酶最适pH的测定配制pH为5.0、5.5、6.0的0.1 mol/L柠檬酸-柠檬酸钠缓冲液,配制pH为6.5、7.0、7.5、8.0的0.1 mol/L PBS缓冲液。取1 mL发酵液至试管中,加入3 mL不同pH的缓冲液和80 μL氯仿充分振荡,按1.2.2方法测定β-半乳糖苷酶活力。
1.2.4.2β-半乳糖苷酶热稳定性的测定取1 mL发酵液至试管中,加入3 mL Z-buffer和80 μL氯仿,充分振荡后将试管分别至于45、50、55℃水浴锅中温育4 h,按1.2.2方法测定β-半乳糖苷酶活力。
1.2.5β-半乳糖苷酶基因序列分析分别以罗伊氏乳杆菌SD2112(Lactobacillus reuteri SD2112)的β-半乳糖苷酶编码基因lacZ(GenBank accession no. AEI56354)、lacL(GenBank accession no.AEI57702)和lacM(GenBank accession No.AEI57703)的序列为模板设计引物。引物lacZ-F(5’TGGTAGCAAAGAA GTTATTGACGAG 3’)和lacZ-R(5’ACACTGGTTGA TTGAAAAAGGGTAG 3’)扩增基因lacZ;引物lacL-F(5’CCTCTCCTCTTGCTATCTCA 3)和lacL-R(5’CCGTCACCACTAAGTCCTAA 3’)扩增基因lacL;引物lacM-F(5’ACTTGACAAATACCCACA 3’)和lacMR(5’GAACATAGCAGCATAGAA 3’)扩增基因lacM。PCR反应条件:95℃预变性5 min后进入30个循环(94℃变性1 min,退火1 min,72℃延伸1 min),循环结束后72℃终延伸10 min。
PCR产物经测序后,使用ORF Finder(Open Reading Frame Finder)软件预测β-半乳糖苷酶的氨基酸序列[15],采用Compute pI/Mw在线分析软件预测编码蛋白质的分子量和等电点[16-17],采用PSIPRED预测β-半乳糖苷酶的二级结构[18]。在UniProt数据库中查找多个乳酸杆菌的β-半乳糖苷酶序列,并在EBI网站上运用Clustal Omega软件进行比对分析[19-20]。
2 结果与分析
2.1产β-半乳糖苷酶耐热乳酸菌的筛选
共分离得到11株产β-半乳糖苷酶的耐热乳酸菌。进一步将分离菌株的β-半乳糖苷酶粗酶液在50℃水浴锅中温育2 h,测定β-半乳糖苷酶剩余活力,结果见表1。
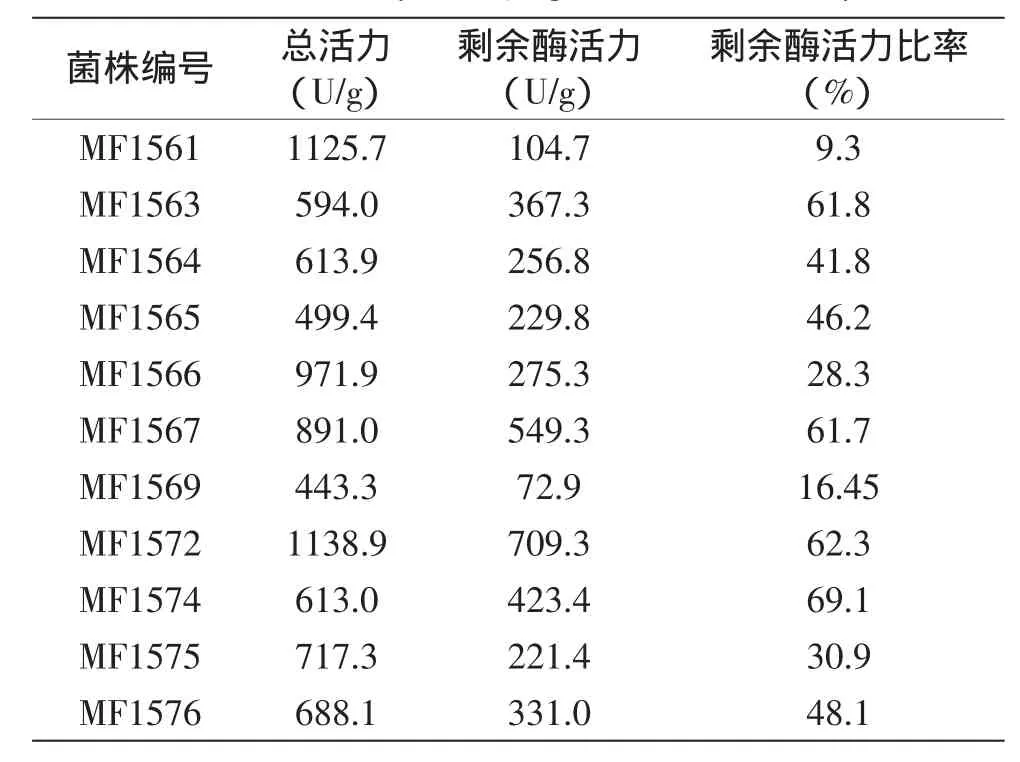
表1 产β-半乳糖苷酶耐热乳酸菌β-半乳糖苷酶活力的测定Table 1 Analysis of β-galactosidase activity
由表1可知,分离菌株MF1561、MF1566、MF1567和MF1572在37℃具有很高的酶活力,分别为1125.7、971.9、891.0和1138.9 U/g。50℃温育后,菌株MF1561产生的β-半乳糖苷酶活力仅剩9.3%,分离菌株MF1566、MF1567和MF1572的剩余酶活力比率分别为28.3%、61.7%和62.3%。此外,分离菌株MF1563、MF1574和MF1576的剩余酶活力比率较高,分别为61.8%、69.1%和48.1%。因此,最终选择菌株MF1563、MF1566、MF1567、MF1572、MF1574和MF1576,共6株分离菌株进行分析。
2.2分离菌株的16S rRNA鉴定
同源性比对结果见图1,显示6株分离菌株MF1563、MF1566、MF1567、MF1572、MF1574和MF1576与罗伊氏乳杆菌(Lactobacillus reuteri)的同源程度均为99%,因此确定6株菌株均为罗伊氏乳杆菌。罗伊氏乳杆菌是天然存在于脊椎动物和哺乳动物肠道内的乳酸菌,可改善肠道菌群的分布,并具有拮抗有害菌定植等益生功能[21]。我国卫生部于2003年批准了罗伊氏乳杆菌为可用于保健食品的益生菌菌株。
由图1可以看出,根据16S rRNA基因序列,6株分离得到的罗伊氏乳杆菌分为两类,罗伊氏乳杆菌MF1572为一类,其他罗伊氏乳杆菌为另一类。罗伊氏乳杆菌除与阴道乳杆菌(L.vaginalis)的亲源关系最近外,与发酵乳杆菌(L.fermentum)的亲源关系最近,而与嗜热链球菌(Streptococcus thermophilus)、乳明串珠菌(Leuconostoc lactis)的亲源关系较远,与双歧杆菌(Bifidobacterium)的亲源关系最远。
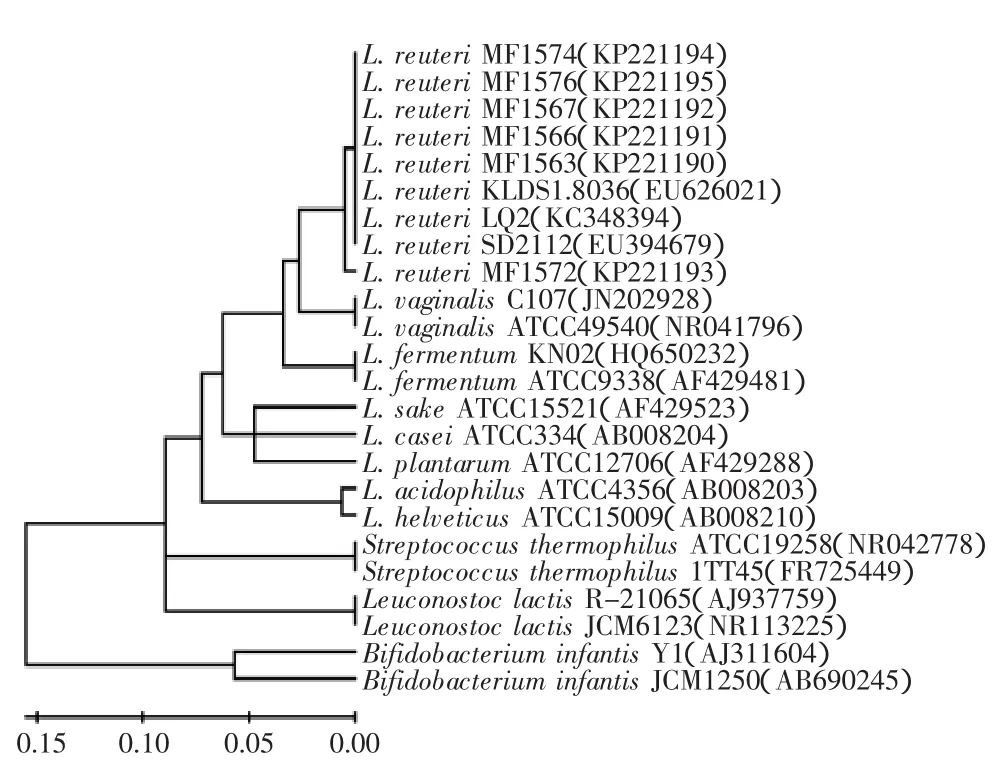
图1 基于16S rRNA构建的系统发育树Fig.1 Phylogenetic tree based on 16S rRNA gene sequences
2.3β-半乳糖苷酶最适pH的测定
结果见图2。6株罗伊氏乳杆菌在pH6.5时酶活力最高,即6株罗伊氏乳杆菌的最适pH均为6.5。

图2 罗伊氏乳杆菌β-半乳糖苷酶最适pHFig.2 Optimum pH of the β-galactosidase from isolated L.reuteri strains
2.4β-半乳糖苷酶热稳定性的测定
进一步考察MF1563、MF1566、MF1567、MF1572、MF1574、MF1576,6株罗伊氏乳杆菌β-半乳糖苷酶的热稳定性。结果分别见图3中的(a~c)。
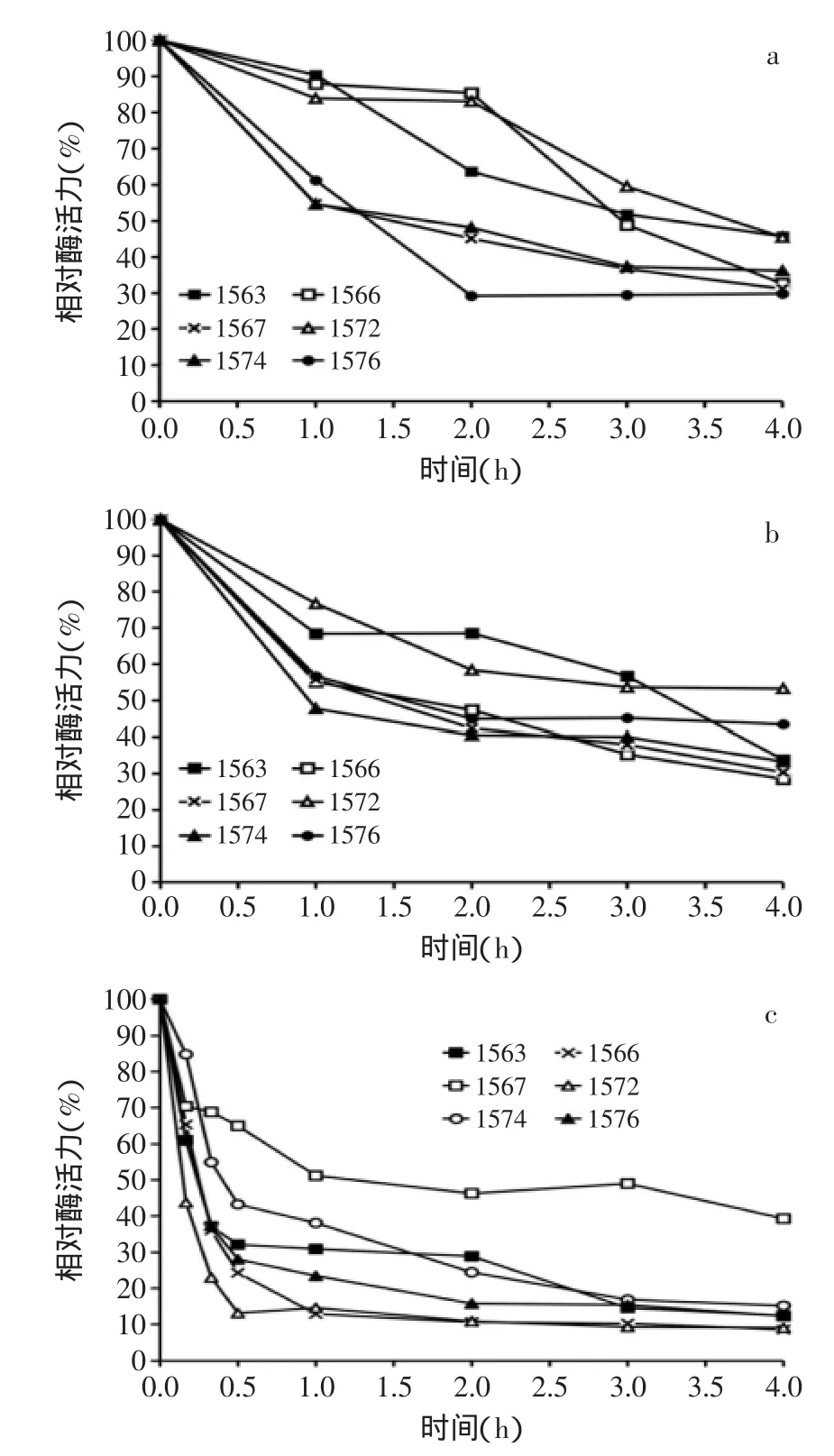
图3 罗伊氏乳杆菌β-半乳糖苷酶热稳定性Fig.3 Thermostable of β-galactosidase from L.reuteri strains
6株罗伊氏乳杆菌的β-半乳糖苷酶粗酶液在45℃温育1 h后,菌株MF1563、MF1566和MF1572合成的β-半乳糖苷酶比较稳定,分别剩余90.5%、88.0%和84.0%的酶活力;在45℃温育2 h后,菌株MF1563的酶活力降低至63.7%,而菌株MF1566和MF1567仍具有85.4%和83.0%的酶活力;在45℃温育4 h后,所有菌株的剩余酶活力均低于50%。
6株罗伊氏乳杆菌的粗酶液在50℃温育1 h后,菌株MF1563和MF1572仍有超过65%的酶活力,菌株MF1566、MF1567和MF1576的剩余酶活力大于55%,继续温育,各菌株的酶活力逐渐降低。
6株罗伊氏乳杆菌的β-半乳糖苷酶粗酶液在55℃温育15 min,菌株MF1572的酶活力迅速降低至43.8%,其余菌株仍具有超过60%的酶活力。55℃温育30 min后,菌株MF1567剩余65.0%的酶活力,而其余5株罗伊氏乳杆菌的酶活力均迅速下降至50%以下,继续温育至1 h后,菌株MF1567剩余51.2%的酶活力,此后继续保温,菌株MF1567的剩余酶活力趋于稳定,4 h后剩余酶活力为39.3%,而其余5株菌的酶活力随着温育时间的延长而逐渐降低,4 h后剩余约10%的酶活力。由此猜测,罗伊氏乳杆菌MF1567可能同时合成两种β-半乳糖苷酶,其中一种不具有热稳定性,在55℃温育1 h失去全部活力,而另一种β-半乳糖苷酶则具有相对热稳定性。
2.5β-半乳糖苷酶氨基酸序列同源性分析
将6株罗伊氏乳杆菌(MF1563、MF1566、MF1567、MF1572、MF1574和MF1576)的β-半乳糖苷酶基因扩增产物送至北京华大基因公司进行序列测定。将测序的β-半乳糖苷酶基因序列上传至GenBank,获得的序列接收号见表2。

表2 分离菌株β-半乳糖苷酶基因序列接收号Table 2 β-galactosidase gene GenBank accession no.of 6 isolated strains
由于密码子具有简并性,某个碱基的突变可能不会引起氨基酸序列的改变。在UniProt数据库中检索多株乳酸杆菌LacZ、LacL和LacM的氨基酸序列,分别与分离得到的6株罗伊氏乳杆菌进行同源性比对。以罗伊氏乳杆菌SD2112的LacZ、LacL和LacM为100%,6株分离得到的罗伊氏乳杆菌的LacZ、LacL和LacM与罗伊氏乳杆菌SD2112的同源程度均大于97%,其中罗伊氏乳杆菌MF1567的LacL和LacM与罗伊氏乳杆菌SD2112的相似度达到100%。
2.6β-半乳糖苷酶LacZ的结构分析
罗伊氏乳杆菌SD2112 LacZ的氨基酸活性位点Glu-150为质子给予体,Glu-309为亲核试剂;底物结合位点分别为Arg-111、Asn-149和Trp-317;金属锌离子结合位点分别为Cys-115、Cys-155、Cys-157和Cys-160[22]。在EBI网站上运用Clustal Omega软件将分离得到的6株罗伊氏乳杆菌LacZ序列与UniProt数据库中的罗伊氏乳杆菌SD2112和MF2-2的LacZ氨基酸序列进行比对,分离得到的6株罗伊氏乳杆菌与罗伊氏乳杆菌SD2112和MF2-2具有相同的保守氨基酸,结果见图4。
然而,产耐热β-半乳糖苷酶的罗伊氏乳杆菌MF1567的LacZ与参比菌株罗伊氏乳杆菌SD2112有22个氨基酸不同,通过PSIPRED蛋白质结构预测软件,在线预测罗伊氏乳杆菌MF1567 lacZ基因编码的β-半乳糖苷酶二级结构,结果显示菌株MF1567的LacZ含有26.5%的α-螺旋和17.6%的β-折叠,而罗伊氏乳杆菌SD2112含有26.0%的α-螺旋和17.7%的β-折叠。罗伊氏乳杆菌MF1567比菌株SD2112多含有0.5%的α-螺旋结构,这可能与其具有较好的热稳定性有关[23-24]。

图4 LacZ氨基酸序列比对Fig.4 Amino acid sequences alignment of LacZ
2.7β-半乳糖苷酶LacLM的活性中心位点分析
罗伊氏乳杆菌lacL和lacM基因编码的异源二聚体β-半乳糖苷酶属于糖苷水解酶2族(GHF-2),lacL基因编码β-半乳糖苷酶的大亚基,lacM基因编码小亚基,而且单独的LacL和LacM都没有催化活性,只有当lacL和lacM两个基因同时表达时,才能获得具有催化活性的β-半乳糖苷酶[25]。
利用POSITE在线分析罗伊氏乳杆菌GHF-2 LacLM的结构域和功能标记,结果发现LacL氨基酸序列存在两个高度保守的序列,LacM无任何活性氨基酸位点。将同属于糖苷水解酶2族的LacLM和大肠杆菌LacZ的保守序列进行对比,结果见表3。属于同一糖苷水解酶家族的LacLM和大肠杆菌LacZ分别有41个保守氨基酸,其中有17个氨基酸有显著性差异,占保守序列的41.5%。

表3 糖苷水解酶2族LacLM和LacZ保守序列对比Table 3 Comparison of conservative sequences of GHF-2 LacLM and LacZ
3 结论
本研究采用加热预处理的方式,首先从新鲜鸡粪样品中分离出11株产β-半乳糖苷酶的耐热乳酸菌,通过酶活力测定和对粗酶液的热处理,进一步筛选出6株产酶活力高而且所产生的β-半乳糖苷酶具有一定耐热性的乳酸菌。经16S rRNA鉴定,6株分离菌株均为罗伊氏乳杆菌。其中菌株MF1567编码的β-半乳糖苷酶在55℃保温1 h仍能保持51.2%的酶活力,将来可以通过育种进一步提高β-半乳糖苷酶活力,最终用于工业化生产。
[1]吕晓华,刘世贵,高荣.生物技术在乳糖不耐受防止中的应用[J].中国乳品工业,2002,30(1):44-47.
[2]杨月欣,何梅,崔红梅,等.中国儿童乳糖不耐受发病率的调查研究[J].卫生研究,1999,28(1):44-46.
[3]龚群,张凤玲,何琳,等.0~6岁儿童乳糖缺乏的现状与健康关系的研究[J].中国儿童保健杂志,2008,16(5):567-569.
[4]张敏文,顾取良,张博,等.乳糖酶研究进展[J].微生物学杂志,2011,31(3):81-86.
[5]Parvez S,Malik K A,Kang S A,et al.Probiotics and their fermented food products are beneficial for health[J].Journal of Applied Microbiology,2006,100:1171-1185.
[6]Chunming N,Bo L,Yuhong Z,et al.Production and secretion of Lactobacillus crispatus β-galactosidase in Pichia pastoris[J].Protein expression and purification,2013,92:88-93.
[7]Nguyen T H,Barbara S,Krasteva S,et al.Characterization and molecular cloning of a heterodimeric beta-galactosidase from the probiotic strain Lactobacillus acidophilus R22[J].FEMS Microbiol Lett,2007,269(1):136-144.
[8]王丽凤,张家超,马晨,等.鸡肠道微生物研究进展[J].动物营养学报,2013,25(3):494-502.
[9]Lu J,Idris U,Harmon B,et al.Diversity and succession of the intestinal bacterial community of the maturing broiler chicken[J].Applied and Environmental Microbiology,2003,69(11):6816-6824.
[10]Dagbagli S,Goksungur Y.Optimization of β-galactosidase production using Kluyveromyces lactis NRRL Y-8279 by response surface methodology[J].Electronic Journal of Biotechnology,2008,11(4):1-12.
[11]Lodi T,Donnini C.Lactose-induced cell death of betagalactosidase mutants in Kluyveromyces lactis[J].FEMS Yeast Research,2005,5(8):727-734.
[12]Sambrook J,Fritsch E F,Maniatis T.Molecular cloning[M].New York:Cold Spring Harbor Laboratory Press,1989.
[13]Suzuki M T,Giovannoni S J.Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J].Applied and Environmental microbiology,1996,62(2):625-630.
[14]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionarygeneticsanalysisusingmaximumlikelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28:2731-2739.
[15]Morgulis A,Coulouris G,Raytselis Y,et al.Database indexing for production Mega BLAST searches[J].Bioinformatics,2008,[16]Bjellqvist B,Hughes G J,Pasquali C,et al.The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences[J].Electrophoresis,1993,14:1023-1031.
15:1757-1764.
[17]Bjellqvist B,Basse B,Olsen E,et al.Reference points for comparisons of two-dimensional maps of proteins from different human cell types defined in a pH scale where isoelectric points correlate with polypeptide compositions[J].Electrophoresis,1994,15:529-539.
[18]Kosciolek T,Jones D T.De novo structure prediction of globular proteins aided by sequence variation-derived contacts[J].PloS one,2014,9(3):e92197A.
[19]The UniProt Consortium.Activities at the universal protein resource(UniProt)[J].Nucleic Acids Research,2014,42:191-198.
[20]Sievers F,Wilm A,Dineen D,et al.Fast,scalable generation of high-quality protein multiple sequence alignments using Clustal Omega[J].Molecular systems biology,2011,7:539.
[21]庞洁,周娜,刘鹏,等.罗伊氏乳杆菌的益生功能[J].中国生物工程杂志,2011,31(5):131-137.
[22]Muzny D,Qin X,Buhay C,et al.The complete genome of LactobacillusreuteriATCC55730/SD2112[DB].GenBank databases.
[23]Schulz G E,Schirmer R H.Principles of protein structure in“Springer advanced texts in chemistry”[M].New York:Springer-Verlag,1990.
[24]Branden C,Tooze J.Introduction to protein structure[M].New York:Garland Pub.
[25]Nguyen T H,Splechtna B,Yamabhai M,et al.Cloning and expression of the β-galactosidase genes from Lactobacillus reuteri in Escherichia coli[J].Journal of Biotechnology,2007,129:581-591.
Screening of heat tolerable lactic acid bacteria and characterization of their β-galactosidases
LI Meng-fei1,SUN Qing-hui1,ZHANG Yan2,YANG Hong-jiang1,*
(1.Key Laboratory of Industrial Microbiology,Ministry of Education,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Tianjin Shuang Lian Ke Xin Biotechnology Co.,Ltd.,Tianjin 300403,China)
In this study,heat tolerable LAB strains producing high level β-galactosidase were isolated from chicken feces samples.With 16S rRNA gene sequence analysis,6 isolated strains were all identified as Lactobacillus reuteri.All β-galactosidases from the isolated L.reuteri strains had the same optimum pH of 6.5. After incubating for 1 h at 55℃,51.2%of β-galactosidase of strain MF1567 activity was retained.The amino acid sequence analysis showed that 22 amino acid residues of β-galactosidase LacZ were substituted.The secondary protein structure was further predicted and LacZ had a relatively higher degree of α-helix(26.5%),which might contribute to the heat stability of β-galactosidase LacZ from L.reuteri MF1567.
lactic acid bacteria;β-galactosidase;heat tolerable;amino acid sequences
TS201.2
A
1002-0306(2015)18-0209-06
10.13386/j.issn1002-0306.2015.18.033
2015-01-16
李梦菲(1989-),女,硕士研究生,研究方向:微生物遗传与育种,E-mail:lemonphy23@sina.com。
杨洪江(1966-),男,博士,教授,研究方向:微生物学,E-mail:hongjiangyang@tust.edu.cn。
天津市科技支撑计划重点项目(13ZCZDNC00600)。
