ε-聚赖氨酸产生菌的复合诱变筛选及其发酵培养基优化
2015-11-04吴晨奇扶教龙陈冬铨钱大伟李良智胡翠英王桃云苏州科技学院化学生物与材料工程学院江苏苏州25009苏州市新能源与低碳技术重点实验室江苏苏州25009
吴晨奇,扶教龙,2,*,陈冬铨,钱大伟,李良智,2,胡翠英,王桃云(.苏州科技学院化学生物与材料工程学院,江苏苏州25009;2.苏州市新能源与低碳技术重点实验室,江苏苏州25009)
ε-聚赖氨酸产生菌的复合诱变筛选及其发酵培养基优化
吴晨奇1,扶教龙1,2,*,陈冬铨1,钱大伟1,李良智1,2,胡翠英1,王桃云1
(1.苏州科技学院化学生物与材料工程学院,江苏苏州215009;2.苏州市新能源与低碳技术重点实验室,江苏苏州215009)
以白色链霉菌FQ-9为出发菌株,首次利用(甘氨酸+L-赖氨酸+磺胺胍)复合抗性,进行“紫外-氯化锂”复合诱变,筛选出一株ε-PL产量达(0.668±0.0045)g/L的突变菌株FQC-23,产量提高了15.37%,且其遗传性稳定。然后在单因素实验的基础上,应用响应面分析方法,对其发酵培养基进行优化,最终确定最佳培养基为(g/L):葡萄糖46.1、酵母粉13.0、(NH4)2SO45.9、MgSO4·7H2O 0.5、K2HPO40.8、KH2PO41.36、FeSO4·7H2O 0.03、ZnSO4·7H2O 0.04,在此条件下,FQC-23的ε-PL产量达(1.090±0.0041)g/L,比出发菌株的产量提高了87.56%。
ε-聚赖氨酸,抗性平板,诱变,响应面分析方法,白色链霉菌
ε-聚赖氨酸(ε-PL)是一种由L-赖氨酸残基通过α-羧基和ε-氨基连接而成的微生物源线性多聚物,它可用作食品防腐剂,具有抑菌谱广、安全性能高、热稳定性好等优点,这使它成为目前最具潜力的生物防腐剂[1]。ε-PL已在美国、日本和韩国等地被广泛使用,而我国也批准了ε-PL可用作食品添加剂。此外,ε-PL还可用作载体材料、可降解性材料和高吸水性聚合材料等[2]。因此,ε-PL具有广阔的应用前景。
目前,研究人员在ε-PL高产菌的筛选及育种方面做了大量的研究。然而,ε-PL产生菌的生产能力依然较低,这在一定程度上制约了对它进一步的研究和利用。通过遗传改良来获得高产菌株,是提高ε-PL产率的关键,国内外研究者主要是通过物理或化学方法(UV、NTG、DES、亚硝酸等)对菌种进行诱变,并结合对产物(ε-PL)或代谢中间产物的结构类似物(如AEC、AHV)等的耐受进行高产菌种的筛选[3-7]。但从这些研究可以发现,国内ε-PL产生菌的生产能力与日本相比还存在一定差距,因此在育种方面还需进行深入的研究。微生物代谢控制育种是通过遗传育种技术获得解除或绕过正常代谢途径的突变株,从而选择性地大量合成积累有用产物的方法[8]。基于此,本研究以白色链霉菌FQ-9为出发菌株,应用微生物代谢控制育种与物理复合诱变相结合的方法对其进行诱变筛选,并采用单因素与响应面结合的方法,对其发酵培养基进行优化,以进一步提高ε-PL发酵水平。
1 材料与方法
1.1材料与仪器
白色链霉菌(Streptomyces albulus)FQ-9由本实验室保藏;甲基橙、甘氨酸(Gly)、L-赖氨酸(LLys)、磺胺胍(SG)、酵母粉AR,阿拉丁试剂(上海)有限公司;葡萄糖、硫酸铵、MgSO4·7H2O、K2HPO4、KH2PO4等AR,国药集团化学试剂有限公司;蛋白胨、琼脂粉BR,国药集团化学试剂有限公司;ε-PL标准品南京工业大学徐虹教授惠赠。
UV-2450紫外-可见光分光光度计日本岛津企业管理(中国)有限公司;UNE500灭菌烘箱德国MEMMERT公司;SW-CJ-2FD超净台苏州净化设备有限公司;TS-2102型摇床上海天呈科技有限公司;隔水式恒温培养箱上海精宏实验设备有限公司;实验室常规仪器。
1.2实验方法
1.2.1培养基的配制
1.2.1.1贝特纳斜面培养基葡萄糖10 g,蛋白胨2 g,酵母粉1 g,琼脂15 g,加水定容至1 L,pH7.5,115℃灭菌20 min。
1.2.1.2Gly、L-Lys和SG抗性平板葡萄糖10 g,蛋白胨2 g,酵母粉1 g,琼脂15 g,一定量的Gly,L-Lys和SG,加水定容至1 L,pH7.5,115℃灭菌20 min。
1.2.1.3种子和发酵培养基(M3G)葡萄糖50 g,酵母粉5 g,(NH4)2SO410 g,MgSO4·7H2O 0.5 g,K2HPO40.8 g,KH2PO41.36 g,FeSO4·7H2O 0.03 g,ZnSO4·7H2O 0.04 g,加水定容至1 L,pH6.8,115℃灭菌20 min。
1.2.2培养方法
1.2.2.1斜面及平板培养单孢子悬液涂布于贝纳特斜面培养基或抗性平板,30℃恒温培养5~6 d形成孢子,保藏备用。
1.2.2.2种子培养250 mL的三角瓶中装液50 mL,接入一环孢子,200 r/mim,30℃培养24 h。
1.2.2.3摇瓶发酵培养250 mL的三角瓶中装液50 mL,按10%接种量接入种子液,200 r/mim,30℃培养72 h。
1.2.3指标的测定
1.2.3.1ε-PL产量测定方法参照Itzhaki F R方法[9]。
1.2.3.2致死率计算方法致死率(%)=[(对照组菌落数-处理组菌落数)/对照菌落数]×100
1.2.3.3致死率偏差计算方法致死率偏差=-|致死率-80%|,致死率偏差越接近于零,表明此时致死率越接近80%,负号表明作三维响应面图时开口朝下。
1.2.4单孢子悬浮液制备用无菌生理盐水洗下S.albulus斜面上成熟的孢子,制成孢子悬液,然后转移至含有玻璃珠的无菌三角瓶中,经充分振荡,使孢子打散后,用八层纱布进行过滤,即得单孢子悬液。
1.2.5抗性平板中Gly、L-Lys和SG浓度的确定
1.2.5.1单一抗性物质对单菌落生长的影响将0.1 mL出发菌株的单孢子悬液涂布于含有不同抗性物质,不同设计水平的抗性平板上,每个处理做三个平行,进行平板培养,观察平板上菌落的生长情况,以确定抗性平板中Gly、L-Lys和SG的浓度。其中Gly添加浓度(g/L):0、1.5、3、4.5、5.5、6.5、7.5、8.5、10、12、14、16,其他同斜面培养基;L-Lys添加浓度(g/L):0、0.1、0.4、0.7、1.0、1.3、1.6、1.9、2、2.5、3、4,其他同斜面培养基;SG添加浓度(g/L):0、1.5、4、6.5、9、11.5、14,其他同斜面培养基。
1.2.5.2复合抗性的浓度优化实验在单因素抗性筛选实验的基础上,进一步优化Gly、L-Lys和SG三者的复合浓度。以Gly、L-Lys和SG为三种筛选因子,以致死率偏差为响应值,应用响应面设计方法并利用Design-Expert 8.0.6软件[10],设计三因素三水平实验,其因素与水平设计见表1,优化复合抗性浓度。
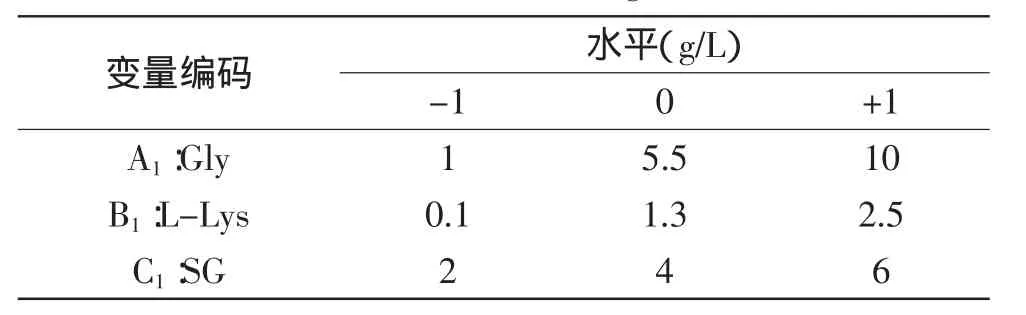
表1 Box-Behnken实验因素与水平Table 1 Variable and levels of response surface Box-Behnken design
1.2.6诱变方法
1.2.6.1紫外(UV)复合氯化锂诱变取单孢子悬液5 mL,加入到9 cm直径的无菌培养皿中,在紫外诱变箱内距15 W紫外灯30 cm处进行搅拌照射诱变,在红光下稀释涂布固体平板培养基,培养基中添加0.5%的LiCl作为助诱变剂[11],避光平板培养。
1.2.6.2初筛紫外复合氯化锂诱变后,涂布于复合抗性平板上,平板培养后,从平板中挑取表面粗糙干燥、呈现圆形或不规则形、孢子量大且丰满的单菌落,接入到斜面培养基中,斜面培养,4℃冰箱中保藏用于复筛[12]。
1.2.6.3复筛将初筛得到的菌株逐个进行摇瓶发酵,测定其ε-PL产量。
1.2.7菌株遗传稳定性实验将筛选出的高产菌株在斜面培养基上连续转接6代,并进行摇瓶发酵培养,测定ε-PL的产量,检测菌株遗传性状。
1.2.8发酵培养基优化
1.2.8.1发酵培养基的单因素实验本实验选择了培养基中对发酵影响较大的三种成分:葡萄糖、酵母粉和硫酸铵,分别考察其不同浓度对诱变菌株发酵产ε-PL的影响。其中,选择葡萄糖浓度(g/L)为10、20、30、40、50、60、70,其他同发酵培养基,来选择最佳的葡萄糖浓度;选择酵母粉浓度(g/L)为2.5、5.0、7.5、10.0、12.5、15.0、17.5,其他同发酵培养基,来选择最佳的酵母粉浓度;选择硫酸铵浓度(g/L)为1.5、3.0、4.5、6.0、7.5、9.0、10.5、12.0,其他同发酵培养基,来选择最佳的硫酸铵浓度。
1.2.8.2发酵培养基优化的响应面分析实验根据单因素的实验结果,选用葡萄糖、酵母粉及硫酸铵为考察因素,采用Box-Behnken中心组合实验设计[13],设计三因素三水平的响应面分析实验,其实验因子和编码水平见表2。
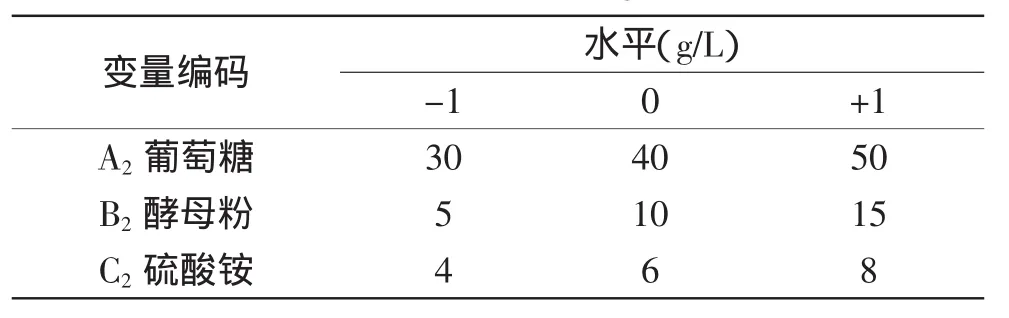
表2 Box-Behnken实验因素与水平Table 2 Variable and levels of response surface Box-Behnken design
1.2.9数据处理方法所有实验做3个平行,Excel进行实验数据误差分析,Design Expert软件对响应面实验得到的数据进行线性回归和方差分析。
2 结果与分析
2.1抗性平板中Gly、L-Lys和SG浓度的确定
目前在筛选ε-PL抗性突变株时,常用的抗性物质是AEC与Gly的混合物,但AEC价格昂贵,且用量极大[4,6,14]。研究表明,L-Lys是ε-PL的合成前体,能直接被ε-PL生物合成所利用[15-16];此外,SG是β-氨基安息香酸的结构类似物,SG抗性可以解除天冬氨酸对磷酸烯醇式丙酮酸羧化酶(PEPC)的反馈抑制作用[16]。选育SG抗性突变株,可增强L-Lys前体天冬氨酸的合成,从而提高L-Lys的代谢流,进而提高ε-PL的产量。
因此,本文选择Gly、L-Lys和SG这三种抗性物质,同时添加到抗性平板上,筛选出具有这三种抗性的突变株。实验首先须确定Gly、L-Lys和SG的最佳浓度。
2.1.1单一抗性物质对单菌落生长的影响当Gly、L-Lys和SG浓度分别为5.5、1.3、4 g/L时,平板中开始出现少量不长孢子的单菌落,但大部分菌落的孢子丰满且量大,菌落生长良好;当Gly、L-Lys和SG浓度分别低于5.5、1.3、4 g/L时,其浓度对出发菌株的生长基本没有影响,孢子量大且丰满;而当三个抗性物质浓度高于上述添加量时,平板中明显大多数单菌落都不长孢子,当三种浓度分别达到14、3、9 g/L时,菌株几乎无法生长。实验结果见表3。根据文献,高产菌株的特征是孢子量大且丰满[12]。故本实验将Gly、L-Lys和SG的浓度分别以5.5、1.3和4 g/L为中心点,以对抗性浓度进行进一步优化。
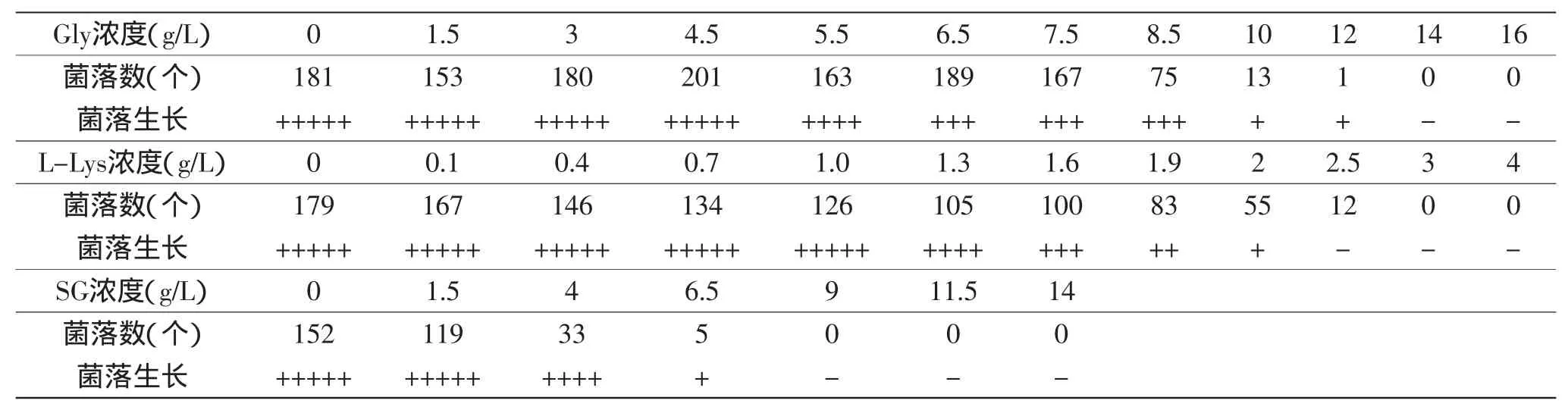
表3 各抗性物质对FQ-9的生长影响Table 3 Effect of resistant substance concentration on growth of FQ-9
2.1.2复合抗性的浓度优化实验结果实验中,设置当复合抗性平板上菌落的致死率越接近80%,复合抗性平板中三种成分的浓度组成越好。响应面实验设计及结果见表4。
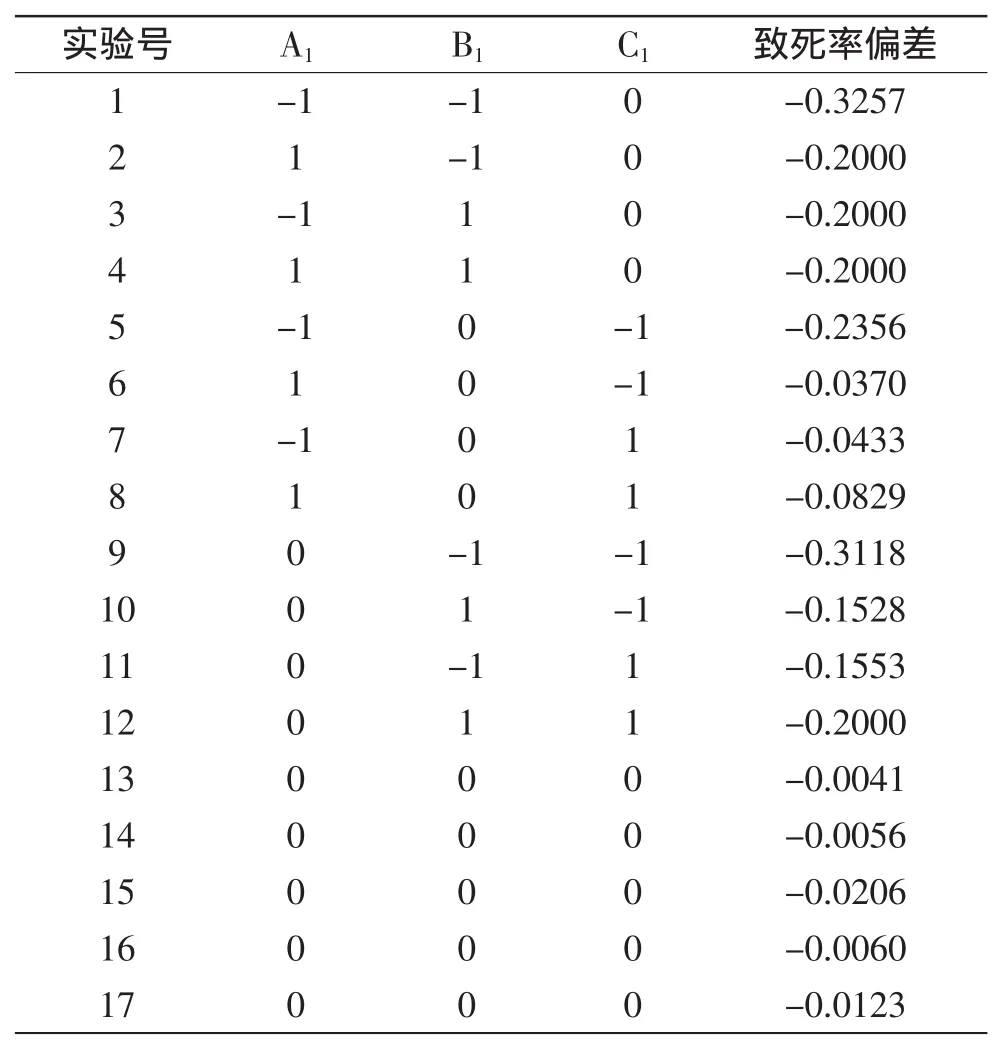
表4 响应面实验设计与结果Table 4 Box-Behnken design and corresponding results
根据表4的实验结果,对表中数据进行多元回归拟合,得到致死率偏差(R1)对Gly(A1)、L-Lys(B1)、SG(C1)的多项回归方程为:R1=-0.853+0.074A1+0.437B1+0.143C1-5.819×10-3A1B1-6.617×10-3A1C1-0.021B1C1-2.875A12-0.114B12-7.941×10-3C12,对实验结果进行方差分析,结果如表5所示。
从表5可以看出,模型相关性系数R2=0.9974,校正决定系数R2Adj=0.9939,这两个值说明模型的实测值和预测值有良好的拟合度,能够较好地解释响应面值的变化。此次实验的C.V.值为6.64%,说明此次实验是可信的。而且模型的p值小于0.0001,表明模型极显著,方程对实验结果拟合较好,而失拟项的p值为0.2163,说明失拟项不显著,残差有随机误差引起,模型是可行的。
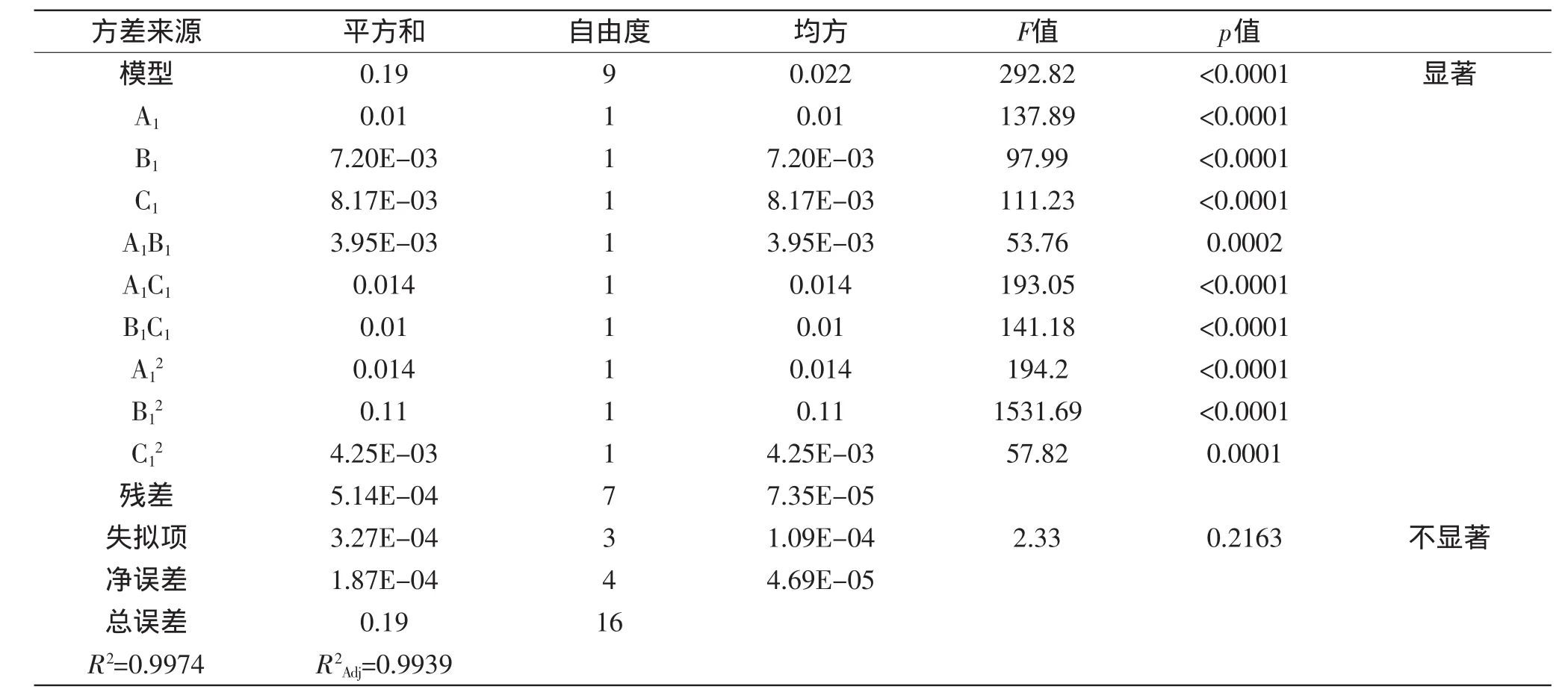
表5 回归系数检验表Table 5 ANOVE analysis for regression equation
通过求解回归方程,可解出复合抗性的最佳组成浓度为:Gly 5.95 g/L,L-Lys 1.33 g/L,SG 4.79 g/L,此时致死率偏差为-0.0014,致死率为80%±0.14%。考虑实际操作的方便,最终三种抗性物质的浓度为:Gly 5.95 g/L,L-Lys 1.35 g/L,SG 4.80 g/L,按此浓度进行三次验证实验,致死率分别为80.29%、80.29%、79.75%,平均致死率为80.11%±0.25%,与预测值接近,且在验证实验中,单菌落基本都长出丰满且量大的孢子。实验结果表明,应用响应面方法优化三种抗性浓度是可靠的。
2.2紫外诱变
2.2.1紫外线诱变时间的确定取制备好的浓度为108个/mL的FQ-9的单孢子悬液分别振荡照射0、15、20、30、45、60、75、90、120 s。将照射后的悬液在红光下进行稀释,取稀释液0.1 mL涂布于复合抗性平板,每个时间做三个平行,同时做对照实验,避光培养后进行活菌计数,以照射时间为横坐标,致死率为纵坐标,绘制致死率曲线图,见图1。
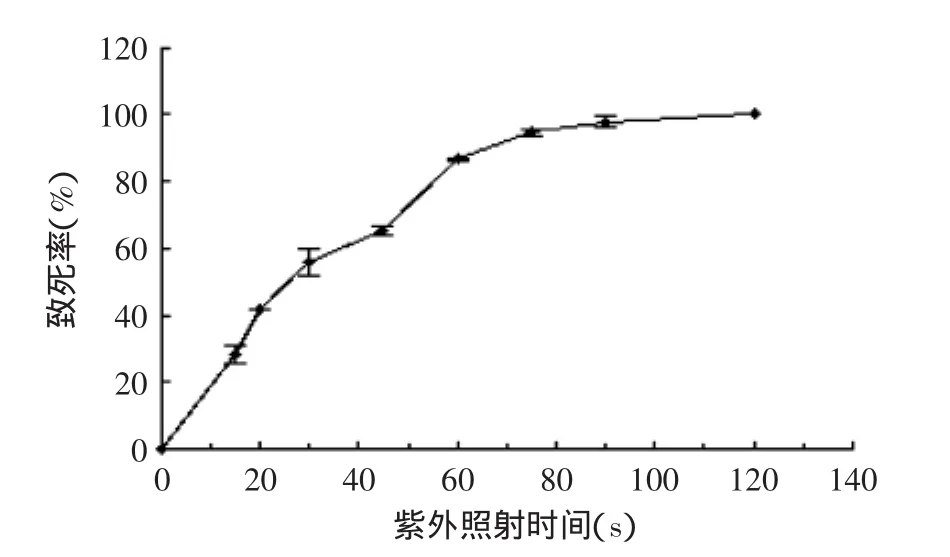
图1 S.albulus FQ-9紫外诱变致死率曲线Fig.1 The fatality rate curve of Streptomyces albulus FQ-9
由图1可看出,当紫外辐照时间为60 s时,致死率为86.73%±0.325%,接近80%,选择60 s为紫外诱变处理时间。
2.2.2UV复合氯化锂突变株筛选结果将诱变处理的孢子悬液涂布于含有0.5%LiCl的复合抗性平板上,避光培养。从平板上挑取40个生长良好的单菌落进行初筛和复筛,测定ε-PL产量。筛选结果见图2,图中水平虚线为出发菌株FQ-9的ε-PL产量。
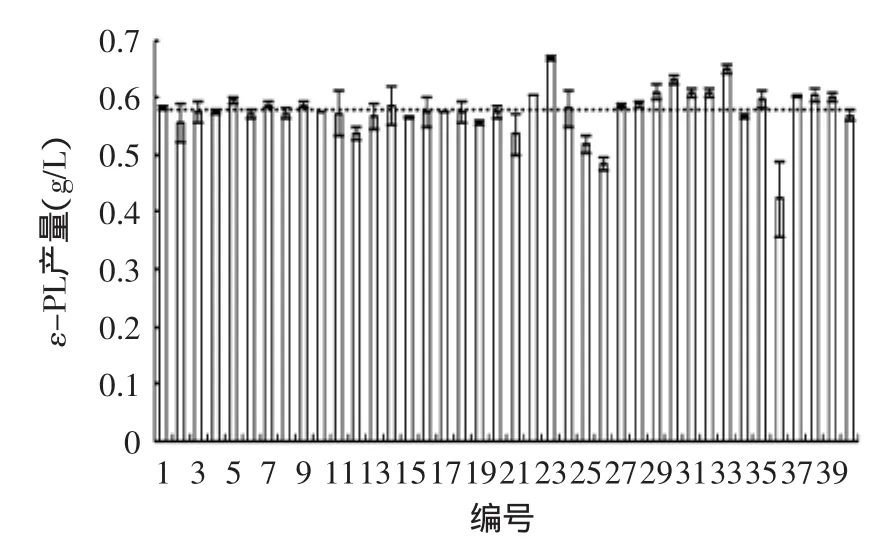
图2 紫外诱变的筛选结果Fig.2 Result of UV mutagenesis
从图2可发现,有19株突变株的产量得到提高,其中23号菌株FQC-23表现最突出,产量达(0.668± 0.0045)g/L,较FQ-9提高了15.37%,故选取FQC-23进行遗传稳定性研究。结果表明,在紫外线、LiCl和复合抗性物质的作用下,正突变率接近50%。
2.2.3遗传性状稳定性实验将筛选出的突变株FQC-23在复合抗性斜面上连续转接6代,其产孢速度基本一致,ε-PL产量稳定,其中第二代的产量为(0.652±0.0038)g/L,第四代为(0.647±0.0015)g/L,第六代为(0.653±0.0015)g/L,ε-PL产量介于0.647~0.653 g/L之间,结果表明该菌株遗传性能稳定,Gly5.95L-Lys1.35SG4.80复合抗性标记可稳定遗传。
2.3发酵培养基的优化
2.3.1葡萄糖浓度对ε-PL产量的影响由图3可以看出,随葡萄糖浓度的增加,ε-PL产量也增加;当葡萄糖浓度达到40 g/L时,ε-PL产量达到最大,可达(0.653±0.0055)g/L;而当葡萄糖浓度继续加大时,ε-PL产量反而下降,这表明过大的添加量并不利于ε-PL产量的增大,这可能是由于在发酵过程中过多葡萄糖容易引起“葡萄糖效应”,进而影响菌体生长和代谢产物的形成。故在本实验的考察范围内葡萄糖最佳浓度为40 g/L。

图3 葡萄糖浓度对ε-PL产量的影响Fig.3 Effect of glucose concentration on the yield of ε-PL
2.3.2酵母粉浓度对ε-PL产量的影响由图4可以看出,当酵母粉浓度低于10 g/L时,ε-PL产量不断增加,并达到最大值(0.823±0.0032)g/L,继续增加酵母粉的浓度,ε-PL产量反而降低,可能是由于酵母粉成分复杂,后期底物消耗不完,会诱导产生一些酶降解白色链霉菌菌丝体,因此,确定酵母粉最佳浓度为10 g/L。
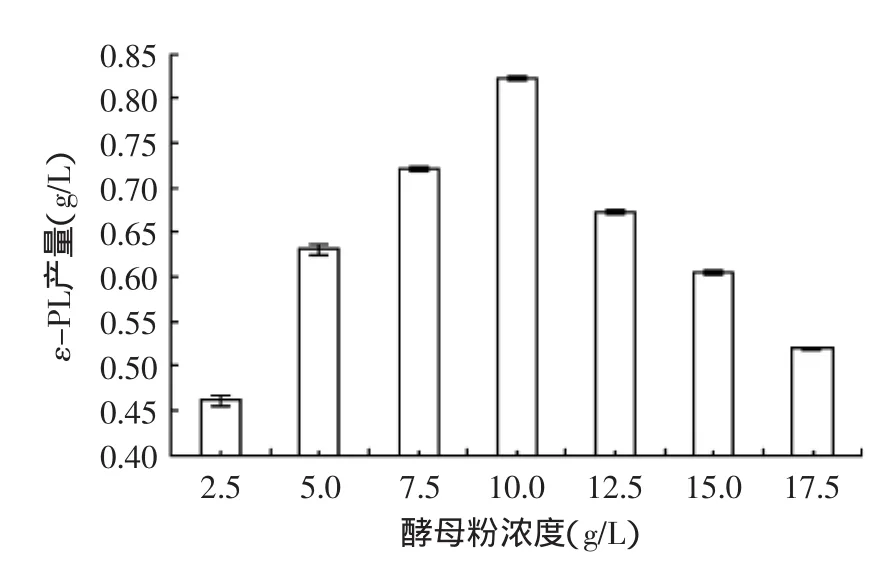
图4 酵母粉浓度对ε-PL产量的影响Fig.4 Effect of yeast powder addition on the yield of ε-PL
2.3.3硫酸铵浓度对ε-PL产量的影响由图5可以看出,当硫酸铵浓度为6 g/L时,ε-PL产量达到最大的(0.658±0.0026)g/L,继续增加硫酸铵浓度,ε-PL产量反而降低,这表明过多的硫酸铵并不利于ε-PL的形成,只有适宜的浓度才有利于ε-PL形成,故在本实验的考察范围内,硫酸铵的最佳浓度为6 g/L。
2.3.4响应面设计优化发酵培养基组成
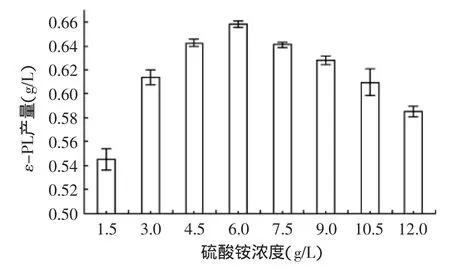
图5 硫酸铵浓度对ε-PL产量的影响Fig.5 Effect of(NH4)2SO4on the yield of ε-PL
2.3.4.1模型的建立及显著性检验根据单因素结果,采用Design-Expert软件对葡萄糖、酵母粉、硫酸铵进行优化,实验结果如表6所示。
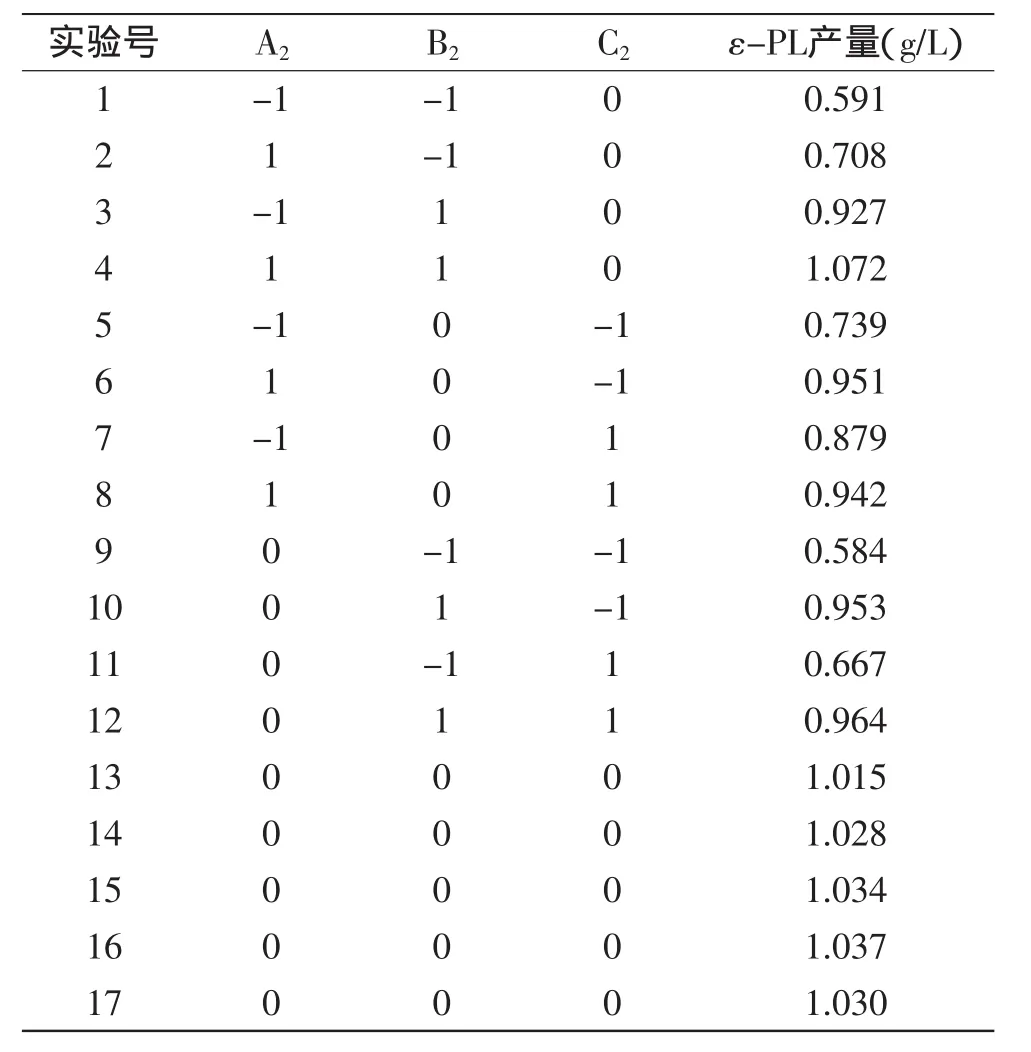
表6 Box-Behnken实验设计及结果Table 6 Box-Behnken design and corresponding results
用Design-Expert软件,对表6进行多元回归拟合,可以得到ε-PL产量(R2)对葡萄糖(A2)、酵母粉(B2)、硫酸铵(C2)的回归方程为:R2=1.030+0.067A2+0.170B2+0.028C2+7.000×10-3A2B2-0.037A2C2-0.018B2C2-0.059A22-0.150B22-0.092C22,对实验结果进行显著性检验及方差分析,结果如表7所示。
从表7可以看出,模型p<0.0001,表明该模型是高度显著的,方程拟合度较好;同时失拟项的p为0.3293,说明模型失拟不显著,残差由随机误差引起,模型选择正确;该方程系数R2=0.9986,说明方程的拟合程度较好,该模型能较好地预测发酵培养基组分与ε-PL产量的关系;校正决定系数R2Adj=0.9967,表明方程模型可信度较高,能够较好地描述实验结果。
2.3.4.2响应面优化及分析根据BB实验设计结果做出三维响应面(见图6~图8),它们分别反映了葡萄糖(A2)、酵母粉(B2)、硫酸铵(C2)这三个因素的两两交互作用对响应值的影响。
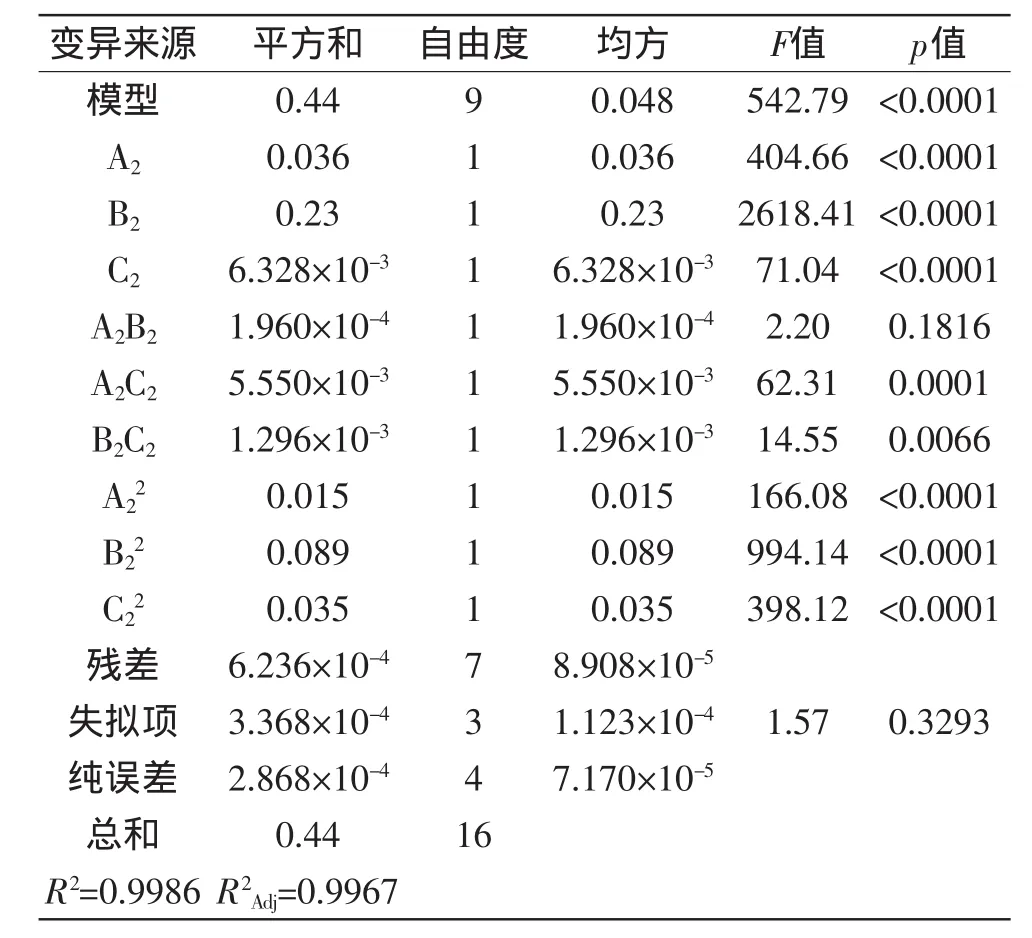
表7 回归系数检验表Table 7 ANOVE analysis for regression equation
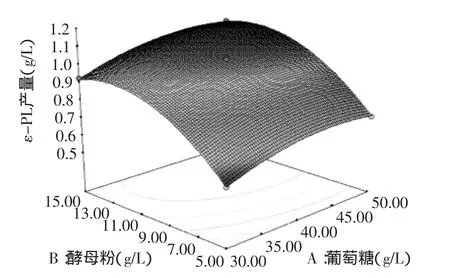
图6 葡萄糖和酵母粉对ε-PL产量影响的响应面分析图Fig.6 Response surface plot for the effects of ε-PL production between glucose and yeast powder
葡萄糖和酵母粉对ε-PL产量的影响如图6所示,当葡萄糖浓度一定时,ε-PL产量随着酵母粉浓度增加而增大,但当酵母粉浓度大于13.03 g时,ε-PL产量呈下降趋势。当酵母粉浓度一定时,随着葡萄糖浓度的增加,开始ε-PL产量也随之增大,但当葡萄糖浓度继续增大时,ε-PL产量逐渐降低。
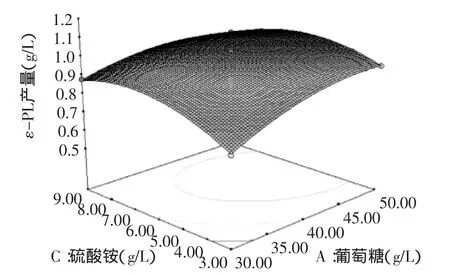
图7 葡萄糖和硫酸铵对ε-PL产量影响的响应面分析图Fig.7 Response surface plot for the effects of ε-PL production between glucose and(NH4)2SO4
等高线的形状可以反映因素间交互作用的强弱,圆形表示交互作用不显著,椭圆形表示交互作用显著。如图7所示,葡萄糖与硫酸铵交互作用显著,等高线葡萄糖的交点多于与硫酸铵的交点,因此葡萄糖、硫酸铵的交互作用中,葡萄糖对ε-PL产量的影响较大,为主效应因子。
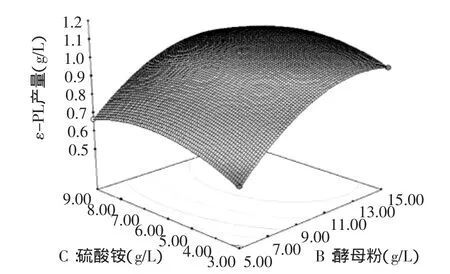
图8 酵母粉和硫酸铵对ε-PL产量影响的响应面分析图Fig.8 Response surface plot for the effects of ε-PL production between(NH4)2SO4and yeast powder
酵母粉和硫酸铵对ε-PL产量的影响如图8所示,当硫酸铵浓度一定时,ε-PL产量随着酵母粉浓度增加呈先增大后降低的趋势。当酵母粉浓度一定时,ε-PL产量先增大后降低,这与图6和图7显示的规律相同。此外从响应面图可分析得出,在各因素之间的交互影响中,酵母粉对ε-PL产量影响最大,葡萄糖次之,硫酸铵最弱。此结果与方差分析表所反映出的结果一致。在此基础上,通过Design-Expert软件,进行分析计算,可得最佳发酵培养基配方为:葡萄糖46.16 g/L、酵母粉13.03 g/L,(NH4)2SO45.91 g/L,在此条件下,ε-PL产量的预测最大值为1.101 g/L。考虑到实际培养基的配制,最终确定这三个因素的浓度分别为:葡萄糖46.1 g/L、酵母粉13.0 g/L,(NH4)2SO45.9 g/L。
2.3.4.3优化培养基的验证为了验证实验结果的可靠性,按上述最终培养基参数进行验证实验,三次重复实验的ε-PL产量分别为1.090、1.095 g/L及1.085 g/L,平均值为(1.090±0.0041)g/L,与预测值只相差1%,表明此模型是可行有效的,并具有一定的实践参考价值。
3 结论
采用紫外-氯化锂复合诱变,结合Gly-L-Lys-SG三种抗性的代谢控制育种方法,筛选获得了一株ε-PL高产菌株Gly5.95L-Lys1.35SG4.80-FQC23,其产量为(0.668±0.0045)g/L,遗传稳定性良好,比出发菌株提高15.37%。并在单因素实验基础上,采用BB实验设计,对其发酵培养基进行了优化,通过响应面法对实验数据进行优化与评价,得到影响ε-PL产量的二次多项式回归模型,并对该模型进行显著性检验。最终得到优化的培养基为(g/L):葡萄糖46.1,酵母粉13.0,(NH4)2SO45.9,MgSO4·7H2O 0.5,K2HPO40.8,KH2PO41.36,FeSO4·7H2O 0.03,ZnSO4·7H2O 0.04,在此条件下,ε-PL产量达1.101 g/L,重复验证测得ε-PL产量为(1.090±0.0041)g/L,两者相对偏差小于5%。因此,采用响应面法优化白色链霉菌培养基组成稳定可行。综上所述,代谢控制育种方法和响应面法优化培养基都为后续进一步深入研究打下了良好的基础。同时,也可为其他菌种的选育提供一定参考借鉴。
[1]Hiraki J,Ichikawa T,Ninomiya S,et al.Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J]. Regulatory Toxicology and Pharmacology,2003,37(2):328-340.
[2]Shih I L,Shen M H,Van Y T.Microbial synthesis of poly(epsilon-lysine)and its various applications[J].Bioresource Technology,2006,97(9):1148-1159.
[3]Hiraki J,Hatakeyama M,Morita H,et al.Improved ε-poly-L-lysine production of an S-(2-aminoethyl)-L-cysteine resistant mutant of Streptomyces albulus[J].Seibutu Kougaku Kaishi,1998,76:487-493.
[4]Kahar P,Iwata T,Hiraki J.Enhancement of epsiIon-polylysine production by Streptomyces albulus strain 410 using pH control[J].Journal of Bioscience and Bioengineering,2001,91(2):190-194.
[5]陈玮玮,朱宏阳,徐虹.ε-聚赖氨酸高产菌株选育及分批发酵的研究[J].工业微生物,2007,37(2):28-30.
[6]李双双,吴振强,吴清平,等.产ε-聚赖氨酸白色链霉菌复合诱变选育研究[J].中国酿造,2010,29(12):108-111.
[7]Li S,Chen X S,Dong C L,et al.Combining genome shuffling and interspecific hybridization among Streptomyces improved ε-Poly-L-Lysineproduction[J].AppliedBiochemistryand Biotechnology,2013,169:338-350.
[8]怀丽华,陈宁.嘧啶核苷高产菌的代谢控制育种策略[J].食品与发酵工业,2005,31(10):107-110.
[9]Itzhaki R F.Colorimetric method for estimating polylysine and polyarginine[J].Analytical Biochemistry,1972,50(2):569-574.
[10]圣志存,郝利民,贾士儒,等.响应面法优化红缘拟层孔菌胞外多糖发酵培养基[J].食品工业科技,2014,35(4):194-198.
[11]余明洁,田丰伟,范大明,等.高产ε-聚赖氨酸白色链霉菌的复合诱变选育研究[J].食品工业科技,2008,29(7):99-104.
[12]杨玉红,于雪骊,刘长江.紫外诱变选育多聚赖氨酸高产菌株的研究[J].北方园艺,2007,31(9):45-46.
[13]刘波,邬应龙,张霞,等.红曲霉固态发酵产木聚糖酶培养基的响应面优化[J].食品工业科技,2014,35(1):254-258.
[14]贾士儒,董惠钧,姜俊云,等.ε-聚赖氨酸高产菌株的选育[J].食品与发酵工业,2004,30(11):14-17.
[15]Kawai T,Kubota T,Hiraki J,et al.Biosynthesis of ε-polyl-lysine in a cell-free system of Streptomyces albulus[J]. Biochemical and Biophysical Research Communications,2003,311(3):635-640.
[16]Hirohara H,Takehara M,Saimura M,et al.Biosynthesis of poly(ε-l-lysine)s in two newly isolated strains of Streptomyces sp[J].Applied Microbiology and Biotechnology,2006,73(2):321-331.
Breeding of ε-poly-L-lysine producing strain with combined mutation and the optimization of its fermentation medium
WU Chen-qi1,FU Jiao-long1,2,*,CHEN Dong-quan1,QIAN Da-wei1,LI Liang-zhi1,2,HU Cui-ying1,WANG Tao-yun1
(1.School of Chemistry Biology and Material Engineering,Suzhou University of Science and Technology,Suzhou 215009,China;2.Key Laboratory of New Energy and Low-carbon Technology of Suzhou City,Suzhou 215009,China)
Using Streptomyces albulus FQ-9 as the initial strain mutated by UV combined with LiCl,and using glycine+sulfaguanidine(SG)+L-lysine as selective markers.Then,a ε-PL-producing strain,Streptomyces albulus FQC-23 of the yield improved to(0.668±0.0045)g/L was screened,which was 15.37%higher than that of FQ-9.Moreover,based on single factor experiment,the fermentation medium of ε-PL producing strain FQC-23 were optimized by response surface methodology,and finally determined the optimal fermentation medium as follows(g/L):glucose 46.1,yeast powder 13.0,(NH4)2SO45.9,MgSO4·7H2O 0.5,K2HPO40.8,KH2PO41.36,FeSO4·7H2O 0.03,ZnSO4·7H2O 0.04.Under the optimized medium,the yield of ε-PL reached(1.090± 0.0041)g/L and increased by 87.56%compared with the previous condition.
ε-poly-L-lysine;resistant medium plate;mutation;response surface methodology;Streptomyces albulus
TS201.3
A
1002-0306(2015)18-0186-07
10.13386/j.issn1002-0306.2015.18.029
2014-12-22
吴晨奇(1989-),男,硕士研究生,研究方向:生物化工、食品微生物,E-mail:612324wcq@163.com。
扶教龙(1969-),男,副教授,主要从事生物化工、发酵工程方面的研究,E-mail:jlfu999@126.com。
苏州市科技计划项目(SYN201317);苏州科技学院科研基金项目(XKZ201411)。
