红皮萝卜泡菜自然发酵过程中乳酸菌的动态变化
2015-11-04刘春燕四川农业大学食品学院四川雅安625014
刘春燕,夏 姣,徐 林,王 双,蒲 彪(四川农业大学食品学院,四川雅安625014)
红皮萝卜泡菜自然发酵过程中乳酸菌的动态变化
刘春燕,夏姣,徐林,王双,蒲彪*
(四川农业大学食品学院,四川雅安625014)
以红皮萝卜为原料,用自然发酵法泡渍,研究其发酵过程中各优势乳酸菌的消长变化规律。从四种培养基中筛选出改良的MC培养基为各类乳酸菌计数培养基,总共得到了七种明显的菌落形态特征的乳酸菌,将其依次鉴定为乳明串珠菌(Leuconostoc lactis)、乳酸乳球菌(Lactococcus lactis)、食窦魏斯氏(Weissella cibaria)、植物乳杆菌(L.plantarum)、发酵乳杆菌(L.fermentum)。对发酵过程中各种乳酸菌计数,结果显示:泡萝卜发酵前期球菌比较旺盛,发酵后期以杆菌为主。泡菜液pH达到3.5后,球菌开始消失。
红皮萝卜,发酵,泡菜,乳酸菌,动态变化
泡菜是最常用蔬菜冷加工的一种方法,其利用天然存在于蔬菜表面的微生物共同作用而完成蔬菜的发酵。乳酸菌在泡菜形成过程发挥重要的作用,能利用碳源发酵产生丰富的乳酸,乳酸既能赋予泡菜丰厚的酸味还能起到抑菌作用。
泡菜中乳酸菌的种类很多,主要覆盖了乳杆菌属、乳球菌属、明串珠菌属、片球菌属、魏斯氏菌属、肠球菌属六个属的乳酸菌。随着泡菜发酵的进行,泡菜环境中营养物质及酸度会发生变化,泡菜中乳酸菌种类和数量也不断变化。Pederson等[1]在1930年首次指出启动泡卷心菜发酵的菌种为肠膜明串珠菌。钟之绚[2]、毕金峰等[3]分别分析了酸白菜酸菜汁、泡超级白菜在不同发酵过程中乳酸菌种类及其变化规律。董硕等[4]研究了泡白菜发酵过程中乳球菌属和乳杆菌属的动态变化。Jung S L等[5]分析了韩国泡菜发酵过程中的微生物区系,发现Weissella confusa和Leuconostoc citreum存在于整个发酵过程中,Lactobacillus sakei和Lactobacillus curvatus在后期才出现。但目前对于泡菜发酵过程中乳酸菌种类及其数量变化缺乏深入研究。本实验通过对红皮萝卜泡菜自然发酵过程中的乳酸菌进行分离鉴定,分析研究了红皮萝卜泡菜自然发酵过程中不同乳酸菌的消长规律,为进一步研究泡红皮萝卜中乳酸菌对其风味的影响机理提供一定的理论依据。
1 材料与方法
1.1材料与仪器
新鲜红皮萝卜购于雅安农贸市场;2×PCR Master Mix、离心柱型细菌基因组DNA提取试剂盒北京天根生物科技有限公司;供试用培养基MRS培养基、蔗糖硫胺培养基、M17培养基、改良MC培养基按文献方法[6-7]配制。
Powerpac Basic电泳仪、MycyclerTMThermal Cycler PCR仪、Universal HoodⅡ凝胶成像系统美国BIORAD公司;YXQ.SG41.280高压蒸汽灭菌锅上海华线医用核子仪器有限公司;CX21S1电子显微镜日本OLYMPUS公司;SW-CJ-IF单人双面超净工作台苏净安泰空气技术有限公司。
1.2实验方法
1.2.1泡菜的泡制将红皮萝卜清洗、切分(2 cm×2 cm的方块)、晾干后放入灭菌泡菜坛中,以料液比1∶2加入灭菌水,再添加3.5%(原料+水)食盐,室温发酵。
1.2.2培养基的优选取不同发酵期的红皮萝卜泡菜液作梯度稀释,取合适的2~3个稀释度的稀释液分别涂布于MRS、蔗糖硫胺、M17、改良MC平板上,30℃恒温培养2~3 d后观察菌落形态,并对各种平板上每种菌落形态和菌落总数进行记录,挑取出现明显菌落形态、菌落形态种类多、菌落总数多的培养基为实验用培养基。
1.2.3红皮萝卜泡菜发酵过程中不同菌落形态乳酸菌的动态变化以1.2.2中出现菌落形态明显且菌落形态种类最多的培养基作为实验用培养基。分别取发酵0~10 d的红皮萝卜泡菜液进行乳酸菌动态分析。将泡菜做梯度稀释后,取2~3个稀释度的稀释液涂布于实验培养基上,30℃恒温培养2~3 d后观察计数,每个梯度做两个平行,计数按照国标[7]进行。
1.2.4pH与可滴定酸的测量pH的测量:用酸度计测量;可滴定酸的测量:按国标GB/T 12456-2008测量[8]。
1.2.5不同菌落形态乳酸菌的鉴定
1.2.5.1乳酸菌的初步鉴定将平板上长的不同形态的菌落每种挑取3~5株划线纯化,进行革兰氏染色镜检观察,并做过氧化氢酶实验。将有典型乳酸菌镜检形态革兰氏阳性且过氧化氢酶阴性的菌株多次纯化后用甘油管保种。生化鉴定方法参照《乳酸细菌分类鉴定及实验方法》[6]和《伯杰氏细菌鉴定手册》第八版[9],根据菌株的培养形态特征及生理生化特性初步确定其分类地位。
1.2.5.2乳酸菌的分子学鉴定将保种的不同菌落形态的菌株进行活化后(每种形态两株),用试剂盒提取菌株的总DNA,以27f、1492r为引物对扩增菌株16S rDNA序列。其引物序列:正向引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物1492r:5′-GGTTACCTTGTTACGACTT-3′[10]。
PCR扩增体系:2×PCRMaster Mix 12.5 μL、引物各1 μL、模板DNA 1 μL、ddH2O补至25 μL。
PCR扩增程序:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,共 30个循环;最后72℃延伸5 min。
PCR扩增产物用1%琼脂糖凝胶电泳检验,目的片段长度在1.5 ku左右。PCR扩增产物送华大基因测序。
1.2.5.3系统发育树分析将菌株的16S rRNA基因序列提交到GenBank核酸序列数据库并与数据库中已知的相关序列进行比较,将相似度高的序列与测定序列通过Clustalx进行多重序列比对,比对结果用MEGA软件中的Neighbor-Joining法构建系统发育树[11]。
1.2.6红皮萝卜泡菜发酵过程中乳酸菌的动态变化
取不同发酵时期的泡菜液进行乳酸菌动态分析。将泡菜液做梯度稀释后,取10-2~10-6的稀释液涂布于实验培养基上,30℃恒温培养3 d后观察菌落形态并对不同的菌落形态菌株分别计数,每个梯度做3个平行,计数方法按照国标方法[7]进行。将不同菌落形态菌株的计数结果结合1.2.5的乳酸菌鉴定结果,将鉴定为同一种属的不同菌落形态计数结果累加,而得到不同乳酸菌的数量。同时测定不同发酵时期泡菜液的总酸及pH,分析乳酸菌的动态变化。
1.2.7数据处理实验数据采用Excel和Origin 8.1软件进行数据处理与分析。
2 结果与分析
2.1培养基的优选
将不同发酵期的红皮萝卜泡菜液涂布在MRS、蔗糖硫胺、M17、改良MC平板上,得到的每种平板上的菌落形态种类以及乳酸菌总数分别见表1、图1。
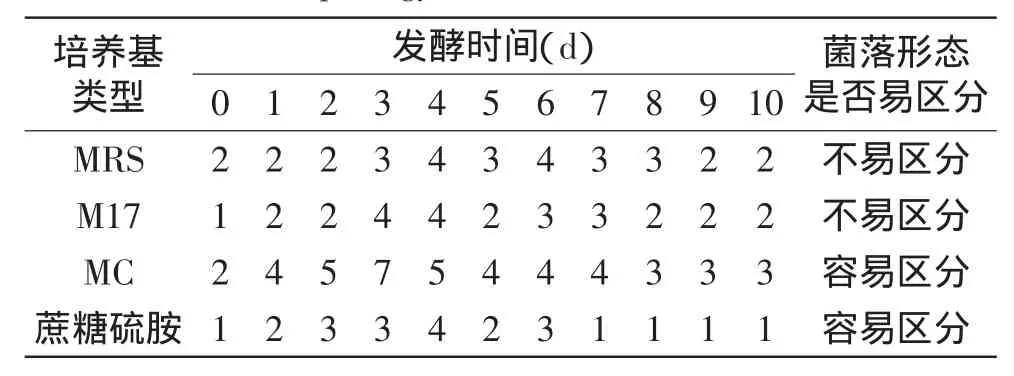
表1 不同培养基上乳酸菌菌落形态种类Table 1 Morphology of colonies in different medium
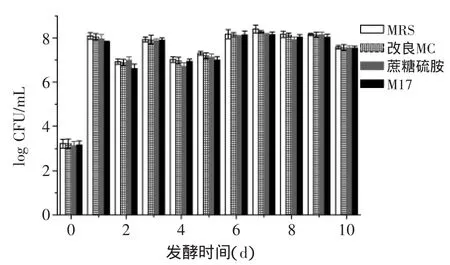
图1 不同培养基上乳酸菌总数的动态变化Fig.1 Dynamic changes of the total number of lactic acid bacteria in different medium
从乳酸菌菌落总数来看,在这四种培养基上,不同发酵期的红皮萝卜泡菜液中乳酸菌菌落总数保持在103~109CFU/mL之间,MRS和改良的MC培养基上乳酸菌菌落总数比M17和蔗糖硫胺培养基上偏高。从菌落形态来看,在改良的MC培养基上泡菜乳酸菌形态特征比较明显,且出现的种类最多。综合考虑乳酸菌菌落总数和乳酸菌菌落形态特征及种类,选择改良的MC培养基对红皮萝卜发酵过程中的每种优势乳酸菌进行计数。
2.2改良MC培养基上乳酸菌菌落形态
分别取发酵1~10 d的红皮萝卜泡菜水的稀释液涂布于改良MC平板上,30℃培养3 d后记录乳酸菌菌落形态和数量,总共得到7种不同菌落形态的乳酸菌,分别命名为MCA-1~MCA-7。挑取改良MC平板上有MCA-1~MCA-7菌落形态的菌株纯化划线,每天的平板上每一类菌落形态的菌挑取3~10株,(每一个平板上挑取菌落总数的平方根株菌划线纯化)纯化后的单个菌落革兰氏染色结果均为阳性,过氧化氢酶阴性,且随机挑取的同一类菌落形态的不同菌株经过多化后菌落形态保持一致,镜检形态也相同,其菌落形态特征及个体形态特征见表2,照片见图2。

表2 菌落形态特征及细胞形态特征Table 2 Morphology of colonies and morphology of microscopy
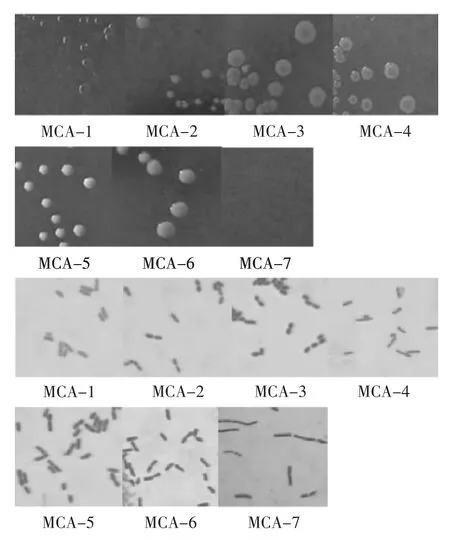
图2 菌落形态特征(上)及细胞形态(下)Fig 2 Morphology of colony(up)and morphology of microscopy(below)
由图2可知,MCA-1~MCA-7有明显的菌落形态特征,彼此容易区分,但细胞形态上却有部分相似点,如MCA-2与MCA-3在菌落形态上差异很大,但细胞形态却很相似。同时MCA-5与MCA-6在细胞形态上也难以区分。结合各菌株的菌落形态及细胞形态,可得不同菌落形态的菌株其细胞形态可能相同。
2.3不同菌落形态乳酸菌的鉴定
2.3.1生理生化挑取每一种菌落形态的菌株3~5株,多次纯化后进行生理生化测试。得到的结果如表3。菌落形态相似的不同菌株其生理生化测试表现一致,此外,从生理生化表现来看,MCA-2与MCA-3应该为同一类球菌,MCA-5、MCA-6可能为同一类杆菌。结合与伯杰氏细菌鉴定手册,MCA-1和MCA-4菌落形态的菌株可能为明串珠菌属或魏斯氏菌属的菌株,MCA-2与MCA-3可能是乳球菌属,MCA-5、MCA-6为乳杆菌属中同型发酵的种,MCA-7为乳杆菌属中异型发酵的种。
2.3.216S rDNA序列测定对分离的不同菌落形态的菌株(每种菌落形态随机选取两株)提取DNA,对其16S rDNA序列进行扩增后进行电泳检测,均得到明显的目的条带,电泳检测图如下:
图3 16SrDNA扩增产物电泳结果Fig.3 Elctrophoresis of amplification products of 16S rDNA
利用BLAST软件,将14株乳酸菌的16SrDNA/rRNA序列与GenBank中已知乳酸菌的相应序列进行比较,比较后可知,3-1-1、2-1-1两株菌与Leuconostoc lactis NBRC 102477的同源性均在99%以上,从分子水平上可将这两株归属为Leuconostoc lactis;而2-2-3,3-2-1,3-3-2,2-3-1与Lactococcus lactis CICC 6025的同源性在99%以上,而可将该四株菌认定为Lactococcus lactis,MCA-2、MCA-3可能为Lactococcus lactis两种不同表型;1-4-1与4-4-1则同Weissella cibaria NRIC 0136有较高的同源性,达到100%;3-5-3,8-5-2,3-6-1,9-6-1则与Lactobacillus plantarumNBRC 101977的同源性达到99%以上,则MCA-5与MCA-6为Lactobacillus plantarum的两种不同表型;3-7-2和6-7-1和Lactobacillus fermentum NBRC 3961同源性为100%,被判定为Lactobacillus fermentum。且同一菌落形态的两株不同菌株均属于同一乳酸菌种群,因而可以将这14株菌和5株相应模式菌株的16S rDNA序列构建了系统发育树,结果见图4。从系统发育树上可看出:七种不同菌落形态的菌株总体可分为5个大群,依次为Leuconostoc lactis、Lactococcus lactis、Weissella cibaria、Lactobacillus fermentum、Lactobacillus plantarum类群,且在改良MC培养基上有不同菌落形态的菌株其在分子分类上可能为同一类。
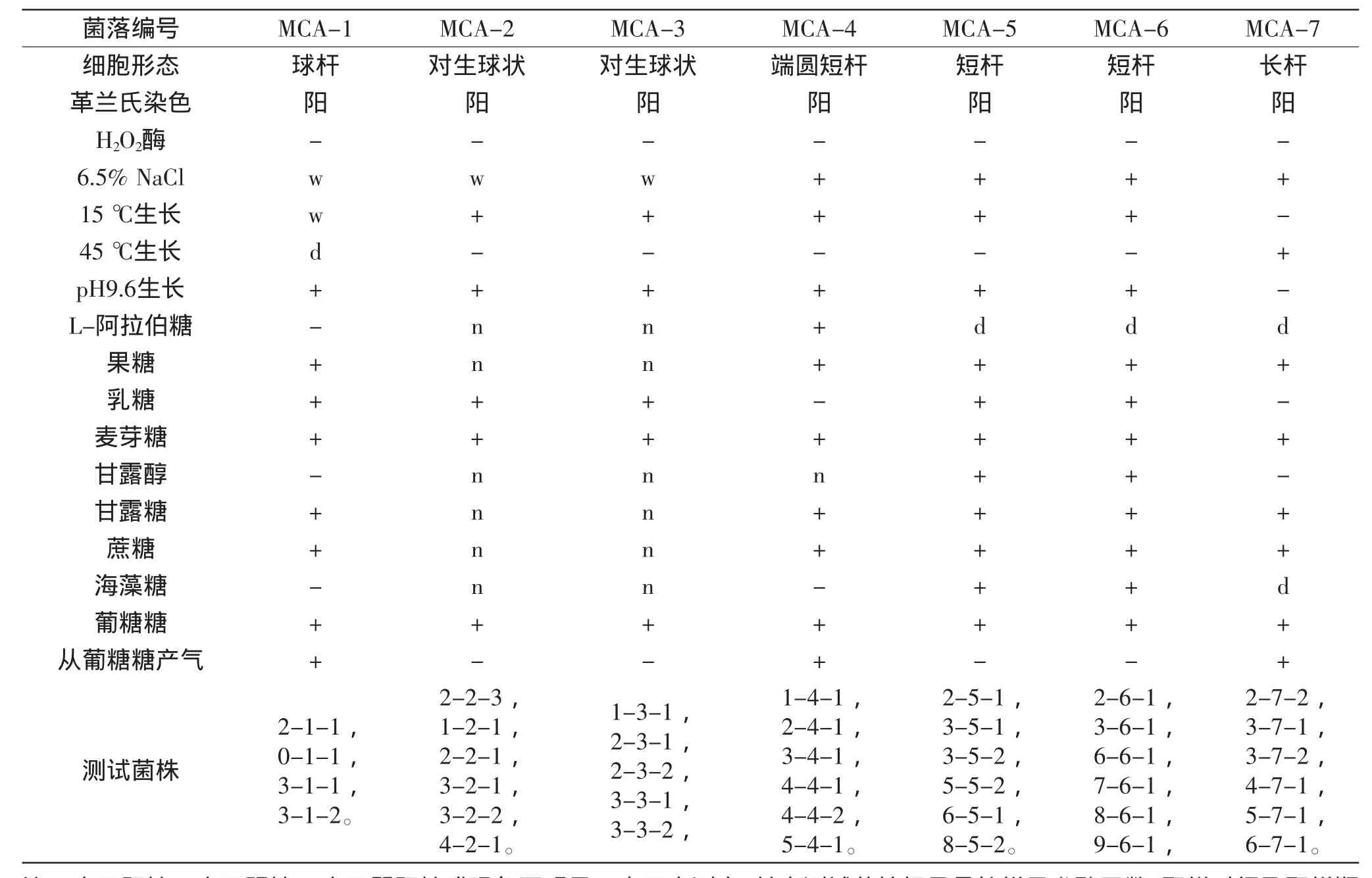
表3 菌株生理生化特性Table 3 Physico-chemical characteristics
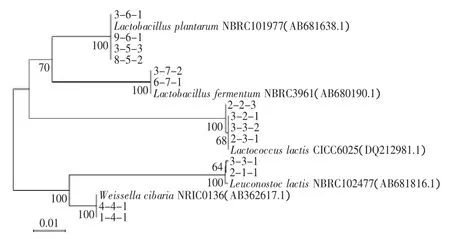
图4 16S rDNA系统发育树Fig.4 Phylogenetic tree derived from 16S rDNA sequences
2.4泡萝卜发酵过程中乳酸菌的动态变化
泡萝卜发酵过程中总酸、pH、乳酸菌的动态变化如图5、图6。
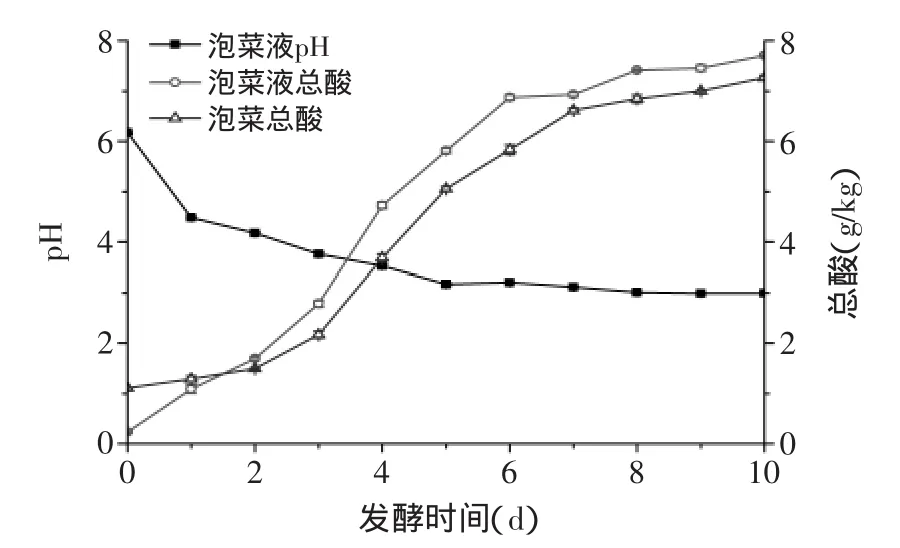
图5 泡萝卜发酵过程总酸、pH动态变化Fig.5 Daynamic changes of total acid and pH during the fermentation of pickled red radish
由图5可知,泡萝卜自然发酵过程,总酸先随时间的增加而显著增加,当总酸含量达到7.0 g/kg时趋于稳定,且泡萝卜和泡菜液中总酸含量基本一致;pH随发酵的进行而明显降低,pH达到3.5后趋于稳定,最后保持在3.0左右。
由图6可以看出,泡萝卜发酵过程中,Leuconostoc lactis、Lactococcus lactis、Weissella cibaria三种菌在泡菜水中活跃早,存活时间较短,该三种菌在发酵的第3 d出现消减趋势,分别在发酵第4、5、6 d完全消失,在泡菜水中的最大检出量依次为6.2、8.0、7.1 log CFU/mL;L.fermentum、L.plantarum在泡菜水中出现的时间稍晚,但存活时间长。植物乳杆菌在泡菜发酵第3 d后数量基本保持在7.0~8.0 log CFU/mL,发酵乳杆菌在发酵第3 d数量达到最大值(7.0 log CFU/mL)后逐渐减少,到发酵的第7 d后保持在5.0 log CFU/mL。在整个发酵过程中,乳酸菌总数的从第1 d后基本稳定,保持在8.0 log CFU/mL左右。
结合泡萝卜发酵过程中乳酸菌、pH、总酸的变化可得:在总酸<2 g/kg时(pH>3.8),泡菜水中的乳酸菌以Leuconostoc lactis、Lactococcus lactis、Weissella cibaria为主体;2 g/kg<总酸<5.5 g/kg时(3.3<pH<3.8),Leuconostoc lactis、Lactococcus lactis、Weissella cibaria、L.fermentum、L.plantarum共存;5.5 g/kg<总酸时(pH<3.3),L.fermentum、L.plantarum为主体。
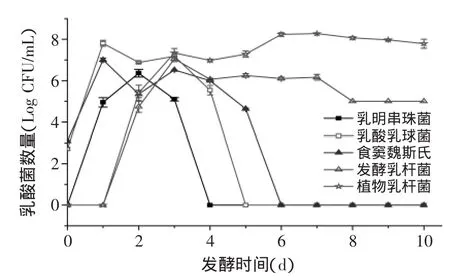
图6 泡萝卜发酵过程中乳酸菌的动态变化Fig.6 Daynamic changes of lactic acid bacteria during the fermentation of pickled radish
3 讨论
泡菜中活动的乳酸菌种类与泡菜产地、原料种类、发酵方式有关。不同学者由于采用的研究方法及原料不一样,得到的结果也不尽相同。陈功等[12]研究了四川泡菜乳酸菌多样性,发现L.plantarum、Pediococcus ethanolidurans、L.brevis、Leuconostoc mesentroides等是四川泡菜发酵的优势菌群。谈重芳等[13]报道了河南林州泡菜中的L.plantarum、L.brevis、L.pentosus、L.fermentum、L.collinoides、Lactobacillus buchneri、Leuconostoc mesentroides,且乳杆菌为优势菌,燕平梅等[14]也有相似的报道。Jie Yu等[15]从泡菜中分离到了Pediococcus ethanolidurans和Leuconostoc lactis,Ayaka IuChi等[16]从日本泡菜nuka-zuke分离到Pediococcus ethanolidurans和Leuconostoc lactis,Yisheng Chen等[17]从发酵黄瓜中分离到了Leuconostoc lactis和Weissella cibaria。国内对泡菜中乳杆菌报道居多,关于Leuconostoc lactis、Weissella cibaria的报道很少。本次实验从泡菜中分离到了Leuconostoc lactis、Lactococcus lactis、Weissella cibaria、L.plantarum、L.fermentum.五种乳酸菌,丰富了国内泡菜中乳酸菌种类报道。但同时未检到常见报道的L.brevis、L.pentosus、Leuconostoc mesentroides,其可能与采用的泡菜原料相关,也有可能是这几种菌在改良MC上的形态与其他菌种相似性太高,且在数量上不占优势相关。
在泡菜自然发酵过程中,随着发酵的进行,泡菜内环境会发生不断变化,不同乳酸菌在泡菜液中的活跃期随其对内环境的耐受性不同而不同。在发酵初期,在盐水的高渗透作用下,蔬菜中的可溶性物质进入泡菜液中,为微生物的生长提供了营养物质,此时,存在于原料上的优势菌属如明串珠菌及乳球菌等快速繁殖。在发酵的第0 d,萝卜泡菜液中只检测到Lactococcus lactis和Weissella cibaria,这说明在原料表面的Lactococcus lactis和Weissella cibaria要远远多于其他乳酸菌。在发酵第1 d,泡菜液中Lactococcus lactis和Weissella cibaria很活跃,数量分别达到7.9、7.1 log CFU/mL,同时Leuconostoc lactis也被检测出来,数量达到5.2 log CFU/mL,这些乳酸菌快速繁殖会产生大量乳酸等酸性代谢产物,而使pH降低。低pH不仅能抑制有害菌的生长,还会抑制乳酸菌本身的生长。Lactococcus lactis、Weissella cibaria、Leuconostoc lactis在泡菜液中消失的时间的先后与自身耐低pH有关。三者的耐pH能力:Leuconostoc lactis<Lactococcus lactis<Weissella cibaria,在泡菜液pH达到3.5时,三者数量明显减少,且分别在第4、5、6 d消失。Lactococcus lactis、Weissella cibaria,Leuconostoc lactis在泡菜发酵前期能保持优势,还跟这三种菌本身的生长周期有关。Sang Hyeon Jeong等[18]研究发现在韩国泡菜发酵过程中,Leuconostoc citreum,Leuconostoc holzapfelii,Lactococcus lactis和Weissella soli在前期比较活跃,随后又被L.sakei,Leuconostoc gasicomitatum和Weissella koreensis代替。乳杆菌在发酵的第2 d被检出,L. fermentum在第3 d达到最高峰后逐渐减少最后保持稳定,L.plantarum从发酵第3 d(pH3.5)开始,在数量上居主导地位,保持在7~8 log CFU/mL。L.fermentum和L.plantarum能稳定生长于泡菜水中,与他们有较强的耐酸性相关。
有学者[19]研究了泡卷心菜中乳酸菌的动态变化,发现泡卷心菜中的优势菌一开始为Leuconostoc mesenteroides subsp.mesenteroides,然后为E.faecalis and L.lactis subsp.lactis、L.zeae,最后L.plantarum和L.casei占主体。与本文的研究在优势菌种类上有差异,由于自然发酵泡菜中的乳酸菌主要来自原料,这可能说明不同地方的不同蔬菜原料附带的乳酸菌种类不一样。陈功等[12]研究了四川泡菜中乳酸菌的多样性,发现四川泡菜主要包括植物乳杆菌、肠膜明串珠菌、短乳杆菌、发酵乳杆菌、乳酸乳球菌、清酒乳杆菌等,没有覆盖本文分离到的乳明串珠菌及魏斯氏菌属,可能是因为这两种菌在泡菜中存活的时间比较短,而大部分研究只是针对发酵成熟的泡菜进行的。
实验研究结果和一些学者的研究结果在动态上有相同点,在菌种类上有差异:如Tao Xiong等[19]研究了酸菜发酵过程中乳酸菌的消长规律,发现Leuconostoc mesenteroides subsp.mesenteroid启动整个发酵过程,随后是E.faecal,Lactococcus 1actis subsp.Lacti,L.zeae出现并参与发酵,最终L.plantarum和L.casei终止发酵过程;Ji Young Jung等[20]发现Leuconostoc Mesenteroides是韩国泡菜发酵前期最活跃的乳酸菌,随后变成L.sakei和W.koreensis,且L.sakei在发酵的第25 d消失。这些在整体上都证明了乳球菌、明串珠菌在泡菜发酵前期活跃,乳杆菌在泡菜发酵中后期较活跃。
4 结论
实验筛选出改良的MC培养基为优良的各类乳酸菌计数培养基,同时从红皮萝卜泡菜自然发酵过程中共分离得到了五种乳酸菌,分别为乳明串珠菌(Leuconostoclactis)、乳酸乳球菌(Lactococcus lactis)、食窦魏斯氏(Weissella cibaria)、植物乳杆菌(L.plantarum)、发酵乳杆菌(L.fermentum)。红皮萝卜泡菜自然发酵过程中前期的优势菌为Lactococcus lactis、Weissella cibaria、Leuconostoc lactis,中后期为L.fermentum和L.plantarum,前期优势菌耐酸力弱于中后期优势菌。
[1]Pederson C S.Floral changes in the fermentation of Sauerkraut[R].Geneva,New York:New York State,1930.
[2]钟之绚,郭剑.酸白菜发酵中乳酸菌群的分析[J].微生物学报,1995,35(1):74-76.
[3]毕金峰,刘和江.自然发酵酸菜汁中乳酸菌的分离鉴定及发酵剂的筛选[J].沈阳农业大学学报,2000,31(4):346-349.[4]董硕,孟宪军,张庆芳.乳酸菌发酵蔬菜菌体生长规律的研究[J].中国调味品,2010,35(11):59-62.
[5]Jung S L,Gun Y H,Jun W L.Analysis of kimchi microflora usingdenaturinggradientgelelectrophoresis[J].International Journal of Food Microbiology,2005,102(2):143-150.
[6]凌代文.乳酸细菌分类鉴定及实验方法[Z].北京:中国轻工业出版社,1999,117-120.
[7]中华人民共和国卫生部GB 4789.35-2010食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2010.
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会GB/T 12456-2008食品中总酸的测定[S].北京:中国标准出版社,2008.
[9]Buchanan E R.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984:702-707.
[10]敖晓琳,张小平,史令,等.四川泡菜中两株优良乳酸菌的鉴定及不同发酵条件对其发酵泡菜品质的影响[J].食品科学,2011,32(11):152-156.
[11]金红星,田方,成文玉.辣白菜中明串珠菌的筛选及鉴定[J].中国酿造,2009,209(8):82-84.
[12]陈功,张其圣,余文华,等.四川泡菜乳酸菌多样性及其功能特性[J].食品与发酵工业,2013,39(3):1-4.
[13]谈重芳,王晶晶,王雁萍,等.河南林州泡菜中微生物多样性及乳酸菌种群的研究[J].食品科技,2010(7):14-17.
[14]燕平梅,谢腾云,高继萍,等.泡白菜卤中优势微生物的分离鉴定及抗菌特性的研究[J].中国酿造,2010,218(5):99-101.
[15]Yu J,Gao W,Qing M,et al.Identification and characterization of lactic acid bacteria isolated from traditional pickles in Sichuan,China[J].The Journal of general and applied microbiology,2012,58(3):163-172.
[16]Aso Y,Takeda A,Sato M,et al.Characterization of Lactic Acid Bacteria Coexisting with a Nisin Z Producer in Tsuda-Turnip Pickles[J].Current Microbiology,2008,57(1):89-94.
[17]Chen Y,Wu H,Lo H,et al.Isolation and characterisation of lactic acid bacteria from jiang-gua(fermented cucumbers),a traditional fermented food in Taiwan[J].Journal of the Science of Food and Agriculture,2012,92(10):2069-2075.
[18]Jeong S H,Lee S H,Jung J Y,et al.Microbial Succession and Metabolite Changes during Long-Term Storage of Kimchi[J]. Journal of Food Science,2013,78(5):M763-M769.
[19]Xiong T,Guan Q Q,Song S H,et al.Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J].Food Control,2012(26):178-181.
[20]Jung Ji Young,Lee Se Hee,Jin Hyun Mi,et al. Metatranscriptomicanalysisoflacticacidbacterialgene expression during kimchi fermentation[J].International Journal of Food Microbiology,2013,163:171-179.
Dynamic changes of lactic acid bacteria flora during the fermentation of red radish pickle
LIU Chun-yan,XIA Jiao,XU Lin,WANG Shuang,PU Biao*
(College of Food,Sichuan Agricultural University,Ya’an 625014,China)
A red radish as materials by spontaneous fermentation making Sichuan pickle in this paper.The dynamic changes of lactic acid bacteria flora during the fermentation period were studied.MC was isolated as lactic acid bacteria counting substrate from 4 substrates,and there were 7 obvious floras characteristics lactic acid bacteria on it,which identified as Leuconostoc lactis,Lactococcus lactis,Weissella cibaria,L.plantarum,L.fermentum.The results showed that,coccus predominated in the early stage of fermentation in radish pickle,while Bacillus were the mainly lactic acid bacteria during final stage of fermentation.After the pH of pickle reached to 3.5,the coccus began to disappearing.
red radish;fermentation;pickle;lactic acid bacteria;dynamic change
TS201.3
A
1002-0306(2015)18-0176-06
10.13386/j.issn1002-0306.2015.18.027
2014-12-22
刘春燕(1989-),女,在读硕士研究生,研究方向;果蔬加工理论与技术,E-mail:chunyanliu1989@126.com.。
蒲彪(1956-),男,博士,教授,研究方向:果蔬加工、功能性食品,E-mail:pubiao2002@163.com。
“十二五”国家科技支撑项目(2012BAD31B04);国家自然科学基金资助项目(31171726);四川省科技支撑计划项目(2012NZ0002)。
