核桃青皮提取物抑菌活性及抑菌机理研究
2015-11-04任先伟魏晓璐夏雪山昆明理工大学生命科学与技术学院云南昆明650500
任先伟,魏晓璐,黄 鑫,刘 丽,冯 悦,夏雪山(昆明理工大学生命科学与技术学院,云南昆明650500)
核桃青皮提取物抑菌活性及抑菌机理研究
任先伟,魏晓璐,黄鑫,刘丽*,冯悦,夏雪山
(昆明理工大学生命科学与技术学院,云南昆明650500)
用石油醚、氯仿、乙酸乙酯和正丁醇等不同极性有机溶剂对核桃青皮乙醇提取物进行萃取,以7种细菌为供试菌,采用离体实验方法对核桃青皮乙醇提取物的不同极性萃取相进行抑菌作用研究并探讨其作用机理。结果表明:各萃取相对供试细菌均有一定抑制作用:乙酸乙酯相>氯仿相>正丁醇相>石油醚相。乙酸乙酯萃取相对7种细菌均有较好抑制效果,具有广谱抑菌作用。在浓度为50 mg/mL时,乙酸乙酯萃取相抑菌效果最好,对金黄色葡萄球菌的抑菌圈直径达到19.94 mm,对其最低抑菌浓度(MIC)和最低杀菌浓度(MBC)分别为0.781和1.563 mg/mL。乙酸乙酯萃取相对温度和紫外线的耐受力较强,抑菌作用受pH影响较大,NaCl和蔗糖的添加对菌体生长也有一定抑制。其抑菌机理主要是破坏菌体的细胞壁或膜的结构。
核桃青皮提取物,抑菌活性,抑菌机理
核桃(Juglans regia Linn.),也叫胡桃或者羌桃,为胡桃科核桃属落叶乔木。我国核桃资源十分丰富[1],核桃全身是宝,其果仁含有丰富的蛋白质、脂肪、矿物质和维生素等,成为食品、食用油脂行业的优质原料;核桃枝、叶、壳、青皮、树皮等均有药用价值[2-3]。近年来,我国核桃产量稳步增长,对核桃资源的综合开发利用已成为发展核桃产业的关键。核桃青皮又称青龙衣,是核桃壳外部的一层厚厚的绿色果皮。核桃青皮在核桃采收后被大量堆放在田间、沟边或地头,严重污染环境也造成资源浪费。核桃青皮中含有大量生物活性物质如酚类、酮类、生物碱等,研究核桃青皮中生物活性物质,有利于充分发挥核桃青皮的利用价值。有学者对其活性物质抗菌杀虫及化感作用等方面做出报道[4-7],但对核桃青皮在抑菌杀虫作用的研究多停留在初步的抑菌效果上[8-12],尤其缺乏对其功能活性的作用机理研究。
本研究通过管碟法和最低抑菌浓度(MIC)实验,检测核桃青皮乙醇提取物的不同极性萃取对常见于临床产生耐药性细菌的抑菌活性,同时考察了pH、温度、NaCl浓度、蔗糖浓度、紫外照射等因素对核桃青皮提取物抑菌作用效果的影响,通过透射电镜观察、检测培养液电导率以及大分子物质溶出情况研究核桃青皮提取物抑菌机理。为进一步探索核桃青皮在农业病害防治、食品安全保藏以及消毒杀菌的医药研发方面提供科学的实验与理论基础,为核桃青皮资源的多途径综合开发应用寻找出路。
1 材料与方法
1.1材料与仪器
核桃青皮取自云南临沧核桃产区,洗净后阴干,阴干的核桃青皮置粉碎机粉碎,过100目筛,储存备用;乙醇、石油醚、氯仿、乙酸乙酯、正丁醇、丙酮均为分析纯,天津博迪化工有限公司;革兰氏阳性菌(G+):金黄色葡萄球菌(Staphylococcus aureus),革兰氏阴性菌(G-):大肠杆菌(Escherichia coli)、普通变形杆菌(Proteus vuigaris)、肺炎克雷伯菌(Klebsiella pneumoniae)、粘质沙雷(Serratia marcescens)、肠炎沙门菌(Salmonellaenteritidis)、铜绿假单胞菌(Pseudomonas aeruginosa)由云南省第一人民医院检验科提供;培养基牛肉膏蛋白胨培养基;磷酸缓冲盐溶液;四氧化锇。
LRH-70F恒温生化培养箱上海玺恒实业有限公司;ALLEGRA X-15R高速冷冻离心机Beckman coulter;Q-250B粉碎机广州市旭朗机械设备有限公司;RE1002旋转蒸发仪、RE1002旋转蒸发器水浴槽、RE300B高压真空泵西安禾普生物科技有限公司;XFH-40CA高温高压灭菌锅湟中东山建材开发有限公司;HH-1恒温水浴锅常州赛普实验仪器厂;BHC-1300IIB2超净工作台苏州苏洁净化设备公司;GK-9040鼓风干燥箱泰州兰迪医用设备厂;DW-86L828超低温冰箱苏州柏兆科学仪器有限公司;TS-100C恒温摇床金坛市精达仪器制造有限公司;Scientz-18SN冷冻干燥机上海市茸研仪器有限公司;JEM-2100透射电镜日本电子株式会社。
1.2实验方法
1.2.1核桃青皮粗提物的制备与分离取核桃青皮粉100 g,用85%乙醇室温冷浸提取4次,每次24 h。合并滤液减压旋转蒸发至浸膏状,将部分醇提物用50%丙酮配成浓度为干样500 mg/mL待测液。剩余部分依次用石油醚、氯仿、乙酸乙酯和正丁醇按1∶1的比例进行液-液逐级萃取各24 h,经45℃旋转蒸发后得到相应萃取相浸膏。用50%丙酮将各萃取相配制成浓度为50 mg/mL的待测液,4℃冰箱保存备用。
1.2.2抑菌活性检测采用管碟法[13]。取培养至对数期、浓度为106~107cfu/mL的菌悬液200 μL加入到9 cm平板中,向平板中加入7 mL培养基,充分混匀制成带菌平板。在培养基上放置牛津杯,分别向牛津杯中加入100 μL不同浓度的待测液,每菌做3组重复,同时设置阴性对照组。金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、肺炎克雷伯菌、肠炎沙门菌、铜绿假单胞菌于37℃、粘滞沙雷菌于30℃培养18 h,用十字交叉法测量抑菌圈直径,取重复实验的平均值作为结果。
1.2.3最低杀菌浓度(MBC)和最低抑菌浓度(MIC)测定[14]采用试管梯度稀释法。将浓度为50 mg/mL的待测液用培养基依次倍比稀释成50、25、12.5、6.25、3.125、1.563 mg/mL的浓度。将已培养至对数生长期的细菌加入待测液中,调整其浓度为106~107cfu/mL。对照组含相应浓度的有机溶剂。220 r/min下,金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、肺炎克雷伯菌、肠炎沙门菌、铜绿假单胞菌37℃、粘滞沙雷30℃培养,18 h后观察,培养液澄清,摇匀后仍澄清者表明无细菌生长,培养液浑浊则表明有细菌生长,以能抑制细菌生长的最低药液浓度作为MIC值。
依次取未见细菌生长的各管培养物,划线于固体培养基上,金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、肺炎克雷伯菌、肠炎沙门菌、铜绿假单胞菌37℃、粘滞沙雷30℃培养18 h。平板上菌落数小于5个的最高药物浓度即为最低杀菌浓度MBC。
1.2.4不同影响因素对核桃青皮提取物抑菌活性的影响
1.2.4.1pH对抑菌作用的影响用1 mol/L的柠檬酸和1 mol/L的NaOH溶液分别将待测液pH调为3.0、5.0、6.0、7.0(待测液原pH为4.12),培养基的pH调为5.0、6.0、7.0、8.0,采用管碟法进行抑菌实验,每处理做3个重复,以相应有机溶剂做空白对照。
1.2.4.2温度对核桃青皮乙酸乙酯萃取相的稳定性的影响将待测液分别置于70、80、90、100℃的水浴中处理20 min,采用管碟法进行抑菌实验,每处理做3个重复,以未经处理的待测液作为对照。
1.2.4.3不同NaCl、蔗糖浓度对抑菌作用的影响分别向待测液中添加10%、20%、30%、50%的NaCl或蔗糖,采用管碟法进行抑菌实验,每处理做3个重复,以未经处理的待测液作为对照。
1.2.4.4紫外线对核桃青皮乙酸乙酯萃取相的稳定性的影响将待测液分别置于紫外灯下处理15、30、45、60 min,采用管碟法进行抑菌实验,每处理做3个重复,以未经处理的待测液作为对照。
1.2.5核桃青皮乙酸乙酯萃取物的抑菌机理
1.2.5.1核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌生长曲线的影响向菌悬液中加入待测液使其终浓度为1 mg/mL,设立阴性对照组,220 r/min、37℃恒温摇床继续培养。每隔2 h取菌液3 mL,离心收集菌体,生理盐水洗3次后重悬于3 mL生理盐水,分光光度计测定600 nm波长下吸光度值。以时间为横坐标,OD600nm值为纵坐标,绘制核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌抑制作用的生长曲线,分析其抑菌活性及作用特点。
1.2.5.2核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌细胞形态的影响以2.5%戊二醛固定细菌,4℃放置2 h,0.01 mol/L磷酸缓冲液洗涤三次,离心后经四氧化锇再固定,乙醇逐级脱水,环氧树脂包埋等步骤处理,制备成超薄切片。在透射电镜下进行观察。
1.2.5.3核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌培养液电导率的影响向菌悬液中加入待测液使其终浓度为1 mg/mL,对照组向菌悬液中加入相应体积的溶剂,220 r/min、37℃恒温摇床继续培养。药物作用0、2、4、6、8、10、12 h取菌液3 mL,5000 r/min离心15 min取上清,去离子水稀释20倍后,用电导仪测各时间点培养液的电导率,做3组重复,从而研究菌体内部离子的渗出变化趋势。
1.2.5.4核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌培养液中大分子物质的影响取活化好的金黄色葡萄球菌,用培养基稀释成含菌数为106~107cfu/mL的菌悬液。处理组向菌悬液中加入待测液使其终浓度为1 mg/mL,设立对照组,220 r/min、37℃恒温摇床继续培养。待药物作用0、2、4、6、8、10、12 h取菌液3 mL,12000 r/min离心5 min取上清,紫外分光光度计测定260 nm波长下吸收值。将含有相同核桃青皮乙酸乙酯萃取物浓度的培养液12000 r/min离心5 min,取其上清样品的OD260nm来校正处理组;研究乙酸乙酯萃取相作用后上清液中DNA和RNA等大分子物质的变化。
1.2.6数据分析应用Excel工具作图。
2 结果与讨论
2.1核桃青皮提取物对7种细菌的抑制作用
2.1.1核桃青皮各萃取相对7种细菌的抑制作用核桃青皮中存在着丰富的抑菌或杀菌活性物质,从核桃青皮乙醇提取物中萃取的不同极性活性物质对7种细菌均有不同程度的抑制作用,结果见表1。不同极性溶剂萃取后所得的相应萃取相抑菌效果存在较大的差异,在供试浓度为50 mg/mL时,各萃取相对供试菌抑制作用为:乙酸乙酯相>氯仿相>正丁醇相>石油醚相。乙酸乙酯萃取相对7种细菌均有较好抑制效果,对金黄色葡萄球菌的抑制效果最好,其次是普通变形杆菌、铜绿假单胞菌和粘质沙雷菌。其中大肠杆菌和肠炎沙门菌仅对乙酸乙酯萃取相敏感,石油醚、氯仿、正丁醇萃取相对这两种菌抑制作用均不明显。乙酸乙酯相的抑菌效果明显优于其他三相,具有广谱抑菌作用,说明核桃青皮中的抑菌活性成分主要集中在中等极性部位,因此选用乙酸乙酯相做进一步研究。同时,对乙酸乙酯萃取相的进一步活性追踪将有望开发出具抗菌活性的物质,本实验仅限于研究核桃青皮粗提物及其萃取物的抑菌活性,对其中起抑菌作用的活性成分进一步分离纯化仍需进一步的探讨。

表1 核桃青皮各萃取相对细菌的抑制效果Table 1 Inhibiting activities of extracts of walnut green husk with different solvents to bacteria
2.1.2不同浓度乙酸乙酯萃取相对7种细菌的抑制作用不同浓度乙酸乙酯萃取相对7种细菌的抑制作用如图1。在6.25~50 mg/mL浓度时对金黄色葡萄球菌作用效果明显,抑菌圈均在10 mm以上,最大可达19.22 mm,在3.125和1.563 mg/mL浓度时也有一定抑制作用。在50和25 mg/mL浓度处理下,对普通变形杆菌、铜绿假单胞菌以及粘质沙雷菌有着由大到小的抑制作用,抑菌圈均在10~16 mm之间;而在3.125~12.5 mg/mL浓度时对3种菌的抑制效果几乎没有差别;1.563 mg/mL浓度时对这3种菌都没有抑制作用。肠炎沙门菌和肺炎克雷伯菌在各浓度作用下抑菌圈也无明显差别,在6.25~50 mg/mL浓度作用时有抑制作用,抑菌圈均不到10 mm。大肠杆菌是几种菌中的最耐药菌,仅在50、25和12.5 mg/mL浓度下被抑制,且抑制效果不够理想,仅在50 mg/mL浓度时抑菌圈达9.19 mm。这与翟梅枝等的研究相符,在40 mg/mL时,对金黄色葡萄球菌有较好的抑制作用,对大肠杆菌的抑制作用较弱[12]。

图1 不同浓度乙酸乙酯萃取相对7种细菌的抑制作用Fig.1 Inhibition of acetyl acetate’s extraction by different concentrations on 7 kinds of bacteria
由此可知,核桃青皮乙酸乙酯萃取相对革兰氏阳性菌金黄色葡萄球菌的抑制作用明显大于其余革兰氏阴性菌,这可能与阳性菌和阴性菌的细胞壁结构组成不同有一定的关系。
2.1.3乙酸乙酯萃取相对7种细菌的MIC和MBC乙酸乙酯萃取相对7种细菌的MIC和MBC见表2,实验结果与管碟法中结果一致。金黄色葡萄球菌的MIC值和MBC值均为最小,分别为0.781 mg/mL和1.563 mg/mL,表明乙酸乙酯相对金黄色葡萄球菌具有明显抑制效果。普通变形杆菌、铜绿假单胞菌以及粘质沙雷菌的MIC和MBC值完全一样,其MIC值为3.125 mg/mL,MBC值为6.25 mg/mL,抑制效果仅次于金黄色葡萄球菌。肠炎沙门菌的MIC值为6.25 mg/mL,略小于肺炎克雷伯菌12.5 mg/mL,但它们的MBC值是一样的均为12.5 mg/mL;大肠杆菌的MIC值和MBC值最大为12.5 mg/mL,对其抑制效果较差。综上,后续实验以金黄色葡萄球菌为试验菌。

表2 乙酸乙酯萃取相对7种细菌的MIC和MBC测定结果Table 2 MIC and MBC results of acetyl acetate’s extraction of walnut seedcases
2.2核桃青皮提取物抑菌活性影响因素研究
(ⅱ)如果c*(t)=0,即则问题仍转化为齐次问题.当Κ≥0时,问题的一般解(16)右边还要添加一项Φ1(z);当Κ<0时,由于相应问题只有零解Φ0(z)≡0,故原问题有唯一非零解Φ1(z).
2.2.1pH对抑菌作用的影响不同pH对乙酸乙酯萃取相抑菌作用的影响如图2所示,金黄色葡萄球菌受乙酸乙酯萃取相溶液pH影响较大。乙酸乙酯萃取相本身的pH为4.16,调整其pH为3时对金黄色葡萄球菌的抑制效果最佳,这可能与细菌本身不宜在酸性条件下生长有关;调整其pH为5、6、7时,抑菌圈逐渐变小。

图2 不同乙酸乙酯萃取相pH对抑菌作用的影响Fig.2 The effect of pH on steady antimicrobial activity of acetyl acetate extraction

图3 不同培养基pH对抑菌作用的影响Fig.3 The effect of medium pH against the antibacterial activity of acetyl acetate extraction
不同培养基pH对抑菌作用的影响如图3所示,金黄色葡萄球菌受培养基pH影响较大,随着培养基pH的降低,抑菌圈也随之增大。在弱碱性条件pH为8时,抑制作用稍有下降,抑菌圈直径为11.95 mm;当培养基pH为5时抑菌圈最大,直径达到19.85 mm;培养基pH为6时,抑菌效果也较明显,抑菌圈直径为15.27 mm。
2.2.2不同处理温度对抑菌作用的影响乙酸乙酯萃取相经70、80、90、100℃温度处理后对金黄色葡萄球菌的抑制作用如图4所示,与对照相比抑菌圈大小无明显变化,表明温度对核桃青皮提取物乙酸乙酯相中活性物质影响不大。

图4 不同处理温度对抑菌作用的影响Fig.4 The effect of temperature against the antibacterial activity of acetyl acetate extraction
2.2.3不同NaCl浓度对抑菌作用的影响10%、20%、30%和50%的NaCl浓度对乙酸乙酯萃取相抑制金黄色葡萄球菌作用的影响如图5。在10%NaCl浓度下的抑菌圈大小与未处理对照组相差不大,而随着NaCl浓度继续增大,抑菌圈也有所扩大,当NaCl浓度达到50%时抑菌圈达到14.61 mm。
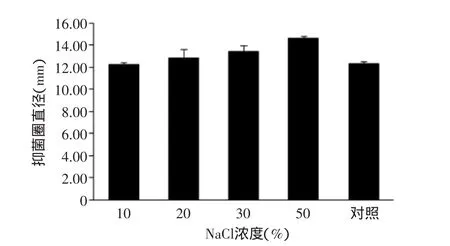
图5 不同NaCl浓度对抑菌作用的影响Fig.5 The effect of different NaCl concentration against the antibacterial activity of acetyl acetate extraction
2.2.4不同蔗糖浓度对抑菌作用的影响10%、20%、30%和50%的蔗糖浓度对乙酸乙酯萃取相抑制金黄色葡萄球菌作用的影响见图6。可看出随着蔗糖浓度的升高,抑菌圈明显变大,在50%高浓度蔗糖处理下,抑菌圈直径可达到16.78 mm。
2.2.5紫外线照射对抑菌作用的影响乙酸乙酯萃取相经15、30、45和60 min紫外线照射后对金黄色葡萄球菌的抑菌作用结果见图7,与对照相比抑菌圈大小无明显变化,说明紫外线照射对乙酸乙酯萃取相抑菌活性无明显的影响。
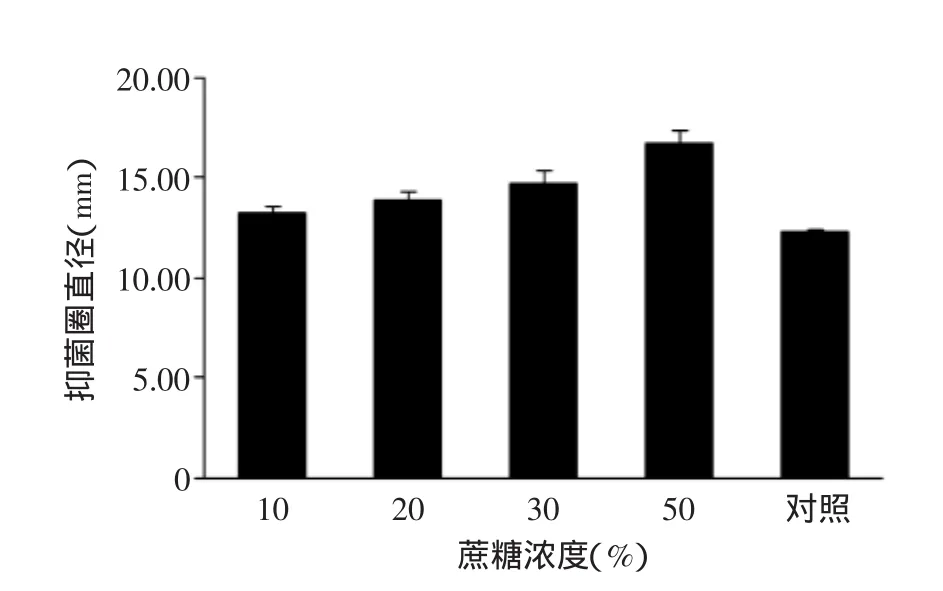
图6 不同蔗糖浓度对抑菌作用的影响Fig.6 The effect of different NaCl concentration against the antibacterial activity of acetyl acetate extraction

图7 不同紫外线照射时间对抑菌作用的影响Fig.7 The effect of different UV irradiation time against the antibacterial activity of acetyl acetate extraction
2.3核桃青皮提取物抑菌机理的研究
2.3.1核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌生长曲线的影响核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌生长曲线的影响如图8所示。对照组金黄色葡萄球菌在0~6 h之间处于调整期,6 h后开始大量繁殖进入对数期,12 h时进入生长稳定期,20 h后进入衰退期。经过乙酸乙酯萃取相作用的金黄色葡萄球菌在整个生长过程中未表现出大量繁殖,处理菌的调整期、对数期和稳定期均被明显延后延长,表明乙酸乙酯萃取相对金黄色葡萄球菌的生长繁殖起到了明显的抑制作用。
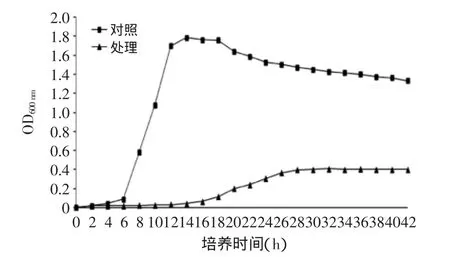
图8 核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌生长曲线的影响Fig.8 Contrast of the growth curves of the normal Staphylococcus aureus and the growth curves of Staphylococcus aureus effect by acetyl acetate extraction
2.3.2核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌细胞形态的影响透射电镜观察显示(图9)正常生长的金黄色葡萄球菌呈完整的圆形或者椭圆形状,菌体非常饱满;细胞壁结构完整,表面光滑;内容物清晰可见且分布均匀。经过乙酸乙酯萃取相处理12 h和18 h后的金黄色葡萄球菌变小,菌体不够饱满;部分菌体细胞膜萎缩与细胞壁分离出现空隙;菌体细胞壁表面粗糙;胞内物质模糊不清;18 h时菌体的变化比12 h更为明显。结果表明,乙酸乙酯萃取相明显增加了金黄色葡萄球菌细胞膜的通透性,破坏了细胞膜和细胞壁结构的完整性。
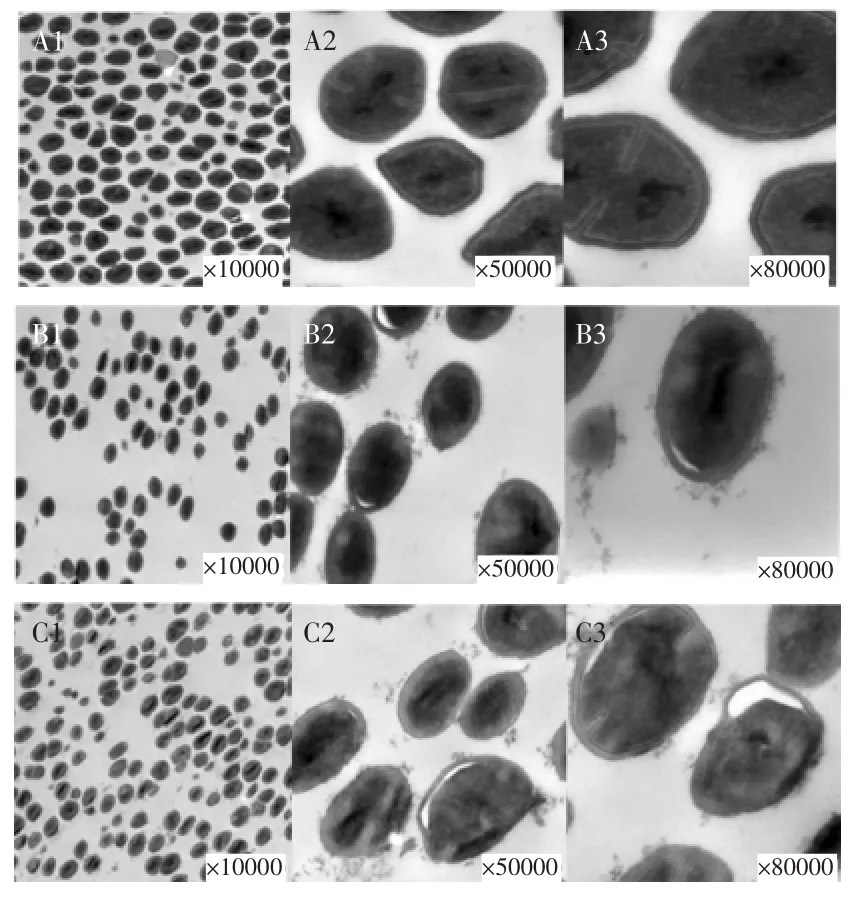
图9 正常的和处理后的金黄色葡萄球菌形态Fig.9 The normal and treated Staphylococcus aureus
2.3.3核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌培养液电导率的影响乙酸乙酯萃取相加入后,金黄色葡萄球菌培养液上清的电导率明显高于未处理的对照组(图10),且随处理时间的推移电导率越来越高,说明菌体内离子的外漏程度随乙酸乙酯萃取相作用时间的推移逐渐变大,菌体细胞膜受到损伤,实现抑菌效果,此结果同透射电镜结果相一致。
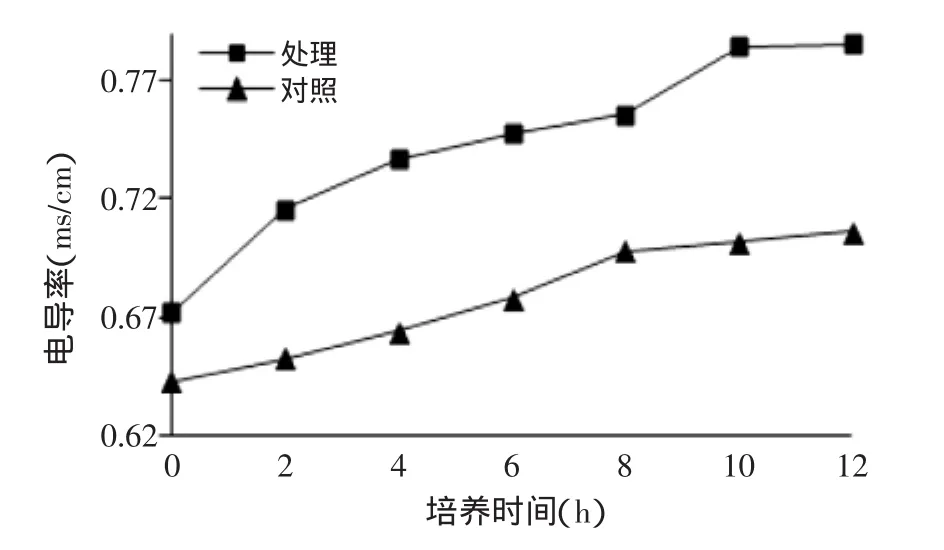
图10 乙酸乙酯萃取物对金黄色葡萄球菌培养液电导率的影响Fig.10 Effect of acetyl acetate extraction on electrical conductivity of Staphylococcus aureus’s culture supernatant
2.3.4核桃青皮乙酸乙酯萃取物对金黄色葡萄球菌培养液中大分子物质的影响核桃青皮乙酸乙酯相萃取物对金黄色葡萄球菌培养液中大分子物质的影响见图11。对照组的金黄色葡萄球菌在整个生长过程中的OD260非常稳定,表示无细胞内容物外溢。而加入乙酸乙酯萃取相的金黄色葡萄球菌初期的2 h内OD260变化缓慢;之后随着时间的推移,OD260呈现出上升趋势,说明细胞内有内容物外溢,大分子物质流出,菌体细胞膜的通透性及完整性有所改变,此结果同透射电镜结果相符合。
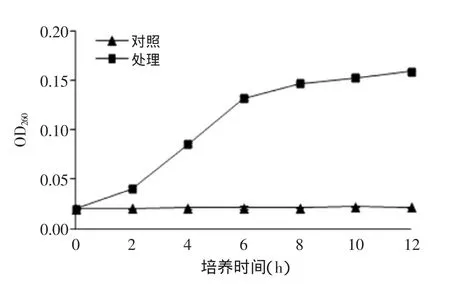
图11 乙酸乙酯萃取物对金黄色葡萄球菌培养液中大分子物质的影响Fig.11 Effect of acetyl acetate extraction on medium OD260nmvalues of Staphylococcus aureus
3 结论
3.1核桃青皮中存在着丰富的抑菌或杀菌活性物质,从核桃青皮乙醇提取物中萃取的不同极性活性物质对7种供试临床耐药细菌均有不同程度的抑制作用,各萃取相对供试菌抑制作用顺序为:乙酸乙酯相>氯仿相>正丁醇相>石油醚相。其中,乙酸乙酯萃取相对7种细菌均有较好抑制效果,具有广谱抑菌作用;对金黄色葡萄球菌的抑制效果最好,MIC和MBC分别为0.781 mg/mL和1.563 mg/mL,其次是普通变形杆菌、铜绿假单胞菌和粘质沙雷菌。其中大肠杆菌和肠炎沙门菌仅对乙酸乙酯萃取相敏感,石油醚、氯仿、正丁醇萃取相对这两种菌抑制作用均不明显。
3.2核桃青皮乙酸乙酯萃取相对温度和紫外线的耐受力较强,表明乙酸乙酯萃取相所含活性物质较为稳定;抑菌作用受pH影响较大,在相应pH范围内酸性越强抑制效果越好;NaCl和蔗糖的添加对菌体抑制作用也有一定影响,抑制作用随浓度的升高而加大,其中渗透压对菌体的抑制作用不可忽视。
3.3抑菌机理研究表明,经过核桃青皮提取物乙酸乙酯萃取相处理后的菌体细胞膜通透性、细胞壁及内容物均受到损害,导致细菌生长曲线发生变化,调整期、对数期和稳定期均被明显延后延长;细胞内容物溶出,OD260呈现出上升趋势;电导率明显升高。
[1]高海生,朱凤妹,李润丰.我国核桃加工产业的生产现状与发展趋势[J].经济林研究,2008,26(3):119-126.
[2]Yang J A,Qiu K Q.Preparation of activated carbons from walnut shells via vacuum chemical activation and their application for methylene blue removal[J].Chemical Engineering Journal,2010,165(1):209-217.
[3]Pereira J A,Oliveira I,Sousa A,et al.Walnut(Juglans regia L.) leaves:phenolic compounds,antibacterial activity and antioxidant potential of different cultivars[J].Food and Chemical Toxicology,2007,45(11):2287-2295.
[4]Lee K S,Li G,Kim S H,et al.Cytotoxic diarylheptanoids from the roots of Juglans and shurica[J].Journal of natural products,2002,65(11):1707-1708.
[5]Davis L,Stonehouse W,Mukuddem-Petersen J,et al.The effects of high walnut and cashew nut diets on the antioxidant status of subjects with metabolic syndrome[J].European journal of nutrition,2007,46(3):155-164.
[6]Márcia Carvalho,Pedro J Ferreira,Vanda S Mendes,et al. Human cancer cell antiproliferative and antioxidant activities of Juglans regia L.[J].Food and Chemical Toxicology,2010,48(1):441-447.
[7]翟梅枝,张凤云,刘朝斌,等.核桃叶提取物对粘虫和小菜蛾的拒食活性研究[J].西北林学院学报,2005,20(2):138-140.
[8]丁存宝,吴卓尚,李桂秋,等.核桃青皮提取物的抗真菌活性研究[J].现代食品科技,2013,29(4):722-724.
[9]Ravikumar,M Kalaiselvi,D Gomathi,et al.In vitro antibacterial and free radical scavenging activity of green hull of Juglans regia[J].Journal of Pharmaceutical Analysis,2013,3(4):298-302.
[10]A Fernández-Agulló,E Pereira,MS Freire,et al.Influence of solvent on the antioxidant and antimicrobial properties of walnut(Juglans regia L.)green husk extracts[J].Industrial Crops and Products,2013,42:126-132.
[11]Vali Akbari,Rashid Jamei,Reza Heidari,et al.Antiradical activity of different parts of Walnut(Juglans regia L.)fruit as a function of genotype[J].Food Chemistry,2012,135(4):2404-2410.
[12]翟梅枝,王磊,何文君,等.核桃青皮乙醇提取物抑菌活性研究[J].西北植物学报,2009,29(12):2542-2547.
[13]陈丽艳,施晓光,付玉杰,等.甘草根茎乙醇提取物抗菌活性研究[J].植物研究,2006(3):229-232.
[14]肖新生,林倩英.枇杷叶提取物抑菌作用研究[J].现代食品科技,2010,26(1):59-62.
Antibacterial activity and mechanism of walnut green husk’extract
REN Xian-wei,WEI Xiao-lu,HUANG Xin,LIU Li*,FENG Yue,XIA Xue-shan
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
The ethanol extracts from walnut green husk were further extracted with different solvents,including petroleum ether,chloroform,ethyl acetate and n-butanol.Antimicrobial activities of the different solvent extracts against 7 microorganisms were studied with the plate diluting method.The results showed that the different solvent extracts had certain inhibition effects on testing microbial and the order was ethyl acetate extract>chloroform extract>n-butanol extract>petroleum ether extract.The ethyl acetate extract had obvious antibacterial effect and broad-spectrum antibacterial activity.The inhabitation of ethyl acetate extract was the best when the concentration was 50 mg/mL.Diameter of the inhibited ring was 19.94 mm to Staphylococcus aureus and the MIC(Minimum inhibitory concentration)and MBC(Minimal bactericidal concentration)were 0.781 and 1.563 mg/mL respectively.Temperature and ultraviolet(uv)had no effect to antibacterial activity,NaCl and sucrose had little influence on it,but it was greatly influenced by pH of culture medium and solution.The mainly antimicrobial mechanism was to destroy bacteria cell wall or membrane structure.
walnut green husk extract;antimicrobial activity;antimicrobial mechanism
TS201.3
A
1002-0306(2015)18-0093-06
10.13386/j.issn1002-0306.2015.18.010
2015-01-22
任先伟(1986-),男,硕士研究生,主要从事食品安全检测及药物生物活性方面的研究,E-mail:396329904@qq.com。
刘丽(1969-),女,硕士,教授,研究方向:环境微生物,E-mail:liuli2272@163.com。
国家科技支撑计划项目(2011BAD46B00)。
