在线凝胶渗透色谱—气相色谱—串联质谱联用检测烟叶中的农药残留
2015-11-03罗彦波等
罗彦波等


摘 要 采用改进QuEChERS方法,以石墨化炭黑/乙二胺-N-丙基键合硅烷/磁性四氧化三铁复合材料为吸附剂,对烟叶提取物进行净化,结合在线凝胶渗透色谱-气相色谱-串联质谱联用仪,建立了烟叶中10种农药残留的检测方法。优化了影响实验结果的参数,最终凝胶渗透色谱在线收集时间选取为3.30~5.30 min、磁性吸附剂用量为80 mg、净化时间为1.0 min。目标物的检出限在0.940~100 ng/L之间,线性相关系数R2≥0.9989,日内和日间相对标准偏差分别小于15.1%和19.8%,实际样品的加标回收率为68.8%~132.2%。本方法成功应用于实际烟叶样品的检测,检测结果与现行标准方法相吻合。
关键词 QuEChERS方法; 在线; 凝胶渗透色谱; 气相色谱-串联质谱; 烟叶; 农药残留
1 引 言
为了防治病虫害,烟草在育种、种植、调制和保存期间要使用农药。残留农药会降低烟叶质量,加剧环境污染, 并威胁人类和其它生物的健康[1]。因此,烟叶中的农药残留检测对保证烟叶质量和环境安全具有重要意义。由于烟叶样品基质复杂,其中残留农药含量低(低至ng/g级),因此通常需要样品预处理过程才能进行后续测定[2]。目前,液-液萃取[3]、固相萃取[4]、固相微萃取[5]等方法已用于烟叶中农药残留测定。这些方法存在有机溶剂消耗量大、操作繁冗费时、回收率低等不足。Anastassiades等[6]开发了“快速、简便、经济、高效、耐用且安全(Quick, easy, cheap, effective, rugged and safe, QuEChERS)”的样品前处理技术。QuEChERS方法具有回收率高、稳定性强和被分析目标物范围广等优点,因此在农药残留检测中广泛应用[3]。常规QuEChERS方法在净化步骤中通过离心或过滤将吸附剂与样品液分离,耗时费力。为了克服这一缺陷,本研究组以石墨化炭黑/乙二胺-N-丙基键合硅烷/四氯化三铁(GCB/PSA/Fe3O4)复合材料为吸附剂,改进了QuEChERS方法[7],吸附剂可以在磁场作用下与提取液快速分离,具有操作简单、快速高效的优点。
在线凝胶渗透色谱-气相色谱-质谱(GPC-GC-MS)是将凝胶渗透色谱和气相色谱-质谱在线联用的分析检测技术,不但具有抗基质干扰能力强、灵敏度高的优点,而且可以连续自动分析,能提高分析速度和结果的准确性,已被应用于农药残留检测[8~10]。本研究采用改进QuEChERS方法对烟叶样品前处理,以在线凝胶渗透色谱-气相色谱-串联质谱(GPC-GC-MS/MS)检测,选取烟草种植生产中对烟叶质量和烟草制品产品安全有影响的常用10种除草剂、抑芽剂和杀虫剂为代表性化合物,建立了烟叶中农药残留量的快速、准确、灵敏分析方法。
2 实验部分
2.1 仪器与试剂
在线GPC-GC-MS/MS系统(日本岛津公司),GPC配有LC-20AD泵,SIL-20A自动进样器,CTO-20AC柱温箱,DGU-20A3R脱气机和SPD-20A紫外检测器;GC-MS/MS包括日本岛津2010-plus气相色谱和TQ 8030三重四级杆质谱,由FCV-12AH电磁阀实现GPC和GC-MS/MS的在线连接。用Quanta 200 扫描电镜(Quanta 200,FEI,Holland)对材料形貌进行表征。
环己烷和丙酮(色谱纯,韩国德山纯化工有限公司)。所用水由Milli-Q系统(Milford, MA, USA)制得。10种目标物和内标(磷酸三苯酯)均购自德国Dr. Ehrenstorfer 公司,以甲苯(必要时添加丙酮或甲醇)为溶剂配制目标物母液(100 μg/mL)。混合标准工作溶液(内标浓度为20 ng/mL)以甲苯配制,并在-20℃下避光保存。采用溶剂热方法制备Fe3O4[7]:在200 mL反应釜内将5.0 g FeCl3·6H2O 溶解在100 mL 乙二醇中并搅拌得到澄清溶液,再加入15.0 g NaAc 和50 mL乙二胺,搅拌30 min,将反应釜于200℃下反应8 h。待反应釜降温后,用水和乙醇清洗产物, 60℃下干燥,备用。制备磁性吸附剂时,将0.4 g GCB、 0.5 g PSA和1 g Fe3O4置于15 mL具盖玻璃瓶内,用5 mL乙腈清洗3次后,将产物在60℃下干燥即可。
2.2 仪器条件
GPC条件:色谱柱为Shodex CLNpak EV-200(150 mm × 2 mm,16 μm);柱温为40℃;流动相为环己烷-丙酮(70∶30, V/V);流速0.1 mL/min;进样量10 μL;GPC收集时间为3.30~5.30 min;GC-MS/MS条件:惰性前置柱5 m × 0.53 mm空柱;预柱DB-35 ms(5 m × 0.25 mm × 0.25 μm),分离柱DB-35 ms(25 m × 0.25 mm × 0.25 μm),柱温箱程序:初始温度82℃,保持5.0 min,再以8℃/min升至300℃,保持7.75 min;不分流进样,进样时间7.0 min;高纯He为载气,压力程序:由120 kPa开始,以100 kPa/min升至180 kPa,保持4.4 min,再以49.8 kPa/min恢复至原始压力,保持33.8 min;程序升温进样口程序:120℃保持5 min,以100℃/min升至250℃,保持33.7 min;接口和离子源温度为300℃和200℃;电离源为EI源;电离电压70 eV;溶剂延迟时间15 min;目标物及内标的多反应监测(MRM)参数如表1所示,碰撞气为Ar,压力200 kPa。
2.3 样品制备
本研究建立烟叶提取液快速净化和检测的方法,因此直接采用文献\[2\]报道的方法提取烟叶: 称取2.00 g 烟叶于离心管中,加入10 mL水浸润样品;静置10 min后加入10 mL 乙腈和100 μL 内标溶液,振荡2 min;于-20℃下保持10 min后加入5 mL甲苯、4 g 无水Na2SO4、1 g NaCl\, 1 g柠檬酸钠和0.5 g 柠檬酸氢二钠,振荡2 min后离心5 min,收集上层提取液;提取液的净化和检测方法为:取0.5 mL提取液到装有磁性吸附剂的离心管中,振荡1 min;在磁场下将磁性吸附剂与溶液分离,所得溶液为待测液,可进行在线GPC-GC-MS/MS分析。将不含目标物的净化液浓缩吹干,再加入相同体积、不同浓度的系列标准工作溶液,混匀溶解即得到基质匹配标准曲线。
3 结果与讨论
3.1 磁性吸附剂的表征
如图1a所示, PSA表面光滑,而磁性吸附剂中PSA表面粗糙(图1b),且在PSA颗粒之间也有材料均匀分布,观察是GCB和Fe3O4颗粒(图1c)。Fe3O4能使吸附剂在磁场作用下与样品溶液快速分离,同时PSA和GCB能分离提取液中的杂质。
3.2 GPC收集时间考察
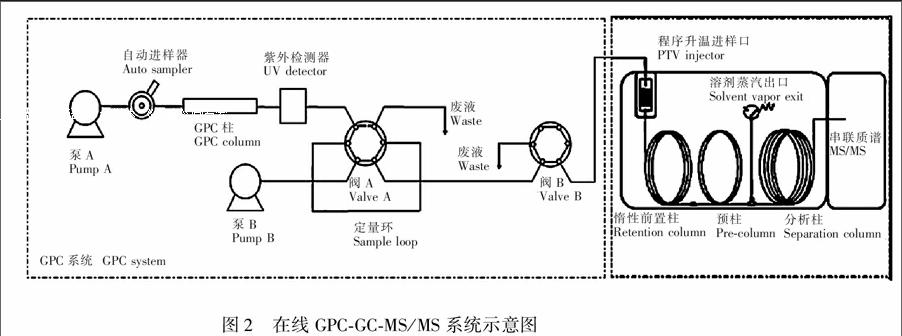
图2为在线GPC-GC-MS/MS系统的示意图。其原理为:样品经GPC柱分离,废液直接排出系统,含有目标物的馏分先被储存在定量环(0.2 mL)中,再全部注入GC。注入GC的样品通过打开溶剂蒸气出口实现溶剂的排出,同时目标分析物在保留在预柱中。待溶剂排出口关闭后柱,温箱开始升温,目标物进入分析柱分离。因此选择收集时间显得尤为重要。目标物的分子量在溴氰菊酯和灭螨蜢之间,因此目标物在GPC上的保留时间也介于二者之间,二者在GPC上的保留时间为3.50和5.08 min。考虑灵敏度和基质去除效果,确定收集时间为3.30~5.30 min。
3.3 改进QuEChERS方法的优化
为了得到较好的净化效果,优化了磁性吸附剂的用量和净化时间(GCB、PSA和Fe3O4之间的质量比为4∶5∶10)。如图3a所示,随着吸附剂用量增加,提取液的颜色由黄色逐渐变为近无色,当吸附剂用量达到80 mg时,继续增加用量对净化效果改善不大。且在考察的范围内,各目标物的峰面积没有变化,这可能是因为在烟叶提取液中含有甲苯,使吸附剂与含苯环目标物之间的相互作用力减弱而引起的。考虑净化效果和吸附剂用量,将吸附剂的用量定为80 mg。在0.5~6.0 min范围内,净化时间对净化效果影响不大,且目标物的峰面积没有变化,这是因为吸附剂在净化时是分散的,可以使吸附快速达到平衡,因此净化时间对净化效果没有太大影响。为了稳定净化效果,净化时间选取1.0 min。
比较了本方法与常规QuEChERS方法的净化效果,如图3b所示,未经净化的烟叶提取液颜色为黄色,经过常规QuEChERS方法净化后,提取液颜色变浅;经过本方法净化后,提取液几乎无色(Ⅲ)。因此,本方法对色素等杂质的去除效果较好。
3.4 方法确认
在优化条件下,考察了方法的检出限、定量限、线性范围和重现性。检出限和定量限为目标物信噪比为3和10时对应的浓度。以目标物浓度及其与内标峰面积之比为横、纵坐标,绘制工作曲线。如表2所示,10种目标物的检出限在0.94~100 ng/L之间,定量限在3.1~34 ng/L之间,线性相关系数R2≥0.9989。本方法提取烟叶的结果与标准方法[11]相同,其中9种目标物(甲氰菊酯除外)的检出限为40~600 ng/L。本方法能显著提高灵敏度,是由吸附剂降低基质干扰和在线GPC-GC-MS/MS提高进样量引起的。
为了考察本方法的重现性,配制3种浓度(各目标物线性范围最低值的2、10和100倍)的样品,以一天内配制的4个样品和连续3天配制的样品进行分析,计算日内和日间相对标准偏差。如表3所示,目标物的日内及日间精密度分别小于15.1%和19.8%,其中目标物在中浓度和高浓度下的日内及日间精密度数值不高于8.5%,低浓度下的日内及日间精密度数值相对较高,这可能是由于测定误差引起的。美国分析化学家学会(Association of Official Analytical Chemists, AOAC)提出[12],可接受的精密度数值随着分析物的浓度或含量降低而升高。本研究中目标物在低浓度(1.52~4.00 μg/L)下的精密度数值低于21%(目标物浓度为10 μg/L时所能接受的精密度数值),说明本方法的重现性可以接受。
3.5 实际样品分析
为了证明本方法在实际样品中应用的效果,采用本方法和现行标准方法[11]处理3种烟叶样品并进行测定。在样品A中测到了七氟菊酯、二甲戊灵和联苯菊酯,采用本方法和标准方法均无法对其进行定量分析;在样品B中测到了七氟菊酯,两种方法的测定结果为1.06和1.03 μg/L,对氟节胺和联苯菊酯均无法进行定量分析;在样品C中测到了仲丁灵、二甲戊灵和氟节胺,两种方法的测定结果为92.1和92.7 μg/L、108.2和112.2 μg/L以及3.68和3.70 μg/L,对七氟菊酯也均无法进行定量分析。结果表明,本方法与标准方法[11]的检测结果相吻合。样品C中测到的目标物数目最多,给出了其中被测到目标物的典型色谱图。如图4所示,目标物均不存在干扰。同时,对净化前的烟叶提取液直接进行在线GPC-GC-MS/MS分析,检测结果与以上两种方法不存在显著性差异:在样品B中测到了七氟菊酯,其浓度为1.01 μg/L;在样品C中测到了仲丁灵、二甲戊灵和氟节胺,其浓度为92.8, 110.2和3.81 μg/L。
将上述3种样品加标后用本方法测定,将所测量与实际加标量相比得到相对回收率。如表4所示,目标物的相对回收率在68.8%~132.2%之间,不同实际样品中目标物在不同浓度下的回收率相差较大,可能是因为不同产地烟叶样品的基质差异引起的。使用气相色谱-串联质谱检测烟叶中的农药残留时,基质增强效应和基质抑制效应同时都存在[13],其中含有氨基的极性农药化合物在气相色谱分析时主要表现为基质增强效应(如二甲戊灵和联苯菊酯,回收率最高为132.2%),但含有同一功能基团的化合物由于理化特性的差异所呈现的基质效应也会有较大差别(如七氟菊酯,回收率最低为68.8%),而且同一化合物在不同浓度水平和样品基质下产生的基质效应程度也不尽相同(如甲氰菊酯)[14]。
4 结 论
采用磁性吸附剂净化烟叶提取液,再用在线GPC-GC-MS/MS检测,优化了在线GPC-GC-MS/MS条件和影响净化效果的因素,在最佳的条件下建立了烟叶样品中10种农药残留量的测定新方法,并用于实际烟叶样品的测定。由于磁性吸附剂可以在磁场作用下实现快速回收,且在线GPC-GC-MS/MS系统可以提高进样量。与现有标准方法[11]相比,本方法具有样品前处理过程操作简单、净化能力强、灵敏度高等优点,为日常烟叶样品中农药残留量的测定提供了一种可选择的方法。
References
1 Damalas C A, Eleftherohorinos I G. Int. J. Environ. Res. Public Health, 2011, 8(5): 1402-1419
2 Chen X S, Bian Z Y, Hou H W, Yang F, Liu S S, Tang G L, Hu Q Y. J. Agric. Food Chem., 2013, 61(24): 5746-5757
3 Lee J M, Park J W, Jang G C, Hwang K J. J. Chromatogr. A, 2008, 1187(1-2): 25-33
4 Haib J, Hofer I, Renaud J M. J. Chromatogr. A, 2003, 1020(2): 173-187
5 Shen A C, Xu Z X, Cai J B, Shao X G. Anal. Sci., 2006, 22(2): 241-244
6 Anastassiades M, Lehotay S J, Stajnbaher D, Schenck F J. J. AOAC Int., 2003, 86(2): 412-431
7 Zheng H B, Zhao Q, Mo J Z, Huang Y Q, Luo Y B, Yu Q W, Feng Y Q. J. Chromatogr. A, 2013, 1300(1): 127-133
8 Liu L B, Hashi Y, Qin Y P, Zhou H X, Lin J M. J. Chromatogr. B, 2007, 845(1): 61-68
9 Lu D S, Qiu X L, Feng C., Jin Y E, Lin Y J, Xiong L B, Wen Y M, Wang D L, Wang G Q. J. Chromatogr. B, 2012, 895-896 (1): 17-24
10 RUAN Hua, RONG Wei-Guang, SONG Ning-Hui, JI Wen-Liang, LIU Hua-Liang, MA Yong-Jian. Chinese J. Anal. Chem., 2014, 42(8): 1110-1116
阮 华, 荣维广, 宋宁慧, 吉文亮, 刘华良, 马永建. 分析化学, 2014, 42(8): 1110-1116
11 YQ/T 47.1- 2014, Tobacco and Tobacco Products Determination of Multi-pesticide Residues Part 1: Gas Chromatography-Tandem Mass Spectrometry Method. Tobacco Industry Standards of the People′s Republic of China.
烟草及烟草制品 多种农药残留量的测定 第1部分: 气相色谱-串联质谱联用法. 中华人民共和国烟草企业标准. YQ/T 47.1-2014
12 Rambla-Alegre M, Esteve-Romero J, Carda-Broch S. J. Chromatogr. A, 2012, 1232 (1): 101-109
13 CHEN Xiao-Shui, BIAN Zhao-Yang, TANG Gang-Ling, HU Qing-Yuan. Chinese Journal of Chromatography, 2012, 30(10): 1043-1055
陈晓水, 边照阳, 唐纲岭, 胡清源. 色谱, 2012, 30(10): 1043-1055
14 HUANG Bao-Yong, OUYANG Xi-Hui, PAN Can-Ping. Chinese J. Pestic. Sci., 2005, 7(4): 299-305
黄宝勇, 欧阳喜辉, 潘灿平. 农业学学报, 2005, 7(4): 299-305
