《物质结构与性质》复习中若干疑难问题辨析*
2015-11-03福建省三明市第一中学严业安
◎福建省三明市第一中学 严业安
《物质结构与性质》复习中若干疑难问题辨析*
◎福建省三明市第一中学严业安
选择《物质结构与性质》复习中师生经常遇到的若干疑难问题,结合相关文献资料进行问题辨析,以期为《物质结构与性质》的复习提供参考。
物质结构与性质;疑难问题;高三复习
【问题1】2014年福建省高考理综试题第31题第3小题,“六方相氮化硼的结构与石墨相似却不导电,原因是?”
【解答】该试题给出的参考答案是“层状结构中没有自由移动的电子”。显然,这是命题者试图要求学生能在正确理解石墨晶体结构的基础上,运用知识迁移能力和逆向思维能力得出的相对合理的结论。笔者曾就一定的学生和教师群体进行调查。结果显示,绝大多数教师和部分学生虽然能得出与参考答案相符的结论,但他们并不明白其中的缘由。可见,参考答案并没有从本质上回答问题,而是流于形式表面,是不够理想的。鲁科版《物质结构与性质》第89页对石墨的结构的描述如下:“石墨的晶体具有层状结构,每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键相结合,形成无限的六边形平面网状结构;每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,因此能够形成遍及整个平面的大π键。正是由于电子可以在整个六边形网状平面上运动,因此石墨的大π键具有金属键的性质,这就是石墨沿层的平行方向导电性强的原因。”
相关资料显示,六方相氮化硼[(BN)n]俗称白石墨,和石墨[(C2)n]是等电子体。白石墨中B原子和N原子形成类似于石墨的平面六边形的层状结构,层间的排列使层中的B原子对准相邻层中的N原子。它的力学性能像石墨,质地柔软,但导电性和石墨不同,具有优良的绝缘性能。这种差别可用能带理论解释,即B-N键的极性使其带隙宽度大于石墨。鲁科版《物质结构与性质》第55页“学海无涯”栏目,对金属的导电性从能带理论的角度进行了介绍,但它属于拓展知识,在高中阶段不作基本要求。既然六方相氮化硼的结构与石墨相似,为什么它却不导电呢?我们可以从白石墨的组成和结构上加以分析:在(BN)n中,同一层上B和N原子都采用sp2杂化轨道头碰头重叠形成σ键,形成无限的六边形平面网状结构;每个B原子各有一个空p轨道,每个N原子各有一个p轨道和1对p电子,p轨道肩并肩重叠形成π键。从电负性的角度看,B和N的电负性分别为2.0和3.0,N的电负性较大,π键上的电子在很大程度上被定域在N的周围,不能自由流动,故白石墨不导电,是理想的电绝缘体。
【问题2】CCl4能否发生水解反应?
【解答】影响共价化合物水解反应的主要因素大致归纳为以下三个方面:(1)中心原子价层结构(中心原子所处周期、配位情况、空轨道、半径大小等);(2)空间效应(中心原子半径、配体的大小和数量等);(3)电负性效应(中心原子与配体电负性的差异)。
SiCl4在常温下激烈水解,而CCl4却不水解。这是因为中心Si原子有3d空轨道,可供水分子立足,而Si的半径相对较大,配位Cl原子难以屏蔽水分子的进攻。在水分子的攻击下,形成五配位的中间态,同时分子构型发生改变(从四面体形变为三角双锥形),Si的杂化类型由sp3过渡到sp3d,有Si-OH2新键形成,然后脱出HCl。此过程重复发生,最终产物为H4SiO4和HCl。

由于C原子半径小,受到4个Cl原子的有效屏蔽,水分子难以钻进去,且C原子处于第二周期,配位已达饱和(最大配位数为4),无能量低的空轨道接受水分子,无法形成五配位的中间态(预期活化能很高)。另一方面,由于C原子半径小,与周围Cl原子轨道的重叠程度大,C-Cl键很牢固难以断裂(常温下难以实现),不能形成三配位的中间态让水分子插入。因此CCl4在常温下不发生水解,应归于动力学阻力。
此外,由下述水解反应式可知,CCl4水解是热力学上可行的反应。当条件改变时,如外界提供能量(断裂C-Cl键)则可发生水解反应。例如,在过热蒸汽条件下,CCl4可水解生成COCl2和HCl。
(1)CCl4(l)+2H2O(l)=CO2(g)+4HCl(g)
ΔrGθ(298K)=-377 kJ·mol-1
(2)CCl4(g)+H2O(g)=COCl2(g)+2HCl(g)
ΔrGθ(T)=-103.7 kJ·mol-1
【问题3】尿素[CO(NH2)2]是平面结构的分子吗?尿素晶体具有怎样的结构?
【解答】如图1所示,尿素分子具有平面结构,与N原子相连的两个H原子属于不同类型,分别处于羰基氧的顺式和反式位置,C-N-H(1),C-N-H(2),H(1)-N-H(2)三个键角都非常接近120°。尿素分子的这些键角及其良好的平面结构,表明分子中C原子和N原子均采用了sp2杂化。尿素分子满足形成离域π键的两个条件,羰基的π键电子和N原子上的孤对电子一起共同形成4中心6电子的离域大π键,即。

图1
顺便指出,苯酚显酸性,羧酸呈酸性,苯胺显碱性,这些均与离域π键的生成有关。如图2所示,苯酚和羧酸电离出H+后,负离子由于生成离域π键而稳定存在;苯胺中由于存在离域π键而不易电离,但它可接受H+形成-NH3+基团,故呈弱碱性。苯酚和苯胺分子中O原子、N原子均采用sp3杂化,苯胺的-NH2基团并不和苯环共平面,但N原子上的孤对电子能参与形成离域π键。

图2
图3给出了尿素晶体中分子的排列和氢键网络的三维结构。由于每一个氢原子都参与形成了N-H…O氢键,尿素分子以头尾相连的方式连接起来形成一个直链。这些链沿平行于c轴的方向延伸,而相邻的链与c轴反平行排列,而且两链的分子平面几乎是互相垂直的。在任何一个尿素分子中,羰基氧被在同一条头尾相连的链上的相邻的反式氢原子H(2)拴住,也被两边相邻链上的另外两个分子中顺式的氢原子H(1)拴住(见图3(a))。这样的三维骨架提供了一个少有的碳基氧原子形成4个N-H…O氢键受体的例子。

图3 尿素晶体结构图
(a)以头-尾方式氢键键连的分子链沿c轴平行排列,每个氧原子形成4个N-H…O受体氢键;
(b)沿c轴投影的尿素晶体氢键网。
【问题4】CH3COOH、CH3CH2Cl、CH3CH=CH2中的碳碳键是极性键还是非极性键?
【解答】鲁科版《物质结构与性质》第35页指出:“一般而言,在双原子分子中,可用成键原子所属元素电负性的差值大小判断形成的共价键的极性强弱。”涉及多原子分子时,如何判断形成的共价键的极性,教材中并未加以说明。其实对于多原子分子,相同原子间形成的共价键是否具有极性,则需要考虑它们所处的化学环境是否相同。
电负性并不是孤立原子的性质,它与该原子所处的化学环境有关,即同一元素的电负性并非固定不变的。成键原子的电负性不仅与其本性有关,还与原子的价态、杂化形式及成键轨道的类型有关。同种元素的原子,其杂化形式不同、成键的原子轨道不同、原子价态不同,其电负性值也不同。分子中,两个C原子分别采用sp3和sp2杂化,sp2杂化态的C原子的电负性大于sp3杂化态的C原子,C-C键具有极性。CH3CH2Cl分子中,虽然C原子均采用sp3杂化,但两个C原子所处的化学环境不同。如图4所示,由于Cl元素的电负性大于C元素的电负性,共用电子就会偏向Cl原子而使C-Cl键产生极性,其中显正性的C原子又会吸引与它相邻的原子上的电子,而使邻近C-C键上的共用电子也产生偏移,导致C-C键具有极性。在CH3-CH=CH2分子中,甲基是具有推电子性能的基团,对碳碳双键会产生推电子作用,使得双键碳原子间的共用电子偏向双键中的链端碳原子,导致C-C、C=C均具有极性。类似问题还有很多,例如,臭氧(O3)分子为V形结构,中间O原子和两端O原子所处的化学环境明显不同,O原子周围电荷的分布不相等,故2个O-O键均为极性键。实验测得,O3分子的偶极矩为1.77×10-30C·m,是含有极性键的极性分子。在丁二醇中,中间的C-C键是非极性键,两边的C-C键是极性键,分子为非极性分子。考虑到中学生的知识水平和理解能力,建议在平时教学中,不涉及多原子分子中同种元素的原子形成的共价键的极性问题。

图4
【问题5】CH4和NH3相比,何者热稳定性更高?
【解答】化合物的热稳定性,一般是指该化合物在一定温度下分解或转化成其他物质的难易程度。在热力学中可以用反应的吉布斯自由能变ΔG的大小进行判断,也可以用反应的平衡温度的高低判断(平衡时ΔG=0,T =ΔH/ΔS)。
CH4和NH3何者热稳定性更高呢?从不同方面进行解释得出的结论是不一致的。
元素周期律:同一周期元素的原子,随着核电荷数的递增,原子半径逐渐减小,元素原子得到电子的能力逐渐增强。即同一周期的元素,从左到右非金属性逐渐增强。人教版《化学2(必修)》第14页指出:“元素的非金属性强弱可以从其单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性来推断。”苏教版《化学2(必修)》第5页指出:“元素的非金属性越强,它的单质越容易与氢气形成气态氢化物,气态氢化物越稳定。”鲁科版《化学2(必修)》第22页指出:“元素原子得电子能力的强弱,可以通过比较元素的单质与氢气化合的难易程度以及气态氢化物的稳定性来间接地判断。一般来说,反应越容易进行,生成的气态氢化物越稳定,元素原子得电子的能力越强”。据此得出NH3的热稳定性比CH4高。
电负性:电负性是元素的原子在化合物中吸引电子能力的标度,其数值是判断元素金属性和非金属性强弱的重要参数之一。元素的电负性数值越大,表示其原子在化合物中吸引电子的能力越强。同一周期,主族元素的电负性从左到右逐渐增大,表明其吸引电子的能力逐渐增强,非金属性逐渐增强。上述三套教材中提供的C和N的电负性数值分别为2.5和3.0,表明N的非金属性强于C,其对应的氢化物NH3的热稳定性比CH4高。
键能:在101.3KPa、298K条件下,断开1molAB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能,常用EA-B表示。键能的大小可以定量地表示化学键的强弱程度。键能愈大,断开时需要的能量就愈多,这个化学键就愈牢固。由键能数据可知,EC-H=413kJ·mol-1,EN-H=391kJ·mol-1。从键能的角度看,CH4的热稳定性比NH3高。
化学反应:苏教版《化学与技术》第21页给出了在某种催化剂作用下,用体积比为1:3的氮、氢混合气体进行合成氨实验达到平衡时混合物中NH3的含量(体积分数):在0.1MPa下,200℃、300℃、400℃、500℃、600℃对应的氨的含量依次为15.3%、2.2%、0.4%、0.1%、0.05%。因为合成氨反应是一个可逆反应,由N2、H2合成NH3的含氨量也可以看成是同一条件下NH3分解达到平衡时的含氨量。可知在0.1MPa时,NH3在600℃以下各温度分解达到平衡时的含量均很低。资料显示:在隔绝空气并加热至1000℃的条件下,甲烷分解生成炭黑和氢气。由此可见,NH3比CH4更容易分解,CH4的热稳定性比NH3高。
化学热力学:在化学反应中,ΔrHmθ(T)和ΔrSmθ(T)随温度的变化很小,一般可以忽略温度的影响。应用Gibbs-Helmholtz方程ΔrGmθ(T)=ΔrHmθ-TΔrSmθ,可以求得分解反应的平衡温度T。CH4和NH3的热分解反应的有关热力学数据见表一。
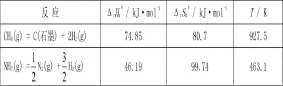
表一 CH4和NH3的热分解反应的有关热力学数据
从表一中可以看出,CH4的热分解温度比NH3高得多,故CH4的热稳定性比NH3高。
分子结构:CH4分子中C原子采用sp3杂化,C原子通过4个sp3杂化轨道与4个H原子的1s轨道重叠形成4个σ键。4个杂化轨道的能量相同,每两个杂化轨道的夹角为109.5°。故CH4分子的空间构型为正四面体形,具有高度的空间对称性,这种结构使得CH4分子为非极性分子,具有特殊的稳定性。NH3分子中N原子也采用sp3杂化,但N原子比C原子多1个电子,生成的4个sp3杂化轨道中,有1个轨道已有一对孤对电子,只有另外3个轨道中的未成对电子可以与H原子的1s电子配对成键。这种含有孤对电子的杂化轨道和成键的杂化轨道能量略有差异,化学上称为不等性杂化轨道。NH3分子中存在着未成键的孤对电子,它对成键电子对的排斥作用较强,使得3个N-H键的空间分布发生变化,键角为107.3°。故NH3分子的空间构型为三角锥形,这种结构使得NH3分子有相当大的极性(偶极矩为1.66D),N-H键之间有一定的排斥作用,NH3分子的对称性比CH4分子低,稳定性更差。CH4和NH3在分子结构上的不同导致了其稳定性的特殊差异,符合“物质结构是决定物质性质的重要因素”的化学思想。
总之,CH4的热稳定性比NH3高。这是一个违反元素周期律和电负性规则的特例,在高中化学教学中应加以注意。
(责任编辑:张贤金)
*本文系2014年度福建省基础教育课程教学研究立项课题“高中化学高效课堂的实践研究”(项目编号:MJYKT2014-214)阶段性研究成果。
