牛胰脏组织蛋白酶L的纯化和酶学性质
2015-11-02崔昱清王复龙崔保威郭秀云李君珂刘世欣刘森轩彭增起
崔昱清,王复龙,崔保威,郭秀云,李君珂,刘世欣,刘森轩,彭增起,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.食品安全与营养协同创新中心,江苏 南京 210095)
牛胰脏组织蛋白酶L的纯化和酶学性质
崔昱清1,2,王复龙1,2,崔保威1,2,郭秀云1,2,李君珂1,2,刘世欣1,2,刘森轩1,2,彭增起1,2,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.食品安全与营养协同创新中心,江苏 南京 210095)
新鲜牛胰脏匀浆物经酸化粗提后,再通过盐析、柱层析等步骤纯化,制备了0.58 mg纯酶,纯化倍数达530.54。经凝胶电泳分析,该酶有2 个亚基,分子质量为29.1 kD和18.9 kD。牛胰脏组织蛋白酶L的最适反应温度为50 ℃,最适反应pH值为6.5。巯基还原剂二硫苏糖醇、L-半胱氨酸均明显激活了该酶活性,10 μmol/L的N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺(E-64)可完全抑制其活性。1 mmol/L的Zn2+对酶活性有明显抑制作用。该纯化酶可水解苄氧羰基-苯丙氨酰-精氨酰-甲基香豆素(Z-Phe-Arg-MCA),其Km值为3.52 μmol/L。
组织蛋白酶L;牛胰脏;纯化;酶学特性
嫩度很早就被认为是影响牛肉食用品质的最重要因素。宰后成熟过程伴随着肌肉蛋白降解,牛肉嫩度会得到明显改善。目前研究表明,催化肌肉蛋白降解的酶类,主要是一些半胱氨酸类蛋白酶。其中,钙离子激活中性蛋白酶(Ca2+-activated neutral proteinase)[1]被研究最多,后被命名为钙激活酶(calpains)[2]。该酶被确认在宰后成熟前期对嫩化具有重要贡献[3]。组织蛋白酶(cathepsins)也被一些研究者认为影响了宰后成熟过程中肉的嫩度。20世纪90年代初Johnson等[4]的研究表明,宰后第10天,牛肉组织蛋白酶B+L的活性与剪切力值负相关。随后O'Halloran等[5]认为当宰后胴体pH值降至偏酸性范围时,组织蛋白酶能够从溶酶体中释放出来,对肌肉中的蛋白进行降解;而此时,钙激活酶的活性已经检测不到[6-7];另外,组织蛋白酶L能够水解包括肌钙蛋白(T、I、C)、伴肌动蛋白、肌联蛋白、原肌球蛋白在内的多种肌原纤维支架蛋白,而这些蛋白在宰后成熟过程中都有不同程度的降解[8-13]。然而,学术界对组织蛋白酶在宰后嫩化过程中的贡献一直存在争议,再加上比较成熟的钙激活酶系统嫩化理论的诞生,致使对组织蛋白酶嫩化机理的研究出现10多年的停滞期。最近Wang Rongrong等[14]的研究发现,具有组织蛋白酶B、L活性的狭鳕肌肉组织提取物可使牛肉肌原纤维蛋白二级结构发生变化,破坏肌束膜的结构,并伴随有明胶形成。
目前组织蛋白酶L已从各类鱼肉、鱼肝胰脏、兔肝、兔肾脏以及人肝中得以分离纯化和性质鉴定[10,15-20]。牛胰脏组织蛋白酶L的研究在国内外未见报道。本实验对牛胰脏组织蛋白酶L进行了分离纯化,并研究了该酶的酶学特性,以期为进一步阐述宰后牛肉蛋白的生化降解机制奠定基础。
1 材料与方法
1.1材料与试剂
新鲜牛胰脏取自黄牛宰杀放血后12 h之内,置于4 ℃冰浴备用。
Bradford蛋白测定试剂盒 江苏碧云天生物技术研究所;7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)、氯乙酸钠、N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺(E-64) 美国Sigma公司;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(dithiothreito,DTT)、低分子质量蛋白Marker 北京索莱宝公司;荧光合成底物Z-Phe-Arg-MCA、Z-Arg-Arg-MCA和L-Arg-MCA日本Peptide公司;层析填料DEAE-Sephacel、Sephacryl S-100、SP Sepharose Fast Flow、Blue Sepharose Fast Flow、ConA Sepharose 4B 美国GE Healthcare公司;L-半胱氨酸(L-Cys)为国产生化纯;甲醇、乙醇、乙酸、盐酸、NaCl、Na2SO4、Na2HPO4、NaH2PO4、KH2PO4、CH3COONa、EDTA-Na2等均为国产分析纯。
1.2仪器与设备
☒KTA Prime Plus蛋白层析系统 美国GE Healthcare公司;SpectraMax M2多功能酶标仪 美国Molecular Devices公司;Allegra 64R高速冷冻离心机 美国Beckman Coulter公司;蛋白电泳系统 美国Bio-Rad公司。
1.3方法
1.3.1组织蛋白酶活力测定
组织蛋白酶活性测定基本按照Barrett等[21]的方法,即分别以组织蛋白酶B、L的特异性荧光合成肽底物Z-Arg-Arg-MCA、Z-Phe-Arg-MCA,测定各纯化步骤所得活性部分的肽水解活性,并检测组织蛋白酶L的总酶活力、酶比活力等。
一个酶活力单位(U)定义为在反应温度40 ℃及反应pH 5.5条件下,1 min内能够水解底物并释放出1 nmol AMC所需的酶量(1 nmol AMC/min)。
蛋白质浓度测定参照Bradford[22]的方法,以牛血清白蛋白作为标准蛋白。
1.3.2组织蛋白酶L的纯化制备
1.3.2.1浓缩粗酶液的制备
新鲜牛胰脏于4 ℃条件下去除脂肪和结缔组织。取500 g切成小块,加入4 倍体积提取缓冲液(25 mmol/L乙酸钠缓冲液,pH 5.0,含5 mmol/L L-Cys、0.3 mmol/L PMSF,缓冲液A)匀浆1~2 min,10 000×g离心20 min得粗酶液。再用1 mol/L HCl将粗酶液pH值调至3.0,于30 ℃条件下处理10 min。然后用1 mol/L NaOH回调pH值至5.8~6.0,并立即10 000×g离心20 min。取上清液用80%硫酸铵充分盐析,10 000×g离心并取沉淀。用透析缓冲液(20 mmol/L磷酸盐缓冲液,pH 6.0,含5 mmol/L L-Cys,缓冲液B)充分透析,并用浓缩超滤管(配Amicon YM-10超滤膜,截留分子质量为10 kD)于5 000×g离心浓缩至适当体积。
1.3.2.2分离纯化
浓缩粗酶液上样到DEAE Sephacel阴离子交换柱(2.6 cm×20 cm),以0~1 mol/L NaCl梯度的磷酸盐缓冲液洗脱;收集活性峰,超滤浓缩后上样于Sephacryl S-100凝胶层析柱(2.6 cm×100 cm),以含0.2 mol/L NaCl的磷酸盐缓冲液洗脱;收集主要活性峰,透析、超滤浓缩后上样于SP Sepharose FF阳离子交换柱(1.6 cm×10 cm)进行层析,以0~1 mol/L NaCl梯度的磷酸盐缓冲液洗脱;收集主要活性峰,用透析、超滤浓缩后上样于Blue Sepharose FF染料亲和层析柱(1.6 cm×10 cm),以含0~1 mol/L NaCl的乙酸钠缓冲液洗脱;收集活性峰,透析、超滤浓缩,上样于ConA Sepharose亲和层析柱(1 cm×10 cm),以0~1 mol/L α-甲基-D-甘露糖苷(洗脱液)梯度的磷酸盐缓冲液洗脱;收集活性峰(穿透峰),超滤浓缩,于-80 ℃贮藏备用。
鉴定采用SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)方法,具体参照文献[14]。其中利用12.5%分离胶和4%浓缩胶,样品进入分离胶前采用80 V电压,之后采用120 V电泳1.5 h左右。电泳胶用凝胶成像系统扫描,用Quantity One电泳图像分析软件分析蛋白分子质量。
1.3.3酶学特性研究
1.3.3.1最适反应温度和热稳定性
按照1.3.1节酶活力测定方法,以Z-Phe-Arg-MCA为底物,在pH 6.0条件下,测定组织蛋白酶L在20~70 ℃范围内的肽水解活性,以测得最高酶活力为100%。此外,将组织蛋白酶L于pH 5.5条件下,在20~70 ℃范围内放置60 min,冷却至4 ℃后测定其残余酶活力,以测得最高酶活力为100%。
1.3.3.2最适反应pH值和pH值稳定性
分别配制pH 4.0~8.0的Mcilvaine's buffer。以Z-Phe-Arg-MCA为底物,测定组织蛋白酶L在不同pH值条件下的肽水解活性,以测得最高酶活力为100%。此外,20 ℃条件下将组织蛋白酶L处于上述不同pH值环境下放置60 min,回调pH值至5.5,测定其残余酶活力,以测得最高酶活力为100%。
1.3.3.3巯基激活剂及抑制剂对组织蛋白酶L活性的影响
按照酶活力测定方法,在pH 5.5、40 ℃条件下,以Z-Phe-Arg-MCA为底物,测定不同浓度的巯基还原剂DTT和L-Cys,以及半胱氨酸蛋白酶专一不可逆抑制剂E-64对组织蛋白酶L肽水解活性影响(均以空白对照的酶活力作为100%)。
1.3.3.4金属离子对组织蛋白酶L的影响
按照酶活力测定方法,在pH 5.5、40 ℃条件下,以Z-Phe-Arg-MCA为底物,测定浓度为1 mmol/L的Ca2+、Mg2+、Mn2+以及Zn2+对组织蛋白酶L肽水解活性影响(均以空白对照的酶活力作为100%)。
1.3.3.5组织蛋白酶L的底物专一性及动力学常数测定
分别以5~30 μmol/L的Z-Phe-Arg-MCA、20~200 μmol/L的Z-Arg-Arg-MCA及20~200 μmol/L的L-Arg-MCA作底物,于pH 5.5、40 ℃条件下,测定组织蛋白酶L的反应初速率,利用Lineweaver-Burk双倒数作图法,测定牛胰脏组织蛋白酶L对荧光合成肽底物Z-Phe-Arg-MCA、Z-Arg-Arg-MCA和L-Arg-MCA的Km值和vmax。
2 结果与分析
2.1组织蛋白酶L的层析纯化


图1 牛胰脏组织蛋白酶L纯化层析结果Fig.1 Purification of cathepsin L from bovine pancreas by ion exchange, get filtration and affinity chromatography
新鲜牛胰脏中的组织蛋白酶L经粗分离、酸处理、盐析及一系列层析,最终得到纯化。层析洗脱曲线图见图1。本实验从500 g牛胰脏中纯化制备了0.58 mg组织蛋白酶L,纯化倍数为530.54,酶活回收率为5.0%。纯化情况见表1,其纯化后的SDS-PAGE结果见图2。牛胰脏组织蛋白酶L在29.1 kD和18.9 kD处出现了两个条带。该结果表明,牛胰脏组织蛋白酶L有分子质量为29.1 kD和18.9 kD两个亚基,其分子质量略小于鲤鱼肝胰脏组织蛋白酶L(30 kD和24 kD)[15]。

表1 牛胰脏组织蛋白酶L纯化结果Table 1 Summary of purification procedures of cathepsin L from bovine pancreas

图2 牛胰脏组织蛋白酶L的SDS-PAGEE结果Fig.2 SDS-PAGE pattern of cathepsin L from bovine pancreas
2.2组织蛋白酶L的酶学特性
2.2.1最适反应温度及热稳定性
由图3可知,牛胰脏组织蛋白酶L的最适反应温度在40~50 ℃之间,与前人研究吻合[15]。其热稳定性随温度升高急剧下降,50 ℃时活性降一半,60 ℃几乎无活性。
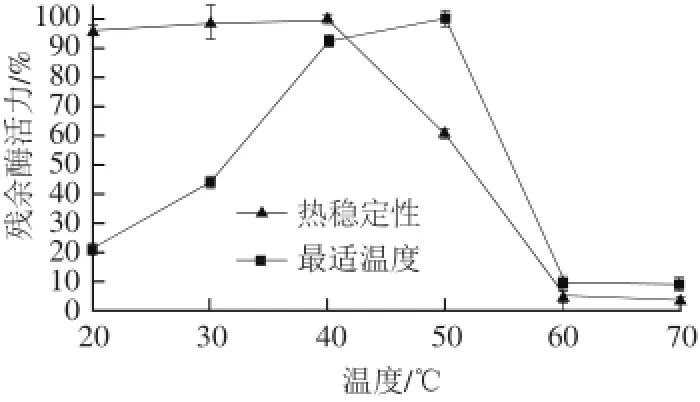
图3 牛胰脏组织蛋白酶L的最适温度和热稳定性Fig.3 Optimal temperature and heat stability of bovine pancreas cathepsin L
2.2.2最适pH值及pH值稳定性
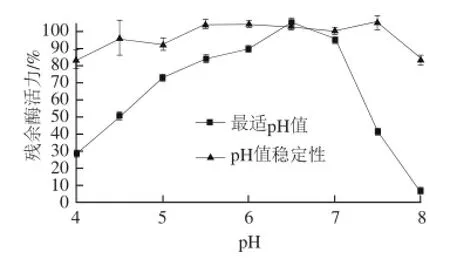
图4 牛胰脏组织蛋白酶L的最适pH值和pH值稳定性Fig.4 Optimal pH and pH stability of bovine pancreas cathepsin L
由图4可知,牛胰脏组织蛋白酶L的最适反应pH值为6.5,略高于鲤鱼肝胰脏组织蛋白酶L(5.5~6.0)[15]。该酶在3.0~8.0的pH值范围内,均保持了70%以上的活力。
2.2.3巯基还原剂及抑制剂对组织蛋白酶L活性的影响

图5 巯基还原剂和抑制剂对牛胰脏组织蛋白酶L的影响Fig.5 Effect of sulphydryl reducing agent and sulphydryl inhibitor on bovine pancreas cathepsin L
由图5a可知,在2~20 mmol/L浓度范围内,2 种巯基还原剂都明显激活了组织蛋白酶L的活性,其中DTT的激活作用最强。由图5b可知,随着E-64浓度升高,组织蛋白酶L活性逐渐降低,浓度达到10-5mol/L时,其活性被完全抑制。
2.2.4金属离子对组织蛋白酶L的影响

表2 金属离子对牛胰脏组织蛋白酶活性的影响Table 2 Effect of metal ion on the activity of bovine pancreas cathepsin L
由表2可知,Ca2+、Mg2+和Mn2+对组织蛋白酶L活性几乎没有影响,而Zn2+则较强烈地抑制其活性。该结果与前人研究基本一致[15-16]。
2.2.5组织蛋白酶L的底物专一性及动力学常数
经测定,牛胰脏组织蛋白酶L对Z-Phe-Arg-MCA有较强水解活性,Km值为3.52 μmol/L,低于箭齿鲽肌肉组织蛋白酶L的8.2 μmol/L和鲢鱼背肌组织蛋白酶L的9.5 μmol/L,表明其具有很强的底物亲和力;vmax值达到500 U/mg,高于鲢鱼背肌组织蛋白酶L的200 U/mg;而对组织蛋白酶B的专一性底物Z-Arg-Arg-MCA和组织蛋白酶H的专一性底物L-Arg-MCA几乎没有水解活性。这与前人纯化的组织蛋白酶L的特性相一致[10,15,23]。
3 结 论
牛胰脏组织蛋白酶L具有两个亚基,分子质量为29.1 kD和18.9 kD;其最适pH值在6.0~6.5之间,最适反应温度为50 ℃,在pH 4.0~8.0之间及40 ℃以下活性都能得到较好保持;巯基激活剂DTT和L-Cys可明显激活该酶的活性,而10-5mol/L巯基蛋白酶抑制剂E-64可强烈抑制其活性;1 mmol/L的Zn2+则可明显抑制其活性。牛胰脏组织蛋白酶L对其专一底物Z-Phe-Arg-MCA有较强水解活性,Km值为3.52 μmol/L,vmax值达到500 U/mg,不能水解组织蛋白酶B的专一底物Z-Arg-Arg-MCA和组织蛋白酶H专一底物L-Arg-MCA。
[1] GUROFF G. A neutral, calcium-activated proteinase from the soluble fraction of rat brain[J]. The Journal of Biological Chemistry, 1964,239(1): 149-155.
[2] KOOHMARAIE M. The role of Ca2+-dependent proteases (calpains)in post mortem proteolysis and meat tenderness[J]. Biochimie, 1992,74(3): 239-245.
[3] KOOHMARAIE M, GEESINK G H. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J]. Meat Science, 2006, 74(1): 34-43.
[4] JOHNSON M H, CALKINS C R, HUFFMAN R D, et al. Differences in cathepsin B + L and calcium-dependent protease activities among breed type and their relationship to beef tenderness[J]. Journal of Animal Science, 1990, 68(8): 2371-2379.
[5] O'HALLORAN G R, TROY D J, BUCKLEY D J, et al. The role of endogenous proteases in the tenderisation of fast glycolysing muscle[J]. Meat Science, 1997, 47(3/4): 187-210.
[6] 陈琳, 唐玮, 徐幸莲, 等. 溶酶体中的组织蛋白酶及其在肌肉成熟中的作用[J]. 江西农业学报, 2008(2): 72-75.
[7] 童敏. 钙激活酶3的性质及其在牛肉成熟过程中作用的研究[D]. 南京: 南京农业大学, 2005.
[8] MIKAMI M, WHITING A H, TAYLOR M A, et al. Degradation of myofibrils from rabbit, chicken and beef by cathepsin L and lysosomal lysates[J]. Meat Science, 1987, 21(2): 81-97.
[9] SANCHO R, JAIME I, BELTRAN J, et al. Degradation of actin by cathepsins in beef fibers stored at 20C[J]. Journal of Muscle Foods,1997, 8(2): 137-146.
[10] LI Shuhong, ZHOU Xiaoqiu, ZHANG Nan, et al. Purification and characterisation of cathepsin L2 from dorsal muscle of silver carp(Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008, 111(4):879-886.
[11] OGATA H, ARANISHI F, HARA K, et al. Proteolytic degradation of myofibrillar components by carp cathepsin L[J]. Journal of the Science of Food and Agriculture, 1998, 76(4): 499-504.
[12] LADRAT C, VERREZ-BAGNIS V, NO☒L J, et al. in vitro proteolysis of myofibrillar and sarcoplasmic proteins of white muscle of sea bass(Dicentrarchus labrax L.): effects of cathepsins B, D and L[J]. Food Chemistry, 2003, 81(4): 517-525.
[13] OKITANI A, MATSUKURA U, HIROMICHI K, et al. Purification and some properties of a myofibrillar protein-degrading protease,cathepsin L, from rabbit skeletal muscle[J]. Journal of Biochemistry,1980, 87(4): 1133-1143.
[14] WANG Rongrong, PENG Zengqi, HUI Teng, et al. Potential use of crude extracts from Alaska Pollock muscle as meat tenderizer[J]. CyTA-Journal of Food, 2013, 11(1): 50-59.
[15] ARANISHI F, OGATA H, HARA K, et al. Purification and characterization of cathepsin L from hepatopancreas of Carp Cyprinus carpio[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 1997, 118(3): 531-537.
[16] ZHONG Chan, CAI Qiufeng, LIU Guangming, et al. Purification and characterisation of cathepsin L from the skeletal muscle of blue scad(Decapterus maruadsi) and comparison of its role with myofibrilbound serine proteinase in the degradation of myofibrillar proteins[J]. Food Chemistry, 2012, 133(4): 1560-1568.
[17] ZHOU Dayong, CHANG Xianna, BAO Shasha, et al. Purification and partial characterisation of a cathepsin L-like proteinase from sea cucumber (Stichopus japonicus) and its tissue distribution in body wall[J]. Food Chemistry, 2014, 158: 192-199.
[18] BANDO Y, KOMINAMI E, KATUNUMA N. Purification and tissue distribution of rat cathepsin L[J]. Journal of Biochemistry, 1986,100(1): 35-42.
[19] MASON R W, GREEN G, BARRETT A J. Human liver cathepsin L[J]. Biochemical Journal, 1985, 226: 233-241.
[20] MASON R W, TAYLOR M, ETHERINGTON D J. The purification and properties of cathepsin L from rabbit liver[J]. Biochemical Journal,1984, 217: 209-217.
[21] BARRETT A J. Cathepsin B, cathepsin H, and cathepsin L[J]. Methods in Enzymology, 1981, 80: 535-561.
[22] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[23] VISESSANGUAN W, BENJAKUL S, AN H. Purification and characterization of cathepsin L in arrowtooth flounder (Atheresthes stomias) muscle[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2003, 134(3): 477-487.
Purification and Characterization of Cathepsin L from Bovine Pancreas
CUI Yuqing1,2, WANG Fulong1,2, CUI Baowei1,2, GUO Xiuyun1,2, LI Junke1,2, LIU Shixin1,2, LIU Senxuan1,2, PENG Zengqi1,2,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. Synergetic Innovation Center of Food Safety and Nutrition, Nanjing 210095, China)
In this study, 0.58 mg of purified enzyme was prepared from acidification and subsequent extraction of fresh bovine pancreas homogenate followed by purification through salting out and column chromatography. The purification fold was 530.54. The purified enzyme had two subunits with molecular weights of 18.9 and 29.1 kD, respectively on SDS-polyacrylamide gel electrophoresis (SDS-PAGE). The optimum reaction temperature for bovine pancreas cathepsin L was 50 ℃, and the optimum pH was 6.5. Its enzyme activity was efficiently activated by dithiothreitol (DTT) and L-cysteine(L-Cys), while it could be completely inhibited by 10 μmol/L E-64 and evidently suppressed by 1 mmol/L Zn2+. The purified enzyme could hydrolyze Z-Phe-Arg-MCA with a Kmvalue of 3.52 μmol/L.
cathepsin L; bovine pancreas; purification; enzymatic characterization
TS201.2
A
1002-6630(2015)15-0142-05
10.7506/spkx1002-6630-201515026
2014-09-25
国家现代农业(肉牛牦牛)产业技术体系建设专项(CARS-38)
崔昱清(1988—),男,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:2012108043@njau.edu.cn
彭增起(1956—),男,教授,博士,研究方向为畜产品、水产品加工与质量控制。E-mail:zqpeng@njau.edu.cn
