解淀粉芽孢杆菌H15产抗菌肽的发酵条件优化和提取方法比较研究
2015-11-02韩玉竹游成真李平兰
韩玉竹,邓 钊,张 宝,游成真,丛 苑,李平兰,*
(1.西南大学荣昌校区动物科学系,重庆 402460;2.中国农业大学食品科学与营养工程学 院,北京 100083)
解淀粉芽孢杆菌H15产抗菌肽的发酵条件优化和提取方法比较研究
韩玉竹1,2,邓 钊2,张 宝2,游成真2,丛 苑2,李平兰2,*
(1.西南大学荣昌校区动物科学系,重庆 402460;2.中国农业大学食品科学与营养工程学 院,北京 100083)
以尖孢镰刀菌为指示菌,无菌滤液抑菌圈直径为考察指标,对解淀粉芽孢杆菌H15所产抗菌肽的发酵和提取条件进行优化。获得优化后的最佳培养基为L-1培养基,最佳培养条件为:接种量3%、初始pH 6.68、培养温度30.79 ℃、培养时间48.61 h、转速160 r/min。在此优化条件下,发酵液抑菌圈直径可高达25.21 mm,比优化前(16.40 mm)提高了53.48%。以4 株玉米中携带的优势霉菌(草酸青霉、串珠镰刀菌、尖孢镰刀菌、黑曲霉)为指示菌,比较分析不同质量浓度硫酸铵沉淀和盐酸沉淀不同有机溶剂抽提对解淀粉芽孢杆菌H15抗菌肽提取的影响,结果均表明盐酸沉淀丙酮抽提法获得的抗菌肽活性最高。
抗菌肽;解淀粉芽孢杆菌;发酵条件;提取方法
霉菌侵染是玉米贮藏过程中的主要问题[1],不仅会造成经济损失,而且霉菌代谢产生的真菌毒素及其他有毒代谢产物会严重危害人类健康[2]。目前,为保障粮食在储藏过程不易发生霉变,传统方法一般是在粮食表面喷洒化学防霉剂,暴露出很多安全问题。目前,寻找天然高效的生物类抗菌物质已成为粮食防霉研究的热点[3]。
芽孢杆菌(Bacillus spp.)生长迅速、营养要求简单、抗逆性强,可以产生多肽类抗菌素以及具有溶菌作用的酶类,作为自然界中广泛存在的非致病菌,绝大多数芽孢杆菌对人畜无害且不会造成环境污染。因此,芽孢杆菌及其代谢产物,是目前控制真菌病害最为安全有效和最具应用前景的天然生物制剂,已应用于植物病害生物防治和生鲜农产品防腐保鲜的研究中,但在粮食防霉上的应用探索较少[4]。
本实验室前期对玉米中携带的霉菌种类进行分离鉴定[5],并筛选出多株对霉菌生长及孢子萌发有强烈抑制作用的芽孢菌株,其分泌的抑菌物质较粮食中使用的常规化学防腐剂更能有效地抑制玉米储藏过程中的霉菌生长,保障粮食安全[6-7]。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)H15是前期实验室筛选的具有较强拮抗粮食霉变真菌的菌株之一,并已明确产生抗菌肽是其拮抗病原真菌的主要机制之一。但抗菌肽的产量和活性受环境条件如温度、发酵时间、培养基组成等的影响很大,因而,对其发酵条件的研究显得十分重要[8]。同时抗菌肽的获得会受到抗菌物质提取方法的影响,选择合适的提取方法,能节省原料简化步骤,增加抗菌物质的获得量。本实验以该菌株为研究对象,对其产抗菌肽发酵和提取条件进行优化,获得该菌代谢产抗菌肽的最适宜条件,以期为该菌株在工业上大量生产高活性的抗菌肽提供一定的实践基础和理论依据。
1 材料与方法
1.1菌种
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)H15,专利保藏用名ivfcaas0003,中国农业大学食品科学与营养工程学院应用微生物研究室保藏菌种,专利保藏号为CGMCC 8230。
指示菌:4 株玉米中携带的优势霉菌[5,9]:草酸青霉(Penicillium oxalicum)ACCC 32576、串珠镰刀菌(Fusarium moniliforme)ACCC 36127、黑曲霉(Aspergillus niger)ACCC 30005、尖孢镰刀菌(Fusarium oxysporum)ACCC 37438,为中国农业大学食品科学与营养工程学院应用微生物研究室保藏菌种。
1.2发酵上清液的制备
以NB培养基作为种子培养基,培养24 h,按3%接种量接入发酵培养基中,三角瓶装液量200 mL/500 mL,在30 ℃、160 r/min振荡培养48 h,10 000 r/min离心10 min去除菌体细胞,用细菌滤器(0.22 μm)过滤,得到发酵液的无菌滤液,对其进行抑菌活性检测。
1.3抑菌活性的测定
采用牛津杯双层琼脂平板扩散-抑菌圈法测定上清液的抑菌活性。具体为:以尖孢镰刀菌为指示菌,将其在PDA斜面上活化,28 ℃培养7 d,加入灭菌水后刮取孢子,配制成浓度为106个/mL的孢子悬浮液。吸取1 mL孢子悬浮液至培养皿(直径为90 mm)中,倒入20 mL冷却到45 ℃的PDA培养基,摇匀,制成含菌平板。在灭菌的牛津杯里加入100 μL无菌滤液,置28 ℃恒温培养,48 h后测量抑菌圈直径。以孔中加入空白培养液为对照,每处理重复3 次。
1.4培养基的筛选
实验选用5 种常用细菌培养基:NB培养基:牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g,蒸馏水1 000 mL;LB培养基:酵母膏5.0 g、胰蛋白胨10.0 g、NaCl 5.0 g,蒸馏水1 000 mL;BPY培养基:牛肉膏5.0 g、蛋白胨10.0 g、酵母膏5.0 g、NaCl 5.0 g、葡萄糖10.0 g,蒸馏水1 000 mL;NYD培养基:牛肉膏8.0 g、酵母膏3.0 g、葡萄糖1.0 g,蒸馏水1 000 mL;PDB培养基:马铃薯200.0 g、葡萄糖20.0 g,蒸馏水1 000 mL。
选用5 种解淀粉芽孢杆菌抗菌物质发酵优化后的培养基:YSB培养基:蔗糖20.0 g、酵母膏20.0 g、牛肉膏15 g、MgSO4·7H2O 0.06 g、FeSO4·7H2O 0.009 g,蒸馏水1 000 mL[10];Landy培养基:葡萄糖20.0 g、L-谷氨酸钠5.0 g、MgSO40.5 g、KCl 0.5 g、KH2PO41.0 g、FeSO40.15 mg、MnSO45.0 mg、CuSO40.16 mg,蒸馏水1 000 mL;Landy优化培养基1(L-1):葡萄糖42.0 g、L-谷氨酸钠14.0 g、MgSO40.5 g、KCl 0.5 g、KH2PO41 g、FeSO40.15 mg、MnSO45.0 mg、CuSO40.16 mg,蒸馏水1 000 mL[11];Landy优化培养基2(L-2):葡萄糖10.0 g、L-谷氨酸钠5.0 g、MgSO40.5 g、KCl 0.78 g、KH2PO41.0 g、FeSO40.05 mg、MnSO45.0 mg、CuSO40.16 mg,蒸馏水1 000 mL[12];Landy优化培养基3(L-3):葡萄糖8.13 g、L-谷氨酸钠4.2 g、NH4NO36.14 g、MgSO40.5 g、KCl 0.5 g、KH2PO41.0 g、FeSO40.15 mg、MnSO44.87 mg、CaCl23.98 g、CuSO40.16 mg,蒸馏水1 000 mL[13]。
上述培养基pH值均为7.0~7.2。
1.5发酵条件的优化
1.5.1接种量对解淀粉芽孢杆菌H15发酵液抑菌活性的影响
分别以0.5%、1%、2%、3%、4%、5%、10%的接种量接种解淀粉芽孢杆菌H15,发酵初始pH值为7.0、培养温度30 ℃、培养时间48 h。发酵结束后,取样并测定发酵液的抑菌活性。
1.5.2发酵初始pH值对解淀粉芽孢杆菌H15发酵液抑菌活性的影响
以3%的接种量接种解淀粉芽孢杆菌H15,发酵初始pH值分别设为5.0、6.0、7.0、8.0、9.0,培养温度30 ℃、培养时间48 h。发酵结束后,取样并测定发酵液的抑菌活性。
1.5.3培养温度对解淀粉芽孢杆菌H15发酵液抑菌活性的影响
以3%接种量接种解淀粉芽孢杆菌H15,发酵初始pH 7.0,培养温度分别设为20、25、30、35、40 ℃,培养时间48 h。发酵结束后,取样并测定发酵液的抑菌活性。
1.5.4培养时间对解淀粉芽孢杆菌H15发酵液抑菌活性的影响
以3%接种量接种解淀粉芽孢杆菌H15、发酵初始pH 7.0、培养温度30 ℃,分别在不同培养时间(0、4、8、12、16、20、24、28、32、36、40、44、48、52、56、60 h)取样并测定发酵液的OD600nm值和抑菌活性。
1.5.5转速对解淀粉芽孢杆菌H15发酵液抑菌活性的影响
以3%接种量接种解淀粉芽孢杆菌H15、发酵初始pH 7.0、培养温度30 ℃、培养时间48 h,转速分别设为100、120、140、160、180、200 r/min,发酵结束后测定发酵液的抑菌活性。
1.6响应面优化
根据单因素试验结果,选取对抑菌活性影响最显著的3 个因素(培养温度、培养时间、初始pH值)为自变量,以无菌滤液的抑菌圈直径为响应值,根据中心组合原理设计方法,设计三因素三水平响应面试验,每组试验重复3 次。
1.7模型的验证
通过响应面法优化解淀粉芽孢杆菌H15产抗菌肽的发酵条件,并以优化后的条件参数进行发酵试验,比较模型预测值和试验值,验证模型的有效性。
1.8抗菌肽提取方法
1.8.1硫酸铵沉淀法
取100 mL发酵上清液,冰浴条件下,边搅拌边缓慢向上清中添加经过研磨的硫酸铵粉末,使铵离子终质量浓度分别达到20、30、40、50、60、70、80、90 g/100 mL,并放置4 ℃冰箱中过夜。10 000 r/min离心10 min,离心所得沉淀即为沉淀蛋白,分别向沉淀物中添加相同体积(发酵液浓缩5 倍)20 mmol/L的磷酸盐缓冲液使沉淀溶解后测定抑菌活性[14-16]。
1.8.2盐酸沉淀有机溶剂抽提法
取发酵液100 mL冰浴条件下,边搅拌边缓慢向上清中添加6 mol/L HCl,调整pH值至2.0,在4 ℃条件下静置过夜。沉淀的蛋白质在10 000 r/min离心10 min,沉淀分别用5 倍体积的甲醇[17]、丙酮[18]、乙醇、正丁醇[19]、乙酸乙酯[20]抽提。抽提后10 000 r/min离心10 min,收集上清液,沉淀用同 种有机溶剂再次抽提,离心除去沉淀。合并两次的抽提液,通风橱内风干有机溶剂后,即为粗提物。用相同体积(发酵液浓缩5 倍)20 mmol/L pH 7.0磷酸盐缓冲液溶解后测定抑菌活性。
1.9数据处理
采用SPSS 11.0进行单因素方差分析和差异显著性分析,采用Design Expert 8.0.6.1进行响应面数据分析。
2 结果与分析
2.1产抗菌肽培养基的筛选
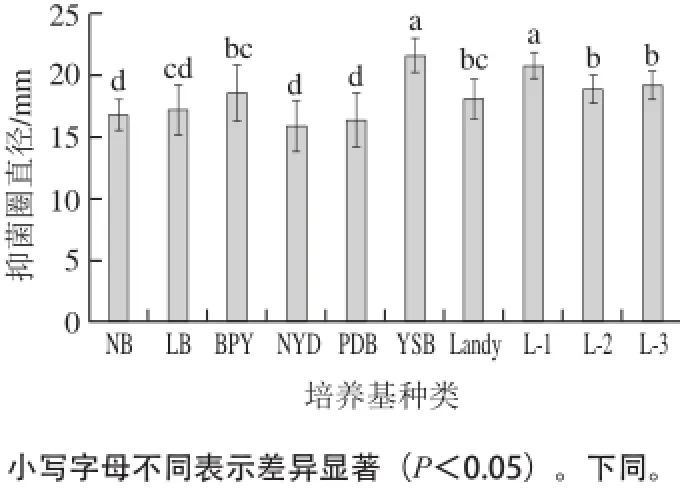
图1 不同培养基对发酵液抑菌活性的影响Fig.1 Effects of different media on the antifungal activity of fermented broth
由图1可知,在同等发酵条件下,采用YSB和L-1培养基都可获得相对较高活性的抗菌肽,两者之间没有显著差异(P<0.05)。其次为L-3、L-2、BPY培养基。但考虑到L-1培养基主要由谷氨酸钠和无机盐组成,成分相对简单,后续抗菌物质分离容易,成本低。因此,采用L-1培养基作为进一步试验的发酵培养基。
2.2发酵条件优化结果
2.2.1培养时间的影响
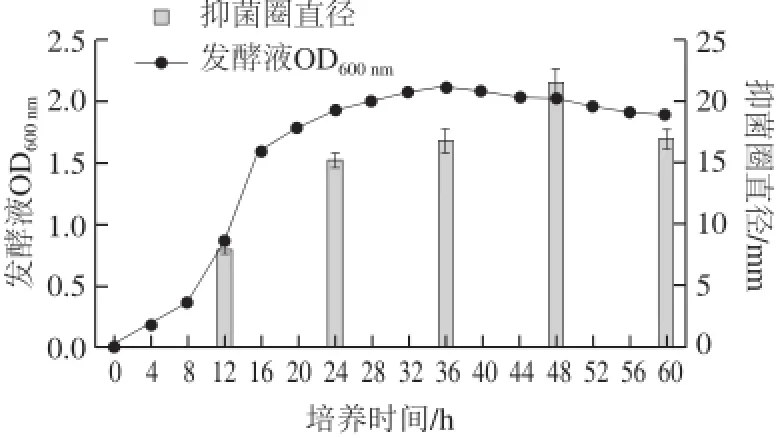
图2 解淀粉芽孢杆菌H15的生长及抑菌活性曲线Fig.2 Growth and antifungal activity curves of B. amyloliquefaciens H15
由图2可知,菌株H15在对数生长期(12 h)已产生抗菌物质,进入稳定期后抗菌活性持续增加,48 h时分泌的抗菌物质活性达到最大值。此后,抗菌物质的活性下降。通常认为抗菌肽的产生与生长相关联,有些抗菌肽在细胞开始生长时即可产生,而有些抗菌肽则在对数生长后期或稳定期才会产生。该抗菌肽在生长到一定时间(48 h)后抑菌活性降低,这可能是由于菌体生长进入衰亡期,菌体发生自溶,释放的蛋白酶降解了部分抗菌蛋白,使其活性降低。结果显示,菌株H15产抗菌肽的最适培养时间为48 h。本试验中,不同培养时间下,菌株H15所产抗菌肽的抑菌活性存在有显著差异(P<0.05),因而,选择48 h作为下一步响应面试验的中心试验点。
2.2.2接种量的影响

图3 不同接种量对解淀粉芽孢杆菌H15发酵液抑菌活性的影响Fig.3 Effect of inoculum amount on the antifungal activity of fermented broth of B. amyloliquefaciens H15
由图3可知,接种量为3%时该发酵上清液的抑菌活性较高,但是方差分析结果显示不同接种量对抗菌肽的合成影响并不显著(P>0.05),这可能是由于抗菌肽是细菌生长到一定阶段,为适应环境变化而产生的,它的合成是受菌体细胞群体感应调节的。虽然试验最开始采用了不同的接种量,但是在发酵48 h后,各处理菌体数量基本一致,抗菌肽的活性也差异不大。鉴于此,在后期的响应面优化试验中未选择接种量作为考察因素。
2.2.3初始pH值的影响

图4 不同初始pH值对解淀粉芽孢杆菌H15发酵液抑菌活性的影响Fig.4 Effect of initial pH on the antifungal activity of fermented broth of B. amyloliquefaciens H15
由图4可知,发酵初始pH值对该菌株抑菌活性的影响较为显著(P<0.05),当发酵初始pH值在5.0~7.0范围内时,菌株H15抗菌肽的抑菌活性增加,当发酵初始pH值为7.0时抑菌圈直径达到最大。之后,随发酵初始pH值的继续升高,抑菌活性呈逐渐下降趋势。这可能是由于某些酸性或碱性条件使得抗菌肽的转录翻译过程受阻。根据发酵上清液抑菌活性的测定结果,确定该菌株产生抗菌肽的最适初始pH值为7.0,并选择初始pH 7.0作为下一步响应面试验的中心试验点。
2.2.4培养温度的影响
由图5可知,不同的培养温度对抗菌肽的活性有较大影响(P<0.05)。随着温度的升高,发酵液的抑菌活性不断增强,当温度为30 ℃时,抑菌圈直径达到最大(22.78 mm),然而,随着温度的继续升高,发酵液的抑菌活性明显下降。因此,确定菌株H15合成抗菌肽的最适温度为30 ℃,并选择其为下一步响应面试验的中心试验点。
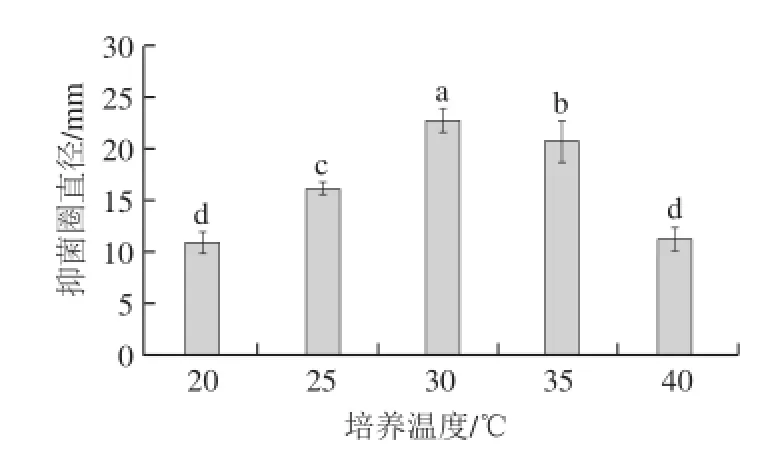
图5 不同培养温度对解淀粉芽孢杆菌H15发酵液抑菌活性的影响Fig.5 Effect of fermentation temperature on the antifungal activity of fermented broth of B. amyloliquefaciens H15
2.2.5转速的影响
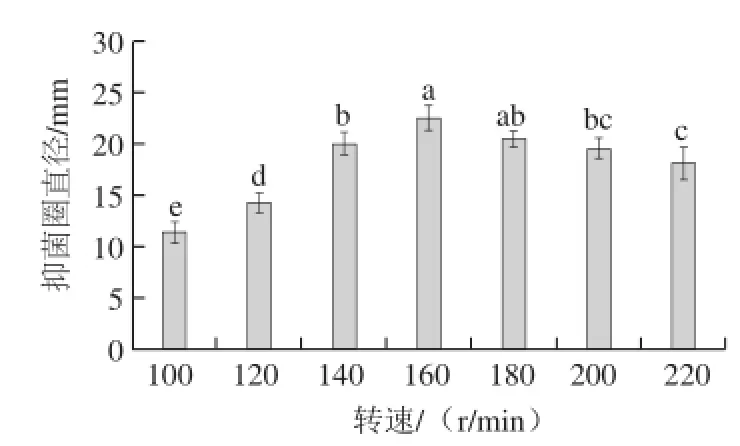
图6 不同转速对解淀粉芽孢杆菌H15发酵液抑菌活性的影响Fig.6 Effect of rotational speed on the antifungal activity of fermented broth of B. amyloliquefaciens H15
由图6可知,不同的转速对抗菌肽的抑菌活性有显著影响(P<0.05)。随着转速的升高,发酵液的抑菌活性不断增强,当转速为160 r/min时,抑菌圈直径达到最大,然而,随着转速的继续升高,发酵液的抑菌活性下降。因此,确定菌株H15合成抗菌肽的最适转速为160 r/min。
虽然转速对抗菌肽的产生有影响,但没有初始pH值、培养时间、培养温度这3 个因素影响大,因此后期的响应面优化试验中未选择转速作为考察因素。
2.3解淀粉芽孢杆菌H15产抗菌肽响应面优化结果
2.3.1回归模型的建立及方差分析
采用中心组合试验设计,方案及结果见表1。用Design Expert 8.0.6.1软件对表中数据进行多元回归拟合,得到解淀粉芽孢杆菌H15上清液的抑菌圈直径(Y)对培养温度(A)、培养时间(B)、初始pH值(C)的多项回归方程:Y=-237.446 50+6.951 15A+1.519 52B+ 35.476 50C+2.5×10-4AB-0.070 5AC-0.026 875BC-0.105 44A2-0.013 861B2-2.393 50C2。2.3.2 回归模型方差分析

表1 中心组合试验方案及结果Table 1 Design and results of central composite tests
对上述回归模型进行方差分析,结果见表2。回归模型极显著(P=0.004 9),失拟检验不显著(P=0.397 9),说明未知因素对试验结果干扰很小。同时,该模型的决定系数为R2=0.968 7,说明方程与实际的试验数据拟合较好,较好地反映了无菌滤液的抑菌活性与培养温度、培养时间、初始pH值的关系,因此可用该模型对解淀粉芽孢杆菌H15代谢产抗菌肽的培养条件进行分析和预测。回归方程中各变量对响应值影响的显著性由F检验来判定,P值越小,则响应变量的显著程度越高。由回归方程系数显著性检验可知:模型一次项C极显著,A、B不显著;二次项A2、B2、C2均处于极显著水平;交互项AB、AC、BC均不显著。

表2 拟合二次多项式模型的方差分析Table 2 Analysis of variance (ANOVA) for the fitted quadratic polynomial model odel
2.3.3响应曲面图及其等高线图
由回归方程所作的响应面立体分析图及其等高线如图7~9所示,它们分别反映了培养温度、培养时间、初始pH值这3 个因素的两两交互作用对响应值的影响。通过方程可知,二次项的系数均为负值,其所表征的抛物面开口向下,具有极大值点。利用Design Expert 8.0.6.1软件分析,可得菌株H15的抑菌活性的最佳培养条件为:培养温度30.79 ℃、培养时间48. 61 h、初始pH 6.68,在此条件下无菌滤液的抑菌圈直径为25.17 mm。
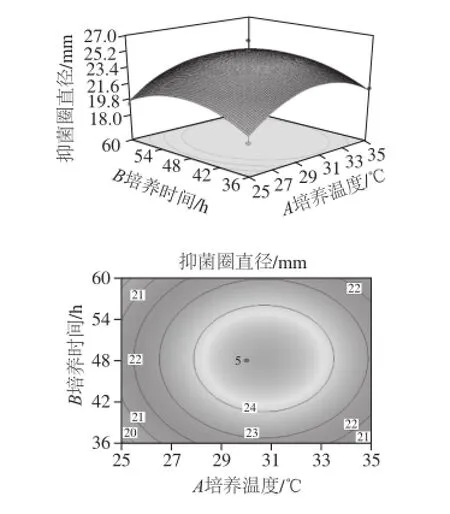
图7 培养温度和培养时间对菌株H15发酵液抑菌活性影响的响应面立体分析图及等高线图Fig.7 Response surface and conto ur plots for the effect of fermentation temperature and fermentation time on the antifungal activity of fermented broth

图8 初始pH值和培养温度对菌株H15发酵液抑菌活性影响的响应面立体分析图及等高线图Fig.8 Response surface and contour plots for the effect of initial pH and fermentation temperature on the antifungal activity of fermented broth
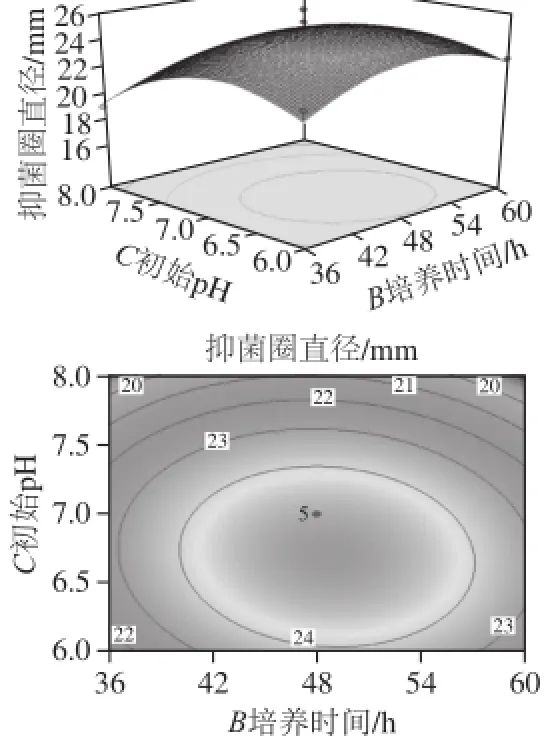
图9 初始pH值和培养时间对菌株H15发酵液抑菌活性影响的响应面立体分析图及等高线图Fig.9 Response surface and contour plots for the effect of initial pH and fermentation time on the antifungal activity of fermented broth
2.3.4回归模型的验证
为了进一步验证预测值,利用优化后确定的培养条件进行3 次重复摇瓶实验,无菌滤液的抑菌圈直径平均值为25.21 mm,与预测值拟合率达99.25%,表明预测值和实际值有良好的拟合性,优化模型可靠。优化后抗菌肽的抑菌活性比优化前(16.40 mm)提高了53.48%,说明本试验所确定的优化方案的设计合理有效,所获得的培养条件能够明显提高发酵液中抗菌物质的活性。
2.4不同提取方法获得抗菌肽对真菌的抑菌效果


图10 不同提取方法获得的抗菌肽对4 株玉米携带优势真菌的抑菌效果Fig.10 Inhibitory effects of antifungal peptides from different extraction methods on four dominant molds isolated from corn
目前解淀粉芽孢杆菌抗菌肽的提取方法主要有硫酸铵沉淀法和盐酸沉淀有机溶剂抽提法。由图10可知,以4 株玉米中携带的优势霉菌[草酸青霉(Penicillium oxalicum)、串珠镰刀菌(Fusarium moniliforme)、黑曲霉(Aspergillus niger)、尖孢镰刀菌(Fusarium oxysporum)]为指示菌,结果均表明,盐酸沉淀有机溶剂抽提均要比硫酸铵沉淀法抗菌肽提取效果好,5 种有机溶剂比较,丙酮抽提效果最好,其次为乙醇,但它们之间没有显著性差异。
不同质量 浓度的硫酸铵之间抑菌圈的大小差别不是很大,且抑菌效果不明显。采用盐酸沉淀有机溶剂抽提时,随着pH值降低,发酵液中将出现大量的沉淀,当pH值降至2.0时沉淀量达到最大,沉淀分别用甲醇、丙酮、乙醇及乙酸乙酯和正丁醇抽提。不同有机溶剂抽提效果差距明显,其中丙酮抽提效果最好,乙酸乙酯效果最弱。综上所述,选择丙酮作为提取溶剂。
3 讨 论
芽孢杆菌次生代谢物的产生主要受培养基营养成分(碳、氮源和无机盐)、发酵条件(温度、pH值、发酵时间、接种量、通气量等)和高度复杂的代谢调节机制的影响[10]。本研究比较了5 种常用细菌培养基和5 种已报道芽孢杆菌抗菌物质发酵优化后的培养基,对解淀粉芽孢杆菌H15菌株产抗菌物质活性的影响。结果发现,同等发酵条件下,YSB和L-1培养基均可获得相对较高活性的抗菌肽,显著高于其他8 种培养基。但考虑到抗菌物质的提取纯化过程是一个不断去除非活性物质和逐渐浓缩活性物质的过程。初始培养液中含有抗菌物质的浓度越大,成分越简单清楚,越利于提高纯化物的得率,简化后期的提取环节,降低生产成本,而且有利于纯化物的鉴定和分析。YSB和L-1两个高产抗菌肽培养基比较,L-1培养基主要由谷氨酸钠和无机盐组成,成分相对简单,成本低,后续抗菌物质分离容易,该培养基具备了今后抗菌肽大量工业发酵生产中应用的先决条件。因此,采用L-1培养基作为进一步试验的发酵培养基。
采用L-1培养基对解淀粉芽孢杆菌H15产抗菌肽的发酵条件进行优化。本研究首先应用单因素试验,对影响解淀粉芽孢杆菌H15产抗菌肽的诸多因素进行了评价,筛选出了影响发酵产抗菌肽的主要内在因素(培养时间、培养温度和初始pH值)。进一步在单因素试验基础上,通过响应曲面法对主要影响因子进行优化和评价,建立解淀粉芽孢杆菌H15菌株发酵产抗菌肽的二次多项式回归模型,并利用统计学方法对该模型进行了显著性检验。通过对该模型进行求导和解矩阵可知,在各因素分别为培养时间48.61 h、培养温度30.79 ℃、初始pH 6.68、转速160 r/min、接种量3%时,可获得最高活性的抑菌物质,预测值为25.17 mm。在此条件下再进行验证实验,得到发酵液抑菌圈直径25.21 mm,与预测值拟合率达99.25%,比优化前(16.40 mm)提高了53.48%。说明本试验所确定的优化方案的设计合理有效,所获得的培养条件能够明显提高发酵液中抑菌物质的活性。
目前国内外关于芽孢杆菌抗菌肽的研究多数集中于提高其发酵产量方面,而如何将高产量的抗菌物质从培养基质中高效提取出来鲜有报道。复杂基质共存下微量活性物质的高效提取仍是困扰资源高效利用的瓶颈问题。因此,本研究选取4 株玉米中携带的优势霉菌[草酸青霉(Penicillium oxalicum)、串珠镰刀菌(Fusarium moniliforme)、黑曲霉(Aspergillus niger)、尖孢镰刀菌(Fusarium oxysporum)]为指示菌,对目前报道的适合芽孢杆菌抗菌物质的提取方法,主要有硫酸铵沉淀法和盐酸沉淀有机溶剂法,进行比较分析。结果均表明,盐酸沉淀有机溶剂抽提均要比硫酸铵沉淀法抗菌肽提取效果好,5 种有机溶剂(甲醇、丙酮、乙醇、乙酸乙酯和正丁醇)比较,丙酮抽提效果最好。这些发酵和提取工艺优化结果对将来研究利用该菌的活性物质具有一定指导意义。
[1] JIN S. Mold growth in maize storage as affected by compound factors:different levels of maize weevils, broken corn and foreign materials,and moisture contents[J]. Journal of Asia-Pacific Entomology, 2001,4(1): 17-21.
[2] ROCHAA M E B, FREIRE F C O, MAIA F E F, et al. Mycotoxins and their effects on human and animal health[J]. Food Control, 2014,36: 159-165.
[3] 蔡静平. 储粮微生物活性及其应用的研究[J]. 中国粮油学报, 2004,19(4): 76-79.
[4] 洪鹏, 安国栋, 胡美英, 等. 解淀粉芽孢杆菌防治果蔬采后病害研究进展[J]. 中国农学通报, 2013, 29(12): 168-173.
[5] 杜奕君, 丛苑, 李平兰. 玉米致腐霉菌的分离、鉴定及其生物学特性[J]. 中国农业大学学报, 2013, 18(5): 90-95.
[6] 李平兰, 丛苑, 杜奕君, 等. 一种抗霉菌芽孢杆菌菌株及其抗菌产物在玉米储藏中的应用: 中国, ZL201310263918.0[P]. 2014-07-23.
[7] 丛苑. 玉米霉菌快速检测技术及控制研究[D]. 北京: 中国农业大学, 2013.
[8] AKPA E, JACQUES P, WATHELET B, et al. Influence of culture conditions on lipopeptide production by Bacillus subtilis[J]. Applied Biochemistry and Biotechnology, 2001, 93: 551-561.
[9] 安美玉, 王福兴, 刘炜, 等. 尖孢镰刀菌(Fusarium oxysporum Schl)在液体培养基中产生毒素条件的研究[J]. 哈尔滨医科大学学报,1980(2): 32-36.
[10] 叶云峰, 黎起秦, 袁高庆, 等. 枯草芽孢杆菌B47菌株高产抗菌物质的培养基及发酵条件优化[J]. 微生物学通报, 2011, 38(9):1339-1346.
[11] 方传记, 陆兆新, 孙力军, 等. 淀粉液化芽孢杆菌抗菌脂肽发酵培养基及发酵条件的优化[J]. 中国农业科学, 2008, 41(2): 533-539.
[12] 孙力军. 植物内生菌Bacillus amyloliquefaciens ES-2的分离筛选及其抗菌物质的研究[D]. 南京: 南京农业大学, 2006.
[13] 沈娟, 陆兆新, 别小妹, 等. Bacillus sp. fmbJ224发酵产新型抗菌肽培养基的优化研究[J]. 生物工程学报, 2005, 21(4): 609-614.
[14] XIN Zhao, ZHI Jiangzhou, YE Han, et al. Isolation and identification of antifungal peptides from Bacillus BH072, a novel bacterium isolated from honey[J]. Microbiological Research, 2013, 168: 598-606.
[15] ZHAO Xiaoyan, ZHAO Xiaomeng, WEI Yanmini, et al. Isolation and identification of a novel antifungal protein from a rhizobacterium Bacillus subtilis strain F3[J]. Journal of Phytopathology, 2013, 161:43-48.
[16] CHEN Zhiteng, AO Jingqun, YANG Wenchuan, et al. Purification and characterization of a novel antifungal protein secreted by Penicillium chrysogenum from an Arctic sediment[J]. Applied Microbiology and Biotechnology, 2013, 97: 10381-10390.
[17] GONG Qingwei, ZHANG Chong, L☒ Fengxia, et al. Identification of bacillomycin D from Bacillus subtilis fmbJ and its inhibition effects against Aspergillus fl avus[J]. Food Control, 2014, 36: 8-14.
[18] SLAVOKHOTOVA A A, ROGOZHIN E A, MUSOLYAMOV A K,et al. Novel antifungal a-hairpinin peptide from Stellaria media seeds: structure, biosynthesis, gene structure and evolution[J]. Plant Molecular Biology, 2014, 84: 189-202.
[19] ZHAO Zhenzhen, WANG Qiushuo, WANG Kaimei, et al. Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J]. Bioresource Technology, 2010, 101: 292-297.
[20] YUAN Bo, WANG Zhe, QIN Sheng, et al. Study of the anti-sapstain fungus activity of Bacillus amyloliquefaciens CGMCC 5569 associated with Ginkgo biloba and identification of its active components[J]. Bioresource Technology, 2012, 114: 536-541.
Optimization of Fermentation Conditions for Production of Antifungal Peptides by Bacillus amyloliquefaciens H15 and Comparison of Extraction Methods for Antifungal Peptides
HAN Yuzhu1,2, DENG Zhao2, ZHANG Bao2, YOU Chengzhen2, CONG Yuan2, LI Pinglan2,*
(1. Department of Animal Science, Rongchang Campus, Southwest University, Chongqing 402460, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Fermentation and extraction conditions for antifungal peptide production by Bacillus amyloliquefaciens H15 were optimized for larger diameters of inhibitory zones of Fusarium oxysporum ACCC 37438 when exposed to cell-free fermentation broths. Results showed that using L-1 medium, the optimal culture conditions were 3%, 6.68, 160 r/min,48.61 h and 30.79 ℃ for inoculum amount, initial pH, rotational speed, culture time and temperature, respectively, leading to an inhibitory zone diameter of 25.21 mm, which was 53.48% higher than that (16.40 mm) before optimization. In addition,extraction efficiencies of ammonia sulfate precipitation and hydrochloric acid precipitation followed by organic solvent extraction for the extraction of antifungal peptides from the fermentation broth were compared by using four dominant molds isolated from corn as the indicator strains. All the obtained results showed that hydrochloric acid precipitation and then acetone extraction yielded the highest antifungal activity.
antifungal peptides; Bacillus amyloliquefaciens; fermentation condition; extraction method
TQ920.6
A
1002-6630(2015)15-0135-07
10.7506/spkx1002-6630-201515025
2014-09-17
公益性行业(农业)科研专项(201303014);“十二五”国家科技支撑计划项目(2012AA101609-7);西南大学博士基金项目(2013Bsr06);中央高校基本科研业务费专项资金项目(XDJK2015C121)
韩玉竹(1982—),女,讲师,博士,研究方向为微生物活性代谢产物。E-mail:63214419@qq.com
李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn
