牛分枝杆菌蛋白基因相互作用研究工具及其进展
2015-11-02张喜悦范伟兴
张喜悦,史 扬,范伟兴
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛市黄岛区畜牧兽医局,山东青岛 266032)
牛分枝杆菌蛋白基因相互作用研究工具及其进展
张喜悦1,史扬2,范伟兴1
(1.中国动物卫生与流行病学中心,山东青岛266032;2.青岛市黄岛区畜牧兽医局,山东青岛266032)
目前有多种技术应用于结核分枝杆菌蛋白相互作用的研究:一是酵母双杂交技术,可以在生物体内验证2个蛋白的相互作用。二是构建分枝杆菌基因突变株,研究蛋白作用的机理,其基本策略为,基因敲除双链DNA的扩增;牛结核分枝杆菌/pJV53感受态细胞的制备;将基因敲除双链DNA片段转化至牛结核分枝杆菌细胞中;筛选、鉴定阳性菌落。三是通过GST pull-down试验检测已知蛋白和靶蛋白的相互作用。目前,研究牛分枝杆菌蛋白基因相互作用较多是RD1 区基因。研究表明,阐明分枝杆菌蛋白的作用机理有助于进一步研发高效的牛结核病诊断试剂和疫苗。
牛结核分枝杆菌;蛋白;相互作用
牛分枝杆菌(Mycobacterium bovis)是牛结核病的主要病原,除感染人外,还可感染50 多种哺乳动物和 25 种禽类[1]。1998年,第一个分枝杆菌的全基因组一一MtbH37Rv在《Nature》杂志上发布[2],标志着分枝杆菌的研究进入了基因组学时代。2003年,牛型分枝杆菌(M.bovis) AF2122/97的基因组序列公布,与结核分枝杆菌相比,其基因组在核酸水平上有超过99.95%的同源性[3]。值得注意的是,相比于MtbH37Rv,M. bovis没有特异的基因,揭示了结核病研究的后基因组时代。无论是开发诊断试剂,还是研制疫苗,都需要对结核分枝杆菌的蛋白作用机理进行基础性和探索性的研究,本文就牛分枝杆菌蛋白基因相互作用研究工具及进展加以综述。
1 酵母双杂交技术是研究蛋白相互作用的有效分子技术
酵母双杂交技术完全模拟了体内环境下蛋白间的相互作用,具有操作简单、结果准确等优势。酵母菌株AH109带有报告基因,正常的AH109菌株在缺少任何一种营养成分的培养基中都不能生长。将已知蛋白基因克隆至诱饵质粒(Bait Plasmid,pGBK-T7),将靶蛋白基因克隆至猎物质粒(Prey Plasmid,pACT-2),只有当质粒pGBK-T7和pACT-2 共同转化入AH109,而且两个质粒表达的蛋白能够相互结合时,才能启动报告基因表达,完成酵母双杂交试验,从而验证2个蛋白的相互作用。李岩等构建了载体质粒pGBKT7-ESAT-6和pGADT7-CFP-10,采用醋酸锂法顺序转染酵母菌AH109,结果实验阳性,证实了这2个基因的相互作用[4]。

图1 酵母双杂交原理示意图
2 结核分枝杆菌重组菌株广泛应用于蛋白功能的研究
Parish等建立了一种构建分枝杆菌基因突变株的方法[5-6],并利用该方法构建了plcABC、tlyA等基因敲除菌株。该方法主要包括两个系列的质粒载体:其中一个为pNIL质粒,包含允许操纵靶基因序列的各种限制性酶切位点;另一个系列为pGOAL质粒,包含夹有标记盒的PacI酶切位点。然后通过从pGOAL载体中克隆标记盒,插入至已经带有要突变基因的pNIL载体中,构建自杀质粒和基因突变结核分枝杆菌菌株。
Julia等建立了pJV53体系构建基因突变菌株,该方法更为高效和简便[7-8]。其基本步骤如下(见图2,引自Julia )。
2.1基因敲除双链DNA的扩增
从Gene bank上查询已知蛋白或靶蛋白(简称为目标蛋白)的序列及其两侧的序列,按照其两侧的序列设计引物,至少保留有500bp的两侧同源序列,扩增出仅有两侧序列而删除目标蛋白基因的PCR片段,即基因敲除双链DNA。将基因敲除双链DNA克隆至pYUB125或pYUB854质粒中,利用PCR扩增或酶切技术,制备基因敲除双链DNA。
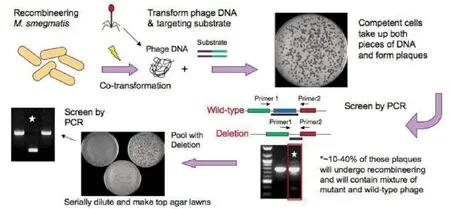
图2 基因敲除菌株构建的基本步骤
将DNA片段扩增至pYUB854。采用在基因敲除重组菌株中增加潮霉素抗性基因的策略,分2段分别将目标蛋白基因两侧的同源序列扩增到pYUB854质粒中潮霉素抗性基因的两端。
2.2制备牛结核分枝杆菌/pJV53感受态细胞
首先培养牛分枝杆菌,当液体培养的牛结核分枝杆菌OD600 = 0.8时收获,使用甘油法制备感受态细胞。其次培养提纯pJV53,将pJV53用电转法感染至牛结核分枝杆菌中,制备牛结核分枝杆菌/ pJV53感受态细胞。最后将该感受态细胞再次培养,当OD600 = 0.5,加入乙酰胺,培养一段时间后,如前述再次制备牛结核分枝杆菌/pJV53感受态细胞,并可用紫外线照射处理感受态细胞。
使用pJV53体系构建基因敲除分枝杆菌菌株的基本原理是pJV53质粒中的Che9c gp60和gp61蛋白可以作为DNA外切酶在菌体内发挥作用,从而实现基因敲除DNA片段与菌株基因组在菌株体内的杂交,完成基因组的突变(见图3,引自Julia)。
2.3将基因敲除双链DNA片段转化至牛结核分枝杆菌中
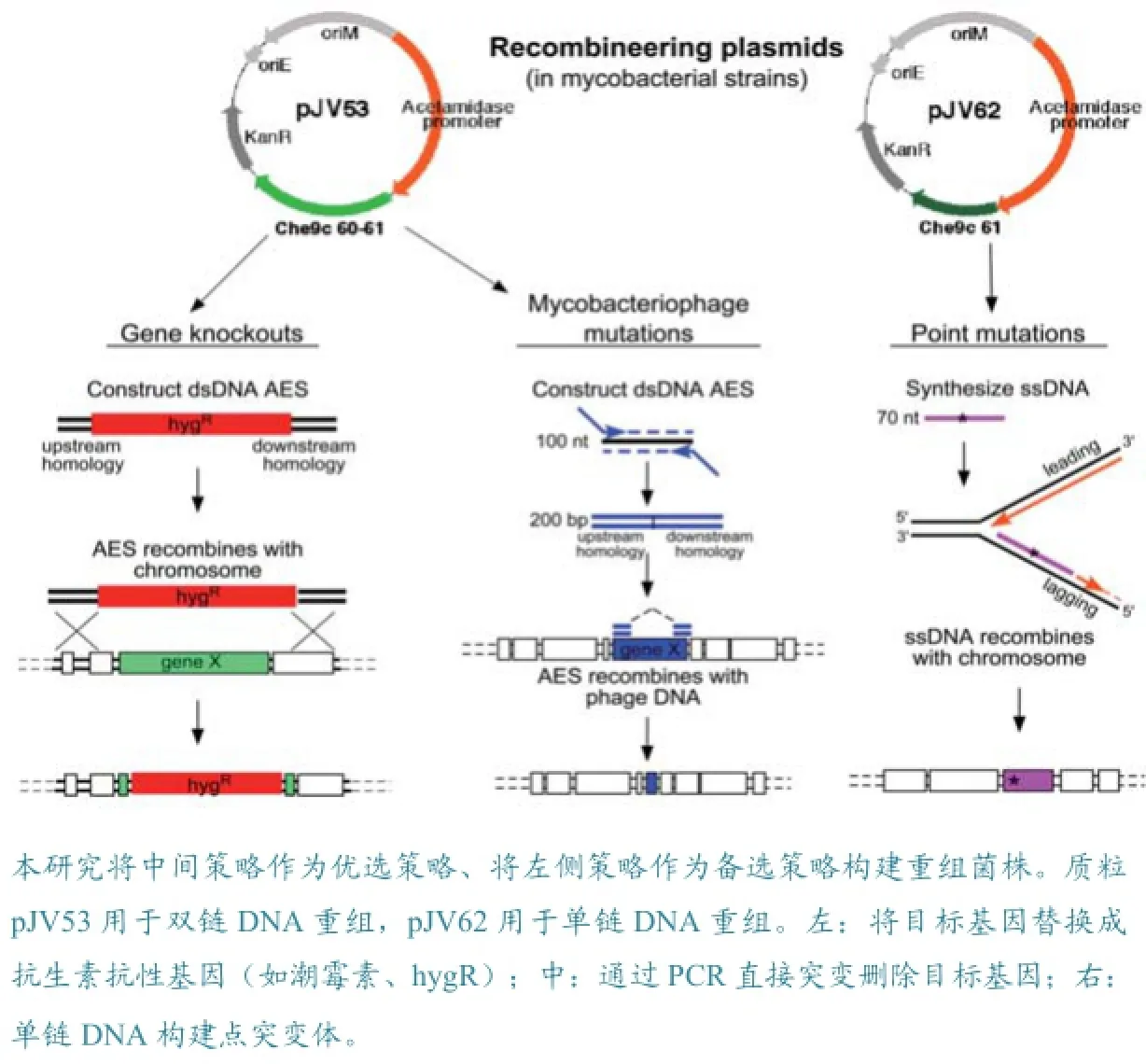
图3 基因突变分枝杆菌菌株构建示意图
将分枝杆菌/pJV53感受态、基因敲除双链DNA片段、pJV53 DNA按比例混合,至冰上作用10分钟,使用电转化仪转染。将转染后的细胞置于7H9 液体中培养2小时,然后接种于固体培养基,使其长出阳性克隆菌落。
当使用潮霉素抗性策略时,应使用潮霉素抗性选择培养基。
2.4筛选、鉴定阳性菌落
挑选单个菌落,扩大培养,然后使用PCR方法鉴定阳性菌落,经测序确定目标蛋白基因已经敲除,将阳性菌落扩大培养,保存备用。当使用潮霉素抗性策略时,应使用潮霉素抗性选择培养基。阳性菌落鉴定完成后,可使用图3“中”的策略去掉潮霉素抗性基因。
3 GST pull-down试验检测已知蛋白和靶蛋白的相互作用
Bryant等通过GST Pull down试验研究分枝杆菌蛋白EspBM和Mh3879c的相互作用[9]。该方法主要分为2个步骤。
3.1构建质粒与亲和纯化
构建已知蛋白pGST重组质粒,融合表达pGST已知蛋白,将表达的已知融合蛋白经过亲和层析纯化,将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,作为与目的蛋白亲和的支撑物。
3.2GST pull-down试验操作
培养分枝杆菌,制备全菌裂解物和细菌培养滤液蛋白混合物作为目的蛋白溶液,将目的蛋白溶液过柱,从中捕获与之相互作用的靶蛋白。洗脱层析结合物后,使用western-blot检测靶蛋白的表达水平,从而研究已知蛋白和靶蛋白的相互作用。
4 分枝杆菌蛋白基因相互作用研究进展
目前研究较多的有RD1 区基因[9-11]。这是一组与结核杆菌致病性相关的基因,其中ESAT-6能广泛地被人和不同种属动物的免疫系统所识别,诱导宿主的特异性CD4+T 细胞和CD8+CTL的增殖及IFN的大量产生。CFP-10也是一种免疫优势抗原,能够诱导强烈的细胞和体液免疫。二者在保护性免疫反应中发挥重要的作用,是构建新型结核疫苗和诊断试剂的候选基因。ESAT-6 和CFP-10 编码基因的位置相邻,处于同一操纵子中协同转录。Priscille等通过敲除目的基因[12],证实Rv3868、 Rv3869、Rv3870、Rv3871和Rv3877等基因对于ESAT-6和CFP10的分泌是必需的,而Rv3873 和Rv3876的失活并不影响ESAT-6的分泌。Bryant等证实EspBM和Mh3879c具有相互作用,同时其结核分枝杆菌同源物EspBT与Rv3879c也具有相互作用,而敲除了EspBM与Mh3879c结合位点的突变株就不能分泌EspBM[9]。
Janka等使用酵母双杂交试验[11],发现ESAT-6和CFP10能够形成异源和同源二聚体,Rv3873、Rv3866、Rv3868和CFP-10可以相互作用形成异源二聚体,但这些蛋白与ESAT-6并无相互作用,揭示ESAT-6必须通过与CFP-10的相互作用才能够发挥其作用。这些蛋白相互作用形成一个外分泌通道,但在该外分泌通道中,仍然缺乏ESAT-5通过细胞壁的关键蛋白环节
Saïd-Salim等发现MPB70和MPB83这2种蛋白的高水平表达与Rv0444c的突变相关联[13]。高水平表达MPB70/MPB83的卡介苗俄罗斯菌株,经补充野生型Rv0444c基因后,会导致mpb70/ mpb83的表达显著下降。通过酵母双杂交,证实Rv0444c编码蛋白的N端与SigK相互作用,进一步证明了Rv0444c编码抗SigK蛋白,该基因的变异则可以解释部分菌株MPT70/MPT83的高水平表达。但目前对这些具有强烈免疫反应分子的作用机理仍然缺乏深入的研究。
Blair等发现结核分枝杆菌的Lsr2可导致ESX分泌系统及PE/PPE蛋白家族表达的下调[14]。2012年,Khalid等研究了PPE18调节作用[15]。Valentina等深入研究了PE11-PPE17的配对,通过构建PE11敲除菌株和PPE区域突变菌株,发现PPE17不是分泌蛋白而是暴露于菌株表面;PPE17可以在缺乏PE11的情况下定位于菌株表面,而该分子的PPE区域是定位的关键区域[16]。相对而言,更多的PE/PPE蛋白的作用机理尚不清晰。
5 牛分枝杆菌分子蛋白相互作用的研究意义
国内外众多学者尝试克隆表达不同的或联合的分子抗原,用于牛结核病诊断试剂和疫苗的研发,但其效果要差于牛结核全菌提取抗原制备的诊断试剂或全菌疫苗(BCG)。牛结核分枝杆菌与病毒不同,其单个蛋白的发挥效应要受制于其上下游的多个蛋白。诊断试剂研发中,ESAT-6和CFP10往往要联合才能高效发挥其作用;疫苗研发中,机体内的某个或某几个联合分子重组疫苗,虽然能表达,但其作用机理多不清晰。如何通过上下游调节信号通路调节蛋白的表达、如何通过细胞壁分泌到环境中进而刺激机体产生免疫保护等均不清晰。只有阐明了这些蛋白的作用机理,才能够进一步研发高效的牛结核病诊断试剂抗原和重组疫苗。因此,牛分枝杆菌分子蛋白相互作用的研究,将为开发诊断试剂和疫苗提供工具和基础数据。
[1] OIE. BOVINE TUBERCULOSIS[EB/OL].(2014-10-11). http://www.oie.int/fileadmin/Home/eng/Health_standards/ tahm/ 2.04.07_BOVINE_TB.pdf.
[2]Cole S T, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence[J]. Nature. 1998,393(6685):537-44.
[3]Garnier T, Eiglmeier K, Camus J C, et al. The complete genome sequence of Mycobacterium bovis[J]. Proc Natl Acad Sci U S A. 2003,100(13):7877-82.
[4]李岩,鲍朗,张会东,等. 结核分枝杆菌ESAT-6与CFP-10蛋白间的相互作用[J].四川大学学报(医学版),2006,37(3):349-352.
[5]Parish T,Stoker N G. Use of a flexible cassette method to generate a double unmarked Mycobacterium tuberculosis tlyA plcABC mutant by gene replacements[J]. Microbiology, 2000,146(8):1969-1975.
[6]Kendall S L,Frita R. Construction of targeted mycobacterial mutants by homologous recombination[J]. Methods Mol Biol,2009,465:297-310.
[7]Julia C V K,Laura J M,Graham F H. Recombineering mycobacteria and their phages[J]. Nat Rev Microbiol,2008,6(11):851-857.
[8]Otmane L,Michel D. Genetic engineering of Mycobacterium tuberculosis:A review. Tuberculosis,2012, 92:365-376.
[9]Bryant M,Janet SC,Jason AM,et al. A Mycobacterium ESX-1 Secreted Virulence Factor with Unique Requirements for Export[J]. PLoS Pathog,2007,3(8):e105.
[10]Priscille B,Laleh M,Laurent M,et al. Dissection of ESAT-6 System 1 of Mycobacterium tuberculosis and Impact on Immunogenicity and Virulence[J] . INFECTION AND IMMUNITY, 2006,74(1):88-98.
[11]Janka T,Gisbert S,Ute M L,et al. A protein linkage map of the ESAT-6 secretion system 1(ESX-1) of Mycobacterium tuberculosis[J]. Microbiological Research,2009,164:253-259.
[12]Priscille B,Laleh M,Laurent M,et al. Dissection of ESAT-6 System 1 of Mycobacterium tuberculosis and Impact on Immunogenicity and Virulence[J]. Infection and Immunity,2006, 74(1):88-98.
[13]Saïd-Salim B,Mostowy S,Kristof A S,et al. Mutations in Mycobacterium tuberculosis Rv0444c,the gene encoding anti-SigK,explain high level expression ofMPB70 and MPB83 in Mycobacterium bovis[J]. Mol Microbiol,2006,62(5):1251-1263.
[14]Blair R G G,Li Y,Wang L R,et al. Lsr2 is a nucleoidassociated protein that targets AT-rich sequences and virulence genes in Mycobacterium tuberculosis[J]. Proc Natl Acad Sci USA,2010,107(11):5154-5159.
[15]Khalid H B,Asma A,Santosh K,et al. Role of PPE18 Protein in Intracellular Survival and Pathogenicity of Mycobacterium tuberculosis in Mice[J]. PLoS One,2012,7(12):e52601.
[16]Valentina D,Marcello V,Michela S,et al. The PPE Domain of PPE17 Is Responsible for Its Surface Localization and Can Be Used to Express Heterologous Proteins on the Mycobacterial Surface[J]. PLoS One,2013,8(3):e57517.
(责任编辑:朱迪国)
M. bovis Protein Interaction and Its Investigative Tools
Zhang Xiyue1,Shi Yang2,Fan Weixing1
(1.China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2.Huangdao Animal Husbandry and Veterinary Bureau,Qingdao,Shandong 266400)
Several tools were applied in the M.bovis protein interaction investigation. First,the yeast two-hybrid was applied to verify two protein interactions in-vivo. Second,mutant strains were constructed to elucidate the mechanism of protein function. The strategies include:(1) amplifi cation of knockout DNA;(2)preparation of Mycobacterium/pJV53 competent cells;(3)transportation of knockout DNA to competent cells;(4)screening and identification of positive colonies. The third,GST pull-down was applied to investigate known protein and target protein interaction. RD1 was investigated intensively in M. bovis protein interactions. The mechanisms were found such as that dimmer was formed by ESAT-6 and CFP10,interaction was existed in Rv3873,Rv3866, Rv3868 and CFP-10,and ESAT-6 achieved its function only after it was combined with CFP-10. These fi ndings suggest that elucidation of the interactions could facilitate the development of effi cient diagnostic reagents and vaccines for bovine tuberculosis.
M. bovis;protein;interaction
S852.23
B
1005-944X(2015)09-0064-05
科技基础性工作专项(2012FY111000);现代农业(奶牛)产业技术体系建设项目(CARS37)
范伟兴
