一株几丁质酶产生菌的筛选及产酶条件优化
2015-10-31郝之奎杨美玲张自英吴翰桂廖祥儒
郝之奎,杨美玲,张自英,吴翰桂,廖祥儒
(1.台州职业技术学院应用生物技术研究所,浙江台州318000;2.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122)
一株几丁质酶产生菌的筛选及产酶条件优化
郝之奎1,杨美玲1,张自英1,吴翰桂1,廖祥儒2
(1.台州职业技术学院应用生物技术研究所,浙江台州318000;2.江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122)
从浙江省台州市剑门港海区采集海底淤泥样本,以几丁质作为惟一营养因子,筛选出5株几丁质酶产生菌,对其中一株产酶活性较高的菌株从形态学、生理生化、脂肪酸组成及含量、G+C含量、醌型及分子生物学特征进行了鉴定(geneBank:HM136777)。结果表明,该菌属于慢生根瘤菌科(Bradyrhizobiaceae),芽生杆菌属(Blastobacter)中的一种,命名为Bradyrhizobiaceae blastobacter SYBC-H2。P-B实验结果显示,几丁质、葡萄糖及玉米浆粉是该菌株产几丁质酶的关键营养因子,利用中心组合设计实验(Contral Composite Design)对该菌株的产酶培养基进行了成分优化,结果表明,当培养基主要成分几丁质、葡萄糖和玉米浆粉质量浓度分别为2.7、0.85、2.64 g/L时,几丁质酶活性最高,达到5.70 U/mL。
SYBC-H2;几丁质酶;分离;鉴定;发酵优化
几丁质是自然界中储量巨大的可再生的资源之一,随着对几丁质研究的不断深入,其水解产物几丁寡糖、N-乙酰-D-氨基葡萄糖及其衍生物所具有优异特性不断被发现并逐步应用于食品、医药、环保、生防等领域[1-2]。几丁质在自然界中分布广泛,多作为生物结构内容物存在于线虫的微纤维鞘、昆虫的肠道内壁、真菌的细胞壁、软体动物的器官以及虾、蟹等节肢动物的外骨架中,其中,海洋生物中的几丁质储存量约为10亿t。几丁质分子式为(C8H13NO5)n,由基本单位N-乙酰氨基-2-脱氧-β-D-葡萄糖,通过β-1,4-糖苷键连接形成直链多糖,相对分子质量大都在100万以上,不溶于水,这种性质大大影响了几丁质的大规模应用。几丁质酶(E. C.3.2.1.14)是一类能催化水解至少含有一个N-乙酰葡萄糖胺基团糖苷键的酶,几丁质酶能水解几丁质生成几丁寡糖、几丁二糖或N-乙酰-D-氨基葡萄糖等。随着现代分子生物技术的发展,可从环境中克隆出几丁质酶基因构建产几丁质酶基因工程菌,但是,从自然界中分离野生的几丁质酶合成微生物仍然是不可替代的工作,深入研究野生几丁质酶产生菌的生物属性,探索其几丁质酶合成机理,更能够揭示其中的奥秘,为几丁质酶产业化服务并能够为工程菌的深入研究提供理论基础。
1 材料与方法
1.1材料
样本采自于浙江省台州市剑门港海区海底淤泥(28°1′57″N,121°36′38″E),共10份。
1.2仪器
高速粉碎机(YK 200B)、立式压力蒸汽灭菌器(LDZX-50FB)、超净工作台(ZHJH-C2112C)、可见分光光度计(UV-7504)、回转式恒温摇床(HZQX400)、恒温培养箱(HZQ-F 160A)、电热恒温水浴锅(HH-S)、紫外分光光度计(UV-3000,HITACHI)、光学显微镜(NIKON eclipse 50i)、冷冻离心机(Centrifuge 5430)、Quanta 200扫描电子显微镜、pH计(雷磁Phb-4)、微量移液器(Eppendorf)、Ep管、枪头等。
1.3化学试剂
常用试剂为化学纯,购自国药集团化学试剂有限公司
1.4培养基
1.4.1富集培养基(g/L)MgSO4·7H2O 0.5,KH2PO40.7,K2HPO40.3,FeSO4·7H2O 0.01,粉粒几丁质4。
1.4.2筛选培养基(g/L)MgSO4·7H2O 0.5,KH2PO40.7,K2HPO40.3,FeSO4·7H2O 0.01,琼脂20,粉粒几丁质4,胶体几丁质40;pH 7.4。
1.4.3保藏培养基(斜面)(g/L)MgSO4·7H2O 0.5,KH2PO40.7,K2HPO40.3,FeSO4·7H2O 0.01,琼脂20,葡萄糖2,蛋白胨2,牛肉膏2;pH 7.0。
1.4.4种子培养基(g/L)MgSO4·7H2O 0.5,KH2PO40.7,K2HPO40.3,FeSO4·7H2O 0.01,葡萄糖2,蛋白胨2,牛肉膏2;pH 7.0。
1.5胶体几丁质配制
将5 g细粉几丁质(100目过筛)放入200mL烧杯中,加丙酮20 mL,充分浸润2 min。缓缓加入HCl 100mL,充分搅拌至糊状,停放3 h。缓缓加入到盛有1 000 m L冷水的烧杯中,边加边剧烈搅拌,然后静置。待胶态几丁质析出后8 000 g离心,收集胶态几丁质,反复用去离子水冲洗胶体几丁质。把收集到得胶体几丁质用纤维细纱过滤到盛有1 000 mL去离子水中直至pH值达到5.4左右。检测胶体几丁质质量浓度(0.5 g/dL)灭菌备用。
1.6菌株的初筛
取采集到的海底淤泥样品1 g加入灭菌后的富集培养基中,30℃、200 r/min条件下培养168 h。取培养后的富集培养液样品,用无菌水稀释制成101~106倍,然后取104、105及106三个稀释倍数的样品各0.1mL,分别涂布到筛选培养基平板上,30℃培养120 h后观察,挑取能够产生透明圈的菌株,在新的筛选培养基平板上划线转接,直至获得单菌落纯培养产物,接着进一步复筛或4℃保存备用。
1.7菌株的复筛
把初筛得到的菌株接种至种子培养基中,600nm检测其生长情况,取生长一致的种子1 mL分别接种于产酶培养基中(50 mL/250 mL三角瓶)。30℃、200 r/min下培养96 h检测酶活。
1.8几丁质酶活性的测定方法
几丁质酶活测定以胶体几丁质为底物,参照文献[3]采用DNS比色法(3,5-二硝基水杨酸)测还原糖,将1.9 mL浓度为0.1 mol/L广泛缓冲液(pH 7.0)和0.5 mL、0.5 g/dL的胶体几丁质加100μL酶液组成的反应体系,37℃水浴30 min,沸水浴5 min中止反应,加入1.5mLDNS试剂,沸水浴5 min,冷却至室温,离心后取上清液,在波长535 nm下测吸光度,以灭活的等量酶液作空白对照。酶活定义为37℃下lmin转化底物胶体几丁质产生lμmoL还原糖所需的酶量规定为1个活力单位(U)。
酶活力(U/mL)=ΔOD×V总×n/Δt×V酶×10-6
其中,ΔOD为吸光度OD的变化值;V总为反应液总体积(mL);n为酶液稀释倍数;Δt为反应时间;V酶为酶液体积(mL)
1.9菌体生物量的测定
含有不溶几丁质的发酵培养基经过单层滤纸过滤,600 nm下测吸光值。
1.10菌株形态学及生理生化特征研究
将SYBC-H2接种于种子培养基平板上,30℃下倒置培养24 h,观察其菌落生长状态。将SYBCH2接种于筛选培养基平板上,30℃倒置培养96 h后观察透明圈形成状态。样品送江南大学教育部工业微生物重点实验室通过扫描电镜观察并拍照记录,革兰氏染色观察光镜下形态。
菌株形态及生理生化实验参照工业微生物实验技术手册[4]和伯杰氏细菌鉴定手册[5-6]。在恒温培养箱观察其5~45℃(间隔5℃)生长情况;在恒温培养箱30℃条件下,pH为3~9时的生长情况;研究其对单一碳源的利用情况,碳源质量浓度分别是0.2、0.5、0.7 g/L。
1.11脂肪酸含量测定
样品送上海市公共卫生临床中心检测。
1.12G+C含量测定
样品基因组提取及纯化参照文献[7],高相液相法[8]测定G+C含量。
1.13醌类测定
样品送广州微生物研究所检测。
1.14菌株的分子生物学研究
1.14.1DNA的提取种子于200 r/min、30℃条件下发酵10 h,8 000 g冷冻离心10 min,收集菌体。总DNA提取方法按照试剂盒方法进行(细菌基因组提取试剂盒为上海赛百盛基因技术有限公司产品)。
1.14.2利用通用引物扩增16S rRNA基因引物由上海赛百盛基因技术有限公司合成:5’-GAGTTTGATCCTGGCTCA-3’和5’-CGGTTACCTTGTTACGACTT-3’[9]。PCR反应条件为:94℃预变性4 min,进入循环,94℃变性50 s,55℃退火50 s,72℃延伸2 min,35个循环,72℃延伸10 min后保存于4℃。PCR产物用UltraClean PCR Clean-up kit纯化,及时送上海生物工程有限公司测序。
1.14.3序列及系统发育分析通过BLAST(http:// www.ncbi.nlm.nih.gov/BLAST)将菌株SYBC-H1的16S rRNA基因序列进行同源分析。多序列比对应用软件ClustalW(V 1.83)[10],用BioEdit(V 7.01)进行序列调整,最后用Mega软件(V 5.1)采用邻位相连法(neighbor-joining,NJ)构建(Kimura 2-parameter distance calculation)进化树[11],1 000 bootstrap检验[12]。
1.15几丁质酶产酶条件优化
采用P-B实验(Plackett-Burman Deisign,P-B)和中心组合试验(Central Composite Design,CCD)方法,使用软件Dsign-Expert进行实验设计与分析。利用单因素实验初步筛选出对产几丁质酶有潜在影响的10种培养基成分,在进行P-B实验设计时各成分的高水平和低水平相差5~10倍。根据P-B实验结果作为CCD实验的因素,进一步确定培养基各成分的最佳含量并验证。本实验发酵培养条件为:温度35℃,转速200 r/min,装液量50 mL/250 mL,培养时间96 h。数据取三个平行实验的平均值,显著性分析采用t-检验,P<0.05为显著,P<0.01为差异极显著。
2 结果与分析
2.1几丁质酶产生菌的筛选
2.1.1产生几丁质酶菌株的初筛粉粒几丁质是一种白色不透明物质,在筛选培养基中均匀分布,几丁质酶产生菌所分泌的几丁质酶在固体培养基中扩散,可以把不透明的粉粒几丁质水解成可溶的物质,形成清晰的透明圈。因此,利用透明圈法对几丁质酶产生菌的筛选是一种简便可行且高效可靠的方法。
样品经过富集培养基培养7 d后,能利用几丁质的微生物生长得到进一步的强化并逐渐形成优势菌株,再经过筛选培养基,几丁质酶产生菌逐渐被分离出来并在筛选培养基上形成菌落,挑取透明圈大且特征明显的菌落转移到新鲜筛选培养基平板上并编号。连续划线接种,直至获取纯培养物。编号为NO.1,NO.2,NO.3,NO.4以及NO.5样品的菌落周围出现较大透明圈,说明这些菌株产生的几丁质酶水解固体培养基内的粉粒几丁质能力较强,活力较高。把这些菌落转接到斜面保藏培养基上,30℃下培养24 h后作进一步的复筛、鉴定或于4℃保存备用。
为验证菌株几丁质酶产酶强度与透明圈的相关性,将初筛得到的NO.1,NO.2,NO.3,NO.4以及NO.5几丁质酶高产菌株重新接种于筛选培养基平板上,30℃下培养约7 d,结果显示,这些菌株都能在平板上生长,其菌落周围都产生了透明圈,且与原来结果基本一致,由此可以进一步确定这5株菌能够产生一定的胞外几丁质酶。
2.1.2高产几丁质酶菌株的复筛为进一步确证初筛的5株几丁质酶高产菌,采用摇瓶发酵方法进行复筛验证,产酶结果见表1。结果表明,这5株菌落形态及酶活大小上不尽不同,其中NO.2和NO.3菌株几丁质酶的酶活明显高于其他几株菌,对于本次筛选到的这几株几丁质酶产生菌,产生的透明圈大小基本与几丁质酶酶活一致。

表1 几丁质酶产生菌发酵产几丁质酶的比较Table 1 Com parison of chitinase production from the five bacterium
2.1.3高产几丁质酶菌株的复筛根据复筛结果得知,所筛选的5株菌都有不同的特点。NO.2相对其他几株酶活较高,菌落半透明,乳白色,粘稠,不易挑起。NO.4土黄色、粘稠,生长迅速,但酶活较低。NO.5菌落稀,生长慢。NO.1酶活较低,生长较慢,菌落不明显,较稀,像水一样不易挑起。综合考虑,作者确定以NO.3作为进一步的研究菌株,命名为Bradyrhizobiaceae blastobacter SYBC-H2。
2.2菌株Bradyrhizobiaceae blastobacter SYBCH 2的鉴定
2.2.1B.blastobacter SYBC-H2的形态观察及生理生化特点B.blastobacter SYBC-H2菌落呈圆形,表面光滑,半透明,边缘整齐,菌体粘稠不易挑起,在选择培养基上会产生透明圈(图1 A);菌体长度约0.5~2μm,直径约0.5~0.9μm;杆状(图1 B/C)。
生理生化实验结果表明,B.bacterium SYBCH2是革兰氏阴性菌;在10~42℃范围内都能生长,25~35℃适宜生长,最适温度是30℃;pH为6~8时都能生长,最佳生长pH是7.0;严格好氧性;V-P实验阴性;产碱;能使明胶液化。能利用的碳源有:核糖、蔗糖、N-乙酰氨基葡萄糖、壳二糖、半乳糖、葡萄糖、果糖、纤维素、菊粉、麦芽糖、阿拉伯糖、木糖、鼠李糖。能分泌的酶如下:过氧化氢酶、几丁质酶、半乳糖酶、β-葡萄糖苷酶、尿酶、果聚糖酶、蔗糖酶、麦芽糖酶、角蛋白酶、淀粉酶及微量脂肪酶等。不能产的酶有:葡萄糖转移酶、漆酶等。
2.2.2B.blastobacter SYBC-H2的脂肪酸组分与质量分数脂肪酸检测结果表明,B.blastobacter SYBC-H2含主要脂肪酸是C12∶03OH(5.87%),C14∶0(3.65%),C16∶12OH(2.15%),C16∶0(28.16%),C18∶1ω7c(20.48%)和Summed Feature 3(C16∶1w7c/15iso2OH,34.12%),其质量分数与组成比例在分子水平上属于Bosea属[13]。
2.2.3B.blastobacter SYBC-H2的(G+C)摩尔分数及醌型经检测,B.Blastobacter SYBC-H2菌的醌型为Q-8,与Bosea属醌型一致。DNA(G+C)摩尔分数为67.3624%,属于Bosea属DNA中(G+C)摩尔分数范围内(66%~75%)[13]。据有关文献报导,不同属微生物(G+C)摩尔分数相差10%以上[14],所以G+C摩尔分数相差10%以上的微生物可认为是非同属的,可以确认B.Blastobacter SYBC-H2属于Bosea属。
2.2.4菌株B.Blastobacter SYBC-H2的16S rRNA基因序列测定及聚类分析通过分子生物学手段获得B.Blastobacter SYBC-H2的16S rRNA基因,测序片段总长1 479 bp,把该序列提交到GenBank,所得注册号为HM136777。登录http://blast.ncbi. nlm.nih.gov/Blast.利用blast进行同源性分析,结果显示,与Bosea sp.BIWAKO-01(AB425327.1)最接近,Max Ident达到99%。根据blast结果,选择有代表性的菌株使用软件Mega3.1利用临接法(Neighbor-Joinning)构建系统发育树,见图2,同时用最大相似法进行验证。

图1 B.bacterium SYBC-H2菌体平板上产生的透明圈(A)及显微照片(B/C)Fig.1 Transparent circle generated on the plate(A)and m icrograph of B.bacterium SYBC-H2(B/C)

图2 基于16S rRNA基因序列构建的NJ系统发育树Fig.2 Neighbor-joining tree resulting from analysis of the 16Sr RNA gene sequences
从形态学、生理生化、脂肪酸组成及质量分数、(G+C)摩尔分数、醌型及分子生物学特征鉴定表明,该菌属于慢生根瘤菌科(Bradyrhizobiaceae),芽生杆菌属(Blastobacter)中的一种。对于该属能够产几丁质酶菌株还未曾见过文献报道。本菌株保藏于中国典型微生物保藏中心(保藏号:CCTCC NO:M2013582)。
2.3产酶条件的优化实验结果
以单因素实验数据为依据,对产几丁质酶有潜在影响的玉米浆粉、羽毛粉、大豆粕等10种营养成分进行进一步的关联性筛选,P-B实验各因素、水平及实验结果见表2-3。Plackett-Burman方差分析见表4。根据(ANOVA)分析知,95%的概率水平下模型是极显著的(P=0.015 7<0.05),而失拟合不显著(P=0.247 6>0.05)说明所建立的模型有效,实验结果可靠。Plackett-Burman设计及几丁质酶活回归分析见表5。据回归分析结果知,玉米浆粉、几丁质及葡萄糖的p值分别是0.001 8、0.024 0和0.014 9,说明这三类物质对几丁质酶的合成有显著影响,是几丁质酶合成的关键影响因子,且都表现为促进几丁质酶的合成,其中玉米浆粉影响极为显著,贡献率可达50.02%。

表2 Plackett-Burman设计各因素水平Table 2 Variables representingmedium components used in Plackett-Burman design

表3 Plackett-Burman及实验结果Table 3 Plackett-Burman experimental designmatrix w ith the observed response

表4 Plackett-Burm an设计方差分析Table 4 Results analysis of the P-B ANOVA

表5 Plackett-Burman设计及几丁质酶活回归分析Table 5 Statistical analysis ofmedium com ponents for chitinase production by Plackett-Burman design
几丁质酶产量的优化使用中心组合设计法(CCD),根据P-B实验结果及前期试验基础,选择影响几丁质酶合成的几丁质、葡萄糖和玉米浆粉三因素作为CCD研究对象并确定其水平和步长。中心组合设计水平、编码及实验结果见表6。软件拟合所得二次多项式方程式为:
Y=5.17+1.07X1-0.22X2-0.24X3-0.24X1X2-0.44X1X3-0.067X2X3-0.45X12-0.78X22-0.78X32+ 0.54X1X2X3
中心组合实验设计方差及回归分析见表7。可知,模型p=0.002 2<0.05,说明该模型在99.5%的概率水平下是显著的。而失拟合不显著(p=0.075 2>0.05),说明模型中无需再引入其他因素。二次方系数的值分别是-0.45,-0.78和-0.77,说明抛物线开口向下,可求出最大值。对回归方程进行求导,结合图2-4的三维响应面,求得该模型的最大值,X1=-0.32,X2=-0.35,X3=-0.24,对应的几丁质、葡萄糖和玉米浆粉的实际值分别为2.7、0.825、2.64 g/L,此模型的最大响应值为5.7 U/mL。

表6 中心组合设计水平、编码及实验结果Table 6 Experimental design and results of the central com posite design
图3反映了几丁质与葡萄糖两种营养之间的关系,P(0.197 4)>0.05,说明它们之间的交互作用不显著的,它们的值在高位、在低位甚至在理想的条件下,都不能达到最大的产酶水平。从图4知,几丁质和玉米浆粉两种营养成分之间的交互作用是显著的(P=0.037 0<0.05),当几丁质在1.00~3.00 g/L之间变化,所对应的玉米浆粉在1.50~4.50 g/L的范围内变化,在几丁质质量浓度为2.7 g/L(X1=-0.32)时,几丁质酶的产量达最大值,此时几丁质酶活性为5.70 U/mL。图5反映葡萄糖与玉米浆粉两种营养成分之间关系,它们之间交互作用对几丁质酶合成的影响不显著P(0.694 7),在实验设置的质量浓度范围内,产酶仅受到一定的影响。
图6表明,实际值与预测值都分布在直线附近,进一步说明该模型与事实是相符的。
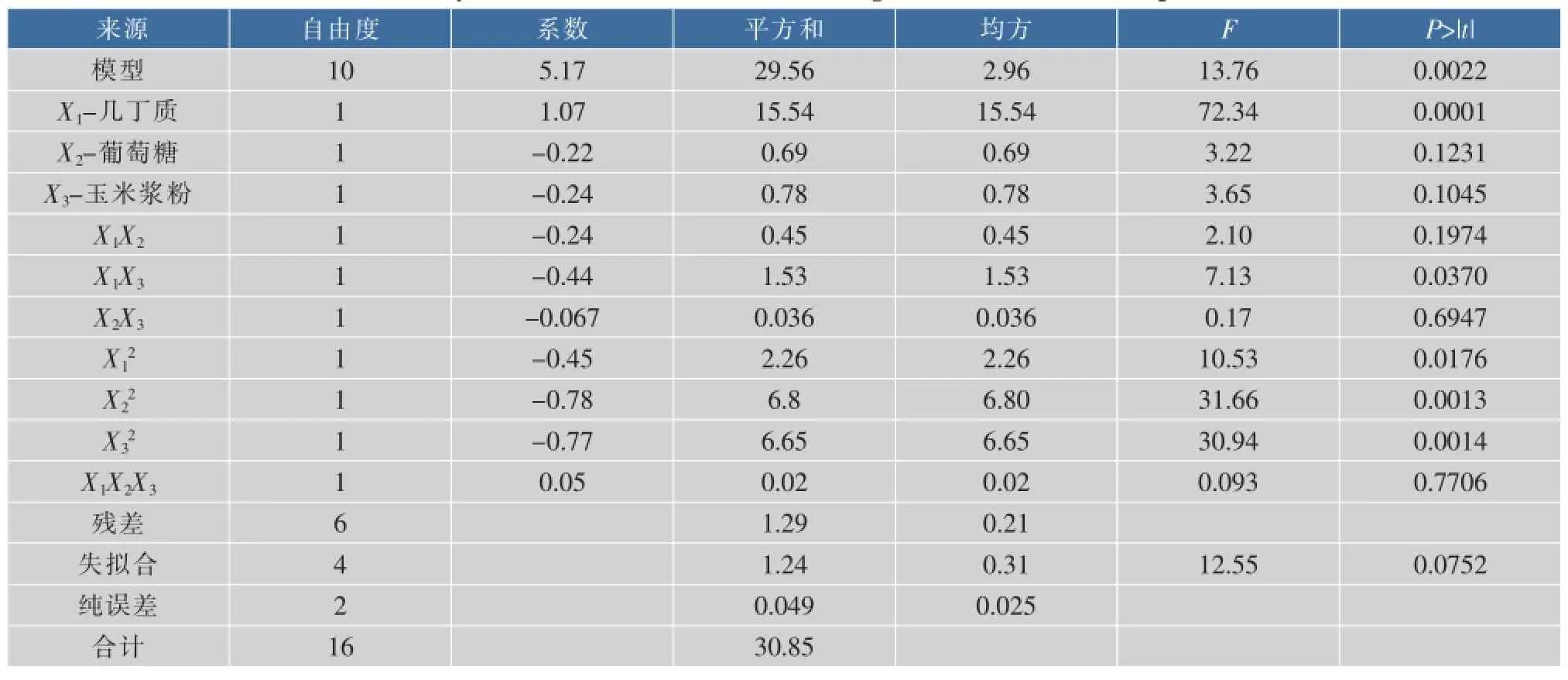
表7 中心组合实验设计方差及回归分析Table 7 Analysis of variance(ANOVA)and regression for chitinnase production
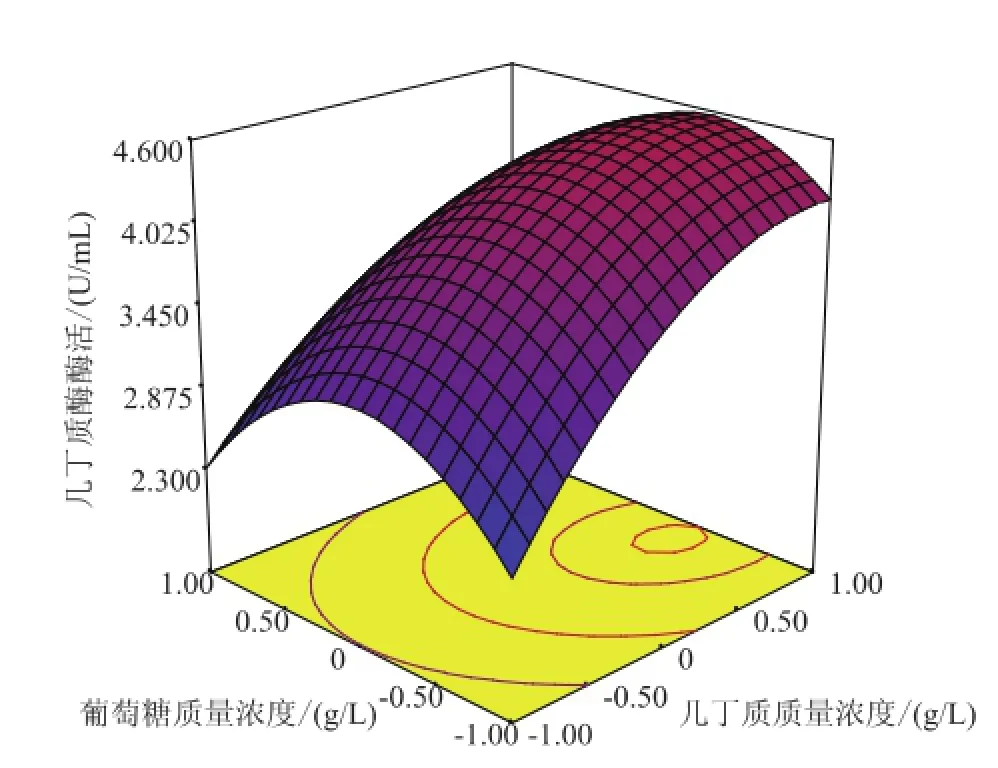
图3 几丁质及葡萄糖对几丁质酶活的影响三维图Fig.3 3D response surface curve for effects of chitin,glucose and their m utual interaction

图4 几丁质及玉米浆粉对几丁质酶活的影响三维图Fig.4 3D response sur face curve for effects of chitin,corn steep powder and their mutual interaction

图5 葡萄糖及玉米浆粉对几丁质酶活的影响三维图Fig.5 3D response surface curve for effects of glucose,corn steep powder and their mutual interaction

图6 实验值与预测值之间关系图Fig.6 Plot of predicted vs actual chitinase activity
3 结语
几丁质是自然界中储存量仅次于纤维素的可再生资源,海洋中储存着巨量的优质几丁质,同时,海洋也是几丁质酶产生菌的重要来源地,海洋生境的复杂性及特异性赋予了海洋微生物多样性极为丰富,代谢种类繁多,海洋微生物资源是现代生物技术研究和生物技术产业的源泉。传统方法鉴定菌株一般涉及菌株的形态及生理生化等方面,在长期的进化过程中,不同的微生物因自然选择的压力形成了不同的遗传特性,传统方法与现代分子生物学技术相结合,更能够准确判断微生物的遗传结构,反映其在历史进化中的位置,有利于对该微生物的深入研究。本研究筛选获得的菌株SYBC-H2属于慢生根瘤菌科(Bradyrhizobiaceae),芽生杆菌属(Blastobacter),该菌株较为常见,但是到目前为止还没发现该菌株产几丁质酶的报道。
生物技术产业不仅要求有优质的微生物资源,同时该类微生物的产能潜力也需得到应有的挖掘,作者对几丁质酶产生菌产酶培养基的优化即为这类工作。本实验的研究结果验证了微生物具有营养的多样性,营养因子对微生物代谢途径影响巨大,从而影响目标产物的产量。本研究也表明,菌株SYBC-H2产几丁质酶也需要诱导,几丁质在菌株SYBC-H2的生命活动中首先起到诱导作用,同时也作为碳源和氮源为微生物提供物质和能量。再者,几丁质也影响玉米浆粉的利用,与玉米浆粉有着明显的交互作用(P=0.037 0<0.05)。玉米浆粉是一种工业副产品,廉价但营养较为丰富,利用玉米浆粉作为发酵工业原料有着很大优势,本实验在这方面作了有益的探索。
[1]Ruggiero A,Tricarico L,Olabi A.Weld-bead profile and costs optimisation of the CO2dissimilar laser welding process of low carbon steeland austeritic steel AISI[J].Optics&Laser Technology,2010,43:82-90.
[2]Buchanan R E,Gibbons N E.Bergey’s Manual of Determ inative Bacteriology[M].Baltimore:The W illiams&W ilkins Company,1974.
[3]JoshiS,KozlowskiM,Richens S,etal.Chitinase and chitobiase production during fermentation of genetically improved Serratia liquefaciens[J].Enzym e M icrob Tech,1989,11(5):289-296.
[4]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
[5]RE布坎南,N E吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[6]KmpferP,Young CC,SridharK,etal.Transferof Flexibacter sancti,Flexibacter filiformis,Flexibacter japonensis and Cytophaga]arvensicola to thegenusChitinophagaand description of Chitinophaga skermanii sp.nov[J].Int J Syst EvolM icr,2006,56(9):2223-2228.
[7]M armur J.A procedure for the isolation of deoxyribonucleic acid from m icroorganisms[J].JM ol Biol,1961,3(2):208-218.
[8]MesbahM,Premachandran U,WhitmanWB.Precisemeasurementof theG+Ccontentofdeoxyribonucleicacidby high-performance liquid chromatography[J].Int JSyst EvolM icr,1989,39(2):159-167.
[9]Brosius J,DullT J,SleeterD D,etal.Geneorganization and primary structureofa ribosomalRNA operon from Escherichia coli1[J].Journal of M olecular Biology,1981,148(2):107-127.
[10]Weon H,Kim B,Yoo S,etal.Andreprevotia chitinilytica gen.nov.,sp.nov.,isolated from forest soil from Halla Mountain,Jeju Island,Korea[J].Int JSyst EvolM icr,2007,57(7):1572-1575.
[11]Saitou N,NeiM.The neighbor-joiningmethod:a new method for reconstructing phylogenetic trees[J].M ol Biol Evol,1987,4(4):406-425.
[12]K imura M.A simple model for estimating evolutionary rates of base substitutions through com parative studies of nucleotide sequences[J].JM ol Evol,1980,16:111-120.
[13]东英珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]Wayne L,Brenner D,Colwell R.International committee on systematic bacteriology.report of the ad hoc committee on reconciliation ofapproaches to bacterialsystematics[J].Int J Syst Bacteriol,1987,37:463-464.
Screening and Optimizing Conditions of Chitinase Production for Bradyrhizobiaceae blastobacter SYBC-H2
HAO Zhikui1,YANGMeiling1,ZHANG Ziying1,WU Hangui1,LIAO Xiangru2
(1.Institute of Applied Biotechnology,Taizhou Vocational&Technical College,Taizhou 318000,China;2.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Five strainsofbacteria producing chitinasewere separated from Jianmen harbour seafloor mud in Taizhou of Zhejiang Province,China.One of strainswith higher enzyme activity was further identified by morphology,physiology and biochem istry,composition and content of fatty acid,content of(G+C)mol%,types of quinones,and molecular biological characteristics.The results showed that this strain belonged to the genus Blastobacter,named as Bradyrhizobiaceae blastobacter SYBC-H2.Moreover,the results of the Plackett-Burman Deisign experiments showed that chitin,glucose and corn steep powder were the key nutritional factors to produce chitinase.Composite Design Contral was applied to optim ize the fermentative production of chitinase.As a result,the maximum chitinase activity wasup to 5.70U/m Lwhen the culturemedium was composed of 2.7 g/Lchitin,0.85 g/L glucose and 2.64 g/L corn steep powder.
SYBC-H2,chitinase,isolation,identification,optim ization of fermentation
TQ 920.1
A
1673—1689(2015)11—1203—09
2014-05-23
浙江省教育厅科研计划项目(Y20125673);台州市海洋生物资源开发与利用科技创新团队(MBR2012032);浙江省访问工程师校企合作项目(FW2012048);台州职业技术学院重点课题(2013ZD11)。
郝之奎(1972—),男,安徽阜阳人,工学博士,工程师,主要从事海洋微生物资源开发与利用方面的研究。
E-mail:haozhikui123@126.com
