杨氏柠檬酸杆菌磷脂酶A1基因在E.coli中的表达
2015-10-31姚其玉张梁石贵阳顾正华丁重阳
姚其玉,张梁*,石贵阳,顾正华,丁重阳
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡214122)
杨氏柠檬酸杆菌磷脂酶A1基因在E.coli中的表达
姚其玉1,2,张梁*1,2,石贵阳1,2,顾正华1,2,丁重阳1,2
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡214122)
为实现磷脂酶A1(PLA1)的异源表达,将杨氏柠檬酸杆菌(CICC No.21596)PLA1基因插入载体pET28a(+)中,构建重组表达质粒pET28a(+)-pla1,并将重组质粒转入宿主菌E.coli BL21(DE3)中,获得重组菌pET28a(+)-pla1/DE3。在IPTG诱导作用下经SDS-PAGE检测,发现在重组菌发酵破碎上清液中存在33 000大小的蛋白质,与预期蛋白质大小相符。在硼砂卵黄平板上对重组菌PLA1活性进行检测,结果显示重组菌具有明显的PLA1活性,表明PLA1基因在大肠杆菌中得到了表达。经发酵初步优化,获得摇瓶发酵的最佳诱导表达条件为:转接体积分数4%、诱导时机2 h、IPTG终浓度为0.4 mmol/L、37℃诱导培养8 h。经酸碱滴定法测得最高酶活为(5.6±0.2)U/mL。
杨氏柠檬酸杆菌;磷脂酶A1;表达;优化;大肠杆菌
磷脂酶A1(phospholipaseA1,PLA1,EC3.1.1.32),是一类水解磷脂生成溶血性磷脂和自由脂肪酸的酶[1]。PLA1在工业上被广泛应用于油脂脱胶以及磷脂改性[2-4],此外由其催化磷脂水解生成的溶血性磷脂在食品、医药、化工等领域也具有极为广泛的应用[5-6]。PLA1的来源渠道比较狭窄,主要来自蛇的毒液和动物胰脏,目前还远远不能满足工业化生产的需求。目前已有筛选得到产PLA1菌株的报导[7-8],但由于野生菌株产酶量往往较低且难以分离纯化,并且存在一定的食品安全隐患,因此应用野生菌株产酶的前景大大降低。而微生物来源的酶具有生产周期短、操作简单且可大规模生产等优点,因此具有很大的应用价值。目前已经有PLA1基因在不同宿主菌中异源表达的报导,例如液化沙雷氏菌PLA1基因在大肠杆菌中的表达[9-10]以及米曲霉PLA1基因在酿酒酵母中的表达[11],但酶活力普遍较低。作者以杨氏柠檬酸杆菌为出发菌株,利用基因工程技术,将PLA1基因转入大肠杆菌中,以期实现PLA1的异源表达。
1 材料与方法
1.1材料
1.1.1菌株和质粒菌种Citrobacter youngae:保藏于中国工业微生物菌种保藏中心(CICCNo.21596);E.coli JM109、BL21(DE3)菌株及载体pET28a(+):均为作者所在实验室保藏。
1.1.2试剂限制性内切酶Bam H I、Hind III、DNA marker、Proteinmarker:购自宝生物(大连)工程有限公司;T4 DNA连接酶、Taq DNA聚合酶、Ex Taq DNA聚合酶、dNTPs、pMD19-T(Simple)载体:购自TaKaRa公司;DNA片段纯化试剂盒、质粒小量提取试剂盒、胶回收试剂盒:均购自北京博大泰克生物技术公司;50%卵黄:购自上海江莱生物科技有限公司;其他试剂均为国产分析纯试剂。
下游引物P2
上述引物由上海生工技术有限公司合成。
1.1.4培养基LB培养基:l g/dL胰蛋白胨、0.5 g/dL酵母提取物、l g/dLNaCl,并调节pH至7.0。制备固体培养基则加入1.5 g/dL琼脂。
硼砂卵黄固体培养基:NaCl 0.66 g/dL、硼酸1.09 g/dL、硼砂0.19 g/dL、琼脂1.5 g/dL、卵黄2 g/dL,pH 7.2~7.4。
1.2方法
1.2.1杨氏柠檬酸杆菌pla1基因的获取Citrobacter youngae染色体DNA的提取操作按照文献[12]进行。根据NCBI上报导的Citrobacter youngae ATCC 29220 PLA1基因序列设计引物P1及P2,利用引物P1及P2以杨氏柠檬酸杆菌染色体为模板进行PCR扩增,反应条件为:95℃预变性5 min;94℃30 s、57℃1 min、72℃1 min,共30个循环;72℃10 min。将PCR产物进行凝胶电泳检测,并用纯化试剂盒纯化。
1.2.2重组质粒pMD19T-pla1的构建将纯化回收的目的基因片段与pMD19-T(Simple)连接,转化大肠杆菌JM109,并涂布氨苄LB抗性平板,挑取转化子转接至含氨苄的LB培养基中,提取转化子质粒并用Bam H I和Hind III酶切验证,将验证正确的质粒送到上海生工进行测序。将测序正确的重组质粒命名为pMD19T-pla1。
1.2.3表达重组质粒pET28a-pla1的构建提取重组菌pMD19T-pla1/JM109的质粒,用Bam H I和Hind III酶切,割胶回收目的片段,与同样经Bam H I和Hind III酶切线性化的pET28a(+)载体16℃过夜连接。将连接产物转化至大肠杆菌JM109中,并涂布卡那霉素抗性平板,37℃培养10 h,挑取转化子接种至卡那霉素LB培养基中,培养12 h,提质粒并用Bam H I和Hind III双酶切验证,将验证正确的转化子命名为pET28a(+)-pla1。
1.2.4重组PLA1工程菌的构建提取pET28a(+)-pla1/JM109的质粒,转化大肠杆菌DE3,并涂布卡那霉素抗性平板进行筛选。
1.2.5重组菌的诱导表达及SDS-PAGE分析接种重组菌pET28a(+)-pla1/DE3以及pET28a(+)/ DE3于LB卡那霉素培养基中,37℃培养过夜,第二天以4%的接种体积分数转接至50 mL LB卡那霉素培养基中,当OD600为0.6~0.8时,加入IPTG至终浓度为0.5mmol/L,37℃诱导6 h。诱导结束后离心收集菌体,用pH 7.0的磷酸盐缓冲液重悬菌体进行超声波破碎,将破碎液12 000 r/min离心20 min,取上清液用10 g/dL的分离胶进行SDS-PAGE电泳。1.2.6 PLA1酶活力的测定采用硼砂卵黄平板法[10]和酸碱滴定法[13-14]进行酶活力测定。
1.2.7重组菌生长曲线的测定接种大肠杆菌重组菌于20 mL含卡那霉素抗性的LB培养基中,37℃、200 r/min培养过夜,以4%的接种体积分数转接至50 mL含卡纳霉素抗性的LB培养基中,37℃、200 r/min培养,定时取样并测OD600值。
1.2.8诱导条件的优化研究诱导剂加入时机、诱导时间、诱导剂浓度以及诱导温度对产酶的影响。
2 结果与分析
2.1PLA1基因扩增及pMD19T-pla1的构建
杨氏柠檬酸杆菌PLA1基因的大小为870 bp,所设计引物P1及P2之间的片段大小为986 bp,将PCR扩增产物进行1 g/dL琼脂糖凝胶电泳后,可在1 000 bp附近看到清晰的目的条带,见图1,与预期扩增片段大小相符。与pMD19-T(Simple)连接后用Bam H I和Hind III双酶切验证,结果见图2。出现986 bp和2692 bp两条带,分别对应目的基因片段和载体大小。挑取验证正确的转化子送上海生工测序,测序结果显示,扩增序列与ATCC29220的PLA1基因序列比对相似度为90.11%。
2.2重组质粒pET28a(+)-pla1的构建
将所构建的pET28a(+)-pla1重组质粒用Bam H I和Hind III酶切后得到pET28a(+)和PLA1基因两个片段,大小分别为5 369 bp和986 bp,结果见图3,表明重组质粒构建成功。
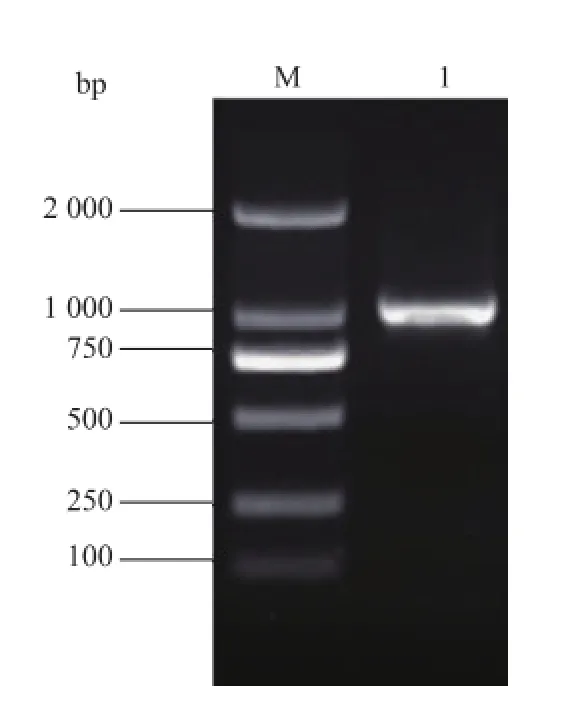
图1 目的基因PCR扩增Fig.1 Product of PCR am plification

图2 重组表达载体pMD19-pla1的酶切鉴定Fig.2 Identification of recombinant expression vector pMD 19-pla1 by enzym e digesion
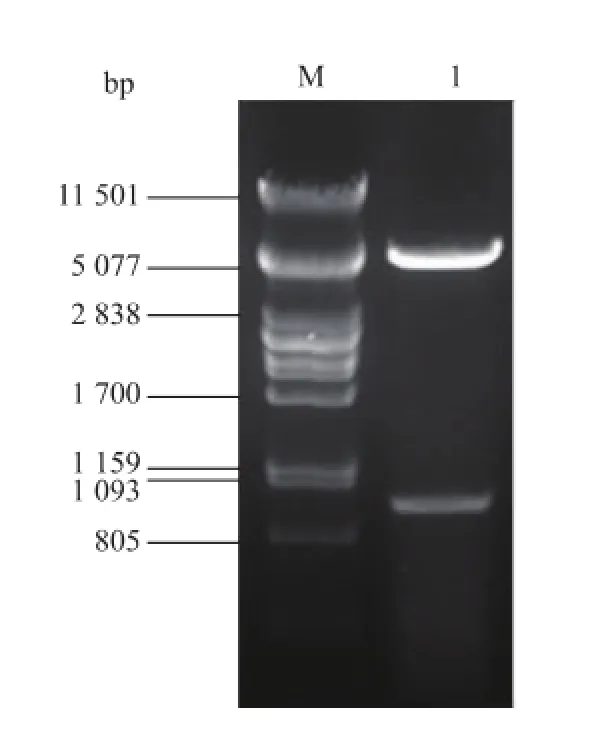
图3 重组表达载体pM D19-pla1的酶切鉴定Fig.3 Identification of recombinant expression vector pET28a-pla1 by enzyme digesion
2.3SDS-PAGE电泳结果
将构建好的重组质粒pET28a(+)-pla1转化大肠杆菌BL21(DE3)感受态细胞,挑取转化子酶切验证,获得重组菌pET28a(+)-pla1/DE3。接种重组菌pET28a(+)-pla1/DE3,经IPTG诱导,离心收集菌体并超声波破碎后进行SDS-PAGE电泳,结果见图4。在33 000处有明显蛋白质条带,初步说明PLA1基因在大肠杆菌中得到了表达。
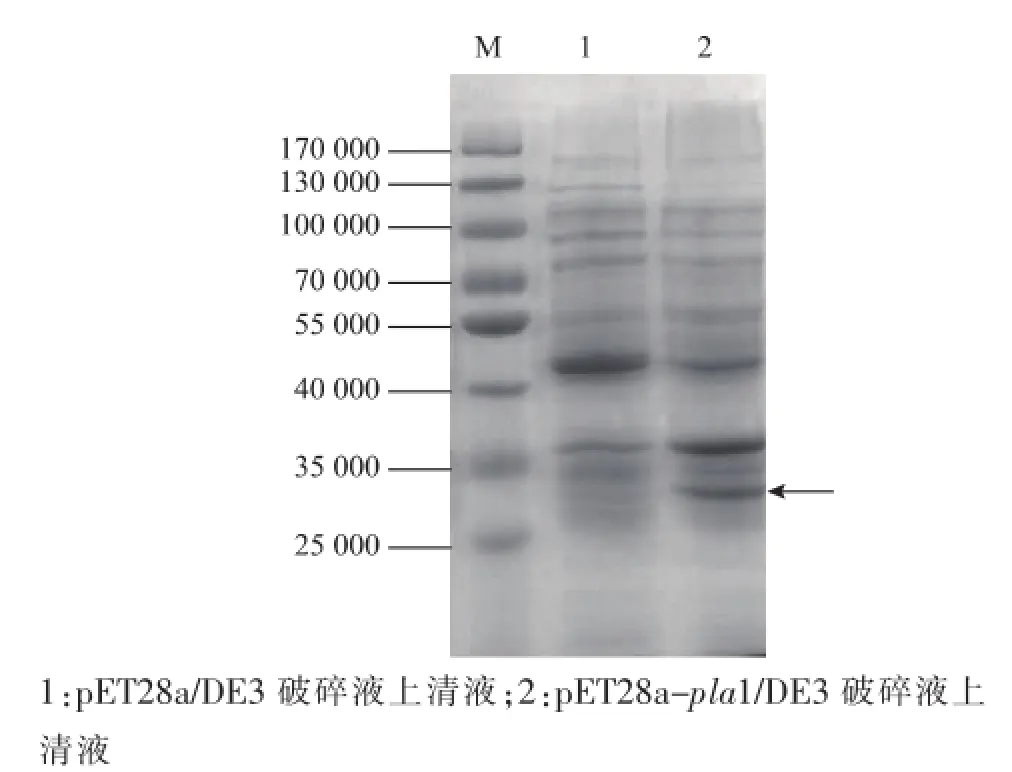
图4 重组菌表达产物的SDS-PAGE分析Fig.4 SDS-PAGE of expressedt protin
2.4重组菌酶活力检测
接种pET28a(+)-pla1/DE3和pET28a(+)/DE3,经IPTG诱导后离心收集菌体并超声波破碎。将获得的破碎液于12 000 r/min离心20min,各取100 μL点到放置有牛津杯的硼砂卵黄平板上,37℃放置8 h观察酶活力情况,其结果见图5。从图5可以看出,重组菌pET28a(+)-pla1/DE3破碎液在卵黄平板上可产生明显的白色晕圈,而其对照pET28a(+)/DE3并没有产生晕圈,说明PLA1在重组菌中得到了表达。

图5 重组菌磷脂酶A1活力检测Fig.5 Detetion of the recombinan t E.coli PLA1 activity
2.5重组菌生长曲线的测定
通过测定重组菌的生长曲线可清楚地分析重组菌的生长状态,从而可以更好地确定诱导剂加入的时机,生长曲线见图6。从图6可以看出,重组菌接种后的0~1 h为延滞期,1~6 h为对数生长期,之后进入稳定期。
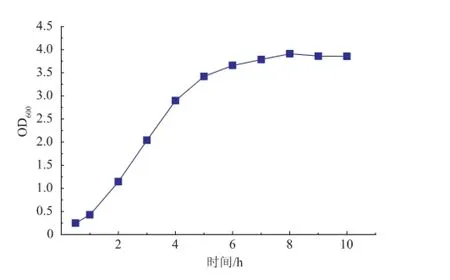
图6 重组菌pET28a-pla1/DE3生长曲线Fig.6 Grow th curve of recombinant strains pET28apla1/DE3
2.6重组菌诱导条件的优化
2.6.1诱导时机对酶活力的影响分别选取重组菌生长对数期不同时间段添加诱导剂进行诱导,研究其对产酶活力的影响,结果见图7。在菌体转接2 h后,诱导所产酶活力最高。诱导剂加入的时间过早,会影响菌体的生长和产酶能力;诱导剂加入时间过晚,细胞活力会降低,从而影响重组菌的表达。

图7 诱导时机对产酶的影响Fig.7 Effect of induction initial time on PLA1 production
2.6.2诱导温度对酶活力的影响大肠杆菌的最适生长温度为37℃,最佳诱导温度随产物不同而异。一般来说,在25~37℃诱导表达,外源蛋白易于以活性状态存在;37℃以上诱导,则易形成包涵体[15-16]。因此作者选取25、30、37℃三个温度研究温度对产酶水平的影响,结果见图8。随着诱导温度的升高,酶活力也随之升高,在37℃时酶活达到最高,因此选取最佳诱导温度为37℃。
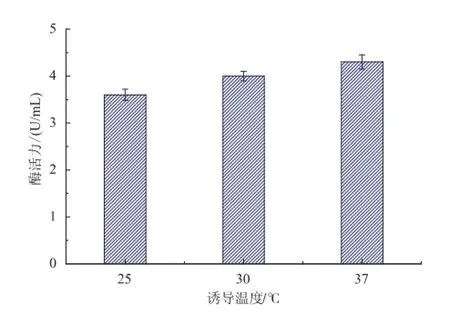
图8 诱导温度对产酶的影响Fig.8 Effectof induction tem peratureon PLA1 production
2.6.3诱导剂浓度对酶活力的影响IPTG是一种作用极强的诱导剂,但高浓度IPTG对重组菌的生长具有抑制作用,再加上IPTG本身价格昂贵,因此选择一个合适的IPTG的浓度是非常必要的。为研究IPTG浓度对产酶的影响,作者选取0.1~0.6 mmol/L之间6个不同IPTG浓度对重组菌进行诱导表达。由图9可以看出,IPTG浓度对产酶水平影响不是很大,在IPTG浓度为0.4 mmol/L时酶活力最大,因此确定该重组菌的最适IPTG浓度为0.4mmol/L。
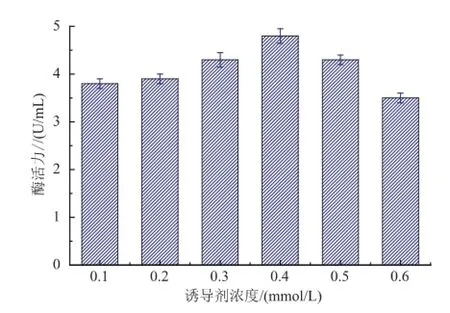
图9 IPTG浓度对产酶的影响Fig.9 Effect of IPTG concentration on PLA1 p roduction
2.6.4诱导时间对酶活力的影响分别选择诱导时间2、4、6、8、10、12 h,研究其对菌体产酶活力的影响,结果见图10。随着时间的延长,酶活力不断上升,在8 h时酶活力达到最高值,之后酶活力稍有下降。
综上所述,在IPTG的添加终浓度为0.4mmol/L,诱导温度37℃、诱导时机为接种后2 h、诱导时间8 h时,大肠杆菌重组菌产PLA1水平达到最高,通过酸碱滴定法测得最高酶活力为(5.6±0.2)U/mL。

图10 诱导时间对产酶的影响Fig.10 Effect of induction time on PLA1 production
3 结语
近年来,随着PLA1的应用范围不断扩大,国内外关对于PLA1的研究也在不断增加,但关于PLA1异源表达的报导仍然很少。目前PLA1异源表达的宿主菌主要是大肠杆菌,1988年Givskov[9]等从Serratia liquefaciens中获得了PLA1基因,并在大肠杆菌中得到了表达,最高酶活力达到1 U/mL;1999年Jae Kwag[10]等从Serratia sp.MK1中获得了PLA1基因,并在大肠杆菌中表达;2007年国内付建红[17]等从新疆天山一号冰川冻土中筛选到一种产低温碱性磷脂酶A1的耐冷居全沙雷氏菌Serratia sp. xjF1,并将提取该菌的磷脂酶A1基因在大肠杆菌中表达,最高酶活力可达4.3 U/mL。以上在大肠杆菌表达的PLA1基因的来源菌均是液化沙雷氏菌属,目前其它菌来源的PLA1基因在大肠杆菌的表达研究还很少,本研究首次实现了杨氏柠檬酸杆菌来源的PLA1基因在大肠杆菌的表达,对于研究PLA1生产菌株具有一定的指导意义。
作者成功克隆了杨氏柠檬酸杆菌PLA1基因,通过载体pET28a(+),成功构建了表达PLA1的工程化大肠杆菌。通过对诱导时机、诱导剂浓度、诱导时间以及诱导温度对PLA1酶活力影响的研究,得到了该工程菌的最佳诱导发酵条件。在最佳诱导条件下培养该工程菌,最高酶活力可达到(5.6±0.2)U/mL。该重组菌产生的PLA1重组蛋白质的C端具有HIS融合标签,为其下游的分离纯化提供了方便。后续工作将利用C端的HIS融合标签对表达的蛋白质进行分离纯化,以研究该PLA1的酶学性质,并将该PLA1基因在枯草芽孢杆菌、毕赤酵母以及乳酸克鲁维酵母等更加优越安全的表达系统中进行表达,以期获得产量更高且更加安全的PLA1活性蛋白质。
[1]Gregory S.Terry K.Phospholipase A1[J].Int JM ol Sci,2011,12(1):588-612.
[2]WANG Yong,ZHAO Mouming,SONG Keke,etal.Partial hydrolysis of soybean oil by phospholipase A1(Lecitase Ultra)[J]. Food Chem istry,2010,121(4):1066-1072.
[3]De Maria L,Vind J,Oxenboll K M,et al.Phospholipases and their industrial applications[J].Applied M icrobiology and Biotechnology,2007,74(2):290-300.
[4]黄丹,马美湖,蔡朝霞,等.磷脂酶A1改性制备高乳化性蛋黄粉的工艺条件优化[J].食品科学,2010,31(6):20-25. HUANG Dan,MA Meihu,CAIZhaoxia,et al.Phospholipase A1 modification for preparation of egg yolk powder w ith high emulsifying properties[J].Food Science,2010,31(6):20-25.(in Chinese)
[5]李永端,谷克仁.溶血磷脂的性能与应用[J].油脂工程,2007(4):55-57. LIYongrui,GU Keren.Study on properties and application of lysophospholipids[J].Cereals and Oils Processing,2007(4):55-57.(in Chinese)
[6]管伟举,谷克仁.溶血磷脂在面包中应用研究[J].粮食与油脂,2007(4):26-28. GUANWeiju,GU Keren.Study on application of lysophospholipids in bread[J].Cereal and Oils,2007(4):55-57.(in Chinese)
[7]付建红,唐辉桂,姚斌,等.一株产低温碱性磷脂酶A 1耐冷细菌的筛选及发酵条件的初步研究[J].工业微生物,2008,38(5):12-16. FU Jianhong,TANG Huijia,YAO Bin,etal.Screening ofpsychrotrophic bacteria producing cold-adapted alkaline phospholipase A1 and prelim inary studieson its fermentation conditions[J].Industrial M icrobiology,2008,38(5):12-16.(in Chinese)
[8]Nishihara M,Kamata M,Koyama T,etal.New phospholipase A1-producing bacteria from amarine fish[J].M arine Biotechnol,2008,10(4):382-387.
[9]Givskov M,Olsen L,Molin S.Cloning and expression in Escherichia coli of the gene for extracellular phospholipase A l from Serratia liquefaciens[J].Journal of Bacteriology,1988,170(12):5855-5862.
[10]Song J K,Kim M K,Rhee J S.Cloning and expression of the gene encoding phospholipase A1 from Serratia sp.MK1 in Escherichia coli[J].Journal of Biotechnology,1999,72(1):103-114.
[11]Watanabe I,KoishiR,Yao Y,etal.Molecular cloning and expression of the gene encoding a phospholipase A1 from Aspergillus oryzae[J].Biosci Biotechnol Biochem,1999,63(5):820-826.
[12]奥斯伯FM,金斯顿R E,塞德曼JG,等.精编分子生物学实验指南(5版)[M].北京:科学出版社,2008.
[13]Shiba Y,Ono C,FukuiF,etal.High-levelsecretory production of phospholipase A1 by Saccharomyces cerevisiae and Aspergillus oryzae[J].Biosci Biotechnol Biochem,2001,65(1):94-101.
[14]李脉,杨继国,杨博.磷脂酶A1酶活测定方法的研究[J].现代食品科技,2007,23(8):80-82. LIMai,YANG Jiguo,YANG Bo.Study on measurement of the enzymatic activity of phospholipase A1[J].M odern Food Science and Technology,2007,23(8):80-82.(in Chinese)
[15]解庭波.大肠杆菌表达系统的研究进展[J].长江大学学报,2008,5(3):77-82. XIETingbo.The studieson E.coli asan expression system[J].Journal of Yangtze University,2008,5(3):77-82.(in Chinese)
[16]LIANG Rubin,LIU Xipeng,LIU Jianhua,et al.A T7-expression system under temperature control could create temperaturesensitive phenotype of targetgene in Escherichia coli[J].JM icrobiol M ethods,2007,68(3):497-506.
[17]FU Jianhong,HUANGHuoqing,MENG Kun,etal.A novel cold-adapted phospholipase A1 from Serratia sp.xjF1:gene cloning,expressionand characterization[J].Enzyme and M icrobial Technology,2008,42(2):187-194.
Molecular Clone and Expression of Phospholipase A1 Gene from Citrobacter youngae in Escherichia coli
YAOQiyu1,2,ZHANG Liang*1,2,SHIGuiyang1,2,GU Zhenghua1,2,DINGChongyang1,2
(1.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,W uxi 214122,China;2.Key Laboratory of Industrial Biotechnology of M inistry of Education,Jiangnan University,Wuxi 214122,China)
For theheterologousexpression of phospholipase A1,the gene of phospholipase A1 from Citrobacter youngae(CICC No.21596)was cloned into the expression vector pET28a(+)to construct the recombinant plasm id pET28a(+)-pla1.Then the recombinant plasm id was transformed into E.coli BL21(DE3)to achieve the recombinantstrain pET28a(+)-pla1/DE3.A fter subsequent induction by isopropylβ-D-1-thiogalactopyranoside(IPTG),an approximately 33 000 proteinwas detected in the cell lysate supernatantby SDS-PAGE.The PLA1 activitywasdetected in an egg yolk agar plate,indicating that the PLA1 gene was expressed in E.coli.The best induction conditions for PLA1 expression were achieved by the optim ization of fermentation condition and itwas showed as follows,4%of inoculum amount,2 h of initial culture,8 h of induced culture in the presence of 0.4mmol/L of IPTG,and grow th at37℃.Under theoptim ized conditions,themaximum PLA1 activity in the supernatantwas(5.6±0.2)U/m L.
Citrobacter youngae,phospholipase A1,expression,optim ization,E.coli
Q 786
A
1673—1689(2015)11—1172—06
2014-03-04
国家863计划项目(2011AA100905);江苏省“六大人才高峰”高层次人才项目(2012-NY-002);江南大学食品科学与技术国家重点实验室自由探索项目(SKLF-ZZA-201201)。
张梁(1978—),男,江苏无锡人,工学博士,教授,博士研究生导师,主要从事工业微生物、酶工程技术方面的研究。
E-mail:zhangl@jiangnan.edu.cn
