浓香型白酒发酵黄水中微生物群落结构解析
2015-10-31李可范志刚王俊芳林凯向文良
李可,范志刚,王俊芳,林凯,向文良*
(1.成都宏亿实业集团有限公司,四川成都610000;2.四川省农业科学院农产品加工研究所,四川成都61000;3.西华大学生物工程学院,四川成都610039)
浓香型白酒发酵黄水中微生物群落结构解析
李可1,2,范志刚1,王俊芳1,林凯3,向文良*3
(1.成都宏亿实业集团有限公司,四川成都610000;2.四川省农业科学院农产品加工研究所,四川成都61000;3.西华大学生物工程学院,四川成都610039)
运用传统培养和构建SSU rRNA文库的方法探索发酵黄水中微生物多样性。所获得的151个细菌克隆子分别归为变形菌门、柔膜菌门、拟杆菌门、厚壁菌门、黏胶球形菌门及放线菌门等6个门以及一个未分类类群,其中厚壁菌门(47.6%)、变形菌门(29.1%)为主要类群。在种属分类水平上,梭菌属(25.8%)、乳酸菌属(15.9%)和沙雷氏菌属(14.6%)为优势菌群。随机选择的37株古菌克隆子均属于广古菌门、甲烷微菌纲,其中以A13为代表甲烷八叠球菌属古细菌(59.5%)及以A8为代表的产甲烷囊菌属(35.1%)占古菌数量的绝大多数。细菌和古菌克隆文库的多样性指数(香浓指数H)分别为2.75和0.83、优势度指数12.88和2.14、盖度指数99.9%和100%。物种鉴定结果显示,黄水中多数微生物为功能性微生物,在营养物质代谢、酸、醇、酯、醛、酮等功能成分合成方面发挥着重要作用,是浓香型白酒香味物质的来源与基础之一。
浓香型白酒;黄水;微生物多样性;SSU rRNA,克隆文库
浓香型白酒主要产于我国西南地区的四川省,采用泥窖固态发酵,以高粱为主要原料,配以大米、豌豆、小麦等多种谷物,经加曲、打量水后入池发酵。在发酵过程中,微生物分解淀粉、蛋白质等大分子物质生成还原糖、氨基酸等营养成分,香味前提物、酒精、二氧化碳、单宁及多种呈香物质[1]。这些物质随着水分向窖池底部的渗透,而形成棕黄色或者褐色、具有特殊臭味、粘稠度较大的液体,这部分液体就是黄水[2]。黄水富集了各层糟醅和窖泥中的营养物质,为窖池中的益生菌群提供理想的生长环境,大量来自于糟醅及窖泥的经长期驯化,适于高酸、高酒精等极端条件的益生菌在这里发生着一系列复杂的生理、生化反应,产生种类繁多的醇、酯、酸、酮、醛等呈味物质,对白酒生产的产量和质量具有重要影响。
黄水是一个极其复杂的微生态体系,是浓香型白酒发酵窖池中重要组成部分,不仅介导窖泥和糟醅间物质和能量的流动,其本身在白酒发酵过程中也起到举足轻重的作用。彭太升[3]、罗惠波[4]等通过大量采集两个代表地区样品——安徽口子窖和泸州老窖,不同窖龄、发酵阶段、生产工艺和季节的窖池中正常发酵黄水进行常规组分分析,并总结出发酵黄水的含量范围。张晓磊等[5-6]首次采用GC/MS技术对我国北方的辽宁地区的三沟酒业及中部地区安徽双轮酒业发酵黄水中挥发性成分进行分析。结果显示,黄水中挥发性成分种类和构成与白酒风味的形成具有紧密联系,对白酒风味的形成具有突出贡献。随着对黄水认识的不断加深,对黄水的开发应用也逐渐成为白酒工作者研究的对象。目前除了将黄水用于拌糟回窖发酵、培养人工窖泥或养窖、食醋酿造、食品防腐、调酒等方面,还开展了黄水综合利用技术的研究,并取得了一系列成果[4、7-8]。但以上多局限于对黄水中理化成分的研究和应用,对其中经长期驯化的有益微生物功能的认识仅停留在传统形态学特征上的分类研究,黄水的资源化利用仍有较大的研究空间。因此,作者在已有的糟醅和窖泥微生物菌群结构研究的基础上,运用现代分子生物学方法探索发酵黄水中微生物菌群构成,完善了对窖池微生态体系的了解及浓香型白酒发酵机理,揭示了黄水在浓香型白酒发酵过程中的重要作用,为挖掘黄水中益生菌资源及其应用潜力提供理论基础。
1 材料与方法
1.1实验材料
黄水样品:采自于四川某浓香型白酒企业20年窖龄的窖池,样品采集后立即进行基因组DNA提取。
1.2实验方法
1.2.1基因组DNA提取、SSU rRNA扩增黄水基因组DNA提取方法参照土壤DNA Kit(Omega Inc. USA)说明书,重复提取3次混合后作为PCR扩增模板.SSU rRNA基因片段扩增反应体系及程序参照文献[9],反应结束后于-20℃保存。
1.2.2连接与转化PCR产物按照pGEM-T克隆试剂盒使用说明将目的片段连接至载体并转化至JM109感受态细胞,经蓝白斑筛选挑取白色阳性克隆子。
1.2.3SSU rRNA序列分析及系统发育树构建将所测序列中包含的测序引物T7、SP6序列去除,运用BioEdit序列分析软件对所测得的SSU rRNA序列进行可信度分析,除去出现信号衰减、重峰、信号较弱的序列。所测得的细菌和古菌序列用CLASSIFIER(RDPII,http://rdp.cme.msu.edu./classifier/ classifier.jsp)进行分类、鉴定,并将测序结果与GenBank数据库(http://blast.ncbi.nlm.nih.gov/)进行分类、鉴定,从数据库中寻找与所提交序列相似度最高的已知菌种类。从比对结果相同的序列中挑选代表序列,与数据库中已知菌种序列经利用MEGA5.0软件经多重比对后,采用Neighbor-Joining法进行1 000次步长计算构建系统发育树。
1.2.4基因文库评估将所获得的序列用BioEdit软件进行相似度矩阵分析,相似度大于97%的序列被归为1个OTU。根据OTU个数及每个OTU的丰富度利用rerafaction软件绘制稀释度曲线,利用Estimate软件计算克隆文库的香浓多样性指数、SChao1、SACE丰富度指数、辛普森优势度指数[10-11],盖度指数为
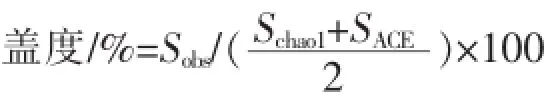
2 结果与分析
2.1黄水中细菌群落序列分析
将测序结果提交至RDP进行分类所得151个克隆子分别归为变形菌门、柔膜菌门、拟杆菌门、厚壁菌门、黏胶球形菌门及放线菌门等6个门以及一个未分类类群,在属分类水平上分别被归为Ochrobactrum、Burkholderia、Serratia、Enterobacteriaceae,Acinetobacter、Weissella、Rummeliibacillus,Alkalibaculum、Syntrophomonas、Pelotomaculum、Caloramator、Clostridium sensu stricto、Clostridium IV、Papillibacter、Saccharofermentans、Bacteroides、Victivallis、Proteiniphilum、Acholeplasma等属及1个属、2个门分类不明确类群。将代表序列提交至NCBI获得登陆号为:KJ734840-KJ734866。
Eichler[12]等认为,当16S rRNA序列相似度大于98%即可鉴定为同一个种。将所测的序列提交至GenBank,经Blast比对后发现,24个代表克隆子中,以D34(95%)、D15(95%)、D41(97%)、D2(90%)、D23(92%)、D9(89%)、D8(94%)、D10(94%)、D32(90%)等9个代表克隆子16S rRNA序列相似度与数据库中已知菌株16S r RNA序列相似度较低,它们的分类学地位有待进一步研究。克隆子D47被鉴定为A.bacchi(99%)、D26被鉴定为Cal.viterbiensis(99%)、D54被鉴定为C.tyrobutyricum(99%)、D51被鉴定为P.isophthalicicum(99%)、D72被鉴定为S.wolfei(99%)、D39被鉴定为Pap. cinnamivorans(98%)、D16被鉴定为Sac.acetigenes(99%)、D69被鉴定为W.paramesenteroides(99%)、D79被鉴定为R.pycnus(99%)、D11被鉴定为Och.cytisi(99%)、D36被鉴定为B.phytofirmans(99%)、D21被鉴定为Aci.guillouiae(99%)、D68被鉴定为E.hormaechei(99%)、D40被鉴定为Ser. nematodiphila(99%)、D55被鉴定为C.leptum(99%),见表1。

表1 黄水样品中细菌序列比对分类鉴定结果Table 1 Identification and classification of bacteria in yellow water
2.2发酵黄水中古细菌群落序列的相似性分析
测序结果显示,随机测序的37个古菌克隆子均属于广古菌门门、甲烷微菌纲,其中以A13为代表的22个古菌克隆子被归为甲烷八叠球菌属;以A8为代表的13个克隆子和以A19为代表的2个克隆子分别被归为产甲烷囊菌属和小甲烷粒菌属。序列提交至NCBI获得序列号为:KJ 734865-KJ 734867。
将所测的37个古菌克隆子序列提交至GenBank经Blast比对后发现,所测得序列代表克隆子16S r RNA序列与数据库中已知序列相似度均高于98%,因此,黄水中的古菌分别被鉴定为M.bourgensis、M.thermophila(98%)、M.bavaricum(99%),见表2。

表2 黄水样品中古菌序列比对分类鉴定结果Table 2 Identification and classification of archaea in yellow water
2.3窖池黄水中细菌群落系统发育及结构分析
根据黄水中细菌群落16S rRNA分析结果可知,在黄水中还存在着许多目前分类地位尚不明确,很难确定其种类的细菌类群。为了进一步探明黄水中细菌的分类学地位及其之间的亲缘关系,选取代表序列与GenBank中已知菌株序列利用MEGA5.0构建系统发育树,结果见图1。
从系统发育树看,大多数代表克隆子与已知菌种具有较高的同源性(≥98),一些同源性较低的克隆子D34与C.ultunense聚为一支、D15与C.oroticum聚为一支、D8与O.pofusa聚为一支、D2与A.morum聚为一支,D23与L.acetotoleans聚为一支、D9与V.vadensis聚为一支、D10与P.acetatigenes聚为一支、D32与B.propioicifaciens聚为一支,说明它们在系统进化上的具有较近亲缘关系,也有与已知菌株同种的可能,但具体的分类及生态学功能有待进一步研究。
2.4黄水环境古细菌群落系统发育分析
从图2可以看出,所获得的古菌克隆子主要分布在广古菌门、甲烷微菌纲,但种类较少,分为产甲烷八叠球菌和产甲烷杆菌目2个分支。其中以A19及A8为代表的克隆子分别于已知菌株Methanocorpusculum bavaricum和Methanoculleus bourgensis聚为一支,具有较高的同源性,以A13为代表的克隆子与其相似菌株Methanosarcina thermophila在系统发育上具有较大的进化距离。
2.5基因文库评估
微生物SSU r RNA克隆文库的测序结果表明,真菌克隆子序列差异较小,物种结构较简单。所分析的37个菌株中,同源性小于97%的菌株被归为1个OTU。因此,所有古菌克隆子被分为3个OTU。细菌菌株序列差异性大,物种多样性丰富,所获得的151个纯菌落被分为23个OTU。根据OTU个数及其丰富度,其香浓多样性指数、SChao1、SACE丰富度指数、辛普森优势度指数、覆盖度指数计算结果见表3,稀释度曲线见图3。
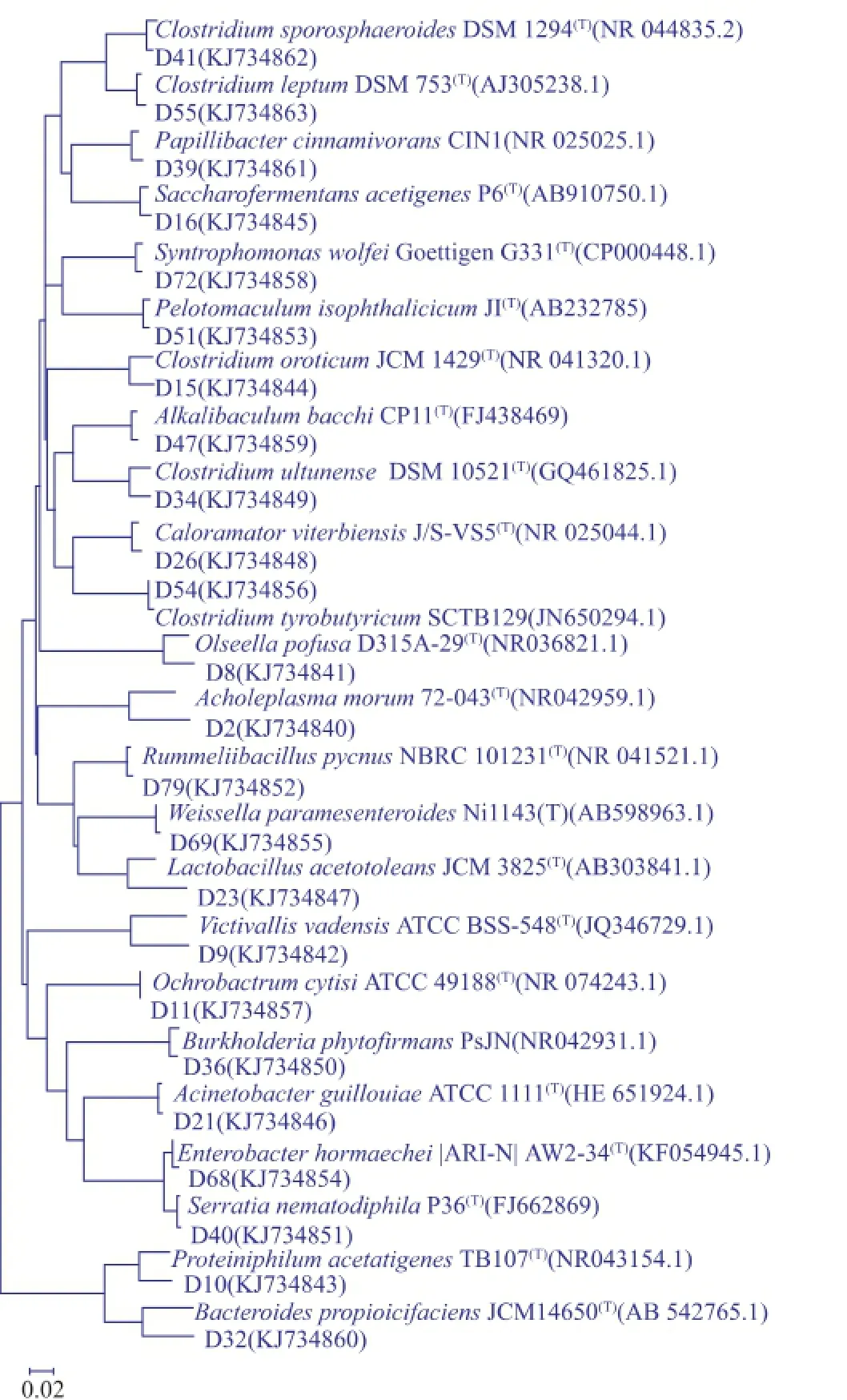
图1 基于16S rRNA构建的黄水中细菌系统发育树图Fig.1 Phylogenetic tree of bacteria in the yellow water based on 16S rRNA sequence

图2 基于16S rRNA构建的黄水中古细菌系统发育树图Fig.2 Phylogenetic tree of A rchaea in the yellow waterbased on 16S rRNA sequence
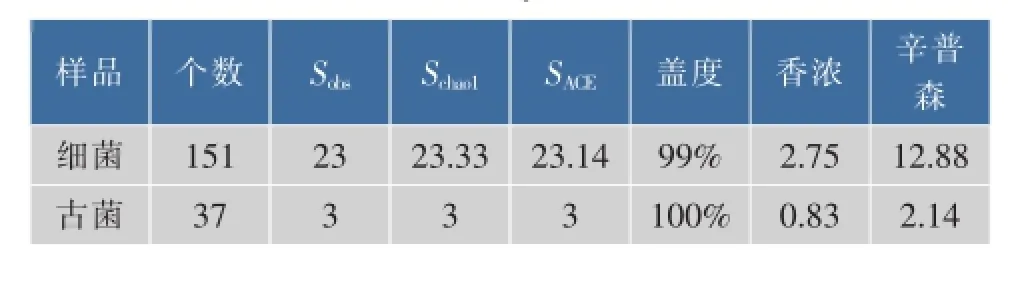
表3 黄水中古菌和细菌微生物多样性指数分析Table 3 M icrobial richness and diversity estimations of OTUs derived from yellow w ater
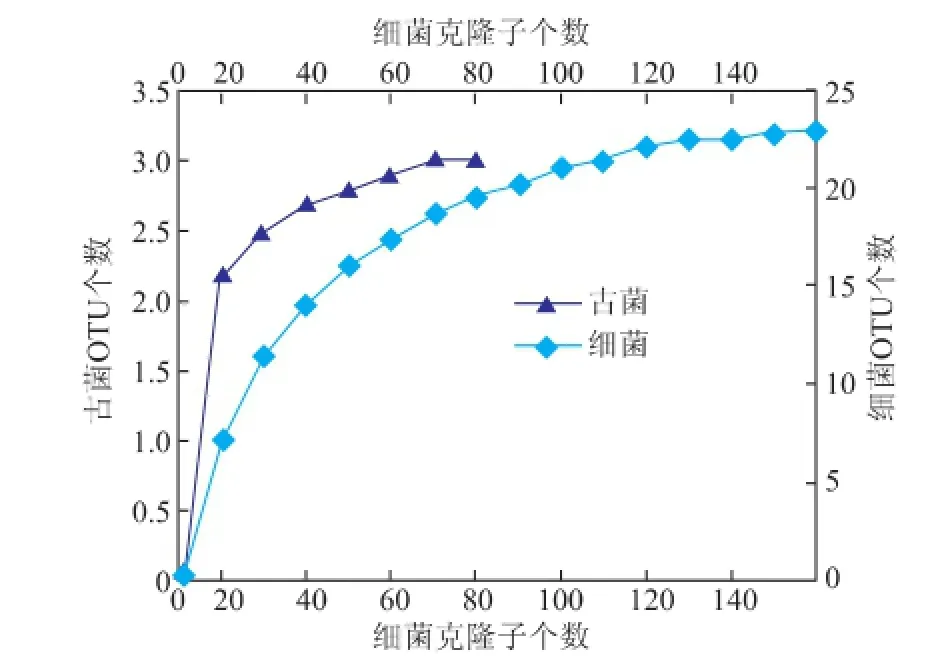
图3 黄水中细菌和古菌克隆子稀释度曲线Fig.3 Rarefaction analysis of bacteria and archaea comm unity in yellow water
根据稀释度曲线可以看出,细菌群落结构的稀释度曲线随着克隆子数量的增加渐趋平缓,说明本文所分离的细菌类群能够代表大多数黄水中细菌群落结构。同时,细菌种群丰富度指数Schao1、SACE及覆盖度指数与稀释度曲线结果相互印证,分别为23.33%、23.11%和99%。细菌群落的多样性指数和优势度指数分别为2.75和12.88。该结果表明,黄水中包含着丰富多样的细菌类群,本研究所获得的细菌类群能够较好的反应样品中可细菌的多样性。古菌稀释度曲线没有趋于平缓,其丰富度指数Schao1、SACE分别为3、3,其多样性指数和优势度指数分别为0.95和2.16,说明黄水中含有更多的真菌种类和数量。然而,其覆盖度指数为100%。该结果说明本研究所鉴定的古菌种类和数量虽少,但却能较好表现黄水中古菌构成。结合刘森[13]等研究结果认为,与窖泥中古菌菌群结构,黄水中古菌在中分类水平上种类较少。
3 结语
浓香白酒发酵黄水环境恶劣,厌氧、高酸、高乙醇含量,很多生长在该环境的微生物更难在常规的培养方法培养,作者采取直接从黄水中提取宏基因组DNA,采用克隆文库的方法探索黄水中真菌、细菌和古菌等微生物群落的构成。杨瑞[21]等研究认为,由于黄水特殊的环境,黄水中大量驯化的良好酸、盐耐受能力的厌氧微生物,黄水中细菌数量约是真菌数量的10万倍。在本研究结果中,基因组DNA提取和细菌、古菌16S rRNA序列PCR都能获得较为满意的结果,而真菌通用引物在不同PCR反应条件下均不能获得满足后续实验的目的片段。分析其原因主要有以下几个方面:真核微生物相对数量较少;真核微生物DNA提取较困难;黄水具有较高的酸度,不适宜微生物的生长,霉菌在这种条件下多以孢子形式存在,许多酵母也会发生自溶。
通过构建基因文库的方法研究发现,黄水中细菌群落结构主要由严格厌氧菌构成,表明在黄水中存在大量严格厌氧的微生物类群,同时通过比较发现,黄水中细菌类群的分类和数量构成上与浓香型白酒窖泥中微生物菌群结构有较多的相同之处。较优势的细菌类群主要有厚壁菌门(66.8%)、拟杆菌门(16.0%)、螺旋体(2.2%)、放线菌门(1.8%)以及丰富度<1%的变形菌门、柔膜菌门、黏胶球形菌门等19个细菌门[14]。叶光斌[15]等研究发现,泸州地区浓香型白酒窖泥中细菌类群主要分布在厚壁菌门(89.8%)、拟杆菌门(8.0%)、柔膜菌门(1.1%)和螺旋体门(1.1%)[13]。作者研究浓香型白酒发酵黄水细菌构成发现,黄水中细菌类群主要分布于厚壁菌门(47.6%)、变形菌门(29.1%)、放线菌门(6%)黏胶球菌门(1.3%),拟杆菌门(2.6%)和柔膜菌门(0.7%)等6个门,且在纲、目、科甚至属等分类水平上也有较高的相似度,说明黄水中微生物区系的构成和浓香型白酒窖泥中菌群构成具有较大的相关性。
根据RDP分类结果,在种分类水平上被归为18个属、4个属分类不名确的类群,及一个门分类不确定的类群。其中Rummeliibacillus、Alkalibaculum、Syntrophomonas、Clostridium sensu stricto、Saccharofermentans、Proteiniphilum、Pelotomaculum、Clostridium IV、Papillibacter、Coriobacteriaceae、unclassified Clostridiales、Acholeplasma[14]、Bacteroides和Proteiniphilum[15],以及未分类的细菌在浓香型白酒窖泥中为优势菌,陶勇[14]、叶光斌[15]等认为,这些微生物在白酒发酵过程中参与着营养物质降解、有机酸、多种醇类、醛类等物质的产生及酯化发应的发生发挥着重要作用,是浓香型白酒香味物质的来源与基础。
此外,作者还检测到如Ochrobactrum、Burkholderia、Serratia、unclassified Enterobacteri aceae、Acinetobacter、Weissella、Victivallis以及unclassified Lachnospiraceae类群。它们分别于Och. cytisi、B.phytofirmans、Ser.nematodiphila、E.hormaechei、Aci.guillouiae、W.paramesenteroides、V.vadensis、C.oroticum等已知菌具有较高的同源性。W.paramesenteroides和C.oroticum均具有产有机酸的能力,W.paramesenteroides是新鲜蔬菜表面的优势菌,常见于豆酱[16]和酱油[17]等甚至肉类发酵食品中等多种传统发酵食品中[18],对食品的风味产生具有重要作用,因此,它们也有可能在白酒发酵过程中对白酒风味的形成具有一定影响。
甲烷菌在自然环境中分布广泛,但因其多分布于含氧量极低或严格厌氧环境如海洋底泥、动物肠道等而较难以培养,因此对环境古细菌的研究多采用分子生物学方法。本研究发现的古细菌被分为产甲烷八叠球菌目和甲烷微菌目,其中产甲烷八叠球菌目的Mehanosarcina属和甲烷微菌目的Methanoculleus属为主要的古细菌类群,该结果与刘森[13]等浓香型白酒窖泥古细菌菌群结构较为相似,这些甲烷菌可与一些甲烷菌共生细菌属如Syntrophobotulus属细菌相互协作利用白酒窖池内的次级代谢产物,改善白酒发酵产品质量,参与窖泥老熟过程发挥重要作用[13-15]。
[1]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2009.
[2]郝江华.黄水调味液在新型白酒中的应用[J].酿酒科技,2005(1):52-53. HAO Jianghua.The application of yellow w ater flavoring liquid in new style Luzhou-flavor liquor[J].Liquor-M aking Science &Technology,2005(1):52-53.
[3]彭太升.黄水调酒液在浓香型白酒中的应用[J].酿酒,2011,38(6):36-37. PENG Taisheng.The application of yellow water to w in to strong aromatic Chinese spirits[J].Liquor-M aking,2011,38(6):36-37.(in Chinese)
[4]罗惠波,张宿义,卢中明.浓香型白酒黄水的应用探索[J].酿酒科技,2004,31(2):71-72. LUO Huibo,ZHANG Suyi,LU Zhongm ing.Application investigation of Luzhou-flavor liquor-yellow water[J].Liquor-M aking,2004,31(2):71-72.(in Chinese)
[5]张晓磊,史潜玉,王化斌,等.白酒酿造副产物黄水中挥发性化合物的研究[J].酿酒,2010,37(2):41-44. ZHANG Xiaolei,SHIQianyu,WANG Huabin,etal.Study on volatile com ponentsof yellow water-liquor fermentation byproduct[J].Liquor-Making,2010,37(2):41-44.(in Chinese)
[6]张晓磊,安红梅,王志海,等.三沟酒酿造副产物黄水中挥发性化合物的研究[J].酿酒科技,2011(8):99-103. ZHANG X iaolei,AN Hongmei,WANG Zhihai,et al.Research on volatile compounds in yellow water-byproduct in Sangou liquor production[J].Liquor-Making Science&Technology,2011(8):99-103.(in Chinese)
[7]曹新莉,王明山.白酒生产中黄水和酒尾的应用[J].酿酒科技,2008(10):96-99. CAO X inli,WANG M ingshan.Application of yellow w ater and ending w ater in liquor production[J].L iquor-M aking Science &Technology,2008(10):96-99.(in Chinese)
[8]刘兴禹,张为民,徐光.浓香型白酒生产中黄水的应用[J].酿酒,2000(3):43-44. LIU Xingyu,ZHANGW eim in,XU Guang.Application of yellow water in Luzhou liquor fermentation[J].L iquor-M aking,2000(3):43-44.(in Chinese)
[9]Xiang W L,Li K,Liu S,et al.Microbial succession in the traditional Chinese Luzhou-flavor liquor fermentation process as evaluated by SSU rRNA prodiles[J].W or ld JM icrobiol Biotechnol,2013,29(3):559-567.
[10]Chao A.Non-parametric estimation of thenumberof classesin a population[J].Scand JStatistics,1984,11:265-270.
[11]Chao A.Estimating the population size of capture-recaputure dataw ith unequalcatchability.Biometric 1987,43:783-791.
[12]Eichler S,Christen R,Holje C,et al.Composition and dynam ics of bacterial communities of a drinking water supply system as assessed by RNA-and DNA-Based 16SrRNA gene fingerprinting[J].Appl Environ M icrobiol,2006,72(3):1858-1872.
[13]刘森.中国浓香型白酒窖池窖泥中原核微生物群落的空间异质性[D].成都:西华大学,2013.
[14]陶勇,芮俊鹏,李家宝,等.浓香型白酒窖泥中细菌和古菌的组成与多样性分析[J].化工学报,2013,5:1800-1807. TAO Yong,RUIJunpeng,LIJiabao,etal.M icrobial community compositionsand diversity in pitmud of Chinese Luzhou-flavor liquor[J].CIESC Journal,2013,5:1800-1807.(in Chinese)
[15]叶光斌,罗惠波,杨晓东,等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学,2013,34(17):176-181. YE Guangbin,LUO Huibo,YANG X iaodong,et al.Community structure of prokaryotes in pitmud of Lu-flavor liquor from Luzhou prefecturebased on culture-independentapproach[J].Food Science,2013,34(17):176-181.(in Chinese)
[16]张巧云.豆酱中微生物多样性及人工接种多菌种发酵豆酱的研究[D].哈尔滨:东北农业大学,2013.
[17]谢显华.酱油发酵过程中微生物群落结构的动态研究[D].广州:华南理工大学,2010.
[18]Bjorkroth K J,Schilinger U,Geisen R,etal.Taxonomic study of Weissella confuseand description of Weissella cibaria sp.nov.,detected in food and clinicalsamples[J].Int J Syst Evol M icrobiol,2002,52(1):141-148.
会议信息
会议名称(中文):2016年生物分子工程国际会议
会议名称(英文):International Conference of Biomolecular Engineering
开始日期:2016-01-05结束日期:2016-01-07
所在国家:新加坡所在城市:新加坡
具体地点:Singapore
主办单位:American Institute of Chemical Engineers
E-MAIL:bio@aiche.org
会议网站:http://www.aiche.org/sbe/conferences/international-conference-biomolecular-engineering-icbe/2016
会议背景介绍:
ICBE brings together researchers who are using quantitative approaches to advance the understanding and app lication of molecular biology.These scientists,engineers,and professionals are contributing to the development of analytical,molecular,high-throughput,and therapeutic strategies that are directly relevant to public health and energy related issues.The conference will stimulate efforts to integrate these approaches across the scales of biological complexity in a single-track non Gordon-style conference format.
Microbial Diversity in Fermented Yellow Water of Traditional Intense Flavor Liquor
LIKe1,2,FAN Zhigang1,WANG Junfang1,LIN Kai3,XIANGWenliang*3
(1.Hongyi Industrial Group Co.,Lte.Chengdu 610100,China;2.Institute of Agro-Products Processing Science and Technology,Chengdu 610000,China;3.Departmentof Bioengineering,XihuaUniversity,Chengdu610039,China)
SSU rRNA librarywas carried out to investigate the m icrobial diversity in fermented yellow water of traditional intense flavor liquor.A ll 151 bacterial sequences recovered from fermented yellow waterwere classfied into Proteobacteria,Firm icutes,Bacteroidetes,Lentisphaerae,Actinobacteria,Tenericutes and an unclassied domain,respectively.The Firm icutes and Proteobacteriawere the dom inant in yellow water.The Clostridium(25.8%),Lactobacillus(15.9%)and Serratia(14.6%)were the dom inantgenus.All37 archae clonesbelonged to the Euryarchaeota,Methanom icrobia,and the archea community in yellow water mostly consist of genera Methanosarcina(59.5%)and Methanoculleus(35.1%).The diversity index of bacterial and archeacommunities were 2.75 and 0.83,respectively.The dom inance index were 12.88 and 2.14,and coveragewere 99.9%and 100%,respectively.A ll the results indicated that them icrobes involved in yellow water play a key role in metabiolizing nutrients and producing flavor components such as alcohol,esters,acerbity,ketone,aldehydeetal.
intense fragrance liquor,yellow water,m icrobialdiversity,SSU rRNA,clone libriary
TS 201.3
A
1673—1689(2015)11—1155—07
2014-07-18
国家自然科学基金项目(31571935);教育部春晖计划项目(Z2014061);四川省应用基础项目(2014JY0045);四川省教育厅重点项目(14ZA0110);四川省泡菜产业链项目(2012NZ0002-8);四川省食品生物技术重点实验室项目(SZJJ2014-007)。
李可(1987—),男,河南永城人,工学硕士,实习研究员,主要从事农产品贮藏保鲜、发酵工程方面的研究。
E-mail:like2341@126.com
向文良(1973—),男,四川成都人,理学博士,教授,硕士研究生导师,主要从事传统发酵食品微生物过程学方面的研究。
E-mail:xwllm7687@sina.com
