两阶段pH和搅拌控制策略提高哈茨木霉产β-1,3-葡聚糖内切酶
2015-10-31李珊詹晓北郑志永朱莉李晶徐敏
李珊,詹晓北*,,郑志永,朱莉,李晶,徐敏
(1.江南大学生物工程学院,江苏无锡214122;2.江苏瑞光生物科技有限公司,江苏无锡214125)
两阶段pH和搅拌控制策略提高哈茨木霉产β-1,3-葡聚糖内切酶
李珊1,詹晓北*1,2,郑志永1,朱莉2,李晶1,徐敏1
(1.江南大学生物工程学院,江苏无锡214122;2.江苏瑞光生物科技有限公司,江苏无锡214125)
为提高哈茨木霉(Trichoderma harzianum GIM 3.442)发酵生产β-1,3-葡聚糖内切酶的酶活Eendo及其内切酶酶活在总酶活中所占的比例Eendo/Etotal,在7 L发酵罐水平考察了不同pH和搅拌转速对菌体和产酶的影响。结果表明,单一pH或搅拌转速的优化不能使菌体生长和产物合成同时达到最优效果。通过分析不同pH和转速下发酵曲线和动力学参数,提出了两阶段pH和搅拌转速控制策略:在发酵前期(0~24 h)控制pH 7.0,搅拌转速100 r/min,发酵后期(24~168 h)控制pH 5.0,搅拌转速200 r/min。β-1,3-葡聚糖内切酶(Eendo)、酶合成生产强度(QE,endo)和Eendo/Etotal分别达到了407.8 U/mL、3.09 U/(mL·h)和0.71,比优化前分别提高了320.0%、398.4%和65.1%。
β-1,3葡聚糖内切酶;哈茨木霉;发酵策略;pH;搅拌转速
β-1,3-葡聚糖酶是一类水解酶,广泛存在于真菌、细菌、软体动物和高等植物[1-3]中。主要分为β-1,3-葡聚糖外切酶(EC 3.2.1.58)、β-1,3-葡聚糖内切酶(EC 3.2.1.6)[4],主要用于啤酒的澄清[5]、诱导植物抵御真菌病害[4];制备原生质体[6];改善肠道菌群结构,促进消化吸收等[7],在食品、农业、生物技术、医药和饲料等领域具有广泛的应用价值。
目前,微生物发酵法是生产β-1,3-葡聚糖酶主要方法。国内外研究主要集中在基因工程菌的构建、内切酶的提取纯化和酶学性质等方面[8-10]。1996年,Noronha[11]等利用T.harzianum发酵得到了339.6 mg/L的蛋白质,但粗酶液β-1,3-葡聚糖酶总酶活Etotal仅达到了5.3 U/mg。2010年,研究者从放线菌中提取出编码β-1,3-葡聚糖酶的基因bglS27,并将其导入到大肠杆菌BL21(DE3)中表达,得到相对分子质量为42 700的蛋白质[12]。现阶段研究发酵得到的β-1,3-葡聚糖酶的总酶活已有很大提高,而β-1,3-葡聚糖内切酶由于占总酶量的比例较低并且受到较少关注,而提高β-1,3-葡聚糖内切酶活性同时降低β-1,3-葡聚糖外切酶活性对于制备β-1,3-葡寡糖至关重要,这对降低β-1,3-葡聚糖内切酶纯化成本和大规模生产β-1,3-葡寡糖将是一项非常有价值的课题。
Giese[13]等研究了哈茨木霉发酵得到的β-1,3-葡聚糖内切酶对海带多糖进行水解,得到不同聚合度的寡糖。而哈茨木霉是一株产酶系相对丰富的菌株,β-1,3-葡聚糖内切酶可将其细胞壁降解造成细胞自溶,菌体生长和产物合成不能同时达到理想状态。有报道表明,菌体最适生长pH和产酶的pH往往不同[14-15];且β-1,3-葡聚糖内切酶属于好氧发酵,发酵罐中搅拌速率直接影响基质的利用和溶氧水平[16]。作者以T.harzianum GIM 3.442为出发菌株,在分批培养的基础上,考察了不同pH和搅拌转速对β-1,3-葡聚糖内切酶酶活及其在总酶活中所占比例的影响,提出了两阶段pH和搅拌转速控制策略,提高了β-1,3-葡聚糖内切酶酶活及其在总酶活中所占的比例,为进一步大规模生产β-1,3-葡聚糖内切酶和制备β-1,3-葡寡糖提供了基础条件。
1 材料与方法
1.1材料
1.1.1菌株哈茨木霉(Trichoderma harzianum GIM 3.442):购于中国广东省微生物菌种保藏中心,-20℃沙土管保藏。
1.1.2试剂茯苓多糖;胰蛋白胨、酵母粉提取物、K2HPO4、NaNO3、乙酸乙酯、乙酸、地衣酚等:均为国产分析纯试剂,国药集团化学试剂有限公司;热凝胶:购于日本Takeda-Kirin Food Co.。
1.1.3培养基
1)产孢子培养基(g/L):马铃薯(去皮)200,葡萄糖20,KH2PO43,MgSO4·7H2O 1.5,硫胺素0.008,琼脂20;pH 6.0,于121℃灭菌30min。
2)种子培养基(g/L):葡萄糖20,酵母浸粉15,(NH4)2SO42.5,KH2PO46.0,MgSO4·7H2O 0.8,CaCl20.5;pH 6.0。
3)发酵培养基(g/L):茯苓多糖40,胰蛋白胨5.0,KH2PO45.0,MgSO4·7H2O 0.2,CaCl20.4;Mandels微量元素液1mL,pH 6.0。
4)Mandels微量元素液(mg/L):FeSO4·7H2O 5.0,MnSO4·H2O 1.6,ZnSO4·7H2O 1.4,CoCl22.0。
1.1.4仪器与设备3K-15型台式高速离心机:美国Sigma-Aldrich Company;CM-5000型HPLC仪:日本Hitachi America Ltd;BioFlo110型7 L发酵罐:美国New Brunswick Scientific Co.Inc。
1.2实验方法
1.2.1孢子悬浮液的制备T.harzianum GIM 3.442菌株在PDA培养基上,25℃培养5~7 d至形成孢子。用无菌生理盐水冲洗孢子,摇床振荡20min,使其分散均匀[17]。
1.2.2种子培养以1×108个/mL的接种量将孢子悬浮液接种于种子培养基中,25℃、110 r/min摇床培养36 h。
1.2.3摇瓶发酵培养以5%的接种体积分数将种子液接入含100 mL发酵培养基的500 mL三角瓶
中,25℃、110 r/min摇床培养6 d。
1.2.47 L发酵罐小试发酵将培养36 h的种子液以10%的接种体积分数接种到发酵罐中,装液量为4 L,控制通气量为1.0~2.0 vvm,200 r/min、28℃下发酵6 d。发酵过程中每12小时跟踪测定各项生化参数(残糖消耗、菌体生长、蛋白质积累、pH变化、总酶活和β-1,3-葡聚糖内切酶活性等)。
1.2.5粗酶液的制备取发酵6 d后的发酵液,8 000 r/min离心10 min,取上清液置于4℃冰箱保存备用。
1.2.6酶催化底物热凝胶悬浊液的制备热凝胶难溶于水,为提高酶水解效率,作者所在实验室在前期研究中确定了热凝胶悬浊液的制备方法[18],称取20 g热凝胶粉末溶于1 000 m L、1.0 mol/L的NaOH溶液中,磁力搅拌3~4 h至其充分溶解。缓慢加入HCl溶液中和至中性,中和液8 000 r/min离心10min,用水洗涤沉淀2~3次。将沉淀溶于pH 6.0、0.025mol磷酸钠缓冲液中,得到20 g/L的热凝胶超细悬浊液。
1.3分析方法
1.3.1生物量测定菌体干重法。取一定量发酵液于8 000 r/min下离心10 min,去除上清液,用水洗涤2~3次,于105℃烘至恒重后称重。
1.3.2发酵液中残糖浓度测定发酵结束后离心去除菌体,采用苯酚硫酸法[19]测定上清液中的残余总糖浓度。
1.3.3β-1,3-葡寡糖定量分析高效液相色谱分析(HPLC):采用Hitachi CM 5000 HPLC系统,Click Maltose(7.6mm×150mm)色谱柱,RI检测器;流动相为V(乙腈)∶V(水)=70∶30;流速0.8mL/min;进样量10.0μL[18]。
1.3.4内切β-1,3-葡聚糖酶活力定量测定反应体系10 m L,包含5.0 m L醋酸钠缓冲液(0.025 mol/L,pH 6.0),加入2.5 mL 2.0 g/dL热凝胶溶液和2.0mL粗酶液。该体系于50℃反应4h,沸水浴10min终止反应。HPLC法测定产物浓度,以预先加热失活的粗酶液做为空白对照,计算水解产物的浓度,所有结果均为3次重复平均值。
总酶活力(Etotal):每分钟水解热凝胶生成1μg总产物所需的酶量为1个酶活单位(U)。
β-1,3-葡聚糖内切酶活力(Eendo):每分钟水解热凝胶生成1μg葡寡糖(2≤DP<6)所需的酶量为1个酶活单位(U)。
1.3.5动力学参数计算方法利用Origin软件对菌体生长、产物合成数据进行插值计算(时间步长为0.1 h),经过平滑处理后得到不同pH和搅拌转速下比生长速率μ(h-1)、内切酶比合成速率qE,endo(U/(g·h))—时间关系曲线。比生长速率μ和β-1,3 -葡聚糖内切酶比合成速率的表达式分别为:

其中,x为菌体质量浓度(g/L);Eendo为β-1,3-葡聚糖内切酶酶活(U/mL);t为时间(h)。
2 结果与讨论
2.1T.harzianum产β-1,3-葡聚糖内切酶分批发酵过程
作者以前期工作中优化得到的培养基和发酵条件进行7 L发酵罐小试。由图1可知,发酵前期T.harzianum生长迅速,总蛋白量、Etotal、Eendo和Eendo/Etotal均较低,pH从6.0下降到5.0,说明微生物在利用游离的单糖和寡糖作为碳源;在12 h后菌体进入对数期并迅速生长,在对数中后期蛋白质开始积累,Etotal和Eendo活性随着蛋白质含量的增加而逐渐增加,pH基本维持在5.5左右;Eendo/Etotal也逐渐增加。在96 h后菌体达到最大(19.5 g/L)并开始自溶,稳定期较短,此时Etotal和Eendo开始大量积累,并在144 h后达到稳定,分别为225.9、97.2 U/mL,Eendo/Etotal达到了0.43。这一期间茯苓多糖加速被水解释放出葡萄糖并被微生物快速利用导致pH下降到4.0左右。随着发酵时间的延长,β-1,3-葡聚糖内切酶将T.harzianum细胞壁分解,造成菌体自溶,释放出大量蛋白质,增加了Etotal和Eendo。由于在发酵96 h后Etotal和Eendo在总蛋白质中的比酶活基本维持不变(0.68左右),且该酶属于混合酶系,成分比较复杂,总蛋白质中杂蛋白质较多,所以在后续分析中蛋白质含量作为次级指标,主要考虑Etotal、Eendo和Eendo/Etotal。
2.2不同pH下β-1,3-葡聚糖内切酶发酵曲线及动力学参数分析
由分批发酵看出,菌体生长和产酶过程的pH变化比较大。Colussi等[14]发现菌体生长和产酶的最适pH往往有所不同。作者通过分批发酵过程中流加NaOH溶液恒定发酵液的pH,设定值分别为5.0、6.0、7.0、8.0,发酵进程曲线见图2。可以看出,不同pH下T.harzianum生长与产酶曲线趋势基本相同。在pH为7.0时生物量、Eendo、Eendo/Etotal均相对较高,分别为29.5 g/L、315.6 U/mL和0.60;pH为6.0时次之;pH过低(5.0)生物量较低(19.5 g/L),但是Eendo/Etotal相对较高(0.65);pH过高(8.0)生物量、Eendo、Eendo/Etotal均有所下降,说明pH过高不利于菌体生长和产酶;菌体最适生长pH(7.0)不能保证最大产酶得率,pH为5.0时有利于产酶及提高Eendo/Etotal,但是菌体的生长变慢限制了β-1,3-葡聚糖内切酶的大量合成。这说明单一pH不能同时保证最大菌体生长和产酶得率。
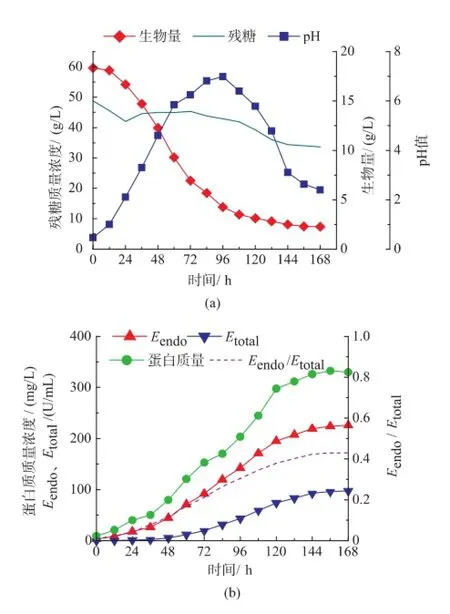
图1 T.harzianum产β-1,3-葡聚糖内切酶分批发酵进程曲线Fig.1 Batch fermentation tim e course ofβ-1,3-endoglucanase production by T.harzianum
结合图3和表1给出了不同pH下的发酵动力学参数及过程参数的比较发现,在整个发酵过程中,不同pH下比生长速率和β-1,3-葡聚糖内切酶比合成速率qE,endo趋势基本相同。μ达到最大值的时间在发酵前期(24 h),而qE,endo最大值在发酵后期(132 h),原因可能是在发酵前期,菌体生长比较旺盛,当生物量达到一定值,自身产酶积累到一定程度时,菌体开始自溶并大量释放出β-1,3-葡聚糖内切酶。与其他pH值相比,当pH为7.0时,μmax(0.056 h-1)比其他值要高,且达到最大值的时间(24h)要短;pH 7.0下细胞生产强度QX为0.351 g/(L·h),远远高于其他pH值下的QX,而qE,endo相差不大,说明在发酵前期(30 h)pH控制在7.0有利于菌体生长。pH 5.0时Etotal和Eendo活性不高,分别为400.1 U/mL和261.5 U/mL,但是qE,endo在整个发酵过程中都较高,且随着时间的延长,增加幅度逐渐增大,并高于其他值,在132 h时达到最大值262.0 U/(g·h)。这说明在pH 5.0时,虽然不利于菌体生长,但是促进了β-1,3-葡聚糖内切酶的生产。以上结果表明,发酵过程中设定单一pH,不能使菌体生长和产物合成同时达到最理想状态。

图3 不同恒定pH值下T.harzianum产β-1,3-葡聚糖内切酶的动力学参数比较Fig.3 Comparison of kinetic parameters inβ-1,3-endoglucanase production by T.harzianum at various constant pH values
2.3不同搅拌转速下β-1,3-葡聚糖内切酶发酵曲线及动力学参数分析
丝状真菌在液体发酵过程中产物与菌体形态有关,对于好氧发酵,搅拌速率显著影响菌体形态和溶氧水平。实验研究了不同的搅拌转速(0、100、200、300 r/min)下菌体生长与产酶关系,结果见图4。可以看出,当搅拌转速为0 r/min时,由于反应器底部设置有气体分布器,反应装置类似鼓泡反应器,喷出的气泡尺寸较大,菌体生长缓慢,菌丝体形成不规则的大菌团,贴壁现象比较明显,达到稳定期的时间较长(132 h),Eendo和Eendo/Etotal较低(211.5 U/mL和0.58),而适当增大搅拌转速(100 r/min和200 r/min)时,由于气液分散效果增强,气泡尺寸显著减少,菌体迅速生长,达到稳定期时间缩短(96 h),Eendo和Eendo/Etotal也相对较高,分别为293.1 U/mL,0.66和360.0 U/mL,0.68。这可能是由于在一定通气量条件下,搅拌使菌丝体分散,避免了大规模结团现象,增大了固液传递接触面积,有利于氧的传递。搅拌转速过高(300 r/min),菌体最大生物量降低,菌体下降速率增大,这可能是由于剧烈的搅拌作用使菌丝体断裂,不易形成合适大小的菌球,菌丝断裂使微生物生理受损,不利于酶的合成。当转速为100 r/min时,细胞生产强度QX(0.286 g/(L·h))最大,转速为200 r/min时,内切酶生产强度QE,endo(2.50 U/(mL·h))最大,说明最适菌体生长和产酶合成的最佳转速并不一致。

表1 不同pH下β-1,3-葡聚糖内切酶分批发酵过程参数比较Table 1 Comparison ofβ-1,3-endoglucanase batch fermentations by T.harzianum at various constant pH values
结合图5和表2中不同转速下的发酵动力学参数及过程参数比较可以看出,不同搅拌速率对μ影响较大,当转速为100 r/min时,μ达到最大值的时间(20 h)比转速为200 r/min时(30 h)要短,但是最大值(0.073 h-1)比转速为200 r/min(0.080 h-1)时要小,而qE,endo相差不大;随着发酵时间的延长,不同转速下qE,endo的增加幅度明显不同,当搅拌转速为200 r/min时,qE,endo在140 h达到最大值(471.0U/(mL·h)),远远高于其他搅拌转速下的qE,endo。综上所述,低搅拌速率利于菌体的生长,而高搅拌速率利于产物的合成。发酵过程中设定单一的搅拌速率,不能使菌体生长和产物合成同时达到最理想状态。

图4 不同搅拌转速下哈茨木霉产β-1,3-葡聚糖内切酶发酵进程曲线Fig.4 Time courses ofβ-1,3-endoglucanase production by T.harzianum at various agitation speeds

图5 不同搅拌转速下T.harzianum产β-1,3-葡聚糖内切酶的动力学参数比较Fig.5 Com parison of kinetic parameters inβ-1,3-endoglucanase production by T.harzianum at various agitation speeds
2.4两阶段p H和搅拌转速控制策略强化T . harzianum发酵产β -1,3 -葡聚糖内切酶
为在保证菌体生长的同时提高Eendo和Eendo/ Etotal,从上述分析中提出一种两阶段p H和搅拌转速控制策略:在发酵前期(0~3 6 h),控制p H 7 . 0,搅拌转速1 0 0 r / m i n,在发酵中后期(3 6~1 6 8 h),控制p H 5 . 0,搅拌转速2 0 0 r / m i n进行分批发酵,结果见图6。由图可知,在发酵前期菌体生长速率加快,达到最大生物量的时间由9 6 h缩短为7 2 h,且最大生物量达到了3 2 . 6 g / L;发酵后期Etotal达到了5 7 2 . 9 U / m L。表3比较了分批发酵条件和两阶段控制发酵的结果,后者比分批发酵时提高了1 5 3 . 6 %,远远高于D e l a C r u z[20]等人报道的利用T . h a r z i a n u m发酵得到的β -1,3 -葡聚糖酶总酶活Etotal(2 3 . 8 U / m L);而据H o n g[21]等人报道,从类芽孢杆菌中分离得到的β -1,3 -葡聚糖酶总酶活Etotal仅为2 . 2 6 U / m L。此外国内外多数报道[22-24]仅关注了Etotal及其应用,单纯的β -1,3 -内切酶酶活Eendo和Eendo/ Etotal则没有受到足够重视,且纯化后的Eendo活性依然很低。作者在分批发酵的基础上采用两阶段控制,不仅显著提高了Etotal,更提高了Eendo和Eendo/ Etotal。通过两阶段控制Eendo达到了4 0 7 . 8 U / m L,比优化前(9 7 . 2 U / m L)时提高了3 2 0 . 0 %,生产强度由0 . 6 2 U /(m L · h)增加到3 . 0 9 U /(m L · h);Eendo/ Etotal达到了0 . 7 1,比优化前(0 . 4 3)提高了6 5 . 1 %。说明在此策控制策略下,不仅提高了最大生物量,缩短了菌体达到最大生物量的时间,还提高了Eendo、QE,endo和Eendo/Etotal,为降低β-1,3-葡聚糖内切酶纯化成本和大规模生产β-1,3-葡寡糖提供了基础条件。

表2 不同转速下β-1,3-葡聚糖内切酶分批发酵过程参数比较Table 2 Comparison of parameters in batch production ofβ-1,3-endoglucanase by T.harzianum at different agitation speeds

图6 两阶段pH和搅拌转速控制T.harzianum产β-1,3-葡聚糖内切酶Fig.6 Time course ofβ-1,3-endoglucanase p roduction by T.harzianum using two-stage pH and agitation speed control strategy

表3 不同控制条件下β-1,3-葡聚糖内切酶分批发酵过程参数比较Table 3 Com parison of parameters ofβ-1,3-endoglucanase production by T.harzianum at various control strategies
3 结语
β-1,3-葡聚糖内切酶发酵过程中最适菌体生长和产酶pH不同,分别为7.0和5.0,且不同pH下β-1,3-内切酶活在总酶中的比例也不相同;在7 L发酵罐中搅拌转速对丝状真菌的菌丝体形态和产酶也有显著影响。作者采用两阶段pH和搅拌转速控制策略,在发酵前期(0~36 h)控制pH为7.0,搅拌转速100 r/min,保证菌体在短时间内达到最大比生长速率;在发酵后期(36~168 h)控制pH为5.0,搅拌转速200 r/min,在提高Eendo和Eendo/Etotal的同时缩短产酶达到最大比合成速率的时间。采用此两阶段控制策略,Eendo、酶合成生产强度QE,endo和Eendo/Etotal分别达到了407.8 U/mL、3.09 U/(mL·h)和0.71,比优化前分批发酵分别提高了320.0%和398.4%和65.1%。
[1]Zur I,Golebiow ska G,Dubas E,et al.β-1,3-glucanase and chitinase activities in w inter triticales during cold hardening and subsequent infection by Microdochium nivale[J].Biologia,2013,68(2):241-248.
[2]Pitson SM,Seviour R J,M cDougall B M.Noncellulolytic fungalβ-glucanases:their physiology and regulation[J].Enzym e and M icrobial Technology,1993,15(3):178-192.
[3]Lieshout JV,Faijies M,Neito J,et al.Hydrolase and glycosynthase activity of endo-1,3-β-glucanase from the thermophile Pyrococcus furiosus[J].A rchaea,2004,1(4):285-292.
[4]Song JM,Nam K,Sun Y U,etal.Molecularand biochemical characterizationsofa novelarthropod endo-β-1,3-glucanase from the Antarctic springtail,Cryptopygus antarcticus,horizontally acquired from bacteria[J].Comparative Biochem istry and Physiology Part B:Biochem istry and M olecular Biology,2010,155(4):403-412.
[5]MannersD J,Wilson G.Purification and propertiesof an endo-(1→3)-β-d-glucanase from malted barley[J].Carbohydrate Research,1974,37(1):9-22.
[6]Antony B,Geoffrey B F,Bruce A S.Chem istry,bio-chem istry,and biology of 1-3 beta glucans and related polysaccharides[M]. New York:Academ ic Press,2009:259-282.
[7]谭会泽,冯定远.饲料中的β-葡聚糖和β-葡聚糖酶的应用[J].畜禽业,2005,3:18-20. TAN Huize,FENG Dingyuan.App lication ofβ-glucan andβ-glucanase in foolder[J].Livestock and Poulty Industry,2005,3:18-20.(in Chinese)
[8]Sakamoto Y,Nakade K,Konno N.Endo-β-1,3-glucanase GLU 1,from the fruiting body of Lentinula edodes,belongs to a new glycoside hydrolase fam ily[J].App lied and Environmental M icrobiology,2011,77(23):8350-8354.
[9]Duan F,Lu X.Enzymatic properties and kinetics of an endo-β-1,3-glucanase of Mitsuaria chitosanitabida H12 and preparation of1,3-β-d-glucooligosaccharides from yeastβ-glucan[J].Annals of M icrobiology,2012,62(1):307-312.
[10]Shu C H,Xu C J,Lin E S.Production,purification and partial characterization of a novel endo-β-1,3-glucanase from Agaricus brasiliensis[J].Process Biochem istry,2006,41(5):1229-1233.
[11]Noronha E F,Ulhoa C J.Purification and characterization of an endo-β-1,3-glucanase from Trichoderma harzianum[J]. Canadian Jou rnal of M icrobiology,1996,42(10):1039-1044.
[12]Shi P,Yao G,Yang P,etal.Cloning,characterization,and antifungal activity of an endo-1,3-β-d-glucanase from Streptomyces sp.S27[J].App lied M icrobiology and Biotechnology,2010,85(5):1483-1490.
[13]Giese E C,Covizzi L G,Dekker R F H,et al.Enzymatic hydrolysis of botryosphaeran and laminarin byβ-1,3-glucanases produced by Botryosphaeria rhodina and Trichoderma harzianum Rifai[J].Process Biochem istry,2006,41:1265-1271.
[14]Colussi F,Garcia W,Rosseto F R,et al.Effect of pH and temperature on the global compactness,structure,and activity of cellobiohydrolase Cel7A from Trichoderma harzianum[J].European Biophysics Journal,2012,41(1):89-98.
[15]Theodore K,Panda T.Application of response surfacemethodology to evaluate the influenceof temperatureand initialpH on the productionofβ-1,3-glucanaseand carboxymethylcellulase from Trichoderma harzianum[J].Enzym e and M icrobial Technology,1995,17(12):1043-1049.
[16]Darah I,SumathiG,Jain K,etal.Influence of agitation speed on tannase production andmorphology of Aspergillus niger FETL FT3 in submerged fermentation[J].App lied Biochem istry and Biotechnology,2011,165(7-8):1682-1690.
[17]姚强,黄琰,陈冠军.哈茨木霉SDU3.87耐碱性纤维素酶液体发酵条件的研究[J].山东大学学报:理学版,2005,40(3):110-115. YAO Qiang,HUANG Yan,CHEN Guanjun.Liquid fermentation technology of alkaline-endurable cellulases from Trichoclerma harzianum SDU 3.87[J].Journal of Shandong University:Natural Science,2005,40(3):110-115.(in Chinese)
[18]Li J,Zhu L,Zheng Z Y,etal.A new effective process for production of curdlan oligosaccharides based on alkali-neutralization treatmentand acid hydrolysis of curd lan particles in water suspension[J].App lied M icrobiology and Biotechnology,2013:97(19):8495-8503.
[19]孙培龙.生物化学技术实验指导[M].北京:化学工业出版社,2008:35-36.
[20]De La Cruz J,Pintor-Toro JA,Benitez T,etal.A novel endo-beta-1,3-glucanase,BGN13.1,involved in themycoparasitism of Trichoderma harzianum[J].Journal of Bacteriology,1995,177(23):6937-6945.
[21]Hong T Y,Meng M.Biochemical characterization and antifungal activity of an endo-1,3-β-glucanase of Paenibacillus sp.isolated from garden soil[J].Applied M icrobiology and Biotechnology,2003,61(5-6):472-478.
[22]Giese E C,Covizzi L G,Borsato D,et al.Botryosphaeran,a new substrate for the production ofβ-1,3-glucanases by Botryosphaeria rhodina and Trichoderma harzianum Rifai[J].Process Biochem istry,2005,40(12):3783-3788.
[23]De La Cruz J,Rey M,Lora JM,et al.Carbon source control onβ-glucanases,chitobiase and chitinase from Trichoderma harzianum[J].Archives of M icrobiology,1993,159(4):316-322.
[24]Günter E A,Kapustina O M,Ovodov Y S.Influence of the fungus Trichoderma harzianum on the enzyme and polysaccharide composition of Silene vulgaris callus[J].Biochem istry(M oscow),2013,78(3):290-294.
会议信息
会议名称(中文):第三届中国微生物与白酒酿造技术研讨会
开始日期:2015-12-03结束日期:2015-12-05
所在城市:四川省宜宾市
具体地点:四川省宜宾市竹海世外桃源度假酒店主办单位:中国微生物学会工业微生物学专业委员会
协办单位:中国食品发酵工业研究院
承办单位:宜宾五粮液股份有限公司,宜宾学院,固态发酵资源利用四川省重点实验室
联系人:胡育骄联系电话:010-53218310,18600736797
E-MAIL:jane@china-cicc.org会议注册费:¥1500
会议网站:http://csm.im.ac.cn/templates/team/introduction.aspx?nodeid=9&page=ContentPage&contentid=3716
会议背景介绍:微生物是中国传统白酒酿造的核心技术。不同的制曲工艺,不同的窖酿工艺,培育出独特的微生物优势种群,形成独步世界的香型各异的中国白酒。微生物对白酒酿造的重要意义越来越受到广泛重视,近5年来,在酿酒微生物领域取得的科技成果是过去10年总量的3倍。“十三五”期间,微生物技术在中国白酒的优质高效,安全健康,智能制造,环境保护等多个产业升级换代领域都将发挥重要作用。第三届大会以白酒酿造功能微生物及其应用为核心主题,诚邀微生物专家、白酒酿造微生物研究团队和白酒酿造企业代表进行深入交流;会议期间,还将举行工业微生物学专业委员会会议、酿酒微生物菌种鉴定与培养技术培训班、五粮液美酒鉴赏会、生态环境考察等多项活动。
会议名称(中文):第五届海峡两岸植物科学与农业生物技术研讨会
开始日期:2015-12-04结束日期:2015-12-06
所在城市:广东省肇庆市具体地点:肇庆学院
主办单位:广东省植物生理学会承办单位:肇庆学院
主题:现代农业生物技术联系人:陈雄伟联系电话:13827511836;0758-2752578
E-MAIL:cxw@zqu.edu.cn会议网站:http://gdspp.scib.ac.cn/zxgg/201507/t20150728_300834.htm l
会议背景介绍:广东省植物生理学会2015年学术年会及第五届海峡两岸植物科学与农业生物技术研讨会定于2015年12月4日-6日在广东肇庆举行,热忱欢迎海峡两岸从事植物生理学科研、教学工作的科研工作者和在读研究生参会,共同探讨两岸植物科学与农业生物技术发展的前沿领域与未来展望,增进海峡两岸科技工作者在相关领域的合成与交流、促进农业技术与示范合成。
论文征集:参会者需于2015年10月15日前提交400-600字论文摘要,摘要格式请见附件,论文摘要发至xuehui@scbg.ac.cn信箱。稿件的电子文档名称采用文章标题,投稿时请将稿件作为电子邮件的”附件”发送,在邮件主题栏中填上“2015年广东省植物生理学会学术年会及第五届海峡两岸植物科学与农业生物技术研讨会论文投稿”字样。会议计划编辑《广东省植物生理学会2015年学术年会暨第五届海峡两岸植物科学与农业生物技术研讨会论文摘要汇编》。
Enhancement of β-1,3-Endoglucanase Production by Trichoderma harzianum Using Two-Stage pH and Agitation Speed Control Strategy
LIShan1,ZHAN Xiaobei*1,2,ZHENG Zhiyong1,ZHU Li2,LIJing1,XU Min1
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Jiangsu Rayguang Biotechnology Co.,Ltd.Wuxi 214125,China)
Beta-1,3-endoglucanase has important applications in food,agriculture and biotechnology.To enhance the productivity ofβ-1,3-endoglucanase and its ratio in totalβ-1,3-glucanase activity by Trichoderma harzianum Rifai GIM 3.442,the effects of pH and agitation speedswere investigated in a 7 L fermentator.Itwasshown that themono-controlof pH oragitation speed could not satisfactorily offer higher biomass andβ-1,3-endoglucanase production simultaneously.A two-stage pH and agitation speed controlstrategywas therefore employed,i.e.,pH and agitation speed were controlled at7.0 and 100 r/m in in the firststage of fermentation(0~24 h)and then sw itched to pH 5.0 and 200 r/m in in the second stage(24~168 h).On accountof this,β-1,3-endoglucanase activity and itsproductivity reached 407.8 U/m L and 3.09 U/(m L·h),320.0%and 398.4%higher than thatof uncontrolled condition,respectively.The ratio ofβ-1,3-endoglucanaseto totalβ-glucanasesactivitywas0.71,increasing 65.1%than thatofuncontrolled condition.
beta-1,3-endoglucanase,Trichoderma harzianum,two-stage strategy,pH,agitation speed
TQ 925
A
1673—1689(2015)11—1146—09
2014-03-07
国家自然科学基金项目(31171640,31271888);国家863计划项目(2012AA021505);无锡市科技支撑计划项目(CLE01N1208);无锡市130计划。
詹晓北(1962—),男,北京人,工学博士,教授,博士研究生导师,主要从事生化工程与反应器方面的研究。
E-mail:xbzhan@yahoo.com
