TWEAK蛋白在出血后大鼠脑组织中的表达及在脑水肿中的作用研究
2015-10-31刘忠伟
刘忠伟
(吉林市人民医院神经内科二疗区,吉林 吉林 132001)
TWEAK蛋白在出血后大鼠脑组织中的表达及在脑水肿中的作用研究
刘忠伟
(吉林市人民医院神经内科二疗区,吉林 吉林 132001)
目的 TWEAK(TNF-like weak inducer of apoptosis)肿瘤坏死因子样凋亡微弱诱导剂是肿瘤坏死因子家族成员之一,最近研究表明TWEAK在脑缺血后的脑水肿形成中起重要作用,但在脑出血中的作用却缺乏研究证据。本研究观察TWEAK在大鼠脑出血后脑组织中的表达及抗TWEAK单克隆抗体对出血后脑水肿形成的影响。方法 免疫印记定量检测对照组及出血后3 h、4.5 h、6 h 及1 d、2 d、7 d大鼠脑组织TWEAK蛋白。颅内注射抗TWEAK单克隆抗体观察TWEAK在大鼠出血后24 h对脑水肿形成的影响。结果 免疫印记表明TWEAK在对照组有基本表达,从出血后3~6 h表达明显增加,在6 h达到高峰。接着在第1、2和7天开始向正常水平回落。此外,与PBS对照组相比,抗TWEAK单克隆抗体能明显降低大鼠脑出血后24 h脑水肿的形成[从(81.8±0.5)%到(78.3±0.3)%,P<0.01]。然而在对侧基底节,TWEAK对脑水含量没有影响。结论 TWEAK在脑出血后的3 h、4.5 h、6 h、24 h表达上调,并在6 h达到高峰,1 d开始表达向正常回落。此外,TWEAK抑制剂在大鼠脑出血后第二天能明显降低脑水肿的形成。
肿瘤坏死因子样凋亡微弱诱导剂;免疫印记;脑出血;脑水肿
1 材料与方法
1.1主要试剂和仪器:兔抗鼠anti-TWEAK单克隆抗体和多克隆抗体购于美国Abcam公司,立体定位仪及图像分析系统由中心实验室学提供。
1.2动物模型及分组:选用注入自体动脉血建立大鼠脑出血模型[1],大鼠用水合氯醛麻醉(350 mg/kg,i.p.)后放置于立体定位仪上,在左侧颅骨(前囟前0.2 mm,中线左侧3 mm)转约1 mm大小的孔(图1A、图2),自体股动脉血(至少50 μL)被收集到无菌不加任何抗凝剂的无针胰岛素注射器内。26号针头立即连接到注射器,用立体定向仪将50 μL股动脉血引入到左侧头骨转孔表面下5.5 mm下的尾状核位置。50 μL股动脉血共10 min注完,留针15 min以防反流。用骨蜡封颅孔,头皮缝合后放入笼内,自由进食水。对照组仅不注血。动物分别在出血损伤后3 h、4.5 h 、6 h、1 d、2 d和7 d被处死用于实验分析。将动物随机分成A、B、C三组。A组用于观察TWEAK在对照组脑组织及出血脑组织TWEAK蛋白表达。分对照组(仅不注血,余同出血组),每组3只;出血模型组,模型组在分成出血后3 h、4.5 h、6 h、24 h、48 h、7 d 6个亚组,每个亚组3只。C组用于观察颅内注射anti-TWEAKmAb(10 μg,20 μL)或同体积PBS后脑水含量变化。分PBS组,anti-TWEAKmAb组,每组6只。
1.3TWEAK蛋白的免疫印迹(Western Blot)检测:免疫印迹用于TWEAK定量分析并确认TWEAK抗体的特异性。将大鼠注入50 μL生理盐水(对照组)或50 μL自体动脉血。对照组在出血后24 h将其处死,出血组分别在出血后3 h、4.5 h、6 h、1 d、2 d、10 d将其处死(每个时间点3只),大鼠经水合氯醛过量麻醉后立即取脑,将其切成3 mm厚的冠状组织块(距额极4 mm处开始),组织匀浆后加入包含有62.5 mmol/L的This-HCl,2%十二烷基硫酸钠(SDS),10%甘油以及50 mmol/L脱氧胆酸的3倍于组织体积的裂解液,裂解20 min后离心(4 ℃,14000 g,15 min),取上清后放于-70 ℃冰箱中备用。采用牛血清蛋白(BSA)检测蛋白浓度。每个凝胶泳道加入15 μg蛋白,用15%分离胶分离蛋白,然后在转膜液中将蛋白转到醋酸纤维膜上,将膜放入含5%脱脂奶粉的TBST液(100 mmol/L Tris,pH 7.6,150 mmol/L NaCl,0.1% Tween 20)中封闭1 h,接着用兔抗鼠TWEAK多克隆抗体(1∶800;Abcam,USA货号ab37170)室温孵育1 h,TBST清洗3次,再用辣根过氧化物酶标记的羊抗兔IgG-HRP(1∶6000;Santa Cruz Biotechnology)孵育1 h,用ECL化学发光系统观察与IgG-HRP结合的TWEAK抗体,用图像分析系统分析TWEAK蛋白免疫印迹条带的光密度。

图1 A Western blot,出血后各时间点TWEAK的蛋白表达

图1 B TWEAK蛋白的免疫印记分析。将各时间点TWEAK的平均蛋白表达水平与相应内参表达的比值比作为标准化比值,得出的各值在相对0 h值得出比值。*P<0.05(与0 h值比较)
1.4脑水含量的测定:将研究动物分成两组,PBS对照组和抗TWEAK单克隆抗体组,每组6只。50 μL自体动脉血注入左侧基底节后2 h将抗TWEAK单克隆抗体(0.5 mg/mL,Abcam,USA)20 μL注入大鼠第三脑室(前囟,-1;中线,0;背腹,5),对照组注入同体积的PBS(图1B、图2)。24 h后取出脑组织用于测量脑水肿。先将脑组织从距额极4 mm处切成3 mm厚的冠状组织块,在沿中线切开成两个半球。每个半球包含有基底节。这样,从每个脑组织中可得2个样本,即:同侧及对侧基底节。用电子分析天枰称重获得湿重(WW),而后将组织放入100 ℃恒温箱中烘烤24 h后获得干重(DW)。如下公式计算脑水含量(%):(WW-DW)/WW×100。
1.5统计分析:不同组间差异采用t检验及方差分析进行检测,所有数据采用均数±标准差表示,P<0.05认为有统计意义。
2 结果
2.1免疫印记分析:从Western Blot中可以看出,TWEAK蛋白在对照组脑组织中有基础表达,但从出血后3~6 h表达明显增加并在6 h达到高峰(图1A-1B)。在第1、2和7天开始向正常回落,第7天明显下降(图1A-1B),但密度值仍高于对照组,然而二者没有显著差异。
2.2TWEAK抑制剂对出血后脑水肿形成的影响:出血后2 h颅内注射抗TWEAK单克隆抗体可明显减少出血后24 h血肿周围的水肿形成。在抗TWEAK抗体组,同侧基底节,脑水含量是(78.3±0.3)%;PBS对照组,同侧基底节,脑水含量是(81.8±0.5)%,P<0.01。在对侧基底节抗TWEAK单克隆隆对脑水含量没有影响,与对照组相比没有明显差异(图2和表1)。
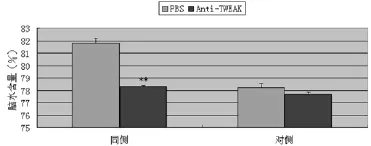
图2 出血24 h后在Anti-TWEAK组和PBS对照组中同侧及对侧基底节的脑水含量(每组6只)。数据用均数±标准差表示。在同侧基底节,Anti-TWEAK组与PBS组相比能明显降低脑水肿,二者有显著差异,P<0.01,在对侧基底节二者没有明显差异,P>0.05,**P<0.01(与对照组比较)

表1 各组脑组织脑水含量变化比较(x-±s,n=6)
3 讨论
TWEAK是表达广泛的细胞因子。已有大量研究表明,TWEAK可在多种细胞和多发性硬化、缺血性卒中等模型的组织中表达。但TWEAK是否参与脑出血还不清楚。本研究表明,TWEAK也同样在脑出血中发挥作用。首先,本研究表明与对照组相比TWEAK在出血组表达上调。通过免疫印迹定量检测TWEAK蛋白发现,与对照组相比TWEAK在出血后3、4.5、6 h表达明显上调,并在6 h达到高峰。在出血后的24 h和48 h表达仍维持在较高水平并开始趋于向正常水平缓慢回落,出血后7 d表达明显下降,但仍高于对照组。以上研究表明,TWEAK同样参与了出血后的脑组织损伤。此外,本研究通过注射TWEAK抑制剂发现,与PBS对照组相比,Anti-TWEAK单克隆抗体能明显降低大鼠出血同侧基底节的脑水肿,而对出血对侧没有影响。这也表明TWEAK可能作为毒性因子在出血后的脑水肿形成中发挥作用.与缺血性卒中相比,脑出血后可通过多条途径造成脑损伤,如炎症相关机制,毒素释放及蛋白分解酶等[2]。往往比缺血性卒中预后更差。Potrovita等发现,在小鼠缺血卒中模型,缺血脑组织中TWEAK表达能提高2倍[3]。本研究通过免疫印迹分析发现,TWEAK表达在出血后6 h达到高峰,表达约提高3倍。这也为脑出血后往往比缺血性卒中有更为严重的损伤和预后提供了部分线索。此外,本研究免疫印迹还表明TWEAK表达在出血后6 h达到高峰后,在24 h和48 h仍维持在较高水平。这表明TWEAK可能在出血后的持续脑水肿中发挥作用,TWEAK参与了出血性脑损伤的延迟相。以往研究表明,脑出血后脑水肿要经历两个严重阶段:出血急性期(<6 h)和出血后48 h的高峰期[4]。二者可能有不同的作用机制。本研究表明TWEAK在出血急性期(<6 h)表达迅速上调,提示TWEAK可能在出血急性期发挥重要作用。因此,在出血急性期治疗脑水肿更为有效;TWEAK抑制剂在治疗出血后脑水肿方面,特别是在出血急性期,可能更好发挥治疗效用。 综上所述,应用TWEAK抑制剂治疗脑水肿可能更为有效,特别是在脑出血急性期(<6 h)。而且,TWEAK抑制剂也可能会在出血后的脑损伤中发挥神经保护作用。这与传统渗透性药物相比可能更具优势。应用TWEAK抑制剂治疗出血后脑水肿很可能成为较为理想的新型疗法。
4 结论
TWEAK蛋白在大鼠脑出血后表达上调,并可能参与了出血后脑水肿的形成。TWEAK抑制剂能明显降低大鼠出血后脑水肿。
[1] Xue M,Del Bigio MR.Comparison of brain cell death and in flammatory reaction in the three models of intracerebral hemorrhage in adult rats[J].Stroke Cerebrovasc Dis,2003,12(3):152-159.
[2] ronowski J,Hall CE.New horizons for primary intracerebral hemorrhage treatmeat:experience from preclinical studies[J].Neurol Res,2005,27(3):268-279.
[3] Potrovita I.Tumor necrosis factor-like weak inducer of apoptosisinduced neurodegeneration[J].Neurosci,2004,24(38):8237-8244.
[4] Wu H,Zhao R,Qi J,et al.The expression and the role of protease nexin-1 on brain edema after intracerebral hemorrhage[J].Neurol Sci,2008,270(1/2):172-183.
R743.3
B
1671-8194(2015)36-0036-02
