RAFT一步聚合制备壳交联药物载体及其控释研究
2015-10-31江国华周慧婕江腾腾杜祥祥
江国华,周慧婕,江腾腾,杜祥祥
(浙江理工大学,a.材料与纺织学院;b.启新学院,杭州310018)
RAFT一步聚合制备壳交联药物载体及其控释研究
江国华a,周慧婕b,江腾腾a,杜祥祥a
(浙江理工大学,a.材料与纺织学院;b.启新学院,杭州310018)
通过可逆加成-断裂链转移(RAFT)一步聚合制备聚甲基丙烯酸二甲胺乙酯-b-聚苯乙烯(PDMAEMA-b-PS)壳交联纳米粒子(SCL-NPs),引入还原敏感性交联剂双(丙烯酰)胱胺(BAC)使得制备得到的药物载体能在还原剂的作用下发生解聚;在制备SCL-NPs的过程中加入吲哚美辛(IND)来制备负载吲哚美辛的SCL-NPs(SCLNPs-IND)。用傅里叶变换红外分光光度计、核磁共振波谱仪、透射电子显微镜、动态光散射纳米粒度分析仪对SCLNPs的结构形貌和性能进行表征,发现SCL-NPs具有明确的核壳结构并且粒径均一;并采用紫外-可见分光光度计对SCL-NPs-IND药物释放性能进行研究,结果表明二硫苏糖醇(DTT)能加速SCL-NPs-IND的药物释放,并且在碱性条件下的释放速度大于酸性条件下的药物释放速度。
RAFT;壳交联;药物载体;还原敏感性;可控释放
0 引 言
20世纪60年代至今,越来越多的学者开始关注药物控制释放体系的研究。相对于传统的给药方式,药物的控释不仅可以提高药物治疗的有效性、安全性和准确性,同时还能减少药物对人体的毒副作用。目前,尽管有关药物控释的研究已有很多,但仍没达到理想的要求,仅有少数被应用到临床上,因此研发理想的药物控释体系成为了研究热点。由于药物载体是药物控释体系的重要组成部分,也是影响药效的主要因素,所以,制备性能良好的药物载体也就成为了药物控释技术的核心内容[1]。
完善已有的药物载体合成方法和研发疗效更好、选择性更强的新型药物载体材料从而达到理想的药物控释效果的药物载体是目前的研究重点[1]。随着药物学、生物材料科学、临床医学等学科的发展与交叉,以及人类不断的提高在药物方面的要求,有关高分子药物载体的研究越来越被重视。当高分子作为药物的载体时,药物的作用时间将增加、选择性会有所提高、毒性也会降低,并且药物还能够被运送到体内确定的部位(靶位)。在药物释放之后,高分子载体能够排出或者在水解后被吸收,并不会在体内长时间积累[2]。另外,可逆加成-断裂链转移聚合(reversible addition-fragmentation chain transfer polymerization,RAFT)具有反应要求低和反应条件温和的显著优点。当反应体系中加入链转移常数较大的链转移剂,不可逆的自由基聚合反应将变为可逆,从而使得聚合反应可控[3]。目前已报道的往往都是不具有环境敏感性的交联剂[4-10],这样制得的壳交联药物载体在药物传递后不能进行解聚,将会影响细胞的代谢。本文采用RAFT聚合技术,在不提前合成大分子链转移剂PDMAEMA的情况下,以S-1-十二烷基-S'-(α,α'-二甲基-α"-乙酸)三硫代碳酸酯(DMP)、偶氮二异丁腈(AIBN)为引发剂,引入还原敏感性交联剂双(丙烯酰)胱胺(BAC),采用RAFT一步聚合的方法制备粒径均一且能在还原剂的作用下发生解聚的壳交联药物载体,并对其进行药物控释研究。
1 试验
1.1实验材料与仪器
甲基丙烯酸二甲氨乙酯(DMAEMA,99%,购自比利时Acros Organics公司);苯乙烯(St,CP,购自上海凌峰化学试剂有限公司);偶氮二异丁腈(AIBN,AR,天津市科密欧化学试剂有限公司);环己烷(AR,杭州高晶精细化工有限公司);S-1-十二烷基-S'-(α,α'-二甲基-α"-乙酸)三硫代碳酸酯(DMP,合成方案如文献[11]中报道)、双(丙烯酰)胱胺(BAC,合成方案如文献[12]中报道)和去离子水,实验室自制。
B-260恒温水浴锅(上海亚荣生化仪器厂);FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司);SHZ-B水浴恒温振荡器(金坛市宏凯仪器厂);AL204电子天平(梅特勒-托利多仪器(上海)有限公司);AVANCE AV 400超导核磁共振波谱仪(德国Bruker公司);Nicolet 5700傅里叶变换红外分光光度计(美国Nicolet公司);LB-550V动态光散射纳米粒度分析仪(日本HORIBA公司);JSM-2100透射电子显微镜(日本JEOL公司);U-3010紫外-可见分光光度计(日本Hitachi公司)。
1.2试验方法
1.2.1SCL-NPs的制备
取1 mL环己烷(0.009 mol)加入0.05 g DMP(0.14 mmol)、0.008 g AIBN(0.05 mmol)、0.7 mL DMAEMA(3.9 mmol)、0.13ml St(1.1 mol)、10 mL H2O及0.0035 g BAC(0.01 mmol)的混合溶液中,搅拌若干分钟使上述物质溶解,之后将其转移入长颈瓶中。然后置于液氮中冷冻,抽真空、通氮气3次。对长颈瓶进行真空封管,将其移入75℃的油浴中反应24 h。反应产物冷却至室温后将其置于透析袋中透析24h,得到液态的SCL-NPs;另外,取一部分产物进行冷冻干燥得到粉末状的SCL-NPs。
1.2.2SCL-NPs-IND的制备
SCL-NPs-IND的制备和1.2.1中SCL-NPs的制备过程相似,只需将0.10 mg IND溶于环己烷后加入其它试剂的混合溶液中。反应结束后,得到负载IND的聚合物粉末(SCL-NPs-IND)。
1.2.3SCL-NPs-IND的药物释放
将0.03 g SCL-NPs-IND加入3 mL一定p H值的磷酸缓冲溶液(PBS)中,接着移入透析袋,将此透析袋放入蓝口瓶并加入27 mL上述PBS。然后将蓝口瓶置于水浴恒温振荡器中振荡,温度维持在37℃。PBS的p H分别为5.9、6.8和7.6,各p H值下加入的二硫苏糖醇(DTT)的量分别为0 mM和10 m M。每组实验进行3次,取平均值。
1.3表征方法
1.3.1傅里叶变换红外分光光度计(FT-IR)
取部分粉末状的SCL-NPs和适量KBr于玛瑙研钵中混合研磨均匀后,压片,制样。用傅里叶变换红外分光光度计测其红外谱图。
1.3.2核磁共振波谱仪(1H NMR)
先取适量样品加入核磁管中,然后加入0.5 m L CDCl3,超声使其溶解。在核磁共振波谱仪的工作频率为400 MHz的情况下进行测定。
1.3.3动态光散射纳米粒度分析仪(DLS)
取适量的样品用水稀释后,即可用动态光散射纳米粒度分析仪进行测定。每个样品测试3次,数据取平均值。
1.3.4透射电子显微镜(TEM)
取少量样品液体用水进行稀释,接着超声波分散1h,然后用毛细管吸取少量分散液,滴在涂有碳膜的铜网(200目)上,室温干燥后在加速电压为200 k V的条件下进行观察。
2 结果与讨论
2.1SCL-NPs的合成讨论
RAFT一步聚合制备具有核壳结构并且粒径均一的药物载体。此制备过程中,略去合成大分子链转移剂PDMAEMA的步骤,直接在合成SCLNPs的乳液体系中通过链转移剂DMP引发DMAEMA均聚合成PDMAEMA稳定剂;其中AIBN作为引发剂,引发St和BAEDS发生共聚,最终制得SCL-NPs。合成路线如图1所示。
2.2样品的核磁表征
图2为SCL-NPs的1H NMR谱图。如图所示:-S-CH2-C-CH3基团上的亚甲基和甲基的质子峰在δ=1.42 ppm和0.91 ppm处;-SCH-CH2-基团上亚甲基的质子峰在δ=1.6 ppm处;在δ=2.0 ppm和2.3 ppm处各有一个单峰,分别对应于(CH3)2-C-COOH基团和-CH2-N-(CH3)2基团上甲基的质子峰;δ=3.68 ppm和2.54 ppm处各有一个单峰,对应于-CH2-CH2-N-基团上亚甲基的质子峰[13-14]。相比于PDMAEMA-b-PS的1H NMR谱图[11],SCL-NPs的1H NMR谱图上δ=6~8 ppm处无特征峰,表明已成功制备SCL-NPs。原因在于:St和BAC可以通过共聚键连接在PDMAEMA稳定剂上,则PDMAEMA-b-PS纳米粒子的壳层将会发生交联,从而阻碍PS链段的运动,这样其链锻上质子氢的信息就无法被核磁检测。由于CDCl3是PS的良溶剂,所以当PS壳层未进行交联时,核磁谱图上就会出现PS的质子氢的信息[14]。
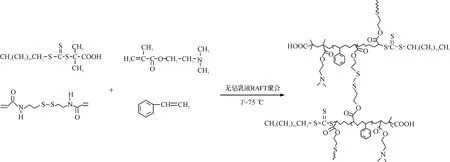
图1 壳交联纳米粒子的合成路线
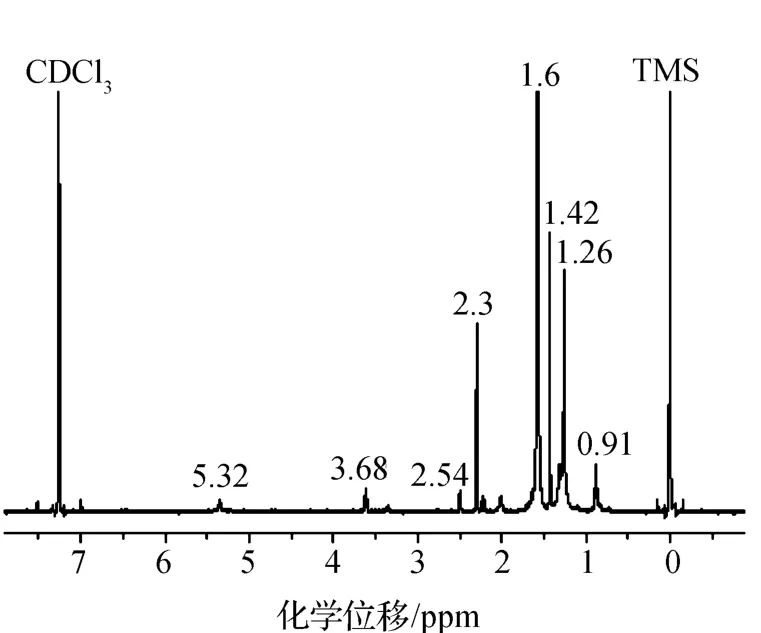
图2 SCL-NPs的氢核磁共振谱图
2.3样品的红外表征
图3为SCL-NPs的红外谱图。从图中可以看出:3400 cm-1处的吸收峰归属于羧酸中-OH的伸缩振动,1125 cm-1处的特征吸收峰对应于C-N的伸缩振动,1749 cm-1处的吸收峰属于C=O的伸缩振动,波数位于1508和1486 cm-1处的特征吸收峰为苯环的伸缩振动,750和708 cm-1处的吸收峰为苯环的单取代的面外C-H的弯曲振动[13-15],表明SCL-NPs已被成功制备。
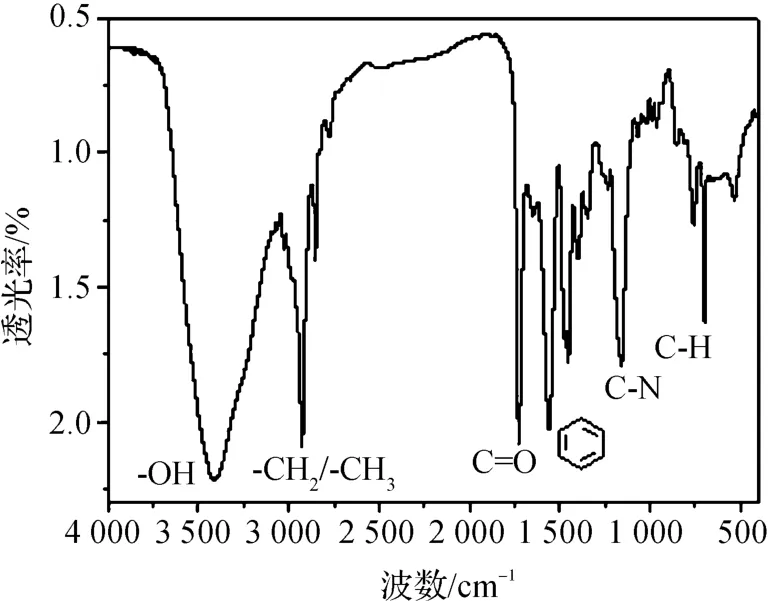
图3 SCL-NPs的红外谱图
2.4样品的DLS表征
图4为标准样品SCL-NPs和SCL-NPs-IND的粒径大小和粒径分布曲线。在25℃的温度下测试出该SCL-NPs的平均粒径为90.44 nm,其分布系数PDI为26.3%;而负载IND后的SCL-NPs的平均粒径为198.2 nm,其分布系数PDI为30.21%。从以上数据可看出SCL-NPs-IND的粒径有所增加,约为SCL-NPs粒径的两倍。
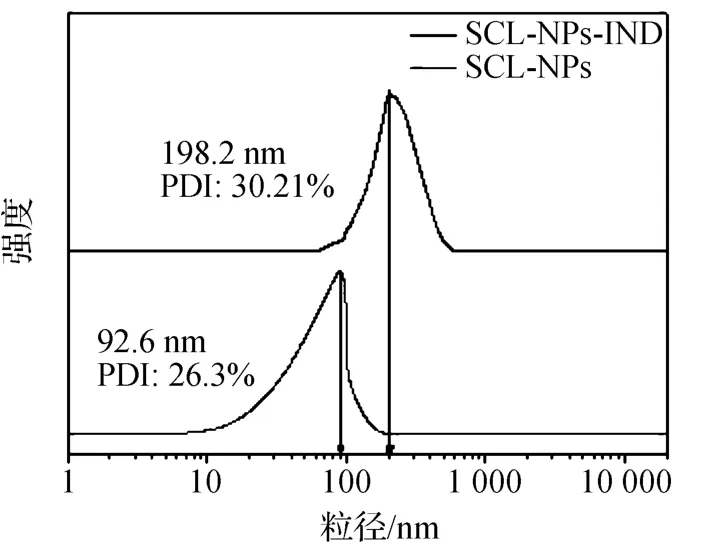
图4 SCL-NPs和SCL-NPs-IND在环己烷中分散的水动力直径分布图
2.5样品形貌
图5为SCL-NPs-IND(a)和SCL-NPs(b)的透射电子显微镜图。由图5可知:所有的样品均为椭球形并且都具有明显的核-壳结构,且SCL-NPs的粒径约为90 nm;负载IND之后,其粒径增加至195 nm左右。与图4中DLS表征结果基本吻合。

图5 SCL-NPs-IND和SCL-NPs的透射电子显微镜图
2.6SCL-NPs-IND的药物释放
SCL-NPs-IND的药物释放机理如图6所示。DTT作为还原剂可以打开SCL-NPs的双硫键,其交联壳层发生解聚,从而促进药物的释放。当p H<7时,PDMAEMA链段被质子化从而带正电,由于同种电荷相互排斥,PDMAEMA链段将会处于舒展状态,IND需要经过较长路程才能从SCL-NPs的核层迁移出来,即SCL-NPs在酸性条件下具有较小的药物释放速度。当p H≥7时,在去质子化的作用下PDMAEMA链段将塌缩在PS的交联核层上并在一定程度上挤压核层,则IND经过相对较短的路程从SCL-NPs的核层迁移出来,即碱性条件下SCL-NPs具有较大的药物释放速度[16-18]。此外,IND在碱性条件下具有较强的溶解性,易于从SCLNPs的核层迁移出来[19]。
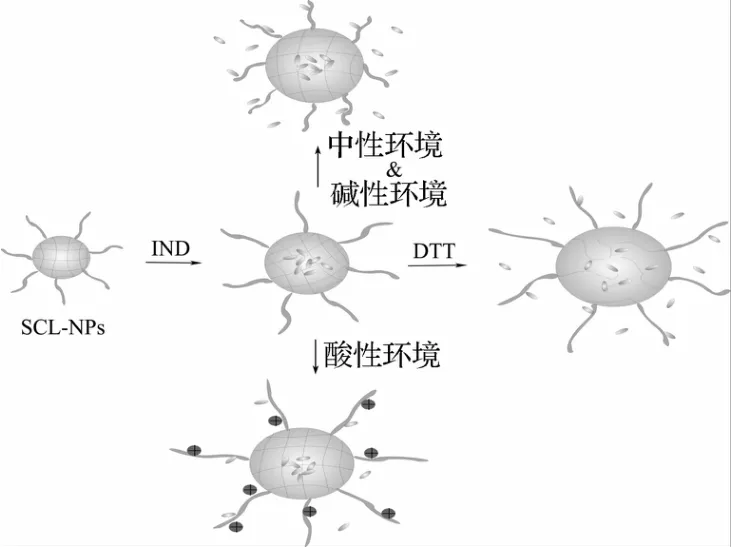
图6 SCL-NPs-IND的药物释放机制示意图
在SCL-NPs-IND的降解过程中,用紫外-可见分光光度计测试溶液在λ=320 nm处的吸光度,然后通过标准曲线计算出IND的释放量。根据文献报道[20],IND的浓度-吸光度标准方程为:
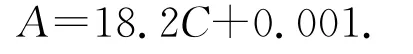
其中:A为紫外分光光度计在320 nm处测得的吸光度;C为溶液中IND的浓度(mg/mL)。
图7为SCL-NPs-IND在不同缓释条件下的药物释放曲线。从A、B、C图中可以看出,药物的释放具有p H敏感性并且DTT可以促进其释放。经过55 h的药物释放,在缓释介质中无DTT存在的情况下,SCL-NPs-IND在不同p H值时的药物释放率分别为:37%(p H=5.9)、42%(p H=6.8)、51%(p H=7.6);向缓释介质中加入10 mM DTT后,SCL-NPs-IND随p H值的增大不仅缓释速度显著加快,而且药物释放率也有所增加,分别为:55%(p H=5.9)、63%(p H=6.8)、72%(p H=7.6)。其中,在p H=7.6且缓释介质中含DTT的条件下的SCL-NPs-IND具有最快的药物释放速度和最大的药物释放率。从以上数据可以看出,DTT能够促进药物的释放,并且碱性条件下的药物释放速度大于酸性条件下的释放速度。
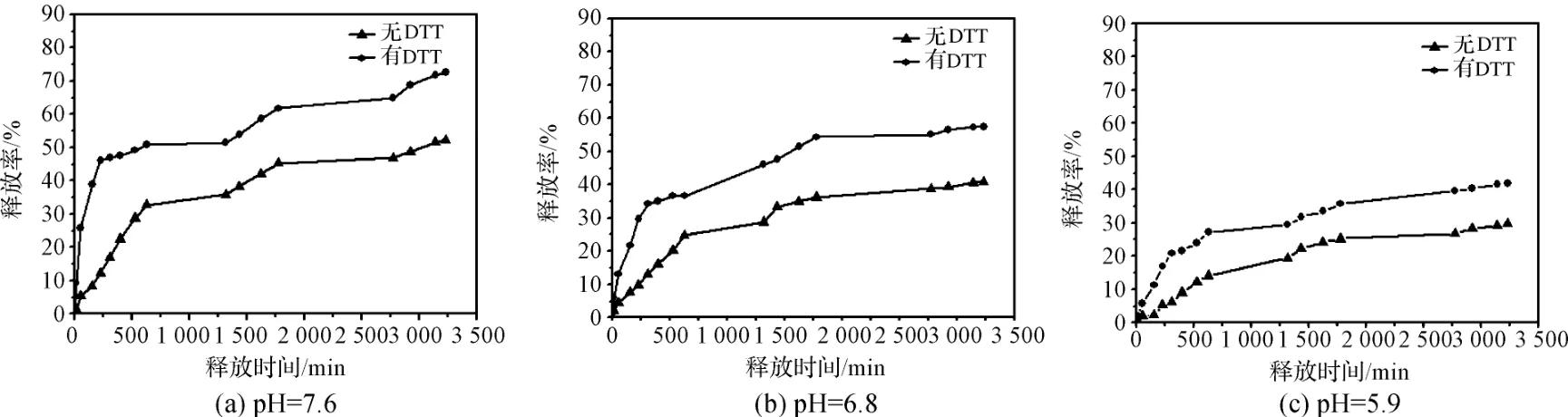
图7 SCL-NPs-IND的药物累积释放曲线
3 结 论
本实验通过无皂乳液RAFT一步聚合制备得到粒径均一、具有明确核壳结构并且能可控释放药物的SCL-NPs,其中引入还原敏感性交联剂BAC使所制SCL-NPs可发生解聚,并采用一步聚合的方法来简化实验流程。还考察了SCL-NPs-IND在不同缓释条件下的药物释放性能,结果显示DTT可以促进药物的释放,并且碱性条件下的释放速度明显大于酸性条件下的释放速度。因此,SCL-NPs作为药物载体可以进行细胞内药物可控释放。
[1]李乐道.药物控释制剂载体的研究进展[J].西北药学杂志,2011,26(3):229-232.
[2]张 玥,赵弘韬,张丽芳.高分子载体药物[J].黑龙江科技信息,2007(20):231-218.
[3]胡芳林.RAFT法制备具有温度响应性的聚合物及其在药物缓释中的应用[D].内蒙古:内蒙古大学,2014.
[4]Read ES,Armes SP.Recent advances in shell cross-linked micelles[J].Chem Commun,2007,43(29):3021-3035.
[5]邱 玲,蒲万芬,张 晶.改进型酚醛树脂交联剂的合成与成胶性能[J].精细石油化工进展,2011,12(8):15-18.
[6]Jiang X Z,Zhang G Y,Narain R,et al.Covalently stabilized temperature and p H responsive four-layer nanoparticles fabricated from surface clickable shell cross-linked micelles[J].Soft Matter,2009,5(7):1530-1538.
[7]李从妮.有机锆复合交联剂的制备及其交联性能研究[D].西安:西安石油大学,2011.
[8]张晓静,胡跃磊,李 翀,等.以纳米笼形POSS为交联剂的PHEMA水凝胶的制备及其对诺氟沙星的缓释行为[J].功能高分子学报,2014,27(3):296-301.
[9]Li Y T,Du J Z,Armes SP.Shell cross-linked micelles as cationic templates for the preparation of silica-coated nanoparticles:strategies for controlling the mean particle diameter[J].Macromol Rapid Commun,2009,30(6):464-468.
[10]张淑芳,马兴元,邱啸寒,等.热反应型水性聚氨酯交联剂的合成与应用[J].中国皮革,2013,42(19):37-40+44.
[11]王小红.环境敏感性聚合物的设计合成及其在药物控释中的应用研究[D].杭州:浙江理工大学,2013.
[12]Yu H,Grainger D W.Amphiphilic thermosensitive NIsopropylacrylamide terpolymer hydrogels prepared by micellar polymerization in aqueous media[J]. Macromolecule,1994,27(16):4554-4560.
[13]Atac A,Karaca C,Gunnaz S,et al.Vibrational(FTIR),electronic(UV-Vis),NMR(1H and13C)spectra and reactivity analyses of 4,5-dimethyl-ophenylenediamine[J].Spectrochim Acta Part A,2014,130:516-525.
[14]王 寅.还原敏感性壳交联药物载体的制备及其在药物控释上的应用研究[D].杭州:浙江理工大学,2012.
[15]Kumar A,Deval V,Tandon P,et al.Experimental and theoretical(FT-IR,FT-Raman,UV-Vis,NMR)spectroscopic analysis and first order hyperpolarizability studies of non-linear optical material:(2E)-3-[4-(methylsulfanyl)phenyl]-1-(4-nitrophenyl)prop-2-en-1-one using density functional theory[J].Spectroschim Acta Part A:2014,130:41-53.
[16]潘 涛,刘大伟,任随周,等.DTT对三苯基甲烷染料脱色的研究[J].环境科学,2012(3):866-870.
[17]Li G Y,Guo L,Ma S M,et al.Complex micelles formed from two diblock copolymersfor applications in controlled drug release[J].J Polym Sci Part A:Polym Chem,2009,47(7):1804-1810.
[18]Lin JP,Zhu JQ,Chen T,et al.Drug releasing behavior of hybrid micelles containing polypeptide triblock copolymer[J].Biomaterials,2009,30(1):108-117.
[19]Wu C L,Ma R J,He H,et al.Fabrication of complex micelles with tunable shell for application in controlled drug release[J].Macromol Biosci,2009,9(12):1185-1193.
[20]Jiang G H,Sun X K,Wang R J,et al.Synthesis of biomimetic hyperbranched zwitterionic polymers as targeting drug delivery carriers[J].J Appl Polym Sci,2013,128(5):3289-3294.
Preparation of Shell Cross-linked Drug Carriers by One-step RAFT Polymerization and Study on Controlled Release
JIANGGuo-huaa,ZHOU Hui-jieb,JIANG Teng-tenga,DU Xiang-xianga
(a.School of Material and Textiles;b.Qixin School,Zhejiang Sci-Tech University,Hangzhou 310018,China)
PDMAEMA-b-PS shell nano particles(SCL-NPs)were prepared by one-step RAFT polymerization using N,N’-bis(acryloyl)cystamine(BAC)as cross-linked agent.Indometacin-contained SCL-NPs(SCL-NPs-IND)was prepared by adding indometacin(IND)in SCL-NPs preparation process. The morphology,structure and properties of SCL-NPs were characterized by fourier transform infrared spectroscopy(FTIR),nuclear magnetic resonance spectrometer(NMR),transmission electron microscope(TEM)and dynamic light scattering analyzer(DLS).It was found that SCL-NPs had explicit core-shell structure and their shapes are rand;The drug release property of SCL-NPs-IND was investigated by ultraviolet-visible spectrophotometer(UV).The results indicated that the drug release rate could be accelerated with assistant of dithiothreitol(DTT).Thus,release rate under alkaline condition was greater than that under acidic condition.
RAFT;shell cross-linked;drug carriers;reduction sensitivity;controlled release
O631.3
A
1673-3851(2015)06-0800-05
(责任编辑:许惠儿)
2014-11-14
国家自然科学基金项目(51373155);国家大学生创新创业训练计划项目(201410338004)
江国华(1975-),男,浙江建德人,教授,主要从事功能高分子材料方面的研究。
