叶瓜参长链碱抑制3T3-L1前脂肪细胞分化作用机制
2015-10-29田迎樱王玉明王静凤薛长湖
毛 磊,徐 慧,田迎樱,徐 杰,王玉明,王静凤*,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
叶瓜参长链碱抑制3T3-L1前脂肪细胞分化作用机制
毛磊,徐慧,田迎樱,徐杰,王玉明,王静凤*,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛266003)
目的:研究叶瓜参长链碱(long-chain base from the sea cucumber Cucumaria frondosa,Cf-LCB)对3T3-L1前脂肪细胞分化的作用,并探 讨其作用机制。方法:以四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测Cf-LCB对3T3-L1前脂肪细胞增殖活性的影响;采用传统鸡尾酒法诱导3T3-L1前脂肪细胞分化为成熟脂肪细胞,分别采用油红O染色和甘油三酯(triglycerides,TG)含量测定法评价其对3T3-L1前脂肪细胞分化的影响;反转录实时荧光定量聚合酶链式反应(quantity real-time reverse transcript polymerase chain reaction,qRT-PCR)法检测脂肪细胞分化关键基因CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα)、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors gamma,PPARγ)以及WNT/β-catenin通路关键基因WNT10b(wingless-type MMTV integration site family members)、卷曲蛋白1(frizzled protein1,FZ1)、低密度脂蛋白受体相关蛋白6(LDL-receptor-related protein6,LRP6)和β-连环蛋白(β-catenin)的mRNA表达水平;Western blotting法检测WNT/β-catenin通路关键基因LRP6和β-catenin的蛋白表达量。结果:Cf-LCB能显著抑制3T3-L1前 脂肪细胞的增殖;抑制3T3-L1细胞脂滴形成以及C/EBPα和PPARγ mRNA表达;显著上调WNT/β-catenin通路关键基因FZ1、LRP6和β-catenin mRNA表达,对WNT10b的表达无影响;显著促进LRP6和β-catenin的蛋白表达,提高核内β-catenin含量。结论:Cf-LCB能够显著抑制3T3-L1前脂肪细胞分化,其作用机制与激活WNT/β-catenin通路有关。
叶瓜参;长链碱;3T3-L1前脂肪细胞;分化;WN T/β-catenin信号通路
肥胖是胰岛素抵抗、2型糖尿病和心血管疾病等代谢综合征的共同诱因,给人类健康和社会发展带来严重危害[1]。研究表明,脂肪细胞过度分化是引起肥胖的重要原因[2],因此,控制脂肪细胞分化是预防和治疗肥胖的重要途径。Ahn等[3]研究发现WNT/β-catenin通路是脂肪细胞分化的“总开关”,WNT/β-catenin通路被激活后,最终通过抑制转录调控因子CCAAT增强子结合蛋白α(CCAAT/ enhancer binding protein alpha,C/EBPα)和过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptors gamma,PPARγ)的表达抑制脂肪细胞分化。
长链碱(long-chain base,LCB)是鞘脂的特征性结构,属于最简单的鞘脂类化合物[4]。海洋无脊椎动物的LCB更易被机体吸收,且具有更强的生理活性[5]。目前国内外关于海参LCB的研究较少,主要发现其具有抗肿瘤[6-7]、改善糖脂代谢[4]功能。然而,关于海参长链 碱对脂肪细胞功能影响的研究尚未见报道。
不同海参中鞘脂含量差异较大,有研究表明,叶瓜参是鞘脂含量较高的物种,可作为制备LCB的原料[8]。徐杰[9]通过液相色谱-质谱联用仪分析确认叶瓜参长链碱(long-chain base from the sea cucumber Cucumaria frondosa,Cf-LCB)主要包括d18∶2、d17∶1、d18∶3和d19∶34 种,其相对分子质量范围为238.4~320.5。本实验从叶瓜参中制备得长链碱,研究Cf-LCB对3T3-L1前脂肪细胞增殖和分化的作用,并对其作用机制进行探讨,为叶瓜参长链碱的进一步开发利用提供理论依据,为预防和治疗肥胖等代谢综合征药物的筛选提供科学依据。
1 材料与方法
1.1材料
叶瓜参(Cucumaria frondosa)干品,购自青岛市南山水产市场;3T3-L1前脂肪细胞株,购自美国模式培养物保藏所(American Type Culture Collection,ATCC)。
1.2试剂
DMEM培养基美国Gibco公司;胎牛血清(fetal bovine serum,FBS)美国Hyclone公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松(dexamethasone,DEX)、胰岛素、油红O染料、胰蛋白酶美国Sigma公司;乳酸脱氢酶(lactic dehydrogenase,LDH)活性检测试剂盒南京建成生物工程研究所;甘油三酯(triglycerides,TG)测定试剂盒北京Aibio公司;Trizol美国Invitrogen公司;M-MLV逆转录酶日本TaKaRa公司;SYBR Green荧光染料瑞士Roche公司;C/EBPα抗体、PPARγ抗体美国Abcam公司;30%丙烯酰胺、四甲基乙二胺(tetramethylethylenediamine,TEMED)、RIPA裂解液、牛血清白蛋白(bovine serum albumin,BSA)北京索莱宝科技有限公司;超敏发光液北京普利莱基因有限公司;脱脂牛奶美国BD公司;所有检测基因引物均由生工生物工程(上海)股份有限公司合成;其他试剂均为国产分析纯。
1.3仪器与设备
2711型CO2培养箱德国Heraeus公司;DL-CJ-1N型超净工作台北京东联哈尔仪器制造有限公司;IX51型倒置显微镜日本Olympus公司;HH-8型数显恒温水浴锅金坛市双捷实验仪器厂;iQ5型实时荧光定量聚合酶链式反应(quantity real-time polymerase chain reaction,qPCR)仪、680型酶标仪美国Bio-Rad公司;DYCP-40C型半干型转膜工作仪、WD-9405A型脱色摇床北京六一仪器厂;EPS 600型电泳仪上海天能科技有限公司;PVDF膜美国Milipore公司;JS-780型全自动凝胶成像分析仪上海培清科技有限公司;Laborota 4000型旋转蒸发仪德国Heidolph公司;1260型高效液相色谱仪美国Agilent公司。
1.4方法
1.4.1Cf-LCB的制备
称取1 kg叶瓜参粉末,用4.5 L氯仿-甲醇(2∶1,V/V)浸提12 h,过滤。反复浸提3 次,合并浸提液,并旋转蒸发至干,得脂质粗提物。将脂质粗提物经4 mol/L KOH在37 ℃条件下皂化1 h,冷却后用氯仿萃取3 次(氯仿、甲醇、水的体积比为2∶1∶0.9),收集下层组分,减压浓缩至干。然后,用1 mol/L盐酸80 ℃酸解反应16 h,冷却后用相同体积的正己烷萃取3 次,舍弃正己烷相,并调pH值至10。最后以0.5 倍体积乙醚萃取得到长链碱粗提物。采用正向硅胶柱层析法分离得到较纯的Cf-LCB。经高效液相色谱法分析,其纯度在86%以上。实验前,Cf-LCB溶解于DMSO中,且细胞培养液中DMSO的终体积分数小于0.1%。
1.4.23T3-L1前脂肪细胞的培养与分化
3T3-L1前脂肪细胞培养于含有体积分数10% FBS、100 μg/mL链霉素以及100 U/mL青霉素的DMEM培养基中,以0.25%胰酶消化传代,于37 ℃、5% CO2且相对湿润的孵箱中常规传代贴壁培养。
取对数生长期的3T3-L1前脂肪细胞,以2×104个/孔接种于24 孔板中。待细胞融合后接触抑制48 h(记为分化第0天),将细胞培养液换为含有0.5 mmol/L IBMX、1 μmol/L DEX、10 μg/mL胰岛素和10% FBS的DMEM培养基。培养48 h后,再换用含10 μg/mL胰岛素和10% FBS的DMEM培养基培养48 h。以后每2 d更换1 次完全培养液(含10% FBS的DMEM培养基),并于第8天检测脂肪含量。
1.4.3Cf-LCB对3T3-L1前脂肪细胞增殖活性的影响
取对数生长期的3T3-L1前脂肪细胞,以2×103个/孔接种于96 孔板中。贴壁培养24 h后弃培养基,将细胞分为对照组和Cf-LCB低、中、高剂量组,其中对照组不添加Cf-LCB,Cf-LCB低、中、高剂量组中Cf-LCB的含量分别为25、50、100 μg/mL,每组4 个复孔,每孔200 μL。培养96 h后,采用MTT法测定各处理组细胞在570 nm波长处吸光度(A570nm),按照下式计算细胞增殖率。
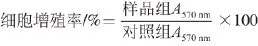
1.4.4Cf-LCB对3T3-L1前脂肪细胞培养上清液中乳酸脱氢酶活性的影响
细胞接种及加样方法同1.4.3节。3T3-L1前脂肪细胞经Cf-LCB作用96 h后,收集细胞培养上清液,采用试剂盒说明书方法测定上清液中LDH活性。
1.4.5Cf-LCB对3T3-L1前脂肪细胞分化的影响
3T3-L1前脂肪细胞以2×104个/孔接种于24 孔板中,按1.4.2节所述方法诱导细胞分化,在细胞分化第0天将细胞分为对照组和Cf-LCB低、中、高剂量组,加样量同1.4.3节。将分化第8天的脂肪细胞用10%多聚甲醛固定1 h,0.5%油红O染色30 min后,于倒置显微镜下观察并拍照。拍照结束后,每孔加入800 μL异丙醇溶解与脂肪细胞结合的油红O染液,并于490 nm波长处测定吸光度,半定量检测脂肪细胞内的脂肪含量。
1.4.6脂肪细胞中TG含量测定
3T3-L1前脂肪细胞以2×104个/孔接种于24 孔板中,按1.4.2节所述方法诱导细胞分化。至分化第8天,将脂肪细胞以0.5% BSA饥饿处理12 h,将细胞分为对照组和Cf-LCB低、中、高剂量组,加样量同1.4.3节。继续培养48 h后,用冰预冷的裂解液裂解细胞30 min,收集细胞裂解液,离心后收集上清液,采用试剂盒测定上清液中TG及蛋白质含量。细胞中TG含量表示为TG质量/蛋白质质量(mg/mg)。
1.4.7qRT-PCR法检测脂肪细胞分化关键基因C/EBPα、PPARγ和WNT/β-catenin通路关键基因WNT10b、FZ1、LRP6、β-catenin mRNA的表达
3T3-L1前脂肪细胞以4.5×104个/孔接种于6 孔板中,按1.4.2节所述方法诱导细胞分化,于分化第0天时,分为对照组和Cf-LCB高剂量组(100 μg/mL)。分别至分化第0、2、4、8天时,采用Trizol法提取细胞中RNA。每组取1 μg RNA逆转录成cDNA,以逆转录得到的cDNA为模板,qRT-PCR法检测C/EBPα、PPARγ、WNT10b(wingless-type MMTV integration site family members)、卷曲蛋白1(frizzled protein1,FZ1)、低密度脂蛋白受体相关蛋白6(LDL-receptor-related protein6,LRP6)和β-连环蛋白(β-catenin)的mRNA表达。以β-actin作为内参校正基因,基因的相对表达量以目的基因表达量/ β-actin表达量表示,引物序列见表1。

表1 3T3-L1前脂肪细胞分化和WNT/ -catenin通路关键基因引物序列Table 1 Primer sequences of the key factors for adipocytes differentiation and WNT/ -catenin pathway
1.4.8Western blotting法检测WNT/β-catenin通路关键基因蛋白表达
3T3-L1前脂肪细胞以4.5×104个/孔接种于6 孔板中,按1.4.2节所述方法诱导细胞分化,于分化第0天时,分为对照组和Cf-LCB高剂量组(100 μg/mL)。于分化第4天时,提取细胞内总蛋白和细胞核蛋白。采用Western blotting法测定LRP6、β-catenin的蛋白表达量。以β-actin作为总蛋白内参,TATA结合蛋白(TATA-binding protein,TBP)为核蛋白内参,蛋白质的相对表达以目的蛋白表达量/β-actin(TBP)表达量表示。
1.5数据统计分析
2 结果与分析
2.1Cf-LCB对3T3-L1前脂肪细胞增殖的影响
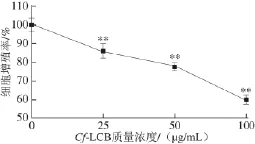
图1 1 CfCf-LCB对3T3-L1前脂肪细胞增殖活性的影响Fig.1 Effect of Cf-LCB on the proliferation of 3T3-L1 preadipocytes
由图1可知,Cf-LCB作用96 h后,能极显著抑制3T3-L1前脂肪细胞的增殖(P<0.01),平均抑制率为20.07%。
2.2Cf-LCB对3T3-L1前脂肪细胞的毒性作用
LDH广泛存在于所有组织细胞的胞质中,当细胞膜结构受到损伤时,细胞质中的LDH会释放到培养液中[10],因此,测定培养液中LDH活性可以反映受试物对细胞的损伤情况[11]。由图2可知,Cf-LCB对3T3-L1前脂肪细胞培养上清液中LDH活性无显著影响,说明其对3T3-L1前脂肪细胞无毒性作用,进一步证明了Cf-LCB对3T3-L1前脂肪细胞的增殖具有抑制作用。

图2 2 CfCf-LCB对3T3-L1前脂肪细胞培养上清液中LDH活性的影响Fig.2 Effect of Cf-LCB on the activity of LDH in the supernatant of 3T3-L1 preadipocytes
2.3Cf-LCB对3T3-L1前脂肪细胞分化的影响
油红O是一种脂溶性染料,可特异性地使细胞中的中性脂肪着色。油红O染色结果显示(图3),从分化第0天开始加样,Cf-LCB能显著地降低3T3-L1成熟脂肪细胞数目及脂肪细胞中脂滴含量。半定量结果显示,Cf-LCB对3T3-L1前脂肪细胞分化的平均抑制率为29.05%(P<0.01)。

图3 3 CfCf-LCB对3T3-L1前脂肪细胞分化的影响Fig.3 Effect of Cf-LCB on the differentiation of 3T3-L1 preadipocytes
2.4Cf-LCB对已分化的3T3-L1前脂肪细胞TG含量的影响

图4 4 CfCf-LCB对已分化的3T3-L1前脂肪细胞脂质积累的影响Fig.4 Effect of Cf-LCB on the lipid accumulation of differentiated 3T3-L1 adipocytes
如图4所示,与对照组相比,Cf-LCB能显著降低细胞中TG含量,且剂量-效应关系明显,Cf-LCB剂量组TG含量平均降低20.44%(P<0.01)。
2.5Cf-LCB对3T3-L1前脂肪细胞分化关键基因C/EBPα和PPARγ mRNA相对表达量的影响

图5 分化不同时期CCff--LLCCBB对 C/EEBBPPα、PPPPAARRγ mRNA相对表达量的影响Fig.5 Effect of Cf-LCB on mRNA expression of C/EBPα and PPARγ at different differentiation stages of 3T3-L1 preadipocytes
由图5可知,随着脂肪细胞分化过程的进行,C/EBPα和PPARγ的mRNA相对表达量逐渐升高,且PPARγ mRNA的相对表达量在分化第4天时达到最大。经Cf-LCB干预后,C/EBPα mRNA的相对表达量在第4天和第8天分别降低了35.34%和50.00%(P<0.01);PPARγ mRNA的相对表达量在第4天和第8天分别降低了53.18%和47.71%(P<0.01)。
2.6Cf-LCB对WNT/β-catenin通路关键基因mRNA表达量的影响
由图6可知,随着3T3-L1前脂肪细胞分化过程的进行,WNT10b、FZ1、LRP6和β-catenin的mRNA相对表达量均呈下降趋势。加入Cf-LCB干预后,FZ1、LRP6和β-catenin的mRNA相对表达量极显著升高(P<0.01)。在分化的第4天,FZ1、LRP6和β-catenin的mRNA相对表达量分别升高了39.00%、52.68%和56.98%,在分化的第8天,FZ1、LRP6和β-catenin的mRNA相对表达量分别升高了25.80%、39%和137.11%。加入Cf-LCB干预后,WNT10b mRNA的相对表达量较对照组无显著性变化,均处于较低水平。

图6 分化不同时期CCff-LCB对WWNNTT//β-catenin通路关键基因mRRNNAA相对表达量的影响Fig.6 Effect of Cf-LCB on mRNA expressions of the key factors for WNT/β-catenin pathway at different differentiation stages of 3T3-L1 preadipocytes
2.7Cf-LCB对WNT/β-catenin通路关键基因蛋白表达的影响
LRP6和β-catenin是WNT/β-catenin通路的重要组成部分,也是脂肪细胞分化的重要负调控因子。上述实验已经证明在脂肪细胞分化第4天时,Cf-LCB增强WNT/ β-catenin通路的作用效果最佳。为了进一步验证Cf-LCB对WNT/β-catenin的影响,本实验测定了分化第4天时,100 μg/mL Cf-LCB对LRP6和β-catenin蛋白表达的影响。如图7所示,Cf-LCB能显著促进LRP6和β-catenin蛋白表达(P<0.01)。与对照组细胞相比,经100 μg/mL Cf-LCB干预后,LRP6和β-catenin蛋白的相对表达量分别升高了286.84%和55.40%。WNT/β-catenin通路激活后,β-catenin在细胞质中积累并转移到细胞核中调控与脂肪细胞分化有关基因的表达。如图7c所示,Cf-LCB能显著促进细胞核内β-catenin的含量。100 μg/mL Cf-LCB作用后的细胞,其细胞核内β-catenin的含量比对照组增加了46.97%(P<0.01)。

图7 分化第4天 时CCff-LCB对WWNNTT//β-catenin通路关键基因蛋白表达的影响Fig.7 Effect of Cf-LCB on protein expression in WNT/β-catenin pathway at day 4 of differentiation
3 讨 论
脂肪细胞在机体能量代谢及平衡中发挥着重要作用[1]。脂肪细胞分化是细胞数量增加、体积增大及TG累积的过程[12]。研究表明,脂肪细胞分化过程紊乱可能是诱发肥胖及其他代谢综合征的一个重要原因[13]。本实验以3T3-L1前脂肪细胞为研究对象,考察了Cf-LCB对其分化的影响。结果表明,Cf-LCB能显著抑制3T3-L1前脂肪细胞的增殖,降低3T3-L1成熟脂肪细胞数目及脂肪细胞中脂滴含量,减少TG在脂肪细胞内的积累,提示其具有潜在的抗肥胖功效。
C/EBPα和PPARγ主要存在于脂肪细胞中,是脂肪细胞分化的两个最重要的转录调控因子[14]。研究证明,在没有任何外界激素的刺激下,C/EBPα的激活可以单独诱导脂肪细胞的分化[15]。PPARγ是唯一被证明在脂肪细胞分化中必不可少的转录调控因子,功能丧失实验证明PPARγ在脂肪细胞分化中是不可取代的[16]。本研究结果表明,Cf-LCB能显著抑制C/EBPα和PPARγ的表达,证明其对脂肪细胞分化具有抑制作用。
WNT/β-catenin通路在细胞增殖及分化中发挥重要作用,研究发现,在脂肪组织中激活WNT/β-catenin通路,不仅会引起脂肪细胞分化受阻,甚至导致成熟脂肪细胞去分化[17]。WNT10b是参与WNT/β-catenin通路的主要WNT蛋白,WNT10b与前脂肪细胞细胞膜上的FZ受体及LRPs辅助受体结合可导致WNT/β-catenin通路被激活[18]。WNT10b在前脂肪细胞中高表达,而随着脂肪细胞分化的进行,其表达量急剧降低,与脂肪含量成负相关[19],本实验结果与此结论一致。FZ及LRPs对于WNT/ β-catenin通路也具有重要的调控作用[20]。研究表明,LRP6缺失型小鼠胚胎可以自发地诱导脂肪细胞分化[21]。体外添加FZ的抑制剂可以在没有任何外界刺激的情况下诱导3T3-L1细胞分化为成熟脂肪细胞[3]。本研究发现,Cf-LCB可以显著增强FZ1和LRP6的表达,这提示Cf-LCB可能通过提高FZ1及LRP6的表达而激活WNT/β-catenin通路。WNT/β-catenin通路被激活后,细胞质中的β-catenin积累并转移到细胞核中[22]。作为WNT/β-catenin通路的关键因子,β-catenin的高表达对于抑制脂肪细胞分化具有重要作用[23]。本研究发现,Cf-LCB增强了β-catenin的表达,并促进其向细胞核转移,这提示Cf-LCB通过激活WNT/β-catenin通路抑制脂肪细胞分化。
综上所述,Cf-LCB通过上调WNT/β-catenin通路中关键受体FZ1和LRP6的表达启动WNT/β-catenin通路,并通过提高β-catenin的表达及稳定性,从而增强β-catenin向细胞核转移及转录活性,抑制C/EBPα和PPARγ的表达,进而抑制3T3-L1前脂肪细胞向成熟脂肪细胞分化。
[1]KIM C K, KIM M, OH S D, et al. Effects of Atractylodes macrocephala Koidzumi rhizome on 3T3-L1 adipogenesis and an animal model of obesity[J]. Journal of Ethnopharmacology, 2011,137(1): 396-402.
[2]陈瑾, 周训伦, 陈洁. 前脂肪细胞分化与肥胖形成关系初探[J]. 中华中医药学刊, 2007, 25(4): 735-736.
[3]AHN J, LEE H, KIM S, et al. Curcumin-induced suppression of adipogenic differentiation is accompanied by activation of Wnt/ β-catenin signaling[J]. American Journal of Physiology-Cell Physiology, 2010, 298(6): C1510-C1516.
[4]高壮, 周鑫, 胡晓倩, 等. 海参脑苷脂及其长链碱基对肥胖小鼠脂代谢和糖代谢的影响[J]. 浙江大学学报: 医学版, 2012, 41(1): 60-64.
[5]YAMADA K, HARA E, MIYAMOTO T, et al. Isolation and structure of biologically active glycosphingolipids from the sea cucumber Cucumaria echinata[J]. European Journal of Organic Chemistry, 1998,1998(2): 371-378.
[6]杜磊. 海参和海星脑苷脂抗肿瘤及改善癌症恶病质作用的研究[D].青岛: 中国海洋大学, 2012: 17-18.
[7]SUGAWARA T, ZAIMA N, YAMAMOTO A, et al. Isolation of sphingoid bases of sea cucumber cerebrosides and their cytotoxicity against human colon cancer cells[J]. Bioscience, Biotechnology, and Biochemistry, 2006, 70(12): 2906-2912.
[8]武凤娟. 海参脑苷脂和海参磷脂对阿尔兹海默症的改善作用研究[D].青岛: 中国海洋大学, 2014: 13-18.
[9]徐杰. 海参脑苷脂的分离纯化、结构分析及活性的初步研究[D]. 青岛: 中国海洋大学, 2011: 28-80.
[10] 文先杰, 徐世元, 郑雪琴, 等. 不同浓度利多卡因对SH-SY5Y细胞乳酸脱氢酶及Caspase-3表达的影响[J]. 中国新药杂志, 2012, 21(24):2941-2943.
[11] PRESTWICH T C, MACDOUGALD O A. Wnt/β-catenin signaling in adipogenesis and metabolism[J]. Current Opinion in Cell Biology,2007, 19(6): 612-617.
[12] 龙腾腾, 王静凤, 常耀光, 等. 海地瓜硫酸软骨素对3T3-L1前脂肪细胞增殖和分化的影响[J]. 中国药理学通报, 2013, 29(5): 708-713.
[13] 鞠大鹏, 詹丽杏. 脂肪细胞分化及其调控的研究进展[J]. 中国细胞生物学学报, 2010, 32(5): 690-695.
[14] WHITE U A, STEPHENS J M. Transcriptional factors that promote formation of white adipose tissue[J]. Molecular and Cellular Endocrinology, 2010, 318(1): 10-14.
[15] DARLINGTON G J, ROSS S E, MACDOUGALD O A. The role of C/EBP genes in adipocyte differentiation[J]. Journal of Biological Chemistry, 1998, 273(46): 30057-30060.
[16] SEO J B, MOON H M, KIM W S, et al. Activated liver X receptors stimulate adipocyte differentiation through induction of peroxisome proliferator-activated receptor γ expression[J]. Molecular and Cellular Biology, 2004, 24(8): 3430-3444.
[17] GUSTAFSON B, SMITH U. Activation of canonical wingless-type MMTV integration site family (Wnt) signaling in mature adipocytes increases β-catenin levels and leads to cell dedifferentiation and insulin resistance[J]. Journal of Biological Chemistry, 2010,285(18): 14031-14041.
[18] LEE H, BAE S, YOON Y. Anti-adipogenic effects of 1,25-dihydroxyvitamin D3 are mediated by the maintenance of the wingless-type MMTV integration site/β-catenin pathway[J]. International Journal of Molecular Medicine, 2012, 30(5): 1219-1224.
[19] LEFTEROVA M I, LAZAR M A. New developments in adipogenesis[J]. Trends in Endocrinology & Metabolism, 2009, 20(3):107-114.
[20] WANG Xinluan, WANG Nan, ZHENG Lizhen, et al. Phytoestrogenic molecule desmethylicaritin suppressed adipogenesis via Wnt/β-catenin signaling pathway[J]. European Journal of Pharmacology, 2013,714(1): 254-260.
[21] ČERVENKA I, WOLF J, MA.EK J, et al. Mitogen-activated protein kinases promote WNT/β-catenin signaling via phosphorylation of LRP6[J]. Molecular and Cellular Biology, 2011, 31(1): 179-189.
[22] NAKAMURA Y, HINOI E, IEZAKI T, et al. Repression of adipogenesis through promotion of Wnt/β-catenin signaling by TIS7 up-regulated in adipocytes under hypoxia[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2013, 1832(8): 1117-1128.
[23] SHIMBA S, WADA T, HARA S, et al. EPAS1 promotes adipose differentiation in 3T3-L1 cells[J]. Journal of Biological Chemistry,2004, 279(39): 40946-40953.
Suppressive Effect of Long-Chain Base from Sea Cucumber Cucumaria frondosa on the Differentiation of 3T3-L1 Preadipocytes and Underlying Mechanism
MAO Lei, XU Hui, TIAN Yingying, XU Jie, WANG Yuming, WANG Jingfeng*, XUE Changhu
(College of Food Science and Engineering, Ocean University of China, Qingdao266003, China)
The aim of the present study was to observe the effect of Cf-LCB on the proliferation and differentiation of 3T3-L1 preadipocytes and to investigate the possible underlying mechanism. The effect of Cf-LCB on the proliferation of 3T3-L1 preadipocytes was evaluated by MTT assay. After using differentiation cocktail to differentiate 3T3-L1 preadipocytes, the effect of Cf-LCB on the differentiation of 3T3-L1 preadipocytes was evaluated by oil red O-staining and determining TG content. mRNA expression levels of key genes associated with differentiation and WNT/β-catenin signal pathway in 3T3-L1 preadipocytes were measured by qRT-PCR. Expression levels of key prote ins in WNT/β-catenin signal pathway were measured by Western blotting. Results showed that Cf-LCB significantly inhibited the proliferation o f 3T3-L1 preadi pocytes, prevented the formation of lipid droplets in mature 3T3-L1 adipocytes and down-regulated C/EBPα and PPARγ. The mRNA expression of FZ1, LRP6 and β-catenin was distinctly enhanced by Cf-LCB, suggesting activation of WNT/β-catenin pathway. The increased protein expressions of key factors in WNT/β-catenin pathway including LRP6,total and nuclear β-catenin further demonstrated that Cf-LCB could markedly suppress the proliferation and differentiation of 3T3-L1 preadipocytes by activating WNT/β-catenin pathway.
Cucumaria frondosa; long-chain base; 3T3-L1 preadipocytes; adipogenesis; WNT/β-catenin signal pathway
R282.77
A
1002-6630(2015)23-0241-06
10.7506/spkx1002-6630-201523044
2015-06-25
国家自然科学基金面上项目(31371876;31201329)
毛磊(1991—),女,硕士研究生,研究方向为海洋生物活性物质。E-mail:1164161817@qq.com
王静凤(1964—),女,教授,博士,研究方向为海洋生物活性物质及分子营养学。E-mail:jfwang@ouc.edu.cn
