毛霉发酵豆粕工艺条件的优化
2015-10-29潘进权刘玉婷刘夏婷
潘进权,刘玉婷,刘夏婷
(岭南师范学院生命科学与技术学院,广东 湛江 524048)
毛霉发酵豆粕工艺条件的优化
潘进权,刘玉婷,刘夏婷
(岭南师范学院生命科学与技术学院,广东 湛江524048)
为探讨豆粕固态发酵同步制备多肽及可溶性膳食纤维的工艺条件,选用雅致放射毛霉AS3.2778为发酵菌株,采用响应面分析方法考察了影响发酵工艺的若干因素,并对发酵工艺条件进行了优化。由此确定了最佳的毛霉固态发酵豆粕的工艺条件:豆粕发酵培养基中添加质量分数3%木糖、0.3% KH2PO4、0.1%吐温-80、0.39% CaCl2,含水量52.7%,初始pH 5.68,27 ℃发酵3 d。在优化的工艺条件下,毛霉发酵豆粕可实现多肽及可溶性膳食纤维的同步高效转化,其得率分别可达到16.1%与18.5%。结果表明毛霉固态发酵豆粕同步制备多肽及可溶性膳食纤维的生产工艺具有可行性。
毛霉;豆粕;固态发酵;多肽;可溶性膳食纤维
豆粕是大豆经榨油后产出的一种副产物,是大豆除去油脂及脂溶性成分后的残渣,因保留了大豆中原有的大量营养成分,尤其是富含蛋白质及膳食纤维等,因此它是一种优良的食品加工原料,具有较好的应用潜力[1]。然而,豆粕中除含有丰富的营养成分外,还共存有多种抗营养因子,如大豆抗原蛋白、蛋白酶抑制剂及植酸等[2-3]。这些抗营养因子在很大程度上限制了豆粕中有效营养成分的利用。因此,关于豆粕资源的开发利用较多的研究停留在如何解除其抗营养因子,提高其生物利用率方面[4-5]。
已有大量研究表明,大豆蛋白质经水解制备所得的多肽具有优于蛋白质及混合氨基酸的营养价值[6-7],而且具有一定的生理保健功能,因此大豆多肽已成为保健食品领域的重要功能因子[8-10]。此外,来源于大豆的大豆膳食纤维,尤其是可溶性膳食纤维(soluble dietary fiber,SDF)因具有多重保健意义,已成为众多保健食品的重要原材料[11-12]。因此,开展豆粕向多肽及可溶性膳食纤维的转化研究对于消除豆粕抗营养因子,提高豆粕的利用率及附加值有更重要的意义[13-14]。
毛霉因含有丰富的胞外酶系,包含有多种蛋白酶及纤维素酶[15-16],其在大豆蛋白水解及膳食纤维制备方面已有良好的表现[17-19],针对毛霉这一特点,本研究开展了毛霉固态发酵制备多肽及可溶性膳食纤维的工艺研究,以对工艺的可行性进行分析。
1 材料与方法
1.1材料
豆粕湛江渤海农业发展有限公司。
1.2菌种与培养基
毛霉(Actinomucor elegans)AS3.2778岭南师范学院酶工程实验室保藏菌种。
斜面培养基:采用PDA培养基。种子培养基:采用麸皮培养基,每支三角瓶中装入干麸皮10 g,加水10 mL,搅拌均匀后在121 ℃条件下灭菌20 min,冷却后备用。
豆粕基础发酵培养基:在每支250 mL的三角瓶中装入干豆粕20 g,加入20 mL水,搅拌均匀灭菌后备用。
1.3方法
1.3.1种子活化
从已活化的试管斜面菌种挑取一环孢子转接到麸皮种子培养基上,充分混匀后将其放置在生化培养箱内,28 ℃恒温培养3 d。
1.3.2毛霉孢子悬浮液的制备
向已培养好的麸皮种子中加入无菌水100 mL,充分摇匀后用4 层无菌纱布过滤,收集所得的滤液即为毛霉孢子悬浮液。
1.3.3豆粕发酵实验
在每支已灭菌后的三角瓶发酵培养基中接入1 mL孢子悬浮液,旋摇三角瓶使之充分混匀,然后将三角瓶放置在生化培养箱中28 ℃恒温培养3 d。
1.3.4发酵豆粕中SDF的提取及得率计算
SDF的提取[19]:发酵结束后,将三角瓶中发酵好的豆粕分散在600 mL蒸馏水中(固液比为1∶30(m/V)),调pH值到4.0,在80 ℃恒温水浴锅中加热120 min,抽滤得到滤液。加入4 倍滤液体积的无水乙醇,静置30 min,抽滤,并用80%乙醇洗涤滤渣,所得滤渣即为可溶性膳食纤维。将滤渣置于烘箱中105 ℃烘干至恒质量并称质量,根据下式计算SDF得率。
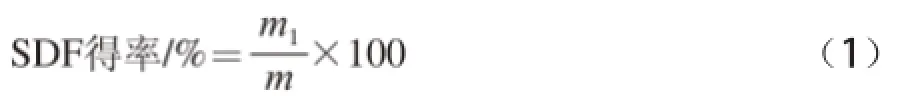
式中:m1为发酵豆粕提取得到的可溶性膳食纤维的质量/g;m为发酵豆粕中原干豆粕的质量/g。
1.3.5发酵豆粕中多肽的提取及得率计算
发酵豆粕中多肽含量的检测参照酸溶蛋白含量的测定方法[20],准确称取发酵豆粕10 g于100 mL烧杯中,准确加入15%三氯乙酸溶液50 mL混合均匀,静置5 min,将提取物转移至离心管,在4 000 r/min离心10 min,其上清液10 mL于消化管中,按半微量凯氏定氮法测定粗蛋白质含量,即为多肽的含量,根据下式计算多肽得率。

式中:m2为发酵豆粕提取所得多肽的总质量/g;m为发酵豆粕中原干豆粕的质量/g。
1.3.6单因素试验
培养基中成分强化物对毛霉发酵豆粕的影响:在基础发酵培养基中以干豆粕为基准分别添加质量分数3%的碳源(分别为蔗糖、果糖、葡萄糖、麦芽糖、木糖)、质量分数0.3%的无机盐(分别为ZnSO4、FeSO4、MnSO4、MgCl2、CaCl2、NaCl)、质量分数0.5%的无机盐(分别为KH2PO4、K2HPO4)及质量分数0.1%的吐温-80,其他成分保持不变,进行固体发酵,由此考察若干成分强化物对毛霉发酵豆粕的影响。
培养基初始pH值对毛霉发酵豆粕的影响:在控制发酵培养基成分及总含水量不变的前提下,分别调节其初始pH值至3.5~8.5的范围,然后按1.3.3节进行发酵试验,由此考察培养基初始pH值对毛霉发酵豆粕的影响。
培养基含水量对毛霉发酵豆粕的影响:分别调节发酵培养基的含水量到35%~80%范围,然后按1.3.3节进行固体发酵试验,考察培养基含水量对毛霉发酵豆粕的影响。
发酵温度对毛霉发酵豆粕的影响:采用基础发酵培养基分别在18、21、24、27、30、33、36 ℃条件下按1.3.3节进行豆粕发酵试验,考察发酵温度对毛霉发酵豆粕的影响。
1.3.7部分析因试验设计
在单因素试验的基础上,利用Minitab统计软件,采用两水平试验设计[21],对毛霉发酵豆粕有促进作用的因素做进一步分析,以筛选出对毛霉发酵有显著促进作用的若干因素,并初步确定各因素的合适取值范围。
1.3.8响应面分析设计
在部分析因试验的基础上,利用SAS 8.2统计软件,采用响应面分析法中的中心组合试验设计[21],对部分析因设计筛选出的因素做进一步优化,并由此确定豆粕发酵制备多肽及可溶性膳食纤维的工艺条件。
2 结果与分析
2.1单因素试验结果
2.1.1发酵培养基中成分强化物对毛霉发酵豆粕的影响分别在发酵培养基中添加不同的物质,考察成分添加物对毛霉发酵豆粕的影响,由此筛选对毛霉发酵豆粕有促进作用的物质,结果见表1。

表1 成分强化物对毛霉发酵豆粕的影响Table 1 Effects of nutritional supplements on the fermentation of soybean meal by Mucor
由表1可知,原基础发酵培养基中的物质成分已基本可满足毛霉菌体的生长及发酵产酶,因此空白对照样品中多肽及可溶性膳食纤维的得率均可达到10%以上;在培养基中添加某些物质,如木糖、CaCl2、KH2PO4、吐温-80对毛霉发酵、多肽及可溶性膳食纤维转化有较明显的促进作用;而有些物质(如果糖、葡萄糖等)则对毛霉发酵表现出抑制作用,这可能是由于这些添加物的存在对毛霉发酵产酶表现出了抑制效应。通过试验初步筛选出对毛霉固体发酵豆粕有促进作用的4 个物质成分:木糖、CaCl2、KH2PO4、吐温-80。
2.1.2培养基初始pH值对毛霉发酵豆粕的影响
对于豆粕固态发酵制备多肽及膳食纤维的工艺而言,发酵培养基的初始pH值既会影响毛霉菌的正常生长、产酶效率,同时也会影响发酵培养基中蛋白酶及纤维素酶的稳定性及水解效率。由图1可知,培养基的初始pH值对毛霉发酵豆粕有较显著的影响。毛霉菌体生长及产酶适宜于在偏酸性的环境;对于多肽转化而言,适宜的初始pH值范围在5.0~6.5;对于可溶性膳食纤维的转化而言,培养基适宜的初始pH值范围在4.0~5.5;多肽转化与SDF转化所需的最适初始pH值略有不同,这应该与这两类酶的分泌及催化适宜条件有关系。通过以上试验初步确定毛霉发酵豆粕的合适培养基初始pH值范围为4.0~6.5。

图1 培养基初始pH值对毛霉发酵豆粕的影响Fig.1 Effect of initial medium pH on the fermentation of soybean meal by Mucor
2.1.3培养基含水量对毛霉发酵豆粕的影响
对于毛霉固体发酵豆粕转化多肽及膳食纤维的生产工艺而言,发酵培养基的含水量是一个重要的影响因素,培养基含水量的高低除了会影响菌体的正常生长及产酶,同时它还会影响培养基中各物质的溶解及酶解反应,进而影响多肽及膳食纤维的转化效率[22-23]。为了确定发酵培养基的合适含水量,分别于培养基不同含水量的条件下进行固体发酵试验,考察了培养基含水量对毛霉固体发酵豆粕的影响,结果见图2。培养基含水量对毛霉发酵豆粕确有显著影响,当发酵培养基的含水量低至35%或是高于65%时,豆粕中多肽及可溶性膳食纤维的转化得率明显偏低。通过以上试验可确定发酵培养基的合适含水量范围在40%~60%。
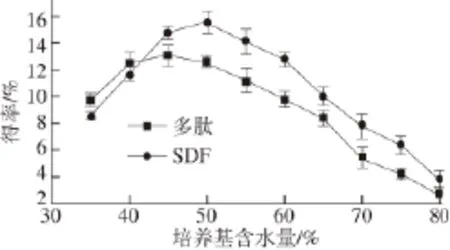
图2 培养基含水量对毛霉发酵豆粕的影响Fig.2 Effect of water content in the medium on the fermentation of soybean meal by Mucor
2.1.4发酵温度对毛霉发酵豆粕的影响
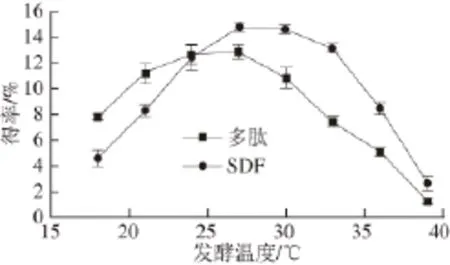
图3 发酵温度对毛霉发酵豆粕的影响Fig.3 Effect of temperature on the fermentation of soybean meal by Mucor
由图3可知,发酵温度对毛霉生长及发酵豆粕有较显著影响。毛霉是一种典型的适低温型菌,在相对较高的温度下(超过33 ℃)菌体生长及产酶较困难,从而导致多肽及SDF的得率明显偏低;而环境温度过低(低于18 ℃)时,菌体生长比较缓慢,酶的分泌及催化效率下降,多肽与SDF得率也不高。通过试验可初步确定毛霉生长及豆粕发酵的适宜温度范围在24~30 ℃。
2.2部分析因试验设计及结果
在单因素试验的基础上,采用部分析因设计中的两水平试验设计方法对上述筛选的影响因子做进一步分析,以确定对毛霉发酵豆粕有显著促进作用的影响因子。表2、3分别给出了部分析因设计的试验设计方案及结果的方差分析。
以多肽与SDF的得率总和(Y)为目标,对部分析因试验的结果进行方差分析,结果如表4所示。在选取的7 个因素及各自对应的取值范围内,因素B、E、F对毛霉发酵豆粕有极显著的影响(P<0.01);因素A对毛霉发酵豆粕有显著的影响(P<0.05);此外,曲率分析(表4中Ct Pt项)的结果则表明,上述因素的二次项对毛霉发酵豆粕也有显著的影响,由这些因素所确定的试验空间是一个显著的曲面(P<0.01),曲面上必然存在极值响应点。为了找出这一极值响应点及各因素对应的取值,以极显著性影响因素B、E及F为对象开展了后续的响应面分析试验,与此同时固定其他因素的取值均为中水平。

表2 部分析因试验设计因素水平表Table 2 Factors and levels used in fractional factorial design

表3 部分析因试验设计及结果Table 3 Fractional f actorial design scheme and corresponding experimental results lts

表4 部分析因试验结果的方差分析Table 4 Analysis of variance (ANOVA) of the experimental results of fractional factorial design ign
2.3响应面分析及优化结果
以部分析因设计筛选出的极显著性影响因素B、E、F为对象,在上述试验空间内进行中心组合试验设计,以确定这3 个因素的最佳取值,试验设计及结果如表5所示。

表5 中心组合试验设计及结果Table 5 Central composite design scheme and corresponding experimental results
分别以多肽得率(Y1)、SDF得率(Y2)及总得率(Y)为响应值,对表5的试验结果进行回归分析可以得到以下数学模型:

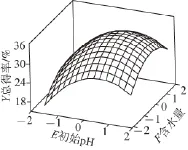
图4 培养基初始pHH值 (E)与含水量(F)对多肽及SDFF 总得率(Y)的影响Fig.4 Effect of pH (E) and water content (F) in the medium on the total yield of polypeptide and SDF (Y)
方差分析的结果显示,回归模型均有非常高的显著性(P<0.01),其R2为0.913 0,说明该模型可解释91.30%的试验结果。图4~6给出了模型(5)的响应曲面,由图可见该响应曲面是一典型的凸面,在其表面存在最大响应点。通过SAS软件分析可确定出该曲面的最大响应值为Y=(34.27±0.73)%,此时对应的因素B、E、F的取值分别为CaCl2质量分数0.39%、pH 5.68、含水量52.7%。

图5 CaaCCll2质量分数(B)与培养基初始ppHH值 (E)对多肽及SDFF 总得率(Y)的影响Fig.5 Effect of CaCl2(B) and medium pH (E) on the total yield of polypeptide and SDF (Y)
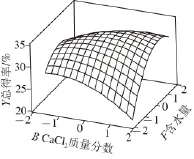
图6 CaaCCll2质量分数(B)与培养基含水量(F)对多肽及SDFF 总得率(Y)的影响Fig.6 Effect of CaCl2(B) and water content (F) in the medium on the total yield of polypeptide and SDF (Y)
通过上述优化试验可确定出毛霉固体发酵豆粕的最佳工艺条件为:豆粕发酵培养基中添加3%木糖、0.3% KH2PO4、0.1%吐温-80、0.39% CaCl2、含水量52.7%、pH 5.68,在27 ℃发酵3 d。在此优化条件下进行多次发酵实验,总得率的平均值为34.6%,结果与模型的预测值相吻合,进一步验证了模型的可靠性。在此优化的发酵条件下,多肽与SDF的总得率分别为16.1%、18.5%。
3 结 论
本研究以开发豆粕中具有高附加值的保健活性物质,多肽及可溶性膳食纤维的综合利用为目标,选用具有复合酶系的毛霉为菌株,拟通过毛霉固态发酵豆粕实现多肽及可溶性膳食纤维的同步高效转化。本实验探讨了毛霉发酵豆粕转化为多肽及可溶性膳食纤维的生产工艺,并对工艺条件进行了优化,最终确定了毛霉发酵豆粕的合适工艺条件为:豆粕发酵培养基中添加质量分数3%木糖、0.3% KH2PO4、0.1%吐温-80、0.39% CaCl2,含水量52.7%,pH 5.68,27 ℃发酵3 d。在优化的工艺条件下,毛霉发酵豆粕确实可实现多肽及可溶性膳食纤维的同步高效转化,两者的得率分别可达到16.1%与18.5%,此结果高于同类文献报道[24-25]。本实验结果表明,以豆粕为原料通过毛霉发酵可显著提高多肽及可溶性膳食纤维的转化得率,生产工艺具有可行性。
[1]杨小佳, 王金水, 管军军, 等. 豆粕的营养价值及影响因素[J]. 粮食与饲料工业, 2013(3): 44-46.
[2]何玉华, 严昌国. 豆粕中抗营养因子及其钝化方法[J]. 吉林农业科技学院学报, 2009, 18(1): 20-22.
[3]ANDERSON R L. Effects of steaming on soybean proteins and trypsin inhibitors[J]. Journal of Agricultural and Food Chemistry, 1992,69(12): 1170-1176.
[4]尹慧君, 宋俊梅. 微生物发酵对豆粕中抗营养因子的影响[J]. 粮食与饲料工业, 2010(12): 56-58.
[5]熊智辉, 过玉英, 陈丽玲, 等. 微生物发酵处理对豆粕抗营养因子的影响[J]. 大豆科学, 2007, 26(3): 396-399.
[6]隋晓楠, 江连洲, 李扬. 大豆多肽的功能特性及在食品工业中的应用[J]. 中国食物与营养, 2010(3): 36-39.
[7]FARZAMIRAD V, ALUKO R. Angiotensin I-converting enzyme inhibition and free-radical scavenging properties of cationic peptides derived from soybean protein hydrolysates[J]. International Journal of Food Sciences and Nutrition, 2008, 59(5): 428-437.
[8]李理, 罗贤慧, 张静. 体外消化对大豆多肽性质和ACE抑制活性的影响[J]. 华南理工大学学报: 自然科学版, 2014, 42(3): 125-130.
[9]胡克邦, 张玉宇, 徐广宇, 等. 大豆多肽对前列腺癌PC-3细胞增殖及凋亡的影响[J]. 中国生物制品学杂志, 2014, 27(9): 1176-1180.
[10] 杨宇轩, 胡森科, 张敬华, 等. 大豆多肽对糖尿病模型大鼠的血糖控制及对胰岛细胞的保护作用[J]. 西安交通大学学报, 2014, 35(2):191-195.
[11] 张绪霞, 陈卫梅, 董海洲, 等. 大豆膳食纤维的营养功能特性及开发前景[J]. 中国食物与营养, 2007(2): 49-51.
[12] SATOH H, HARA T, MURAKAWA D, et al. Soluble dietary fiber protects against nonsteroidal anti-inflammatory drug-induced damage to the small intestine in cats[J]. Digestive Diseases and Sciences, 2010,55(5): 1264-1271.
[13] 姚琨, 李兆勇. 发酵豆粕生产工艺的最新研究进展[J]. 饲料工业,2011, 32(23): 65-70.
[14] 杨学娟, 陈钧, 张春晓. 纳豆芽孢杆菌jS-1固体发酵低温豆粕的工艺条件优化[J]. 中国粮油学报, 2012, 27(6): 20-26.
[15] 龙菊, 吴拥军, 何映霞, 等. 耐高温腐乳毛霉发酵过程中酶活力变化的研究[J]. 中国调味品, 2011, 36(7): 52-54.
[16] 林亲录, 赵谋明, 邓靖. 毛霉产蛋白酶的特性研究[J]. 食品科学,2005, 26(5): 44-47.
[17] 潘进权, 罗晓春, 谢明权. 毛霉蛋白酶的组分特性及对大豆蛋白水解的研究[J]. 中国粮油学报, 2009, 24(5): 31-35.
[18] 潘进权, 罗晓春, 谢明权. 雅致放射毛霉AS3.2778碱性蛋白酶的纯化及水解特性[J]. 华南理工大学学报, 2008, 36(12): 106-111.
[19] 潘进权, 伍惠敏, 陈雨钿. 毛霉发酵法制备豆渣可溶性膳食纤维的研究[J]. 食品科学, 2012, 33(15): 210-215.
[20] 秦卫东, 陈学红, 马利华, 等. 黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学, 2010, 31(23): 289-293.
[21] LIU Chuanbin, LIU Yan, LIAO Wei, et al. Application of statistically based experimental designs for the optimization of nisin production from whey[J]. Biotechnology Letters, 2003, 25(11): 877-882.
[22] HAN Beizhong, MA Yong, ROMBOUTS FRANS M, et al. Effects of temperature and relative humidity on growth and enzyme production by Actinomucor elegans and Rhizopus oligosporus during sufu pehtze preparation[J]. Food Chemistry, 2003, 81(1): 27-34.
[23] ALBA MONICA M G, GUSTAVO V G. Effect of water activity on invertase production in solid state fermentation by improved diploid strains of Aspergillus niger[J]. Process Biochemistry, 2004, 39: 2085-2090.
[24] 韩丙倩, 管军军, 杨国浩, 等. 一步法混菌固态发酵豆粕的工艺研究[J].中国油脂, 2014, 39(1): 19-22.
[25] 惠明, 孟可, 田青, 等. 复合菌株固态发酵豆粕的研究[J]. 河南工业大学学报, 2009, 30(4): 61-64.
Optimization of the Fermentation Process of Soybean Meal by Mucor
PAN Jinquan, LIU Yuting, LIU Xiating
(School of Life Science and Technology, Lingnan Normal University, Zhanjiang524048, China)
The production process of polypeptide and soluble dietary fiber (SDF) from soybean meal with solid-state fermentation by Mucor was investigated and optimized with response surface methodology. After optimization, the optimal process conditions were determined as 20 g of soybean meal in a 250 mL shake flask with the addition of 3.0% xylose (g/g soybean meal), 0.3% KH2PO4, 0.1% Tween-80 and 0.39% CaCl2as the nutrient supplements, initial water content of 52.7%,pH 5.68, fermentation temperature of 27 ℃ and fermentation time of 3 days. Under these conditions, the yield of polypeptide and SDF could reach 16.1% and 18.5%, respectively. The experiment results show that the production process is feasible.
Mucor; soybean meal; solid-state fermentation; polypeptide; soluble dietary fiber
TS201.1
A
1002-6630(2015)23-0178-05
10.7506/spkx1002-6630-201523033
2015-01-12
国家星火计划项目(2013GA780084)
潘进权(1978—),男,副教授,博士,研究方向为酶与发酵工程。E-mail:pjq78@sina.com
