八角莲多酚氧化酶的酶学性质
2015-10-29何军忠袁家代段辉国
何军忠,袁家代,李 维,*,何 兵,段辉国
(1.四川师范大学生命科学学院,四川 成都 610101;2.内江师范学院生命科学学院,四川 内江 641000)
八角莲多酚氧化酶的酶学性质
何军忠1,袁家代1,李维1,*,何兵1,段辉国2
(1.四川师范大学生命科学学院,四川 成都 610101;2.内江师范学院生命科学学院,四川 内江 641000)
以邻苯二酚为底物,研究八角莲多酚氧化酶(polyphenol oxidase,PPO)粗提液的酶学特性。结果表明,底物邻苯二酚最适浓度为1.0 mol/L,八角莲PPO的最适pH值为7.0,最适温度为30 ℃,90 ℃高温处理10 min,八角莲PPO酶活力仅剩11.92%。PPO催化的酶促褐变反应符合米氏动力学方程,相应动力学参数Km和vmax分别为0.230 7 mol/L和769.23 U/min。抗坏血酸、甘氨酸、乙二胺四乙酸、柠檬酸对酶活性具有抑制作用,十二烷基硫酸钠表现出激活 作用,亚硫酸氢钠对酶活性的抑制作用强于硫代硫酸钠,Al3+和Cu2+对酶活性具有一定的激活作用,Ca2+对酶活性有一定的抑制作用,Mg2+、Fe2+和Fe3+对酶活性影响不显著。
八角莲;多酚氧化酶;酶学特性
八角莲(Dysosma versipellis(Hance.)M. Cheng)隶属小檗科八角莲属,为我国特有的濒危药用保护植物。其根茎入药,具有清热解毒、祛痰散结等功效[1]。在现代医学中,八角莲注射液用于治疗流行性出血热、乙型脑炎、腮腺炎、毒蛇咬伤及癌症等[2]。药理研究表明,该属植物中含有鬼臼毒素,具有抗肿瘤、抗病毒以及免疫调节作用,为抗癌药VP-16和VM-26的原料[3]。八角莲分布零星,种群数量不大,对生态环境要求较严格,生长缓慢,种子繁殖率较低,制约了天然药物的进一步开发。目前,通过进行无性繁殖扩大种群数量已成为保护该植物的有效途径之一,前期研究发现,无性繁殖材料中多酚氧化酶(polyphenol oxidase,PPO)活性是影响其成活的关键。多酚氧化酶是植物体内普遍存在的一种末端氧化还原酶[4],在完整的植物组织中,PPO是与内囊体膜结合在一起的,同酚类底物是相互分离的,因此褐变不会发生[5],更主要的是,由于酚类物质在正常的植物组织中,作为呼吸传递体参与了呼吸代谢作用,酚与醌之间的氧化与还原呈动态平衡。当植物细胞受到破坏后,正常的呼吸链被打破,氧气的浸入造成酚类底物在酚酶的作用下迅速氧化成邻醌,转而又快速地通过聚合作用形成褐色素或黑色素[6]。本实验通过研究八角莲多酚氧化酶的酶活特性,将有效地指导无性繁殖的取材,提高繁殖成活率,扩大种群数量,以保护该物种。
1 材料与方法
1.1材料、试剂与仪器
八角莲(Dysosma versipellis(Hance.)M. Cheng)野生植株采摘于四川雅安碧峰峡境内,经四川师范大学何兵副教授鉴定后移栽于四川师范大学生物园内。
聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、磷酸二氢钠、邻苯二酚、抗坏血酸、甘氨酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、柠檬酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、亚硫酸氢钠、硫代硫酸钠、氯化铝、硫酸铜、氯化钙、氯化镁、氯化亚铁、氯化铁(均为分析纯) 成都市苌钲化玻有限公司。
AR224CN型电子天平 奥豪斯仪器(上海)有限公司;HHS1-Ni型电热恒温水浴锅 北京长安科学仪器厂;TU-1901型双光束紫外分光光度计 北京普析通用仪器有限责任公司。
1.2方法
1.2.1粗酶液的提取与活力测定
取八角莲叶柄5.0 g剪碎,加入PVP 0.05 g和少许石英砂[7],然后加入10 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0),在冰浴中快速研磨,10 000 r/min离心20 min,上清液转入20 mL容量瓶,沉淀用5 mL磷酸盐缓冲液再提取一次,上清液并入容量瓶,冰浴中定容备用[8-9]。
取0.2 mL粗酶液于试管中,加入3 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0),摇匀,30 ℃水浴10 min,加入0.5 mL邻苯二酚(1.0 mol/L),在420 nm波长处测定A420nm值,以0.2 mL灭活的粗酶液加磷酸盐缓冲液作对照,每30 s读数1 次,测定5 次[10-12]。酶活力的定义为:每分钟每克鲜样吸光度增加0.01为1 个酶活力单位(U/mL)。因此PPO酶活力计算见下式。

式中:ΔA420nm为反应时间内吸光度的变化;VT为提取酶液总体积/mL;m为样品鲜质量/g;VS为测定时用酶液体积/mL;t为反应时间/min。
1.2.2酶促反应进程的测定
取0.2 mL粗酶液于试管中,加入3 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0),摇匀,30 ℃水浴10 min,加入0.5 mL邻苯二酚(1.0 mol/L),在420 nm波长处测定A420nm值,以0.2 mL灭活的粗酶液加磷酸盐缓冲液作对照,每15 s读数1 次,直至前后连续3 次检测的A420nm示值差小于1%时,则认定其酶促反应趋于稳定。
1.2.3八角莲PPO最适pH值、最适温度和热稳定性的测定
分别配制不同pH 3.0~11.0的磷酸盐缓冲液,按照
1.2.1节的方法测定PPO活力,确定八角莲PPO作用的最适pH值条件。
取3.0 mL最适pH值的磷酸盐缓冲溶液和0.5 mL邻苯二酚(1.0 mol/L),分别在不同温度(20~90 ℃)的水浴中保温10 min,取出后迅速加入0.2 mL八角莲PPO粗酶液,按照1.2.1节方法测定PPO活力,确定八角莲PPO作用的最适温度。
将八角莲PPO粗酶液分别在60、70、80、90 ℃的水浴中分别保温5、10、15、20、25、30 min,迅速冰浴冷却至30 ℃,按照1.2.1节方法测定八角莲PPO活力,研究保温时间和温度对八角莲PPO活性的影响。
1.2.4八角莲PPO最适底物浓度的测定
在最适pH值条件下,分别以不同浓度的邻苯二酚(0.10~1.50 mol/L)作为底物,按照1.2.1节方法测定PPO活力,确定八角莲PPO作用的最适底物浓度。根据Lineweaver-Burk作图法得米氏常数(Km)和最大反应速率(vmax)。
1.2.5有机酸对PPO活性的影响
在加有3 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0)、0.5 mL邻苯二酚(1.0 mol/L)和0.2 mL八角莲PPO粗酶液的反应体系中,分别加入0.2 mL不同质量浓度的抗坏血酸、甘氨酸、EDTA、柠檬酸、SDS溶液,30 ℃保温10 min,在420 nm波长处测定PPO活力。以不加有机酸所测酶活力为100%,计算PPO相对酶活力。
1.2.6还原剂对PPO活性的影响
在加有3 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0)、0.5 mL邻苯二酚(1.0 mol/L)和0.2 mL八角莲PPO粗酶液的反应体系中,分别加入0.2 mL不同质量浓度的亚硫酸氢钠、硫代硫酸钠溶液,30 ℃保温10 min,在420 nm波长处测定PPO活力。以不加还原剂所测酶活力为100%,计算PPO相对酶活力。
1.2.7金属离子对PPO活性的影响
在加有3 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0)、0.5 mL邻苯二酚(1.0 mol/L)和0.2 mL八角莲PPO粗酶液的反应体系中,分别加入0.2 mL不同质量浓度的CuSO4、CaCl2、MgCl2、FeCl2、FeCl3、AlCl3溶液,30 ℃保温10 min,在420 nm波长处测定PPO活力。以不加金属离子所测酶活力为100%,计算PPO相对酶活力。
1.3数据统计与分析
利用Excel 2007统计分析所有数据,计算标准偏差并制图,结果均平行测定3 次。
2 结果与分析
2.1八角莲PPO酶促反应进程

图1 八角莲PPO酶促反应进程曲线Fig.1 Reaction time course catalyzed by PPO from D. versipellis
由图1可知,八角莲PPO酶促反应速率在0~3 min内较快,之后反应变慢,5 min后反应趋于稳定。在反应最初始3 min内吸光度的变化几乎成线性增加,其线性回归方程为Y=0.345 9X+0.510 3(R2=0.994 9)。说明八角莲PPO酶促反应速率较快,产物生成量与时间呈正比关系,随着时间的延长,曲线斜率逐渐降低并趋于平坦,这可能与酶作用底物的消耗和产物的积累对酶的抑制有关。为了正确测定酶促反应速率,本实验采用前3 min反应时间内的吸光度的变化以计算酶活力。
2.2pH值对八角莲PPO活性的影响

图2 pH值对八角莲PPO活性的影响Fig.2 Effect of pH on the activity of PPO from D. versipellis
由图2可知,pH值对八角莲PPO活性的影响很大,该酶对环境酸碱度较为敏感。在测定的pH值范围内,八角莲PPO的活性整体上呈先增大后减小趋势,当pH值为7.0时,八角莲PPO活性最强,不同于结球生菜,其PPO活性适宜pH值为8.0,偏碱性[13]。当pH<3.0时,PPO活性显著被抑制;pH值在4.0~7.0范围内,pH值增大,酶活性增加;当pH>7.0时,pH值升高,酶活性降低;当pH>9.0时,PPO活性显著被抑制。这可能是因为PPO是碱性蛋白质,在较强酸性环境下,PPO中的铜解离出来,使酶失活;当pH值大于7.0时,在碱性环境中,PPO中的辅基铜解离,形成不溶性的氢氧化铜,使其活性降低[14]。
2.3温度对八角莲PPO活性的影响
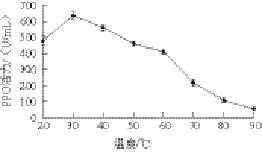
图3 温度对八角莲PPO活性的影响Fig.3 Effect of temperature on the PPO activity of D. versipellis
温度对PPO活性的影响是双重的。温度升高能加快酶催化反应速率,同时也能促使酶蛋白质变性,这是两种对抗效应的综合反应。因为PPO是蛋白质酶,不适宜的温度会破坏其活性部位三维结构的完整性和稳定性,从而使PPO失活;而这种结构又是保持PPO活性的关键因素[15-16]。由图3可知,在所测范围内,随着温度的增加,八角莲PPO活性呈现先升高后降低的趋势,峰值出现在30 ℃;温度在30 ℃以下时,PPO活性随温度升高而增加;温度在30 ℃以上时,PPO活性随着温度升高而降低;温度高于60 ℃时,PPO活性迅速下降,到达90 ℃时,PPO活性几乎消失。
2.4八角莲PPO的热稳定性

图4 八角莲PPO的热稳定性Fig.4 Thermostability of PPO from D. versipellis
将粗酶液在60~90 ℃条件下分别处理5~30 min后,测定八角莲PPO的活性,结果如图4所示,随着加热时间的延长,PPO活性不断降低。PPO在60 ℃时较稳定,该温度下加热30 min仍能保有49.88%的酶活力;70 ℃以上加热15 min,PPO活性损失严重,如90 ℃加热5 min,酶活力仅剩24.23%,加热10 min,酶活力仅剩11.92%。
2.5底物浓度对八角莲PPO活性的影响
分别以0.1~1.5 mol/L的邻苯二酚溶液为底物,研究底物浓度对八角莲PPO活性的影响,结果如图5所示,并以此来研究八角莲PPO的动力学特性。邻苯二酚的浓度对酶活力测定有显著影响。当底物浓度在0.1~1.0 mol/L之间时,酶活力与底物浓度呈正相关,表现为一级反应;当底物浓度大于1.0 mol/L时,酶活力增长变缓,趋于平稳。这是由于底物浓度较低时,并非所有的酶分子都能与底物相结合,随着底物浓度增加,越来越多的酶分子都与底物结合,使酶促反应进行。在达到一定浓度后,所有的酶活性部位都与底物结合,此时酶被底物饱和,进一步增加底物浓度也不能提高酶的活性,酶活性达到最大值[17]。因此,后期实验均采用1.0 mol/L的邻苯二酚作为底物,以确保酶液反应完全。

图5 底物浓度对八角莲PPO活性的影响Fig.5 Effect of substrate concentration on the activity of PPO from D. versipellis

图6 邻苯二酚为PPO底物的双倒数曲线图Fig.6 Lineweaver-Burk curve of PPO using catechol as the substrate
由图6可知,以邻苯二酚做为八角莲PPO底物时,其反应规律符合米氏方程,根据图中直线斜率和纵轴截距,求得底物的Km和vmax分别为0.230 7 mol/L和769.23 U/min。
2.6有机酸对八角莲PPO活性的影响
2.6.1抗坏血酸对八角莲PPO活性的影响

图7 不同质量浓度抗坏血酸对八角莲PPO活性的影响Fig.7 Effect of ascorbic acid concentration on PPO activity of D. versipellis
由图7可知,抗坏血酸能有效抑制八角莲中PPO的活性,同佛手瓜[18]和芒果[19]PPO活性研究一样,随着抗坏血酸质量浓度的增加,酶活性显著降低。添加质量浓度为2.0 g/100 mL的抗坏血酸时,八角莲PPO相对酶活力只有16.6%。这可能是因为抗坏血酸既可以作为醌的还原剂,又可以作为酶分子中铜离子的螯合剂,甚至它可以被PPO直接氧化,起到竞争性抑制剂的作用[20]。
2.6.2甘氨酸对八角莲PPO活性的影响

图8 不同质量浓度甘氨酸对八角莲PPO活性的影响Fig.8 Effect of glycine concentration on PPO activity of D. versipellis
由图8可知,甘氨酸对八角莲PPO的抑制效果较为显著,添加质量浓度为0.1 g/100 mL的甘氨酸时,八角莲PPO相对酶活力为78.2%,添加质量浓度为0.5 g/100 mL的甘氨酸时,相对酶活力降为45.6%,继续加大甘氨酸质量浓度,酶活力下降不显著。
2.6.3EDTA对八角莲PPO活性的影响
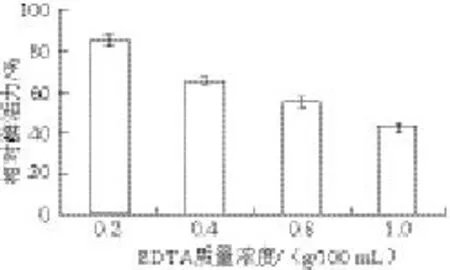
图9 不同质量浓度EDTA对八角莲PPO活性的影响Fig.9 Effect of EDTA concentration on PPO activity of D. versipellis
由图9可知,EDTA对八角莲PPO活性有抑制作用,添加质量浓度为1.0 g/100 mL的EDTA时,相对酶活力为43.2%。这 是因为EDTA具有较强的螯合能力,能螯合多酚氧化酶中Cu2+,从而抑制PPO的活性[21]。
2.6.4柠檬酸对八角莲PPO活性的影响

图10 不同质量浓度柠檬酸对八角莲PPO活性的影响Fig.10 Effect of citric acid concentration on PPO activity of D. versipellis
由图10可知,随着柠檬酸质量浓度的增加,八角莲PPO活性受抑制加强。添加质量浓度为10 g/100 mL的柠檬酸时,八角莲PPO相对酶活力为45.6%,说明八角莲PPO活性对柠檬酸具有较强的适应性。有别于榆黄菇PPO特性[22],柠檬酸在低质量浓度时对酶活性有一定的促进作用,高质量浓度才有一定的抗褐变效果。这可能是由于柠檬酸对PPO的铜离子有较强的螯合作用,同时柠檬酸的酸性使体系偏离PPO最适pH值,酸性溶液中氧气溶解度较小而兼有抗氧化作用,从而抑制酶的活性。
2.6.5SDS对八角莲PPO活性的影响

图11 不同质量浓度SDS对八角莲PPO活性的影响Fig.11 Effect of SDS concentration on PPO activity of D. versipellis
由图11可知,随着SDS质量浓度的增加,八角莲PPO活性逐渐增强。添加质量浓度为0.5 g/100 mL的SDS时,相对酶活力增强121%;添加质量浓度为2.0 g/100 mL的SDS时,PPO活性增加到221%;继续加大SDS的质量浓度,PPO活性增强不显著。同目前对多种果蔬的研究结果类似,SDS可以使PPO的构象发生轻微变化,从而显著增强PPO的活性,研究发现0.5 mmol/L或12.5 mmol/L SDS分别使红熟番茄果实PPO活性增加67.8%或120%[23];12.5 mmol/L SDS使菜花PPO活性增加280.0%[24];25 mmol/L的SDS可以使鸭梨果实PPO活性增强435%[25]。
2.7还原剂对八角莲PPO活性的影响
2.7.1亚硫酸氢钠对八角莲PPO活性的影响

图12 不同质量浓度亚硫酸氢钠对八角莲PPO活性的影响Fig.12 Effects of NaHSO3concentration on PPO activity of D. versipellis
由图12可知,亚硫酸氢钠能有效抑制八角莲中PPO的活性,随着亚硫酸氢钠质量浓度的增加,酶活性显著降低。添加质量浓度为0.5 g/100 mL的亚硫酸氢钠时,相对酶活力只有16.2%。这可能是因为亚硫酸氢钠主要通过与醌生成无色的加成产物,降低了PPO对一元酚和二羟基酚作用的活力,同时与氨基酸等反应生成双硫键化合物,从而抑制PPO的活性。同徐芹等[26]关于砀山酥梨PPO活性的研究类似,亚硫酸氢钠浓度为6 mmol/L时,PPO活性的受抑制程度达到74.47%。
2.7.2硫代硫酸钠对八角莲PPO活性的影响
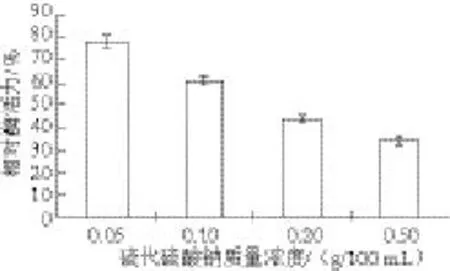
图13 不同质量浓度硫代硫酸钠对八角莲PPO活性的影响Fig.13 Effect of Na2S2O3concentration on PPO activity of D. versipellis
由图13可知,硫代硫酸钠对八角莲PPO活性具有一定的抑制作用,随着硫代硫酸钠质量浓度的增大,对PPO活性的抑制作用增强,当硫代硫酸钠达到0.5 g/100 mL时,PPO的相对酶活力降到34.2%,原因应该与硫代硫酸钠的还原性有关,主要通过不可逆地与醌生成无色的加成产物,降低了酶作用于一元酚和二羟基酚的活力[27]。
2.8金属离子对八角莲PPO活性的影响

图14 不同质量浓度金属离子对八角莲PPO活性的影响Fig.14 Effect of metal ion concentration on PPO activity of D. versipellis
由图14可知,在所测范围内,各金属离子对八角莲PPO活性的影响为:Al3+质量浓度在0.08 g/100 mL以内时,对PPO的酶活力具有一定的激活作用[28],随着质量浓度的增大对酶活性逐渐表现为抑制作用;Cu2+质量浓度在0.04 g/100 mL以内时,对PPO的酶活力具有一定的激活作用[29],随着质量浓度的增大其酶活性逐渐降低,这可能是因为PPO酶是一种含铜离子的酶,适当的铜离子质量浓度有助于提高PPO的活性,同时铜离子可以静电稳定、屏蔽负电荷等途径参加到氧化还原反应中,从而增强PPO的催化能力[21,30];Ca2+对八角莲的酶活力具有一定抑制作用,Ca2+质量浓度为0.1 g/100 mL时,八角莲PPO相对酶活力降为67.2%;Mg2+、Fe2+和Fe3+对八角莲PPO的酶活性几乎没有作用。
3 结 论
目前对于PPO活性的研究多集中在果蔬类,如菜花、番茄、梨、丝瓜等,其目的在于有效控制酶促褐变反应的发生,以便更好地保存和加工。关于八角莲中PPO的酶学特性的研究,仅见于秦小波[31]对峨眉八角莲PPO活性研究的报道,他初步考察了不同pH值、不同温度和不同底物浓度对PPO活性的影响。但关于八角莲PPO是否存在同工酶,尚未见到相关研究报道,由于本实验的酶活力检测是以邻苯二酚为底物,分析八角莲PPO粗提液的酶学特性,如果存在同工酶,所获得的酶学特性即为多种同工酶的综合表现。
本实验在热稳定性、酶反应动力学、激活剂和抑制剂等方面更为全面地开展了有关八角莲PPO特性的相关研究,结果表明,以邻苯二酚为底物,其最适缓冲液pH值为7.0,最适反应温度为30 ℃,70 ℃以上加热15 min,PPO活性损失严重,90 ℃加热10 min,酶活力仅剩11.92%,底物邻苯二酚最适浓度为1.0 mol/L,Km和vmax分别为0.230 7 mol/L和769.23 U/min。
有机酸对PPO活性的影响结果表明,抗坏血酸、甘氨酸、EDTA、柠檬酸对酶活性有抑制作用;SDS表现出激活作用。还原剂对PPO活性的影响结果表明,亚硫酸氢钠对酶活性的抑制作用强于硫代硫酸钠。金属离子对八角莲PPO活性的影响结果表明,在所测范围内,Al3+和Cu2+在低质量浓度时对酶活性有一定的激活作用,随着质量浓度的增大其酶活性逐渐降低;Ca2+对酶活性具有一定的抑制作用;Mg2+、Fe2+和Fe3+对酶活性几乎没有作用。
[1] 权红, 马和平, 兰小中. 鬼臼毒素的研究进展[J]. 现代农业科技,2009(23): 111-112.
[2] 陈洁君, 赵长琦. 鬼臼毒素药源植物及其资源[J]. 生物学通报, 2013,48(5): 3-7.
[3] 尚明英, 徐珞珊, 李萍. 鬼臼类中药及其木脂素类成分的药效学研究[J]. 中草药, 2002, 33(8): 722-724.
[4] 宋立江, 狄莹, 石碧. 植物多酚研究与利用的意义及发展趋势[J]. 化学进展, 2000, 12(2): 161-170.
[5] 胡青霞. 石榴果皮中多酚氧化酶测定最佳试验条件的确定[J]. 河南农业科学, 2007(2): 81-83.
[6] 董英. 藕汁褐变反应及其控制[J]. 农业工程学报, 1994, 10(3):143-147.
[7] 李军. 苦杏仁脱苦工艺的研究[D]. 北京: 北京林业大学, 2012.
[8] ARSLAN O, TEMUR A, TOZLU I. Polyphenol oxidase from Malatya apricot (Prunus armeniaca L.)[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 1239-1241.
[9] 张百刚. 红枣多酚氧化酶(PPO)特性及抑制其酶促褐变的研究[D].西安: 陕西师范大学, 2006.
[10] 慈志娟. 杏果实酶促褐变与制汁适应性评价体系的研究[D]. 泰安:山东农业大学, 2007.
[11] 李宁, 郁志芳, 赵友兴, 等. 莲藕多酚氧化酶的酶学特性[J]. 江苏农业学报, 2002, 18(1): 63-64.
[12] CHEN C Q, BELANGER R R, BENHAMOU N, et a1. Defense enzymes induced in cucumber roots by treatment with plant growth promoting rhizobacteria (PGPR) and Pythium aphanidermatum[J]. Physiological and Molecular Plant Pathology, 2000, 56: 13-23.
[13] 饶先军, 刘升, 王则金, 等. 结球生菜多酚氧化酶动力学特性研究[J].食品工业科技, 2011, 32(9): 80-82.
[14] WANG Jianhui, JIANG Weibo, WANG Baogang, et al. Partial properties of polyphenol oxidase in mango[J]. Journal of Food Biochemistry, 2007, 31: 45-55.
[15] 剧春梅, 王欣, 王俊城, 等. 白玉菇多酚氧化酶的酶学特性[J]. 食品与发酵工业, 2010, 36(5): 5-8.
[16] YEMENICOGLU A, CEMEROGLU B. Consistency of polyphenol oxidase (PPO) thermostability in ripening Apricots (Prunus armeniaca L.): evidenec for the presence of thermostable PPO forming and destabilizing mechanisms in apricots[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 2371-2379.
[17] VAUGHN K C, LAX A R, DUKE S O. Polyphenol oxidase: the chloroplast oxidase with no established function[J]. Physiologia Plantarum, 1988, 72(3): 659-665.
[18] 张福平, 张喜春. 佛手瓜多酚氧化酶酶学特性研究[J]. 食品科学,2010, 31(1): 161-164.
[19] 汤凤霞, 魏好程, 曹禹. 芒果多酚氧化酶的特性及抑制研究[J]. 食品科学, 2006, 27(12): 156-160.
[20] 张亮. 魔芋多酚氧化酶的提取纯化、特性及对多糖流变性的影响[D].武汉: 华中农业大学, 2005.
[21] 王建晖. 涂膜对芒果常温贮藏品质、生理生化的影响及果实PPO酶学特性、分离纯化的研究[D]. 北京: 中国农业大学, 2006.
[22] 朱风妹, 杜彬, 李军, 等. 榆黄菇多酚氧化酶的性质及抑制研究[J].食品科技, 2008, 33(6): 6-22.
[23] 孙静, 沈瑾, 曹冬冬, 等. 红熟番茄果实多酚氧化酶酶学特性[J]. 农业工程学报, 2011, 27(增刊1): 253-257.
[24] 庞凌云, 祝美云, 詹丽娟, 等. 菜花多酚氧化酶的酶学特性研究[J].河南农业大学学报, 2013, 47(1): 83-91.
[25] 李健, 徐艳聪, 黄美, 等. 鸭梨果实多酚氧化酶酶学特性[J]. 食品科学, 2013, 34(15): 154-157. doi: 10.7506/spkx1002-6630-201315031.
[26] 徐芹, 乔勇进, 方强, 等. 砀山酥梨多酚氧化酶酶学特性及抑制效应的研究[J]. 食品科学, 2008, 29(4): 74-77.
[27] 罗志刚, 杨连生, 姜绍通, 等. 抗坏血酸和亚硫酸钠在甘薯破碎中抗褐变的研究[J]. 食品工业科技, 2002, 23(5): 52-53.
[28] YORUK R, MARSHALL M R. Physicochemical properties and function of plant polyphenol oxidase: a review[J]. Journal of Food Biochemistry, 2003, 27(5): 361-422.
[29] MAYER A M. Polyphenol oxidases in plants and fungi: going places?A review[J]. Phytochemistry, 2006, 67(21): 2318-2331.
[30] 刘静, 钱建亚, 李成良, 等. 芡实多酚氧化酶的酶学性质[J]. 食品科学, 2012, 33(7): 176-181.
[31] 秦小波. 峨眉八角莲多酚氧化酶活性与总酚含量的研究[J]. 资源开发与市场, 2013, 29(5): 454-456.
Enzymatic Properties of Polyphenol Oxidase from Dysosma versipellis (Hance.) M. Cheng
HE Junzhong1, YUAN Jiadai1, LI Wei1,*, HE Bing1, DUAN Huiguo2
(1. College of Life Science, Sichuan Normal University, Chengdu 610101, China;2. College of Life Science, Neijiang Normal University, Neijiang 641000, China)
Enzymatic characterization of polyphenol oxidase (PPO) from the leaves of Dysosma versipellis (Hance.) M. Cheng was investigated using catechol as the reaction substrate. The results showed that the optimal substrate was catechol at a concentration of 1.0 mol/L, and the optimal pH and temperature for this enzyme were 7.0 and 30 ℃, respectively. The remaining activity of PPO was 11.92% after thermal treatment at 90 ℃ for 10 min. The kinetics of PPO reaction was fit to the Michaelis-Menten equation, with Kmand vmaxvalue of 0.230 7 mol/L and 769.23 U/min, respectively. Different inhibitory effects on PPO among ascorbic acid, glycine, EDTA and citric acid were observed. NaHSO3showed stronger inhibitory effect on PPO than Na2S2O3. The PPO could be activated by Al3+, Cu2+and SDS. Ca2+had certain inhibitory effect on the PPO enzyme. In contrast, Mg2+, Fe2+and Fe3+had no significant effect on the enzyme activity (P < 0.05).
Dysosma versipellis (Hance.) M. Cheng; polyphenol oxidase; enzymatic properties
Q814.1
A
1002-6630(2015)13-0137-06
10.7506/spkx1002-6630-201513026
2014-07-06
四川省科技支撑计划项目(2012SZ0074);四川省教育厅重点项目(13ZA0145);四川师范大学校级重点科研基金项目(2013-12)
何军忠(1989—),男,硕士研究生,研究方向为生物化学与分子生物学。E-mail:799243209@qq.com
李维(1972—),男,教授,博士,研究方向为天然药物的微生物转化。E-mail:weelee201@aliyun.com
