柘树果实的抗乳腺癌活性部分的提取、分离及结构鉴定
2015-10-29曹春廷孙丛龙白卫滨孙建霞李国强欧仕益
曹春廷,孙丛龙,白卫滨,*,孙建霞,李国强,欧仕益,杨 勇*
(1.四川农业大学食品学院,四川 雅安 625014;2.暨南大学食品科学与工程系,广东 广州 510632;3.广东工业大学轻工化工 学院,广东 广州 510006)
柘树果实的抗乳腺癌活性部分的提取、分离及结构鉴定
曹春廷1,2,孙丛龙2,白卫滨2,*,孙建霞3,李国强2,欧仕益2,杨勇1,*
(1.四川农业大学食品学院,四川 雅安 625014;2.暨南大学食品科学与工程系,广东 广州 510632;3.广东工业大学轻工化工 学院,广东 广州 510006)
为了得到柘树果实中具有抗乳腺癌活性的化合物,以人乳腺癌细胞MDA-MB-231和人乳腺癌细胞MCF-7为细胞模型,通过噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法评价柘树果实石油醚浸膏、乙酸乙酯浸膏、以及正丁醇浸膏粗提取物部位的功能,实验发现乙酸乙酯部位具有明显的抑制乳腺癌细胞的活性,其对乳腺癌细胞MDA-M B-231和MCF-7的IC50分别为:75.4 μg/mL和66.8 μg/mL。采用Sephad ex LH-20柱层析和硅胶柱层析对乙酸乙酯部位进行分离,采用单晶X衍射对得到的化合物进行结构鉴定,得到2 种晶体主成分,分别为4'-O-甲基-吡喃异黄酮、吡喃异黄酮。采用MTT方法对获得的2 种单体进行抗乳腺癌活性研究,发现吡喃异黄酮对乳腺癌细胞MCF-7的生长抑制率达到56.7%。结果表明,柘树果实乙酸乙酯部位含有抗乳腺癌成分,且分离得到2 种类异黄酮化合物,其中吡喃异黄酮体现出一定的抗乳腺癌活性。
柘树果实;分离提取;抗乳腺癌;结构鉴定
柘树(Cudrania tricuspidata)为桑科(Moraceae)柘属(Cudrania)植物,又名柘木、柘桑、刺桑、奴柘等,全世界存在约有6 种柘属植物,主要分布在亚洲和大洋洲。在我国,柘属植物资源非常丰富,存在5 个品种和2 个变种[1],主要分布在我国华南、西南、华北(除内蒙古外)各 省。柘树具有很大的药用价值,前人已经从柘 树中分离纯化出多种化合物,如黄酮、异黄酮、氧杂蒽酮、生物碱、糖类等[1-4],对其活性进行研究发现具有抗肿瘤[5]、抗氧化[6]、保护肝脏[7]、抗炎镇痛[8-9]、保护肝脏[10]和抗结核[11]等作用,而这些生物活性主要是柘树中黄酮类化合物的作用[12-14]。Choi等[15]研究证明了柘树中含有抗乳腺癌的化学成分,从柘树根部分离得到的吉利柘树素A对MCF-7乳腺癌细胞的增殖有抑制作用,IC50为20.0 μg/mL。但上述研究主要集中在柘树的干燥根、根皮树皮以及柘木,而对柘树果实的研究相对较少。研究表明,柘果也具有很多活性物质[16-19],如山柰、芦丁、槲皮素等,但由于柘树树龄超过50 年属于国家一级保护树种,禁止砍伐,而柘果由于一年一结果,并且同柘树根、柘树茎皮以及柘树茎研究利用相比,对其功效成分分析及营养作用知之甚少,对其开发远远不够,因此急需开展对柘果的研究。
截止目前,尚未发现柘树果实中抗乳腺癌的化学成分研究报道。因此,本实验对柘树果实的抗乳腺癌化学成分开展研究,以期为其在抗乳腺癌方面的开发利用提供科学依据。
1 材料与方法
1.1材料与试剂
实验所用原料柘树新鲜果实,采于山东省烟台市。
人乳腺癌细胞MCF-7和MDA-MB-231细胞 暨南大学医药中心;MCF-7细胞CCTCC、MDA-MB-231细胞CCTCC、1640培养基、马血清、胎牛血清、胰蛋白酶、青霉素、链霉素 美国Gibco公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Amresco公司;水溶性VE(Trolox) 美国Sigma公司;其他常用试剂均为国产分析纯。
1.2仪器与设备
柱层析用硅胶(100~200、200~300 目)、GF254硅胶薄层预制板 青岛海洋化工厂;Sephadex LH-20丙基葡聚糖凝胶 GE Healthcare(中国)有限公司;薄层制备板(10 cm×10 cm) 烟台化学工业研究所;RE-52旋转蒸发器 上海嘉鹏科技有限公司;酶标仪美国Thermo Fisher Scientifi c公司;超净工作台 苏州净化设备公司;二氧化碳培养箱 美国Thermo Forma有限责任公司;倒置显微镜 日本Olympus公司;三用紫外分析仪 上海骥辉科学分析仪器有限公司。
1.3方法
1.3.1柘树果实粗提物获得
称取新鲜柘树果实270 g,匀浆机打碎后,置于提取罐中,快速加入1 000 mL甲醇溶剂,常温下静置浸提,24 h后收集浸提液,按上述操作,重复多次,合并浸提液。将获得的全部浸提液,1 500 r/min离心4 h,去掉浸提液中的悬浮物,取上清,在60 ℃条件下进行旋转蒸发,得浸膏(约200 g)。将得到的总浸膏用适量水混悬于烧杯中,依次在浸提罐中用纯石油醚、乙酸乙酯、正丁醇萃取,将石油醚、乙酸乙酯、正丁醇萃取液,在80 ℃条件下进行旋转蒸发,得石油醚(petroleum ether,PE)浸膏31 g,乙酸乙酯(ethyl acetate,AE)浸膏120 g,以及正丁醇(n-butyl alcohol,n-BuOH)浸膏26 g。
1.3.2柘树果实抗乳腺癌有效部位确定
称取相同量获得的PE、AE,以及n-BuOH溶于二甲基亚砜(dimethyl sulphoxide,DMSO)配制为母液,进行MTT实验[20],评价三者的抑癌活性。其具体实验步骤为:收集生长对数期的细胞,通过计数来调整细胞悬液浓度,然后在96 孔板上铺板,每孔加入100 μL,使待测细胞调密度4 000/孔,且96 孔板的边缘孔用无菌磷酸缓冲盐溶液填充;含体积分数5%的CO2,37 ℃孵育,至细胞开始在孔底贴壁生长(96 孔平底板),加入质量浓 度梯度(0、10、20、40、80 μg/mL)的粗提物,原则上细胞贴壁后即可加药;用移液枪吸掉培养基,再加入含药培养基。每个质量浓度设置5 个复孔,同时设置空白组(加入培养基、MTT、DMSO)和对照组(加入细胞、培养液、MTT、DMSO,不加药物)。含体积分数5%的CO2,37 ℃孵育24 h;每孔加入10 μL MTT溶液(5 mg/mL),继续培养4 h后,小心吸去孔内混合溶液,终止培养;然后,每孔加入100 μL DMSO溶液,在酶联免疫检测仪上振摇5 min,使生成的甲瓒充分溶解,然后在波长490 nm处测量每个孔的光密度(OD)值。按下式计算生长抑制率。
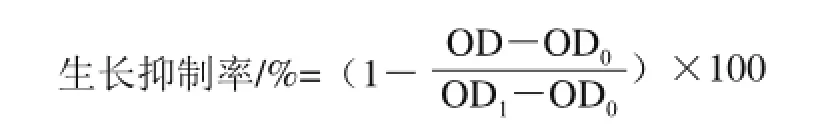
式中:OD0为空白组的光密度值;OD1为对照组的光密度值;OD为实验组的光密度值。
1.3.3柘树果实有效成分分离、结构鉴定
活性部位经硅胶柱层析。称量200~300 目硅胶,30 倍于上样量,采用干法上样法,选用石油醚-乙酸乙酯容积系统,按照比例(100∶3~0∶100)进行梯度洗脱,每50 mL收集一个馏分。在浓硫酸香草醛作为显色剂条件下,用薄层层析分析合并馏分,再用Sephadex LH-20柱色谱进行分离纯化,用的凝胶柱为25 mm×1 200 mm大小,流动相为氯仿和甲醇,其体积比为1∶1,其余步骤与硅胶柱层析方法一致。分离得到晶体化合物采用单晶衍射进行结构鉴定。
1.3.4类异黄酮物质对乳腺癌细胞的抑制作用
两种类异黄酮化合物用DMSO溶解,母液浓度为50 mmol/L。MTT实验步骤及结果处理同1.3.2节。
2 结果与分析
2.1柘树果实对乳腺癌细胞MDA-MB-231抑制效果

图1 3 种粗提物对MDA-MB-231细胞生长抑制率比较Fig.1 Inhibitory rates of three fractions against the growth of MDA-MB-231 cells
如图1所示,与PE和n-BuOH部位相比较,AE部位抑制效果更明显,IC50为75.4 μg/mL,与空白组比较,有显著性差异(P<0.05),表明柘树果实AE部分是含有抗乳腺癌成分主要活性部位。
2.2柘树果实对乳腺癌细胞MCF-7抑制效果

图2 3 种粗提物对MCF-7细胞增殖抑制率比较Fig.2 Inhibitory rates of three fractions against the growth of MCF-7 cells
如图2所示,与PE和n-BuOH部位相比较,AE部位表现出了明显的抑癌活性,IC50为66.8 μg/mL,与空白组比较,有显著性差异(P<0.05),表明柘树果实AE部分是含有抗乳腺癌成分主要活性部位。与乳腺癌细胞MDA-MB-231相比,柘树果实对乳腺癌细胞MCF-7作用更强。
2.3柘树果实分离纯化化合物晶体结构
硅胶柱层析结束,选择浓硫酸香草醛作为显色剂,经薄层层析分析合并,得到多个总馏分。再将总馏分经过Sephadex LH-20柱层析纯化,运用单晶衍射的方法,对得到量大的2 个晶体化合物:4'-O-甲基-吡喃异黄酮(45 mg)、吡喃异黄酮(35 mg)并进行结构鉴定。
化合物4'-O-甲基-吡喃异黄酮:淡黄色针晶,化合物吡喃异黄酮:黄色方晶。2 个晶体的化学结构见图3,数据见表1。
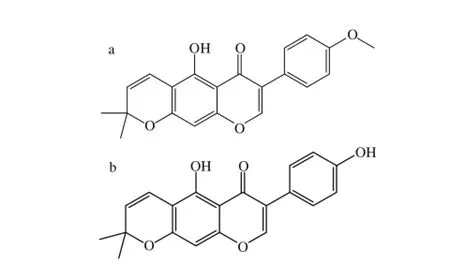
图3 4 3 4'-O-甲基-吡喃异黄酮(a)和吡喃异黄酮(b)的化学结构Fig.3 Chemical structures of 4'-O-methylalpinumfisoflavone (a) and alpinumisoflavone (b)

表 1 4'-O-甲基-吡喃异黄酮和吡喃异黄酮晶体数据Table1 Crystal structural data of 4 -methylalpinumfisoflavone and alpinumisoflavone
2.4类异黄酮物质对乳腺癌细胞的抑制作用
图1、2表明,柘树果实对乳腺癌细胞MCF-7抑制作用更明显,因此选择MCF-7细胞作为研究对象,进一步研究获得的两种类异黄酮晶体4'-O-甲基-吡喃异黄酮和吡喃异黄酮对乳腺癌细胞的生长起抑制作用。MTT实验所用的类异黄酮物质的剂量为0、10、20、40、80 μmol/L,结果如表2。在80 μmol/L浓度作用下,4'-O-甲基-吡喃异黄酮和吡喃异黄酮两种类异黄酮物质对MCF-7细胞生长抑制率分别为12.9%和56.7%,吡喃异黄酮表现出一定的抗乳腺癌活性。

表 2 4'-O-甲基-吡喃异黄酮对MCF-7细胞生长抑制率Table2 Inhibitory rates of 4' -methylalpinumisoflavone against the growth of MCF-7 cells
3 讨 论
本实验对柘果在乳腺癌方面作用进行探讨,发现柘树果实具有抗乳腺癌作用,对不同株系的乳腺癌细胞作用效果不同,其MDA-MB-231和MCF-7的IC50分别为:75.4 μg/mL和66.8 μg/mL,且乙酸乙酯部位是最有效部位。并进一步分离纯化得到2 种类 异黄酮类晶体化合物吡喃异黄酮和4'-O-甲基-吡喃异黄酮。研究吡喃异黄酮和4'-O-甲基-吡喃异黄酮对乳腺癌细胞MCF-7的抑制作用,发现吡喃异黄酮对乳腺癌细胞MCF-7具有一定的抗乳腺癌活性。有研究发现吡喃异黄酮和4'-O-甲基- 吡喃异黄酮具有氧化酶抑制活性,Han Xianghua等[16]研究发现柘果中的4'-O-甲基-吡喃异黄酮、吡喃异黄酮对鼠大脑单胺氧化酶(monoamine oxidase,MAO)抑制作用,对MAO的IC50值分别为23.9 μmol/L和25.8 μmol/L。证明本实验分离出的两种类异黄酮物质具有一定的生物活性。
异黄酮类物质具有预防乳腺癌、前列腺癌、心血管疾病和骨质疏松等疾病[21],有很强的生物效应。已有的很多科学研究表明异黄酮类化合物具有抗肿瘤的作用[22-24]。目前学术界公认的异黄酮抗肿瘤作用机制有:1)通过直接清除自由基或提高抗氧化物酶的活性来清除自由基,进而诱导肿瘤细胞凋亡;2)通过影响致癌物质的代谢酶的活性等来抑制肿瘤的发生;3)异黄酮类化合物能够显著地提高肿瘤细胞对某些化疗药物的敏感性[25]。
吡喃异黄酮和4'-O-甲基-吡喃异黄酮比传统异黄酮母核结构多一个联环,并且二者结构上只存在一个取代基的差异,但在抗乳腺癌活性研究中表现出不同的抑制效果,证明结构对功能的影响。下一步拟研究吡喃异黄酮和4'-O-甲基-吡喃异黄酮结构、生物活性及其作用机制,进一步为柘树果实营养功能的开发提供科学依据。
[1] 李贺然, 邹忠梅, 徐丽珍, 等. 柘属药用植物化学和药理活性研究进展[J]. 国际中医中药杂志, 2003, 25(4): 203-207.
[2] 宋耐宝, 杨学东, 王义明, 等. 柘木化学成分及药理活性研究现状[J].中成药, 2005, 27(3): 335-337.
[3] 张国明, 徐晓英, 奚静芳, 等. 柘木化学成分研究[J]. 中成药, 2008,30(5): 771-773.
[4] 伍伟超, 翟延君, 李正言. 柘木化学成分研究[J]. 中药材, 2010, 33(6):913-915.
[5] SEO W G, PAE H O, OH G S, et al. Ethyl acetate extract of the stem bark of Cudrania tricuspidata induces apoptosis in human leukemia HL-60 cells[J]. American Journal of Chinese Medicine, 2001, 29(2):313-320.
[6] LEE B W, LEE J H, LEE S T, et al. Antioxidant and cytotoxic activities of xanthones from Cudrania tricuspidata[J]. Bioorganic & Medicinal Chemistry Letters, 2005, 15(24): 5548-5552.
[7] KNAPP J E, SCHIFF P L. Isolation and identifi cation of constituents from Cudrania javanensis[J]. Journal of Pharmaceutical Sciences,1971, 60(11): 1729-1730.
[8] YANG G, LEE K, LEE M, et al. Inhibition of lipopolysaccharideinduced nitric oxide and prostaglandin E2 p roduction by chloroform fraction of Cudrania tricuspidata in RAW 264.7 macrophages[J]. BMC Complementary and Alternative Medicine, 2012, 12(1): 250-253.
[9] OH P S, LIM K T. Cudrania tricupidata bureau (CTB) glycoprotein inhibits proliferation by di(2-ethylhexyl) phthalate in primary splenocytes: responses in cell proliferation signaling[J]. Immunological Investigations, 2011, 40(4): 339-355.
[10] TIAN Yuhua, KIM H C, CUI Jiongmo, et al. Hepatoprotective constituents of Cudrania tricuspidata[J]. Archives of Pharmacal Research, 2005, 28(1): 44-48.
[11] 吕强, 许国祥. 拓木抗结核作用的初步研究[J]. 药学通报, 1980,15(12): 36-38.
[12] 张志, 吴海健, 皮恩浩, 等. 柘树黄酮体外抗肿瘤作用研究[J]. 世界临床药物, 2009, 30(10): 60 1-605.
[13] ZOU Yingshu, HOU Aijun, ZHU Guofu, et al. Cytotoxic isoprenylated xanthones from Cudrania tricuspidata[J]. Bioorganic & Medicinal Chemistry, 2004, 12(8): 1947-1953.
[14] 张可炜, 徐誉泰, 张举仁, 等. 银杏叶和拓树提取物的抗氧作用[J].山东大学学报: 自然科学版, 2000, 35(4): 469-472.
[15] CHOI Y J, KIM H M, KIM H D. Synthesis and cytotoxic activities of C-benzylated flavonoids[J]. Archives of Pharmacal Research, 2009,32(1): 59-63.
[16] HAN Xianghua, HONG S S, HWANG J S, et al. Monoamine oxidase inhibitory constituents from the fruits of Cudrania tricuspidata[J]. Archives of Pharmacal Research, 2005, 28(12): 1324-1327.
[17] UDDIN G M, LEE H J, JEON J S, et al. Isolation of prenylated isoflavonoids from Cudrania tricuspidata fruits that inhibit A2E photooxidation[J]. Natural Product Sciences, 2011, 17(3): 206-211.
[18] LEE H, HA H, LEE J K, et al. The fruits of Cudrania tricuspidata suppress development of atopic dermatitis in NC/Ngamice[J]. Phytotherapy Research, 2012, 26(4): 594-599.
[19] HAN Xianghua, HONG S S, JIN Qinghao, et al. Prenylated and benzylated flavonoids from the fruits of Cudrania tricuspidata[J]. Journal of Natural Products, 2008, 72(1): 164-167.
[20] CHEN Tianfeng, WONG Y S. Selenocystine induces caspaseindependent apoptosis in MCF-7 human breast carcinoma cells with involvement of p53 phosphorylation and reactive oxygen species generation[J]. International Journal of Biochemistry and Cell Biology,2009, 41(3): 666-676.
[21] VITALE D C, PIAZZA C, MELILLI B, et al. Isofl avones: estrogenic activity, biological effect and bioavailability[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2013, 38(1): 15-25.
[22] YOKOZAWA T, DONG E, NAKAGAWA T, et al. In vitro and in vivo studies on the radical-scavenging activity of tea[J]. Journal of Agricultural and Food Chemistry, 1998, 46(6): 2143-2146.
[23] BRAVO L. Polyphenols: chemistry, dietary sources, metabolism, and nutritional signifi cance[J]. Nutrition Research Reviews, 1998, 56(11):317-320.
[24] BLOCK G, PATTERSON B, SUBAR A. Fru it, vegetables, and cancer revention: a review of the epidemiological evidence[J]. Nutrition and Cancer, 1992, 18(1): 1-4.
[25] KUO S M. Dietary fl avonoid and cancer prevent ion: evidence and potential mechanism[J]. Critical Reviews in Oncogenesis, 1997, 8(1): 47-49.
Extraction, Separation and Structure Identification of Anti-breast Cancer Compounds from Cudrania tricuspidata Fruits
CAO Chunting1,2, SUN Conglong2, BAI Weibin2,*, SUN Jianxia3, LI Guoqiang2, OU Shiyi2, YANG Yong1,*
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China;2. Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China;3. Faculty of Chemical Engineering and Light Ind ustry, Guangdong University of Technology, Guangzhou 510006, China)
The purpose of the present work was to obtain anti-breast cancer compounds from Cudrania tricuspidata fruits. The methanol extract of Cudrania tricuspidata fruits was sequentially extracted with petroleum ether (PE), ethyl acetate (AE) and n-butyl alcohol (n-BuOH) to obtain PE, AE and n-BuOH fractions. MTT assay was used to evaluate the anti-breast cancer activity of the methanol extract and its three fractions against breast cancer cell lines MDA-MB-231 and MCF-7. The results showed that the AE fraction had significant inhibitory activity on MDA-MB-231 and MCF-7 cells with half maximal inhibitory concentrations (IC50) of 75.4 and 66.8 μg/mL, respectively. Then, the AE fraction was further separated by silica gel column chromatography a nd Sephadex LH-20 column chromatography assay. The structures of crystals obtained from this separation process were identifi ed using single-crystal X diffraction. Two major crystal components were identifi ed including 4'-O-methylalpinumisofl avone and alpinumisofl avone. As evaluated by MTT assay, the inhibitory rate of alpinumisofl avone against MCF-7 cell growth was 56.7%. Therefore, t he AE fraction from Cudrania tricuspidata fru its containing isofl avones and alpinumisofl avones has pot ent anti-breast cancer activity depending on the presence of alpinumisofl avone.
Cudrania tricuspidata (Carr.) Bur. fruits; separation and extraction; anti-breast cancer; structural identifi cation
R151
A
1002-6630(2015)13-048-04
10.7506/spkx1002-6630-201513010
2014-12-27
“十二五”国家科技支撑计划项目(2012BAD36B04)
曹春廷(1990—),女,硕士研究生,研究方向为食品营养。E-mail:caochunting1@163.com
白卫滨(1978—),男,副研究员,博士,研究方向为食品营养与毒理安全性评价。E-mail:baiweibin@163.com杨勇(1969—),男,教授,博士,研究方向为肉品科学与技术。E-mail:yangyong676@163.com
