SDS+HCl催化合成亲水性植物甾醇酯
2015-10-29何文森王慧慧张金库苏春燕马海乐贾承胜冯骉
何文森,王慧慧,张金库,苏春燕,马海乐,贾承胜,冯骉
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江南大学食品学院,江苏无锡214122)
SDS+HCl催化合成亲水性植物甾醇酯
何文森1,王慧慧1,张金库1,苏春燕1,马海乐1,贾承胜2,冯骉2
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.江南大学食品学院,江苏无锡214122)
作者通过两步法将植物甾醇与聚乙二醇结合,即植物甾醇先与琥珀酸酐反应合成植物甾醇琥珀酸单酯(简称单酯),后者再与聚乙二醇酯化制备新型亲水性植物甾醇酯(植物甾醇聚乙二醇琥珀酸二酯,简称二酯)。考察了胶束催化剂对二酯合成的影响,研究了反应条件对转化率的影响。结果表明,十二烷基硫酸钠加盐酸为合成亲水性植物甾醇酯的高效催化剂。在催化剂用量为质量分数6%,单酯与聚乙二醇摩尔比为1∶2,140℃下反应2 h目标产物的转化率可达96%。
植物甾醇;亲水性;聚乙二醇;十二烷基硫酸钠
植物甾醇是植物中天然存在的一种微量活性成分,主要包括β-谷甾醇、豆甾醇、菜油甾醇和菜籽甾醇4种。植物甾主要存在于谷物、豆类、种子、水果、蔬菜、坚果及其副产品。目前,植物油精炼过程产生的脱臭馏出物是植物甾醇的主要来源;另外,造纸业副产物妥尔油也含有大量的植物甾醇,是植物甾醇的另一重要来源[1-2]。
研究发现,植物甾醇主要通过抑制胆固醇在小肠内的吸收,可以有效降低血液TC及LDL-C含量,而对人体有益的HDL-C含量却没有影响[3]。近年来还发现植物甾醇具有抗肿瘤、降低心脏病发生率、抗氧化、抗癌、消炎、退热、防止前列腺疾病、提高免疫力、皮肤保健和美容等多种重要的生理功能[4-8],可广泛应用于食品、医药和化妆品等行业。因此,植物甾醇正受到国内外越来越多的重视。
植物甾醇常温下为结晶形式,其生物可利用性较差。植物甾醇独特的化学结构决定了它具有不溶于水、油溶性低和熔点高等特点,极大地限制了其实际应用。截至目前,大量研究将植物甾醇与脂肪酸或脂肪酸酯通过直接酯化或酯交换反应生成植物甾醇酯,以改善植物甾醇的油溶性,拓宽它在油脂或富含脂肪食品中的应用。Pan等先将Candida sp.99-125脂肪酶固定化处理,后用于植物甾醇油酸酯的合成,最高产率可以到达93%[9]。Zheng等将Candida rugosa脂肪酶通过环氧基固定在磁性微球上,利用此固定酶合成植物甾醇亚麻酸酯,在酸醇摩尔比为2∶1,55℃下反应15 h,最高酯化率可达93%[10]。目前中国市场上已有许多添加植物甾醇或甾醇酯的油脂产品,如金龙鱼植物甾醇玉米油、福临门植物甾醇玉米油、多利甾醇玉米油等。
曾有人利用包埋、微乳、喷雾干燥等物理方法制备富含植物甾醇的相关产品,以改善植物甾醇在水相体系的分散性。Wai-Fun Leong等利用溶剂置换法制备甾醇微乳液,得到微乳液最小粒径为328 nm,PDI为0.16[11]。Alexander等利用大豆磷脂将植物甾醇制成纳米脂质体,当磷脂与甾醇质量比为14∶1和13∶2时制得的脂质体平均粒径为115 nm和150 nm[12]。尽管可在一定程度上改善植物甾醇类化合物在水中的分散性,但通过这些方法制备的植物甾醇类食品具有稳定性差等缺点,会影响食品的感官品质、食用价值和质量安全,不利于产品的长期储存。
目前,国内外鲜有通过分子修饰的方法改善植物甾醇水溶性或亲水性的研究报道。作者以琥珀酸酐为偶联剂,聚乙二醇为修饰剂,通过两步反应将植物甾醇与聚乙二醇结合制备亲水性植物甾醇酯(植物甾醇聚乙二醇琥珀酸二酯,简称二酯),重点研究单酯与聚乙二醇反应制备二酯的合成工艺。
1 材料与方法
1.1材料与仪器
植物甾醇(>95%):江苏春之谷生物制品有限公司提供;无水乙醇、正己烷、石油醚(60~90℃)、甲酸、甲醇、异丙醇、乙酸乙酯、盐酸为分析纯、聚乙二醇(平均相对分子质量1 000,PEG)、十二烷基硫酸钠:化学纯,均购自国药集团化学试剂有限公司;柱层层析硅胶:购自青岛海洋化工厂。
安捷伦1100高效液相色谱仪:美国安捷伦公司产品;ZAM 4000蒸发光散射检测器:德国Schambeck公司产品;DF-101S集热式加热搅拌器:常州普天仪器制造有限公司产品;电热恒温鼓风干燥箱:上海跃进医疗器械厂产品;循环水式多用真空泵:郑州长城科工贸有限公司产品;旋转蒸发器RE-2000B:上海亚荣生化仪器厂产品;JA2003电子天平:上海上平仪器有限公司产品。
1.2实验方法
1.2.1植物甾醇琥珀酸单酯的制备植物甾醇琥珀酸单酯(简称单酯)的制备方法见参考文献[13]。具体反应如下:取4.1 g植物甾醇,1.5 g琥珀酸酐分别加入圆底三口烧瓶,依次加入100 mL甲苯和体积分数1.5%吡啶分别作溶媒和催化剂,固定好冷凝回流管和温度计,油浴加热,回流状态下反应24 h得单酯粗产品。经高效液相色谱分析测得中间产物单酯的转化率达91%。
1.2.2单酯的分离纯化将60 g 100-200目柱层析硅胶G放入烧杯,加入250 mL洗脱溶剂,洗脱剂为v(石油醚)∶v(乙酸乙酯)∶v(甲酸)=5∶5∶0.01,充分搅匀,室温下浸泡2 h。将充分浸泡的硅胶缓缓装入扩口层析柱(D1.2 cm×80 cm),避免气泡出现,待硅胶充分沉降后,静置一晚,待用。
将0.8 g样品溶于5 mL洗脱溶剂,上样,用洗脱剂洗脱硅胶柱,用自动收集器收集洗脱液,10 min/管,并用薄层色谱分析跟踪洗脱产物,将比移值一致的产物合并收集,将分离纯化后的单酯纯品用作后续反应的原料。
1.2.3催化剂的制备称取适量的十二烷基硫酸钠(SDS)放入研钵中,在通风橱中滴加过量盐酸(HCl),研磨大约3 min后,静置约5 min,使SDS与HCl充分接触反应,生成十二烷基硫酸(SDS+HCl),备用。催化剂为每次实验前现配。
1.2.4二酯的制备称取一定量的聚乙二醇加入反应试管,置于温度恒定的油浴磁力搅拌加热装置,开启磁力搅拌,待样品完全熔化后再依次加入单酯、催化剂、通入氮气,开始计时反应。
1.2.5高效液相色谱分析称取待分析产物溶于无水乙醇,配成一定质量浓度的溶液(1~2 mg/mL),用注射器吸取大约1 mL溶液,经0.45 μm有机滤膜过滤后分析。高效液相色谱系统,包括高效液相色谱仪、蒸发光散射检测器和N2000数据处理软件。色谱柱为美国Waters公司的symmetry C18反相柱(D 4.6 mm×150 mm,5 μm),v(甲醇)∶v(甲酸)=1 000∶1,进样量为10 μL。蒸发光散射检测器参数:温度为60℃,载气为氮气,压力为0.2 MPa。其中,分析植物甾醇与琥珀酸酐反应物的流量为0.6 mL/min,柱温25℃。分析纯植物甾醇琥珀酸单酯、聚乙二醇、催化剂SDS+HCl以及植物甾醇琥珀酸单酯与聚乙二醇反应物所用流量均为1.0 mL/min,柱温35℃。
单酯转化率(%)=单酯的峰面积/(植物甾醇的峰面积+单酯的峰面积)×100%
二酯转化率(%)=二酯的峰面积/(单酯的峰面积+二酯的峰面积)×100%
2 结果与讨论
2.1高效液相色谱分析
图1是植物甾醇与琥珀酸酐反应混合物的高效液相色谱图。流动相为含有体积分数1%甲酸的甲醇溶液,流速为0.6 mL/min,柱温为25℃。由图可知,琥珀酸酐保留时间为4.8 min,植物甾醇琥珀酸单酯的保留时间主要集中在21~26 min,植物甾醇的保留时间主要集中在27~30 min。植物甾醇主要包含4种成分,即β-谷甾醇、豆甾醇、菜油甾醇和菜籽甾醇,故植物甾醇丁二酸单酯也含有四种,分别为β-谷甾醇丁二酸单酯、豆甾醇丁二酸单酯、菜油甾醇丁二酸单酯和菜籽甾醇丁二酸单酯。由图可知,植物甾醇琥珀酸单酯与植物甾醇具有类似的峰型结构。β-谷甾醇保留时间为30.4 min,β-谷甾醇丁二酸单酯对应26.8 min。豆甾醇保留时间为29.1 min,豆甾醇丁二酸单酯对应25.5 min。菜油甾醇保留时间为27.7 min,菜油甾醇琥珀酸单酯对应24.6 min。菜籽甾醇含量较低,保留时间小于26 min,色谱峰与单酯重合,而菜籽甾醇琥珀酸单酯对应21.8 min。

图1 植物甾醇与琥珀酸酐反应混合物的高效液相色谱图Fig.1High performance liquid chromatogram of reaction mixture of phytosterols with succinic anhydride
图2(a)是反应原料聚乙二醇的高效液相色谱图。由图可知,聚乙二醇的保留时间为2.74 min。图2(b)是纯的植物甾醇琥珀酸单酯的高效液相色谱图。由图可知,植物甾醇琥珀酸单酯的保留时间主要集中在9~12 min。因为植物甾醇主要包含4种成分,故植物甾醇丁二酸单酯也含有4种主要成分,分别为β-谷甾醇丁二酸单酯、豆甾醇丁二酸单酯、菜油甾醇丁二酸单酯和菜籽甾醇丁二酸单酯。由图2(b)可知,β-谷甾醇丁二酸单酯的保留时间为11.69 min,豆甾醇丁二酸单酯的保留时间为11.09min,菜油甾醇丁二酸单酯的保留时间为10.72 min,菜籽甾醇丁二酸单酯的保留时间为9.60 min。图2(c)是催化剂SDS+HCl的高效液相色谱图。由图可知,SDS-HCl的保留时间为2.39 min。
图3是植物甾醇琥珀酸单酯与聚乙二醇反应混合物的高效液相色谱图。通过与图2对比发现,图3中出现了一个新的色谱峰,说明植物甾醇琥珀酸单酯与聚乙二醇在SDS+HCl催化作用下生成了新的产物。聚乙二醇是一种混合物,相对分子质量分布较广,这与产物呈现出较宽的色谱峰型吻合。由此可初步判定,新出现的色谱峰对应产物植物甾醇聚乙二醇丁二酸二酯。由图可知,产物与反应原料以及催化剂可以明显地分开。
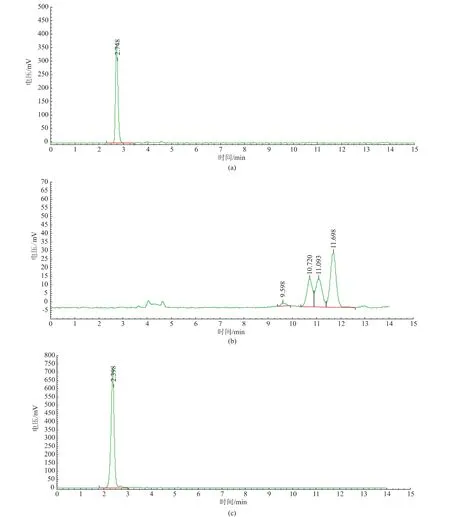
图2 聚乙二醇(a),植物甾醇丁二酸单酯(b),SDS+HCl(c)的高效液相色谱图Fig.2High performance liquid chromatograms of PEG(a),phytosterol hemisuccinate(b)and SDS+HCl(c)

图3 植物甾醇琥珀酸单酯与聚乙二醇反应混合物的高效液相色谱图Fig.3High performance liquid chromatogram of reaction mixture of phytosterol hemisuccinate with PEG
2.2催化剂种类
研究发现,胶束催化剂十二烷基硫酸盐可以有效催化植物甾(烷)醇脂肪酸酯的合成,以改善其油溶性[14-17]。作者首次将十二烷基硫酸盐催化剂用于亲水性植物甾醇酯的合成研究。在预实验基础上,对比研究了SDS,HCl,SDS+HCl对二酯的合成影响,结果见图4所示。由图可知,SDS和SDS+HCl均能催化二酯的合成。SDS是一种阴离子表面活性剂,其催化机理可能与胶束催化有关。同样条件下,以SDS为催化剂时产物的转化率达50%,而SDS+HCl做催化剂时,产物的转化率可达60%。SDS+HCl的催化效率高于SDS,这可能是由于SDS与HCl结合后,更易形成胶束,从而使得反应转化率提高。当以HCl为催化剂时,几乎无二酯生成,这主要是由于HCl是易挥发性酸,沸点仅为57℃,在反应过程中,很快被载气氮气带走。
马媛等发现SDS用于催化合成亚油酸甾烷醇酯,在酸醇摩尔比3∶1,催化剂用量3%,150℃下反应时间5 h,产物转化酯化率达到81.2%[16]。董涛等以SDS+HCl为催化剂,成功合成了植物甾醇月桂酸酯。在酸醇摩尔1.4∶1,催化剂用量为质量分数1.5%,120℃下反应4 h,产物转化率可达87%[14]。因此,选择SDS+HCl为后续反应催化剂。

图4 催化剂种类对转化率的影响Fig.4Effect of different catalysts on the conversion of the product
2.3反应温度
温度是影响酯化反应的一个重要因素。本反应体系为无溶剂体系,因此反应温度至关重要。温度过低,底物不能熔化,酯化反应无法进行。聚乙二醇的熔点在60℃左右,而植物甾醇琥珀酸单酯的熔点高达160℃。因此,最低反应温度选为100℃。图5是不同反应温度对二酯转化率的影响。由图可知,反应温度为100℃时,二酯的转化率很低,不足40%。在100℃时聚乙二醇可以熔化成液态,但单酯不能完全溶解在液态聚乙二醇,底物之间的有效碰撞机会较少,从而影响产物的转化率。随着反应温度的升高,转化率逐渐增加;当反应温度增加到140℃时,转化率可达80%。虽然尚未达到单酯完全熔化的温度,但距熔化温度较近,在液态聚乙二醇的“溶解”下,底物已变为液态,这有助于酯化反应的进行。进一步增加反应温度,二酯转化率没有显著变化。因此,反应温度以140℃为宜。
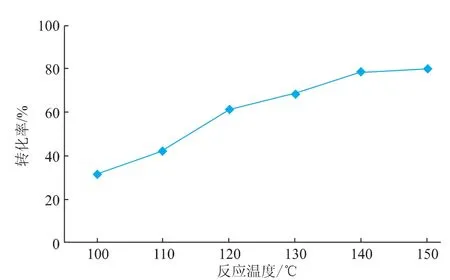
图5 不同反应温度下的转化率Fig.5Effect of reaction temperature on the conversion of the product
2.4催化剂用量
催化剂用量对二酯转化率的影响如图6所示。添加适量催化剂有利于酯化反应的进行,但并非加入量越大,催化效果就越好。由图可知,催化剂用量为底物质量的4%时,产物转化率不足80%。增加催化剂用量,产物转化率逐渐增加,当催化剂用量为6%时,产物转化率达83%。继续增加催化剂用量,二酯转化率没有明显提高。这主要是由于在熔融液态下,适量的催化剂与底物能实现充分地接触。催化剂用量过高,不但不能提高二酯转化率,反而会增加成本。因此,催化剂用量以单酯质量的6%为宜。

图6 不同催化剂用量的转化率Fig.6Effect of catalyst dose on the conversion of the product
2.5底物摩尔比
聚乙二醇与单酯的摩尔比对转化率的影响如7所示。由图可知,随着聚乙二醇与单酯的摩尔比增加,二酯的转化率逐渐增加。这是因为,酯化反应是一个可逆反应,增加其中一种反应底物的用量,有助于促进另外一种底物的转化。当聚乙二醇与单酯的摩尔比为2∶1时,产物的转化率较高,此时为88%。继续增加聚乙二醇的摩尔用量,产物的转化率变化不明显,这是由于酯化反应趋于平衡。因此,聚乙二醇与单酯的最适摩尔比为2∶1。
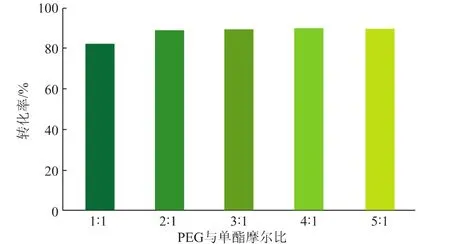
图7 不同反应物摩尔比的转化率Fig.7Effect of the molar ratio of PEG to hemisuccinate on the conversion of the product
2.6反应时间
在前面各最优条件下,考察反应时间对产物转化率的影响,结果如图8所示。由图可知,随着反应时间的延长,底物反应越彻底,二酯的转化越高。由图11可以看出,反应1 h产物的转化率可达87%;反应2 h二酯的转化率可达96%。继续延长反应时间,二酯转化率没有明显提高,说明反应2 h已接近平衡。
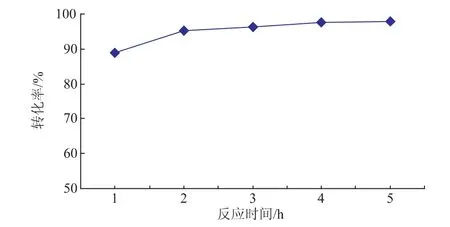
图8 不同反应时间对转化率的影响Fig.8Effect of reaction time on the conversion of the product
3 结语
作者通过两步法成功合成了亲水性植物甾醇酯(植物甾醇聚乙二醇琥珀酸二酯),即用植物甾醇与琥珀酸酐合成单酯,后者再与聚乙二醇结合。重点通过单因素试验考察了以SDS+HCl为催化剂对二酯合成的影响,结果发现:在催化剂用量为质量分数6%,单酯与聚乙二醇摩尔比为1∶2,140℃下反应2 h二酯的转化率可达96%,说明SDS+HCl是一种合成亲水性植物甾醇酯的高效催化剂。
[1]Moreau Robert A,Whitaker Bruce D,Hicks Kevin B.Phytosterols,phytostanols,and their conjugates in foods:structural diversity,quantitative analysis,and health-promoting uses[J].Progress in Lipid Research,2002,41:457-500.
[2]Fernandes P,Cabral J M S.Phytosterols:applications and recovery methods[J].Bioresource Technology,2007,98:2335-2350.
[3]Smet Els De,Mensink Ronald P,Plat Jogchum.Effects of plant sterols and stanols on intestinal cholesterol metabolism:suggested mechanisms from past to present[J].Molecular Nutrition and Food Research,2012,56:1058-1072.
[4]BrufauGemma,CanelaMiguel Angel,Rafecas Magda.Phytosterols:Physiologicandmetabolicaspectsrelatedto cholesterol-lowering properties[J].Nutrition Research,2008,28:217-225.
[5]Bradford Peter G,Awad Atif B.Phytosterols as anticancer compound[J].Molecular Nutrition and Food Research,2007,51:161-170.
[6]Rudkowska Iwona.Plant sterols and stanols for healthy ageing[J].Maturitas,2010,66:158-162.
[7]Tan Zhuliang,Le Khuong,Moghadasian Mohammed,et al.Enzymatic synthesis of phytosteryl docosahexaneates and evaluation of their anti-atherogenic effects in apo-E deficient mice[J].Food Chemistry,2012,134:2097-2104.
[8]Tan Zhuliang,Shahidi Fereidoon.A novel chemoenzymatic synthesis of phytosteryl caffeates and assessment of their antioxidant activity[J].Food Chemistry,2012,133:1427-1434.
[9]Pan Xinxin,Chen Biqiang,Wang Juan,et al.Enzymatic synthesizing of phytosterol oleic esters[J].Applied Biochemistry and Biotechnology,2012,168:68-77.
[10]Zheng Ming-Ming,Dong Ling,Lu Yong,et al.Immobilization of Candida rugosa lipase on magnetic poly(allyl glycidyl ether-co-ethylene glycol dimethacrylate)polymer microsphere for synthesis of phytosterol esters of unsaturated fatty acids[J]. Journal of Molecular Catalysis B:Enzymatic,2012,74:16-23.
[11]Leong WAI FUN,Man Yaakob B.Che,Lai Oi Ming,et al.Optimization of processing parameters for the preparation of phytosterol microemulsions by the solvent displacement method[J].Journal of Agricultural and Food Chemistry,2009,57:842-8433.
[12]Alexander M,Lopez A Acero,Fang Y,et al.Incorporation of phytosterols in soy phospholipids nanoliposomes:Encapsulation efficiency and stability[J].LWT-Food Science and Technology,2012,47:427-436.
[13]He Wen-Sen,Li Jing-Jing,Pan Xiao-Xia,et al.Lipase-mediated synthesis of water-soluble plant stanol derivatives in tert-butanol[J].Bioresource Technology,2012,114:1-5.
[14]贾承胜,张印,徐菁苒,等.植物甾醇脂肪酸酯的胶束催化合成研究[J].食品与生物技术学报,2011,30(6):894-898. JIA Chengsheng,ZHANG Yin,XU Jinran,et al.Synthesis of phytosterol fatty acid esters using micelle-catalyst[J].Journal of Food Science and Biotechnology,2011,30(6):894-898.(in Chinese)
[15]董涛,贾承胜,张晓鸣.SDS催化合成植物甾醇月桂酸酯的研究[J].食品与机械,2008,24(3):44-47. DONG Tao,JIA Chengsheng,ZHANG Xiaoming.Synthesis of phytosterol laurate catalyzed by SDS[J].Food&Machinery,2008,24(3):44-47.(in Chinese)
[16]马媛,贾承胜,张晓鸣,等.无溶剂直接酯化法合成亚油酸甾烷醇酯的研究[J].食品工业科技,2012,33(6):285-289. MA Yuan,JIA Chengsheng,ZHANG Xiaoming,et al.Synthesis of phytostanyl esters of linolic acid by direct esterification without solvent[J].Science and Technology of Food Industry,2012,33(6):285-289.(in Chinese)
[17]HE Wensen,MA Yuan,Pan Xiaoxia,et al.Efficient solvent-free synthesis of phytostanyl esters in the presence of acid-surfactant-combined catalyst[J].Journal of Agricultural and Food Chemistry,2012,60:9763-9769.
SDS+HCl Catalyzed Synthesis of Hydrophilic Phytosterol Esters
HE Wensen1,WANG Huihui1,ZHANG Jinku1,SU Chunyan1,MA Haile1,JIA Chengsheng2,FENG Biao2
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The present study was to synthesize novel hydrophilic phytosterol esters through an intermediate phytosterol hemisuccinate,which was first prepared with phytosterols and succinic anhydride and subsequently coupled with polyethylene glycol.The effects of micelle catalyst and reaction conditions were investigated.Results showed that the combination of sodium lauryl sulfate and hydrochloric acid was highly efficient in the catalysis for the ester synthesis.The optimum reaction conditions were:6%catalyst dose(w/w),1∶2 molar ratio of phytosterol hemisuccinate to phytosterol polyethylene glycol succinate at 140℃for 2 h.With the optimum conditions,the conversion reached above 96%.
phytosterols,hydrophilic,polyethylene glycol,sodium lauryl sulfate
TS 229
A
1673—1689(2015)10—1020—07
2014-12-26
国家自然科学基金项目(31401664);中国博士后科学基金(2014M560406);江苏大学高级人才科研启动基金(13JDG070);江苏高校优势学科建设工程资助项目。
何文森(1985—),男,四川巴中人,工学博士,讲师,硕士研究生导师,主要从事食品科学研究。E-mail:wshe2013@163.com
