蛋白酶产生菌的筛选、鉴定及酶学性质研究
2015-10-28李婵娟王婧杨洁
李婵娟 王婧 杨洁


摘要:采用干酪素平板透明圈法从垃圾附近的土壤中分离得到1株产蛋白酶的优良菌株,通过测定其16S rDNA基因序列,鉴定该菌为铜绿假单胞菌(Pseudomonas aeruginosa)。以酪蛋白为底物对该菌所产蛋白酶粗酶液进行了酶学性质研究,结果表明,该酶最适反应pH为8.5,为碱性蛋白酶;在pH 6.0~9.0的缓冲液中于4 ℃放置12 h后仍有90%以上的酶活性,说明该酶在中性和碱性条件下非常稳定。该酶最适反应温度为55 ℃,在70 ℃和80 ℃处理30 min后仍分别保有68%和45%的残余酶活性,从而表明该酶具有较好的热稳定性。Mg2+和Fe2+对该酶活性几乎没有影响,K+和Mn2+对该酶活性有轻微的抑制作用,EDTA对该酶活性有明显的抑制作用;Cu2+对该酶活性也有26%的抑制作用,只有Ca2+对该酶活性有10%左右的促进作用。
关键词:蛋白酶产生菌;分离;鉴定;酶学性质
中图分类号:Q814.1 文献标识码:A 文章编号:0439-8114(2015)19-4794-04
DOI:10.14088/j.cnki.issn0439-8114.2015.19.035
Abstract:A bacterium producing high protease was isolated from soil around the dump by method of casein plate. The strain was identified as Pseudomonas aeruginosa by measuring its 16S rDNA sequence. The characteristics of the crude protease produced by this strain were studied by using casein as the substrate. The results showed that the crude protease displayed the maximum activity at pH 8.5, therefore, this enzyme was an alkalic protease. The crude enzyme still had 90% of the highest activity after overnight incubation at 4 ℃, pH 6.0~9.0, indicating that the enzyme was very stable under neutral or alkaline conditions. The optimum temperature of the enzyme was 55 ℃. After incubation at 70 ℃ and 80 ℃ for 30 min, it remained 68% and 45% of the highest activity, respectively,so the protease was considered to have a superior thermal stability. The activity of the protease may be dependent on divalent metal ions, because it was not affected by Mg2+ or Fe2+ and was slightly inhibited by K+ and Mn2+, but was obviously inhibited by EDTA, strongly inhibited by Cu2+, reducing by 26% of its activity, and only Ca2+ could increased the activity by 10%.
Key words: protease-producing bacteria; isolation; identification; enzymatic property
蛋白酶是催化水解蛋白质肽键的一类酶的总称,它作用于蛋白质,将其分解为游离氨基酸或多肽。蛋白酶是一种重要的工业化应用酶制剂,广泛应用于洗涤、制革、医药、食品加工、饲料、化学工业、废物处理等行业[1]。蛋白酶普遍存在于动植物及微生物中,其中微生物所产的蛋白酶都是胞外酶,而且微生物具有生长速度快、生长条件较简单、下游技术处理相对简单并适用于大规模生产等优点,因此微生物成为了生物酶的重要来源[2]。但是,利用微生物生产蛋白酶技术还存在产物活性不高、性质差异性大、基因工程菌不稳定等问题,因此筛选高产蛋白酶生产菌株仍是解决诸多问题的重要手段[3]。另外,新型蛋白酶的研究对新产品开发和拓宽应用领域以及深化对多样性、序列和分子进化等领域的认识均有重要意义[4]。因此,本试验对高产蛋白酶的菌株进行了筛选和鉴定工作,并对其酶学性质进行了研究,期望获得具有工业应用价值的蛋白酶。
1 材料与方法
1.1 材料
1.1.1 土样 取校园垃圾堆、污水沟附近的土壤,从中分离产蛋白酶的菌株。
1.1.2 主要试剂及仪器 酪蛋白(AR)、酪氨酸(AR)、福林酚(GR)、PCR相关试剂(GR)、PCR仪(Bio-rad Thermal Cycler MyCycler)、高速离心机(5424型,Eppendorf)、722可见分光光度计、振荡培养箱(SPX-250B-D型)、电热恒温培养箱(DNP-9082BS型)等。
1.1.3 培养基 筛选培养基:牛肉膏1.0%,蛋白胨0.5%,NaCl 0.5%,琼脂1.6%,干酪素1.0%,pH 7.0。复筛发酵培养基:蛋白胨0.5%,干酪素0.8%,酵母膏0.1%,葡萄糖0.1%,NaCl 0.58%,柠檬酸三钠0.45%,pH 7.0。
1.2 方法
1.2.1 产酶菌株的初筛 称取所采集的土样10 g加至装有90 mL无菌去离子水的250 mL三角瓶中,振荡30 min后静置2 min,取上清液1 mL加入到装有9 mL无菌去离子水的试管中,充分混匀,即成10-1的稀释菌液,再吸取1 mL 10-1的稀释菌液移入9 mL无菌水的试管中并摇匀,得到的菌悬液浓度稀释为10-2,依次进行,得到稀释梯度为10-3、10-4、10-5、10-6的菌悬液。分别吸取100 μL的10-4、10-5、10-6梯度的菌悬液至筛选培养基平皿中,涂布均匀后,置于37 ℃的恒温培养箱中培养过夜,挑选产生透明圈的单菌落。
1.2.2 产酶菌株的复筛与酶活性测定 挑选初筛产透明圈的菌株接种至液体发酵培养基中,置于37 ℃的恒温摇床上振荡培养16 h后测定发酵液的酶活。
1)标准曲线的制作。精确称取酪氨酸50 mg,加少量0.2 mol/L HCl溶解,用去离子水定容至100 mL(500 μg/mL),再将此标准液稀释到浓度为0~100 μg/mL,取不同浓度的稀释液1 mL加0.5%酪蛋白溶液2 mL,放入37℃水浴中保温20 min,再加入10%三氯乙酸3 mL ,混匀,在6 000 r/min下离心8 min。取上清液1 mL,加0.55 mol/L Na2CO3溶液5 mL 和福林酚试剂1 mL,放入37 ℃水浴中显色15 min。用不含酪氨酸溶液的试剂作为对照,在680 nm波长下测定吸光度。以酪氨酸的含量为横坐标,吸光度为纵坐标,绘制标准曲线。
2)酶活力的测定。各取1 mL粗酶液置于两支离心管中,其中一支放入沸水中煮沸5 min使酶液灭活作为对照管,另一支为测定管。在对照管和测定管中分别加入2 mL 0.5%酪蛋白溶液,然后置于55 ℃水浴中反应20 min,取出后向两支离心管中均加入10%的三氯乙酸3 mL,混匀,离心。在两支离心管中各取上清液1 mL,加0.55 mol/L Na2CO3溶液5 mL和福林酚试剂1 mL。放入37 ℃水浴中显色15 min。用对照管调零,根据吸光度计算酶活。单位酶活定义:1 mL酶液在特定条件下每分钟水解酪蛋白溶液生成1 μg酪氨酸所需要的酶量定义为1个酶活力单位。
1.2.3 产酶菌株的初步鉴定 对复筛所得的菌株测定其16S rDNA基因序列以进行菌株鉴定。使用细菌基因组DNA小量纯化试剂盒(北京庄盟国际生物基因科技有限公司)提取基因组DNA,然后进行PCR扩增。细菌16S rDNA基因的通用引物序列为:P1:5′-AGAGTTTGATCCTGGCTCAG-3′;P2: 5′-ACGGCTACCTTGTTACGACTT-3′。PCR反应体系包括10×PCR反应缓冲液5 μL;dNTP (10 mmol/L)1 μL;引物P1、P2(10 μmol/L)各1 μL;模板DNA 1 μL;Taq DNA Polymerase (5 U/μL) 1 μL;最后补充去离子水至50 μL。PCR反应条件为94 ℃预变性 5 min; 94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸100 s,共30个循环;72 ℃ 延伸7 min。PCR产物经琼脂糖凝胶电泳分离,切胶回收后送至华大基因公司进行测序。将所测细菌16S rDNA基因序列同GenBank数据库的基因序列进行比对分析,以确定该菌类型。
1.2.4 产酶菌株酶学性质的研究 ①pH对酶活性的影响。配制pH 3.0~10.0梯度缓冲溶液(pH 3.0~8.0为Na2HPO4-柠檬酸缓冲液,pH 8.5~10.0为NaOH-Gly缓冲液),以不同pH缓冲液配制0.5%酪蛋白底物,按照上述酶活性测定方法,测定酶液在不同pH条件下的酶活。②酶的pH稳定性。各取1 mL酶液于pH 3.0~10.0的缓冲液中4 ℃放置12 h,以最适pH缓冲液配制0.5%酪蛋白底物测定活性,以未用缓冲液处理酶液的酶活为100%,计算相对酶活性。③温度对酶活性的影响。以最适pH缓冲液配制浓度为0.5%酪蛋白底物,按照酶活性测定方法测定酶液在不同温度下的酶活,以确定酶液的最适反应温度。④酶的热稳定性。各取1 mL酶液分别放入30、40、50、60、70、80 ℃的水浴锅中保温30 min,然后在最适pH和最适温度下测定酶活性,以未处理酶液的酶活为100%,计算相对酶活。⑤金属离子对酶活性的影响。按照酶活的测定方法,测定终浓度为1 mmol/L的Fe2+、Mg2+、K+、Mn2+、Cu2+、Ca2+和EDTA对酶活性的影响,对照反应体系中不加任何化合物,以对照酶活为100%,计算相对酶活。
2 结果与分析
2.1 产酶菌株的初筛结果
通过酪蛋白筛选培养基初筛后获得6株产透明圈菌株,测定6株菌的菌落直径和透明圈直径,并计算透明圈直径和菌落直径的比值,结果如表1所示。由表1可知,5号菌和6号菌的透明圈直径与菌落直径的比值较大。有文献[3,5]报道,透明圈直径大小以及透明圈与菌落直径的比值与蛋白酶活力高低并非呈显著的正相关。因此,对6株菌株均进行摇瓶发酵复筛,分别测定其发酵液酶活。
2.2 产酶菌株的复筛结果
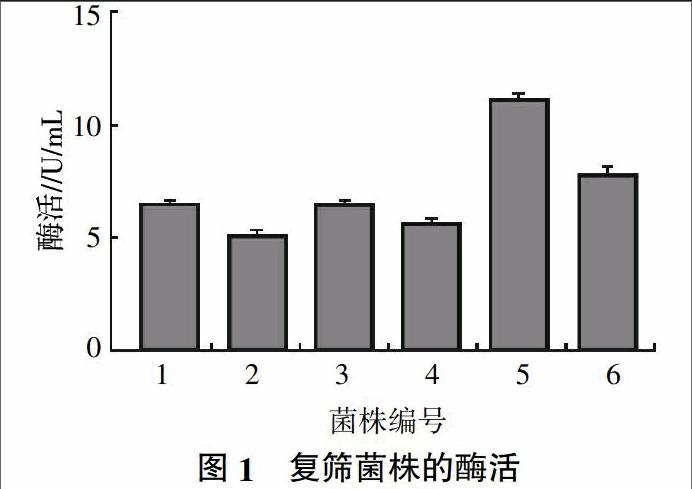
在酪氨酸浓度为0~100 μg/mL范围内,测定其680 nm吸光度,得到标准曲线方程y=0.001 6x+0.004 4,R2=0.996 0。根据酪氨酸标准曲线方程,计算6株菌株发酵液粗酶的活性如图1所示,过夜培养后5号菌的酶活最高,达到11.5 U/mL,因此选择5号菌株进行分子鉴定和酶学性质测定。
2.3 产酶菌株的初步鉴定结果
将5号菌株的16S rDNA测序结果通过Blast软件与GenBank数据库进行同源性比对后,结果表明该序列与假单胞菌属铜绿假单胞菌(Pseudomonas aeruginosa)菌株同源性最高,达到99%。细菌分类学家认为,当16S rDNA的同源性高于97%时,可以认为是属内同种,低于95%则认为是属外成员[3]。根据同源性比对结果,初步确定该菌为铜绿假单胞菌。
2.4 产酶菌株的酶学性质
2.4.1 pH对酶活性的影响 pH对酶活性有重要的影响,反应体系中的pH会影响酶和底物基团的解离状态和电荷性质,从而影响酶与底物复合物的形成,最终影响酶活力,极端pH条件下甚至会使酶蛋白变性。由图2可知,当pH<5.0时,酶活非常低;该酶在pH 5.5~10.0时活性均较高,且在pH 8.5时酶活达到最大,说明该蛋白酶为碱性蛋白酶。碱性蛋白酶广泛应用于洗涤、制革和食品加工行业,因此该酶在这些领域具有应用潜力。目前工业应用的碱性蛋白酶生产菌株多为芽孢杆菌属(Bacillus sp.)[6],但国外有学者尝试利用制革工业中含蛋白质的废弃物发酵铜绿假单胞菌生产蛋白酶[7]。
2.4.2 酶的pH稳定性 酶液在不同pH缓冲液中于4 ℃保存12 h后,测得的相对酶活如图3所示。由图3可知,当缓冲液pH<4.0时,相对酶活低于50%;在pH 4.0~10.0的缓冲液中,相对酶活均在60%以上,尤其是在pH 6.0~9.0的缓冲液中相对酶活达到90%以上,说明该酶的pH稳定性较好,尤其是在中性和碱性条件下该酶非常稳定,这更有利于该酶的工业应用。
2.4.3 温度对酶活性的影响 反应温度对酶活性也有较大的影响,一方面温度升高能加快反应速度,另一方面高温也会导致酶蛋白变性失活。由图4可知,当温度低于55 ℃时,随着温度的增加酶活性逐步增加,当反应温度超过55 ℃时,活性急剧降低,可知该蛋白酶最适反应温度为55 ℃。这与Zambare等[8]发现Pseudomonas aeruginosa MCM B-327所产蛋白酶的酶学性质有所不同,其最适温度仅为35 ℃。在30 ℃和60 ℃时该酶活性也能达到最高酶活的60%以上,说明该酶的作用温度范围较广。
2.4.4 酶的热稳定性 将该酶置于不同的温度下保温30 min后测得的相对酶活如图5所示。由图5可知,当处理温度低于60 ℃时,相对酶活均在90%以上,而且在70 ℃和80 ℃处理30 min后仍分别有68%和45%的残余酶活,说明该酶有非常好的热稳定性。
2.4.5 各种金属离子对酶活性的影响 由图6可知,Mg2+和Fe2+对该酶活性几乎没有影响,K+和Mn2+对该酶有轻微抑制作用,而重金属离子Cu2+对该酶有较强的抑制作用,使其活性降低了26%,说明该酶可能对重金属离子敏感。但有文献[9]报道,某些铜绿假单胞菌可以产重金属离子耐受型蛋白酶。另外EDTA对该酶也有较明显的抑制作用,说明该酶可能为二价金属离子依赖型酶。在所验证的金属离子中只有Ca2+对该酶活性有10%左右的促进作用。
3 结论
从土壤中筛选到一株产蛋白酶菌株,经16S rDNA序列分析鉴定为铜绿假单胞菌属。假单胞菌是蛋白酶的一个重要来源,目前已有多种产蛋白酶假单胞菌属菌株被报道[9],有的甚至产低温蛋白酶[10]。本试验中分离得到的铜绿假单胞菌所产蛋白酶与已报道的铜绿假单胞菌蛋白酶的最适pH、最适温度以及重金属离子的耐受性有明显不同[8]。该蛋白酶最适pH为8.5,在pH 6.0~9.0的缓冲液中于4 ℃放置12 h后仍保有90%以上的酶活,说明该酶在中性和碱性条件下非常稳定。该酶最适反应温度为55 ℃,同时该酶还具有较好的热稳定性,在70 ℃和80 ℃处理30 min后仍分别保持有68%和45%的相对酶活。Mg2+和Fe2+对该酶活性几乎没有影响,K+和Mn2+对该酶活性有轻微抑制作用,Cu2+对该酶活性有26%的抑制作用,EDTA也有较明显的抑制作用,只有Ca2+对该酶活性有10%左右的促进作用。
该菌所产蛋白酶为pH稳定性和热稳定性较好的碱性蛋白酶,在洗涤工业中具有潜在的应用价值。在下一步研究中,计划克隆该菌蛋白酶基因,构建基因工程菌,并利用基因工程或蛋白质工程的手段进一步提高该酶活性以及pH稳定性和热稳定性,使其更加适合在工业上应用。
参考文献:
[1] 罗跃中,李忠英,温拥军,等.黑曲霉固体发酵产酸性蛋白酶条件优化[J].湖北农业科学,2010,49(1):59-63.
[2] 夏 凡,琚争艳.微生物碱性蛋白酶在食品工业中的应用及其安全性研究进展[J].山东食品发酵,2008,149(2):19-22.
[3] 程仕伟,王梦龙,冯志彬,等.碱性蛋白酶产生菌的筛选鉴定及培养条件优化[J].食品与生物技术学报,2012,31(12):1314-1319.
[4] 黄继翔.产碱性蛋白酶芽孢杆菌的鉴定[J].微生物学通报,2011,38(2):157-163.
[5] 徐国英,林学政,王能飞,等.产低温蛋白酶极地菌株的筛选及Pseudoaltermonas sp.QI-1产蛋白酶粗酶性质[J].生物加工过程,2010,8(2):54-60.
[6] 邓菊云.微生物碱性蛋白酶研究进展[J].现代食品科技,2008, 24(3):293-296.
[7] GANASH KUMAR A,SWARMALATHA S, SAIRAM B, et al. Production of alkaline protease by Pseudomonas aeruginosa using proteinaceous solid waste generated from leather manufacturing industries[J]. Bioresour Technol,2008,99(6):1939-1944.
[8] ZAMBARE V, NILEGAONKAR S, KANEKAR P. A novel extracellular protease from Pseudomonas aeruginosa MCM B-327: Enzyme production and its partial characterization[J]. N. Biotechnol,2011,28(2):173-181.
[9] SINGH S K, TRIPATHI V R, KHARE S K, et al. Comparative one-factor-at-a-time, response surface (statistical) and bench-scale bioreactor level optimization of thermoalkaline protease production from a psychrotrophic Pseudomonas putida SKG-1 isolate[J]. Microb Cell Fact, 2011, 10:114.
[10] 倪永清,顾燕玲,史学伟,等.天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育[J].微生物学报,2013, 5(2):164-172.
