急性心肌梗死患者药物洗脱支架植入后光学相干层析成像研究
2015-10-28张文俐朱政斌杜润朱劲舟刘慧竹张瑞岩
张文俐,朱政斌,杜润,朱劲舟,刘慧竹,张瑞岩
·心脏介入Cardiac intervention·
急性心肌梗死患者药物洗脱支架植入后光学相干层析成像研究
张文俐,朱政斌,杜润,朱劲舟,刘慧竹,张瑞岩
目的采用光学相干层析成像(OCT)技术观察急性心肌梗死(AMI)患者药物洗脱支架(DES)植入1年后血管内膜增生及支架小梁覆盖程度,并与稳定型心绞痛(SA)患者作比较。方法入选2011年3月至2012年7月因冠心病接受DES植入术治疗患者39例,其中AMI患者16例,SA患者23例。术后1年复查冠状动脉造影和OCT检查,测定新生内膜厚度、面积、容积、支架小梁覆盖及贴壁比率。结果OCT测定结果显示,AMI组与SA组相比,平均新生内膜厚度(66.8 mm±20.7 mm对121.6 mm± 135.7 mm,P=0.022)、新生内膜容量比率(5.66%±3.18%对11.88%±8.22%,P=0.005)、新生内膜>100 μm截面数比率(22.56%±23.99%对40.14%±30.01%,P=0.034)和支架小梁总体覆盖率(93.42%±7.03%对89.27%± 6.40%,P=0.007)均明显较低。结论AMI患者植入DES后内膜修复情况不佳,内膜增生及支架小梁覆盖率较差。
急性心肌梗死;稳定型心绞痛;药物洗脱支架;光学相干层析成像
临床研究显示,与稳定型心绞痛(SA)患者相比,急性冠状动脉综合征(ACS)患者支架植入术后心血管事件及血栓事件明显增加[1]。尸检研究发现ACS患者存在支架小梁未覆盖、纤维蛋白沉积及炎性反应明显[2]。近年血管内成像技术不断革新,光学相干层析成像(OCT)技术特有的高分辨率(10~15 μm)可用于精确分析药物洗脱支架(DES)植入术后血管修复,如内膜增生、支架贴壁不良(ISA)及内膜增生形态等情况。精确评估支架小梁覆盖程度,可作为预测支架血栓形成及决定DES植入术后双联抗血小板应用最佳时间的依据。目前OCT技术对血管修复情况的分析大多集中于不同类型支架植入后数据比较研究,对急性心肌梗死(AMI)患者和SA患者DES植入后数据的比较研究仍然不足。为此,我们采用OCT技术比较分析AMI患者和SA患者DES植入后内膜增生及ISA,为后续抗血小板治疗提供可靠依据。
1 材料与方法
1.1研究对象
收集上海交通大学医学院附属瑞金医院2011年3月至2012年7月因冠心病接受介入治疗并于1年后再次住院复查并接受冠状动脉造影及OCT检测患者的临床特征、造影表现及住院治疗情况,同时评估患者冠状动脉病变情况。排除标准:①未经治疗的左主干病变;②曾接受冠状动脉搭桥手术;③OCT检查前接受过球囊预扩张;④小血管、分叉病变,扭曲或严重狭窄病变;⑤超出OCT技术范围的血管病变(距离主干近端开口10 mm内或血管直径≥3.4 mm);⑥OCT检测前血流动力学不稳定(严重AMI、充血性心力衰竭或射血分数≤35%);⑦严重肾功能不全;⑧OCT图像质量差。通过筛选共入选患者39例,其中SA患者23例,AMI患者16例。AMI定义依据缺血性胸痛病史、典型心电图表现及心肌酶谱升高,SA多表现为劳力性心绞痛,病情稳定无进展。
1.2方法
1.2.1冠状动脉造影及介入治疗采用美国通用公司Innova 2100-IQ型DSA造影机,以标准Judkins法行选择性定量冠状动脉造影。根据标准手术程序、血管直径1∶1.1~1.2比例植入DES,所有患者均经比DES直径大0.25~0.5 mm的后扩张球囊,以12~18 atm压力扩张10 s以上。手术成功标准定义为残余狭窄<20%,TIMI血流分级为3级。
1.2.2OCT图像获取及分析通过桡动脉途径引入6 F导引导管,采用美国St.Jude医疗公司C7XR型血管内OCT系统,将OCT导管伸入支架远端5 mm以远,自动回撤速度设定在20 mm/s;获取OCT图像过程中为清除管内血液,使用对比剂进行持续冲刷。利用LightLab图像分析软件对OCT数据进行定量分析。分析前需先进行Z偏移校准,对支架段血管每隔1.0 mm(5个截面)进行测量分析;测量内容包括基础信息、支架小梁信息,所有目测标准的定义均依据2012年美国心脏病学会OCT专家共识[3]。基础信息,即对每个截面半自动采集的基础信息,包括支架直径、管腔直径、管腔面积、支架面积、管腔体积、支架体积、内膜增生面积、内膜增生体积等;支架小梁信息,即从每个横截面角度及总体支架小梁角度进行目测分析,观察支架小梁内膜覆盖、贴壁情况。覆盖支架小梁定义:支架小梁腔面可见内膜完全覆盖;ISA定义:支架小梁表面与血管腔面之间距离超过一定数值,该数值因支架种类不同而异(支架小梁厚度+聚合物厚度+OCT分辨率),分别为FirebirdTM支架≥130 μm,Firebird 2TM支架≥113 μm,Xience-VTM支架≥108 μm,ExcelTM支架≥154 μm。血管分叉处的非贴壁支架小梁虽纳入支架小梁覆盖分析范围,但在ISA分析中予以除外。
1.2.3统计学分析采用SPSS 20.0软件进行统计学分析。各组间连续变量的两组间比较用双尾t检验,非参数检验用Mann-Whitney U检验法,多组间比较用最小显著性差异ANOVA法,非参数检验用Kruskal-Wallis ANOVA法,各组数据以均数±标准差表示。比较计数资料用卡方检验或Fisher精确概率检验,各组数据均以数量(百分数)表示。采用二元Logistic多因素回归分析研究内膜贴壁不良、内膜覆盖情况等危险因素,同时绘制感受性曲线评估敏感性和特异性。P<0.05视为有统计学意义。
2 结果
2.1患者临床基线特征
与SA组相比,AMI组吸烟患者较多,左心室射血分数较低,肌酸激酶较高。两组患者年龄、性别、体重指数、2型糖尿病者比率、高血压者比率、高血脂者比率及各项实验室指标均未见明显差异。
2.2定量冠状动脉造影
DES植入术后1年定量冠状动脉造影显示,两组患者晚期支架内管腔丢失、节段内管腔丢失均无明显差异(P>0.05),SA组患者植入Xience-VTM支架较多(34.3%对0%,P=0.004)(表1)。
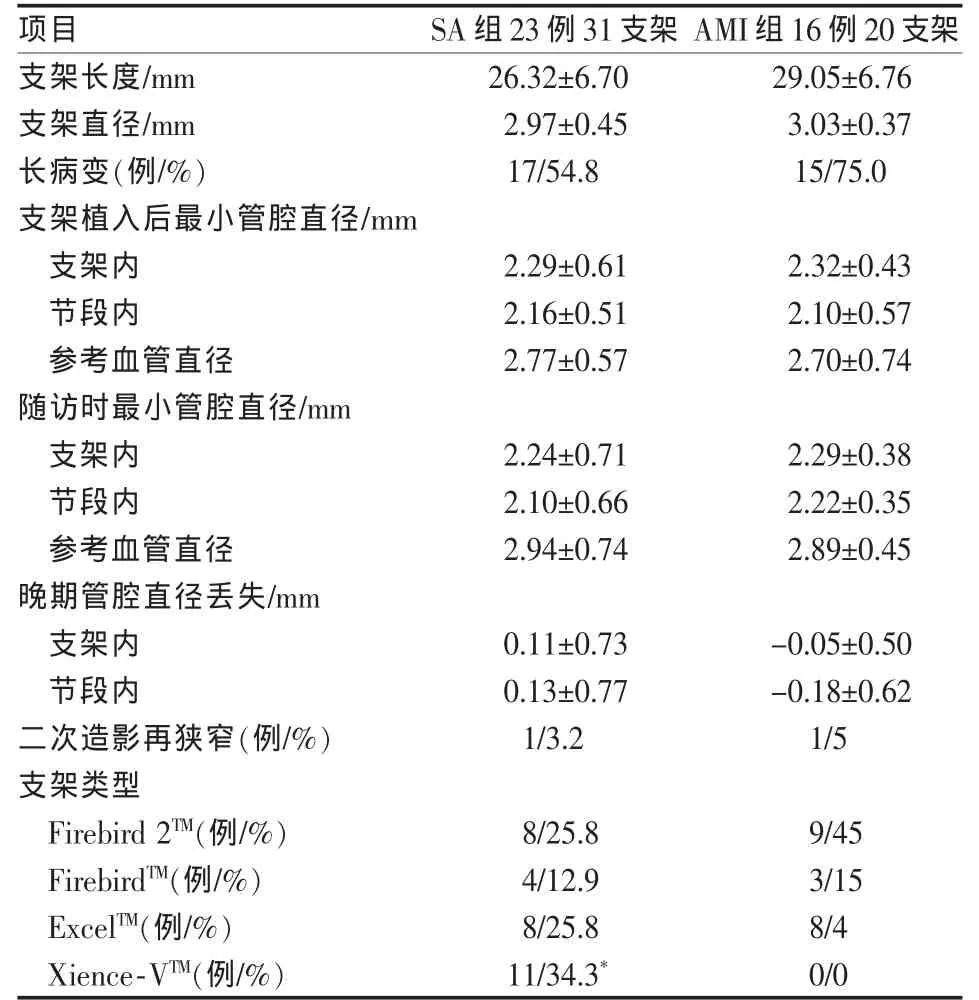
表1 定量冠状动脉造影结果
2.3OCT定量测定
OCT定量测定显示,两组患者平均管腔面积、平均支架面积、平均新生内膜面积、最小新生内膜面积和最大贴壁不良面积相似,平均新生内膜厚度在AMI组明显低于SA组(66.8 mm±20.7 mm对121.6 mm±135.7 mm,P=0.022);容积测定显示,两组贴壁不良容量并无明显差异,但新生内膜容量比率在AMI组明显低于SA组(5.66±3.18%对11.88± 8.22%,P=0.005)(表2)。
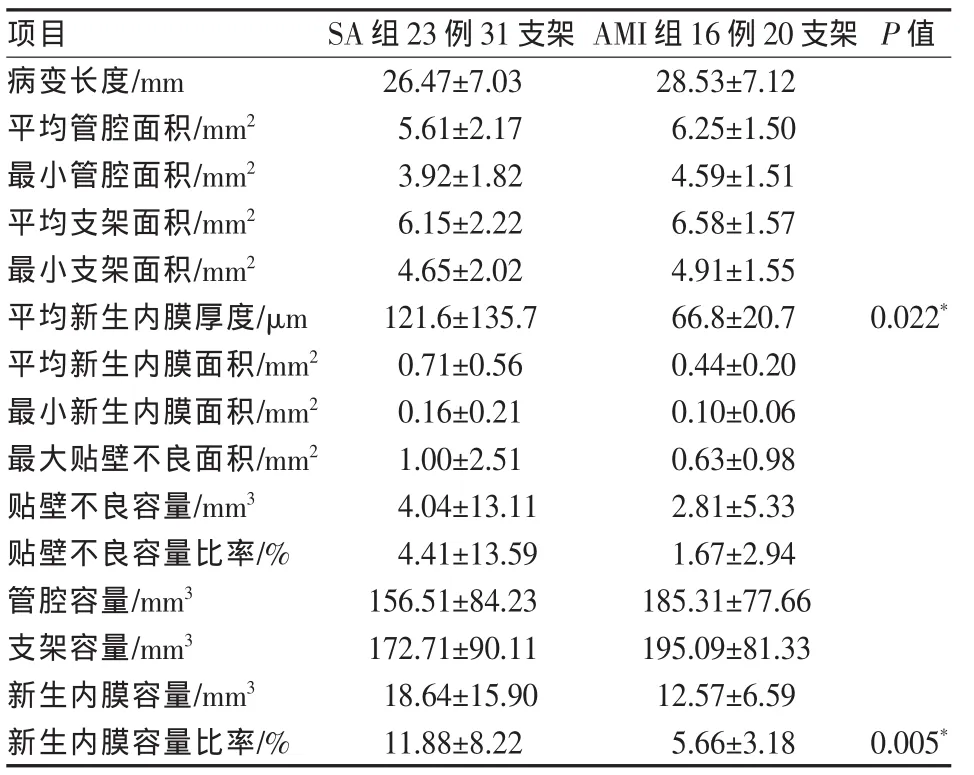
表2 OCT定量测量结果
支架小梁覆盖及贴壁情况显示,AMI组任意未覆盖支架小梁截面比率高于SA组(41.59±17.94%对28.06±22.91%,P=0.014),新生内膜>100 μm截面数比率明显低于SA组(22.56±23.99%对40.14± 30.01%,P=0.034);AMI组支架小梁总体覆盖率明显低于SA组(93.42±7.03%对89.27±6.40%,P= 0.007);两组支架小梁贴壁情况未见明显差异(表3)。

表3 OCT定量测定支架小梁覆盖及贴壁情况
单因素回归分析显示,不同支架植入后任意未覆盖支架小梁截面、内膜>100 μm截面、任意贴壁不良小梁截面比率间差异均无明显统计学意义(P值均>0.05)。
3 讨论
既往研究显示,ACS是晚期支架内血栓形成的独立危险因素[4]。研究证实,晚期支架内血栓形成与OCT检测的支架小梁未覆盖程度及血管内超声(IVUS)检测的血管正性重构相关[5]。OCT检测未覆盖支架的临床意义及其与冠心病病变类型的关系并未充分证实。Gonzalo等[6]在支架植入6个月OCT研究中证实,ST段抬高型心肌梗死(STEMI)患者ISA及支架未覆盖率均较SA患者高。Kim等[7]在不同类型支架植入9个月OCT研究中证实,支架小梁未覆盖率在ACS患者中明显较高。Raeber等[8]在支架植入术后5年OCT研究中证实,ACS患者尤其是AMI患者支架未覆盖率较SA患者高,ISA发生率也较高。上述各不同随访期的研究均表明,DES植入后血管修复应答与患者冠心病病变类型相关,AMI患者内膜覆盖率及支架贴壁较差。
目前关于DES植入后内膜覆盖不全的机制并不明确,冠心病病变类型、支架药物及其药代动力学、支架设计等均可能起着重要作用。我们推断,病变类型不同所致内膜覆盖不全的可能机制在于:①与内膜下斑块形态相关。ACS病变多以大的含有脂质核心和血栓的脂质湖为主,而SA病变多由纤维组织和钙化组织构成[9]。由于DES药物的疏水性,其与富含脂质的斑块之间具有高亲和力,在DES嵌入斑块中可以保持较长时间,这些区域多无血管分布,难以吸引迁移增殖的细胞[10]。②血栓负荷可能延缓DES药物的冲刷作用,血栓不断摄取药物,其浓度增加后可延迟平滑肌细胞增殖和内皮修复[11]。Gonzalo等[6]在为期6个月OCT随访研究中发现,支架未覆盖总概率为76.6%,STEMI患者支架小梁未覆盖率明显较高(P=0.04),同时未覆盖支架也较为分散,表现为未覆盖支架小梁截面比率较高;STEMI患者新生内膜分布并不均匀,可能与支架植入处斑块的离心程度及组成成分相关。Takano等[12]在一项为期2年OCT随访研究中发现,81%患者支架未覆盖。本研究显示,排除不同支架影响后OCT测得的1~2年随访期内支架小梁未覆盖率为90.2%,其中83.9%为SA患者,100%为AMI患者;内膜增生厚度及新生内膜容积率在AMI组最低;AMI组支架未覆盖率明显高于SA组,且未覆盖支架较为分散,表现为未覆盖支架小梁截面比率较高。结果提示,AMI患者病变血管植入DES后血管内膜修复作用较SA患者延迟,符合既往病理研究结果[10]。
冠心病病变类型、支架药物、聚合物、支架设计等均可能影响ISA。心肌梗死患者晚期获得性ISA的一个重要原因是血栓溶解[13]。脂质核的大小亦起到一定作用,支架植入破裂的斑块、小梁嵌入坏死核后内膜修复应答过程,也是ACS患者晚期获得性ISA的重要原因之一[14]。Hong等[15]报道在6个月随访期间IVUS测得的DES植入后晚期ISA发生率为31.8%,Gonzalo等[6]报道6个月随访期间OCT测得的DES植入后晚期ISA发生率为75%,其中STEMI患者ISA发生率较SA患者高,无论是支架小梁总体ISA比率(P=0.001),还是ISA支架小梁截面比率。有多项IVUS研究报道DES植入后ISA与远期随访中的临床事件并不相关[15-17]。亦有IVUS研究报道提示ISA与随后出现的血栓形成可能相关[13,18]。事实证明,OCT与IVUS相比常可检出ISA,尽管大多数ISA患者在远期随访中并未经历临床事件[19]。此外,多项OCT研究提示,并非所有血栓形成患者均会出现ISA[20]。这提示OCT评估ISA、血栓形成及临床事件之间关系,有待进一步商榷。本研究显示,1~2年随访期内OCT测得DES植入后晚期ISA发生率为64.7%,其中71%为SA患者,45%为AMI患者,有血栓形成的AMI患者均发生ISA,而有血栓形成的SA患者中16.1%未发生ISA;两组支架小梁贴壁不良比率、任意贴壁不良支架小梁截面比率之差异,无明显统计学意义。以上研究提示,本组总体ISA发生率较高,两组间ISA虽未见明显差异,但在血栓形成患者中AMI患者ISA发生率较高;OCT检测显示的血栓与临床事件的关系,目前尚不明确。
本研究样本量较小,缺乏DES植入术后即刻OCT资料,仍存在一定局限性。虽然不同支架对病变的作用目前未见明显差异,但仍需要考虑药物、支架的影响因素。
综上所述,DES植入后血管修复应答过程受冠心病病变类型影响,AMI患者内膜修复情况较SA患者差。
[1]丁雪燕,刘夙璇,秦永文.冠状动脉西罗莫司洗脱支架植入术后晚期及超晚期支架内血栓形成的临床研究[J].介入放射学杂志,2012,21:1023-1027.
[2]Farb A,Burke AP,Kolodgie FD,et al.Pathological mechanisms of fatal late coronary stent thrombosis in humans[J].Circulation,2003,108:1701-1706.
[3]Tearney GJ,Regar E,Akasaka TA,et al.Consensus standards for acquisition,measurement,and reporting of intravascular optical coherence tomography studies a report from the international working group for intravascular optical coherence tomography standardization and validation[J].J Am Coll Cardiol,2012,59: 1058-1072.
[4]Daemen J,Wenaweser P,Tsuchida K,et al.Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxeleluting stents in routine clinical practice:data from a large twoinstitutional cohort study[J].Lancet,2007,369:667-678.
[5]Guagliumi G,Sirbu V,Musumeci G,et al.Examination of the in vivo mechanisms of late drug-eluting stent thrombosis:findings from optical coherence tomography and intravascular ultrasoundimaging[J].JACC Cardiovasc Interv,2012,5:12-20.
[6]Gonzalo N,Barlis P,Serruys PW,et al.Incomplete stent apposition and delayed tissue coverage are more frequent in Drug-Eluting stents implanted during primary percutaneous coronary intervention for ST-Segment elevation myocardial infarction than in Drug-Eluting stents implanted for stable/unstable angina insights from optical coherence tomography[J].JACC Cardiovasc Interv,2009,2:445-452.
[7]Kim JS,Fan CY,Choi D,et al.Different patterns of neointimal coverage between acute coronary syndrome and stable angina after various types of drug-eluting stents implantation;9-month follow-up optical coherence tomography study[J].Int J Cardiol,2011,146:341-346.
[8]Raeber L,Zanchin T,Baumgartner S,et al.Differential healing response attributed to culprit lesions of patients with acute coronary syndromes and stable coronary artery after implantation of drug-eluting stents:An optical coherence tomography study[J].Int J Cardiol,2014,173:259-267.
[9]NarulaJ,NakanoM,VirmaniR,etal.Histopathologic characteristicsofatheroscleroticcoronarydiseaseand implications of the findings for the invasive and noninvasive detection of vulnerable plaques[J].J Am Coll Cardiol,2013,61: 1041-1051.
[10]Nakazawa G,Finn AV,Joner M,et al.Delayed arterial healing and increased late stent thrombosis at culprit sites after drugeluting stent placement for acute myocardial infarction patients-An autopsy study[J].Circulation,2008,118:1138-1145.
[11]Hwang CW,Levin AD,Jonas M,et al.Thrombosis modulates arterial drug distribution for drug-eluting stents[J].Circulation,2005,111:1619-1626.
[12]Takano M,Yamamoto M,Inami S,et al.Long-term follow-up evaluation after sirolimus-eluting stent implantation by optical coherence tomography:do uncovered struts persist?[J].J Am Coll Cardiol,2008,51:968-969
[13]Cook S,Wenaweser P,Togni M,et al.Incomplete stent apposition and very late stent thrombosis after drug-eluting stent implantation[J].Circulation,2007,115:2426-2434.
[14]Finn AV,Nakazawa G,Ladich E,et al.Does underlying plaque morphology play a role in vessel healing after drug-eluting stent implantation?[J].JACC Cardiovasc Imaging,2008,1:485-488.
[15]Hong MK,Mintz GS,Lee CW,et al.Late stent malapposition after drug-eluting stent implantation-An intravascular ultrasound analysis with long-term follow-up[J].Circulation,2006,113:414-419.
[16]Degertekin M,Serruys PW,Tanabe K,et al.Long-term follow-up of incomplete stent apposition in patients who received sirolimuseluting stent for de novo coronary lesions.An intravascular ultrasound analysis[J].Circulation,2003,108:2747-2750.
[17]Tanabe K,Serruys PW,Degertekin M,et al.Incomplete stent apposition after implantation of paclitaxel-eluting stents or bare metal stents-Insights from the randomized TAXUSⅡtrial[J]. Circulation,2005,111:900-905.
[18]Alfonso Manterola F,Suarez A,Perez-Vizcayno M,et al. Intravascular ultrasound findings during episodes of drug-eluting stent thrombosis[J].Eur Heart J,2007,28:673-674.
[19]Xie Y,Takano M,Murakami D,et al.Comparison of neointimal coverage by optical coherence tomography of a sirolimus-eluting stent versus a bare-metal stent three months after implantation[J].Am J Cardiol,2008,102:27-31.
[20]Schinkel AF,Barlis P,van Beusekom HM,et al.Images in intervention.Optical coherence tomography findings in very late(4 years)paclitaxel-eluting stent thrombosis[J].JACC Cardiovasc Interv,2008,1:449-451.
Assessment of vascular healing with optical coherence tomography in patients with acute myocardial infarction after receiving drug-eluting stent implantation
ZHANG Wen-li,ZHU Zheng-bin,DU Run,ZHU Jin-zhou,LIU Hui-zhu,ZHANG Rui-yan.Department of Cardiology,Affiliated Ruijin Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai 200025,China
ZHANG Rui-yan,E-mail:zhangruiyan@263.net
ObjectiveBy using optical coherence tomography(OCT)to evaluate the vascular neointimal hyperplasia and the stent strut coverage degree in patients with acute myocardial infarction(AMI)and in patients with stable angina(SA)one year after receiving drug-eluting stent(DES)implantation,and to compare the clinical results between the two groups.MethodsA total of 39 patients,who received DES implantation due to coronary heart disease,including AMI(n=16,AMI group)and SA(n=23,SA group),during the period from March 2011 to July 2012,were enrolled in this study.One year after DES implantation,coronary angiography and OCT reexaminations were performed in all patients.The neointimal hyperplasia(NIH)thickness,NIH area,NIH volume,strut coverage and apposition rate were determined with OCT.The results were compared between the two groups.ResultsOCT measuring results showed that the mean NIH thickness of AMI group and SA group was(66.8±20.7)mm and(121.6±135.7)mm respectively(P=0.022);the NIH volume ratio were 5.66%±3.18%and 11.88%±8.22%respectively(P= 0.005);the percentage of cross-section with NIH thickness over 100 μm was 22.56%±23.99%and 40.14%± 30.01%respectively(P=0.034);and the percentage of overall stent strut coverage was 89.27%±6.40%and 93.42%±7.03%respectively(P=0.007).All the above mentioned data of AMI group were obviously lower than those of SA group.ConclusionAfter DES implantation,the intimal repair,intimal hyperplasia and stent strut coverage in AMI patients are poorer.(J Intervent Radiol,2015,24:287-291)
acute myocardial infarction;stable angina;drug-eluting stent;optical coherence tomography
R528.1
A
1008-794X(2015)-04-0287-05
2014-09-16)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.04.003
200025上海交通大学医学院附属瑞金医院心内科
张瑞岩E-mail:zhangruiyan@263.net
