金纳米棒联合125I粒子诱导肝癌HepG2细胞凋亡的实验研究
2015-10-28沈蕾高斌贺克武肖卫华
沈蕾,高斌,贺克武,肖卫华
金纳米棒联合125I粒子诱导肝癌HepG2细胞凋亡的实验研究
沈蕾,高斌,贺克武,肖卫华
目的探讨叶酸偶联二氧化硅包覆的金纳米棒(GNRs@SiO2-FA)联合125I粒子诱导肝癌HepG2细胞凋亡及其可能的机制,为临床提高肝癌125I粒子组织间植入疗效提供理论依据。方法将体外培养的肝癌HepG2细胞随机分成空白对照组,单纯金纳米棒组,单纯125I粒子照射组及金纳米棒联合125I粒子照射组,采用流式细胞仪检测细胞凋亡情况,PT-PCR检测bax mRNA、bcl-2 mRNA表达水平,免疫细胞化学检测凋亡相关基因bax、bcl-2表达水平及肿瘤细胞核增殖性抗原Ki67表达情况。结果流式细胞仪检测4组肝癌HepG2细胞凋亡率,单纯金纳米棒组、单纯125I粒子照射组较空白对照组均有升高(P<0.05);联合组较单纯金纳米棒组和单纯125I粒子照射组明显升高,差异有统计学意义(P<0.05)。联合组bax mRNA表达明显高于单纯金纳米棒组与单纯125I粒子照射组,bcl-2 mRNA表达明显低于单纯金纳米棒组与单纯125I粒子照射组。肝癌HepG2细胞bax表达于胞质,bcl-2表达于胞质和胞膜,Ki67表达于胞核,均表现为棕黄色细颗粒状沉淀。4组肝癌HepG2细胞凋亡相关基因bax、bcl-2及增殖核抗原Ki67蛋白表达量比较,差异均有统计学意义(P<0.05);联合组较单纯金纳米棒组和单纯125I粒子照射组Bax蛋白阳性表达率明显升高,Bcl-2、Ki67蛋白阳性表达率明显降低,差异有统计学意义(P<0.05)。结论金纳米棒与125I粒子联合应用能更有效增加肝癌细胞凋亡率,其机制可能是通过增加Bax蛋白的表达,抑制Bcl-2蛋白的表达来实现。
金纳米棒;125I粒子;肝癌;细胞凋亡;Bax;Bcl-2;Ki67
肝癌是常见的恶性肿瘤之一,全球发病率居第5位,死亡率居第3位[1]。我国是肝癌发病率最高的国家,占所有癌症死亡的第2位,仅次于肺癌[2]。因此,如何提高患者的生存率是临床工作者亟待攻克的难题。放射性125I粒子组织间植入近距离照射治疗肝癌已经广泛开展并显示出良好疗效,如CT引导下125I粒子组织间植入可诱导兔VX2肿瘤细胞凋亡[3]。金纳米棒联合放射性125I粒子对肝癌HepG2细胞的研究并不多见。本实验以人肝癌HepG2细胞为研究对象,重点探讨金纳米棒联合125I粒子对肝癌HepG2细胞凋亡及Bax、Bcl-2蛋白表达的影响,为肿瘤的联合治疗提供实验依据,从而为肝癌的临床治疗开辟一条新路径。
1 材料与方法
1.1试剂与仪器
肝癌HepG2细胞株(购自上海细胞库)、DMEM培养基(Hyclone公司)、胎牛血清(四季青公司)、细胞凋亡试剂盒(贝博公司)、PCR相关试剂(Thermo公司)、bax抗体(Abcam公司)、bcl-2抗体(CST公司)、Ki67抗体(博士德公司)、DAB显色试剂盒(中杉金桥)、流式细胞仪(FCM,BD公司)、细胞培养箱(Thermo公司)、紫外发光凝胶成像系统(天能公司)、125I粒子(欣科公司)。
1.2方法
1.2.1细胞培养HepG2细胞在37℃、体积分数为0.05的CO2条件下培养于含10%胎牛血清的DMEM培养基中。将实验分为空白对照组、单纯金纳米棒组、单纯125I粒子照射组、金纳米棒联合125I粒子照射组。空白对照组予正常培养;单纯金纳米棒组,给予终浓度为40 μg/ml的金纳米棒;单纯125I粒子照射组,距培养皿1 cm内给予9粒放射性活度为0.8 mCi的125I粒子照射;联合组,同时给予金纳米棒和125I粒子。倒置显微镜下观察细胞生长状态,照射48 h后收集细胞。
1.2.2FCM检测细胞凋亡率取各组HepG2细胞,用0.25%胰酶消化,2 000 r/min,离心5 min,弃上清液。调整细胞密度为1×106/ml,冷PBS洗2遍。将细胞重悬于400 μl的Annexin V结合液中,加入10 μl Annexin V和5 μl PI染液,轻轻混匀,4℃避光反应15 min,上机检测。实验重复4次。
1.2.3RT-PCR检测bax、bcl-2 mRNA表达收集各组细胞,提取RNA后进行RT-PCR。以GAPDH为内参。GAPDH上游引物:5'-AGAAGGCTGGGGCTCATTTG-3';下游引物:5'-AGGGGCCATCCACAGTCTTC-3',产物长度258 bp。bax上游引物:5'-GCCCACCAGCTCTGAGCAGATCAT-3';下游引物:5'-CGGCAATCATCCTCTGCAGC-3',产物长度209 bp。bcl-2上游引物:5'-GACTTCGCCGAGATGTCCAG-3';下游引物:5'-CAGGTGCCGGTTCAGGTACT-3',产物长度225 bp。将扩增产物行琼脂糖凝胶电泳,紫外透射分析仪下观察结果并拍照。
1.2.4细胞免疫化学法检测bax、bcl-2、Ki67基因表达①制作细胞爬片:取对数生长期的HepG2细胞,消化离心后以密度为2×10/ml接种于事先放好盖玻片的培养皿内,培养24 h。②处理方法:按上述分组方法干预细胞,48 h后处理细胞。③细胞免疫化学法:常规设立阴性对照。取出盖玻片用4%多聚甲醛固定20 min,PBS洗5 min×3次;0.1%Triton× 100 4℃10 min,PBS洗5 min×3次;3%H2O2室温孵10 min消除内源性H2O2酶的活性,PBS洗5 min× 3次;滴加血清封闭液,室温湿盒内孵育30 min,封闭非特异性抗原;滴加抗体:倾去血清后直接滴加的一抗bax、bcl-2、Ki67(稀释比例均为1∶100)使其完全覆盖细胞,于4℃下过夜;PBS洗5 min×3次,加人生物素化羊抗兔IgG(1∶200),37℃,30 min,PBS洗5 min×3次;DAB显色:每片滴加DAB 100 μl,显微镜下观察3~5 min,至阳性显色明显时用自来水冲洗,终止显色。复染:用苏木精复染约10 s,自来水充分冲洗。70%、80%、90%、95%、100%梯度乙醇脱水。二甲苯透明、中性树胶封片。
1.2.5IHC结果判定bax阳性表现为细胞质内棕黄色颗粒,bcl-2阳性表现为细胞质和细胞膜内棕黄色颗粒。①定量分析:在光学显微镜400倍视野下,每张切片随机选取阳性细胞分布均匀的10个视野,计数200个细胞中的阳性细胞数并计分,<5%(0分),5%~25%(1分),25%~50%(2分),50%~75%(3分),>75%(4分)。②着色程度:阴性为未着色(0分),弱阳性呈淡黄色(1分),中等阳性呈黄色或深黄色(2分),强阳性呈褐色或棕褐色(3分)。以阳性细胞率和染色强度分值的乘积作为每一例的积分[4]。
Ki67阳性表现为细胞核内棕黄色细颗粒状沉淀,每张切片观察10个以上典型视野(高倍镜下),至少计数200个细胞。以棕色核染为阳性细胞,其百分比为Ki-67细胞增殖指数(Ki-67 proliferation index,KI)。
1.3统计学分析
所有数据资料采用SPSS13.0软件进行统计处理,以均数±标准差表示。多组间比较用方差分析,两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1FCM检测细胞凋亡率
4组肝癌HepG2细胞凋亡率比较,差异有统计学意义(P<0.05);单纯金纳米棒组、单纯125I粒子照射组及联合组肝癌HepG2细胞凋亡率较空白对照组明显升高,差异均有统计学意义(P<0.05);联合组肝癌HepG2细胞凋亡率较单纯金纳米棒组和单纯125I粒子照射组明显升高,差异均有统计学意义(P<0.05)。见表1、图1。
表1 4组肝癌HepG2细胞凋亡率比较(±s)

表1 4组肝癌HepG2细胞凋亡率比较(±s)
组别例数细胞凋亡率(%)空白对照组105.91±1.52单纯金纳米棒组1010.16±3.18单纯125I粒子照射组1020.78±4.79金纳米棒联合125I粒子照射组1033.41±8.00 F值99.82 P值0.00
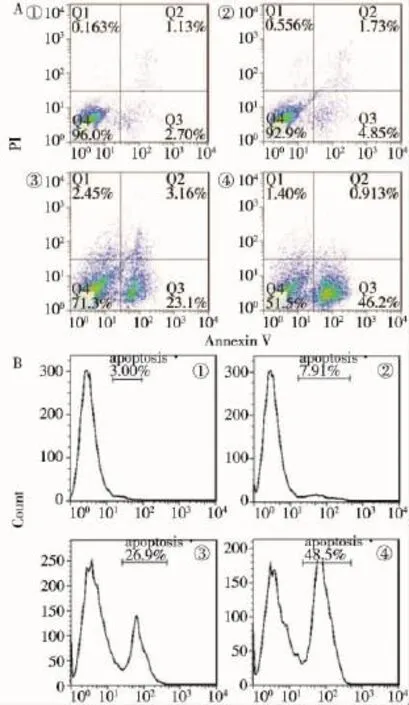
图1 FCM检测各组细胞凋亡情况(A和B)
2.2RT-PCR检测bax、bcl-2 mRNA表达
单纯金纳米棒组与单纯125I粒子照射组的bax mRNA表达均高于空白对照组,联合组bax mRNA表达明显高于单纯金纳米棒组和单纯125I粒子照射组。金纳米棒组与单纯125I粒子照射组的bcl-2 mRNA表达均低于空白对照组,联合组bcl-2 mRNA表达明显低于单纯金纳米棒组和单纯125I粒子照射组。提示金纳米棒与射线作用于肝癌HepG2细胞后bax mRNA的表达量增加,bcl-2 mRNA的表达量减低。见图2。
2.3Bax、Bc1-2、Ki67蛋白在肝癌HepG2细胞中的表达
2.3.1Bax蛋白在肝癌HepG2细胞中的表达空白对照组、单纯金纳米棒组、单纯125I粒子照射组和联合组染色阳性的HepG2细胞Bax蛋白阳性表达积分分别为0.95±0.18、1.51±0.44、4.29±0.86、7.55±1.40。联合组与单纯金纳米棒组和单纯125I粒子照射组比较,Bax蛋白表达增加更明显,差异有统计学意义(P<0.05)。
2.3.2Bc1-2蛋白在肝癌HepG2细胞中的表达空白对照组、单纯金纳米棒组、单纯125I粒子照射组和联合组染色阳性的HepG2细胞Bcl-2蛋白阳性表达积分依次为9.01±1.02、8.39±0.47、3.81±1.28、1.70±0.83。联合组与单纯金纳米棒组和单纯125I粒子照射组比较,Bc1-2蛋白表达降低更明显,差异有统计学意义(P<0.05)。
2.3.3IHC检测HepG2细胞增殖相关抗原Ki67表达空白对照组细胞形态饱满,多数细胞核被染成棕黄色;联合组Ki67表达强度较单纯125I粒子照射组和单纯金纳米棒组明显减弱,细胞核呈淡染。4组KI之间差异有统计学意义(P<0.05)。见表2,图3、4。
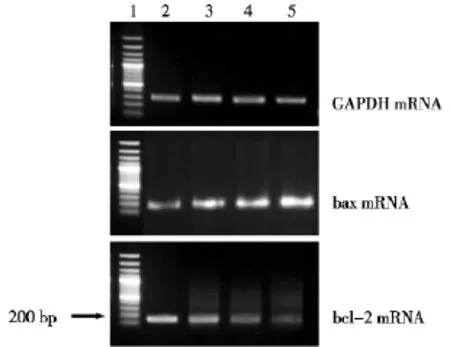
图2 RT-PCR检测金纳米棒联合125I粒子照射作用于肝癌HepG2细胞后bax、bcl-2、GAPDH mRNA表达
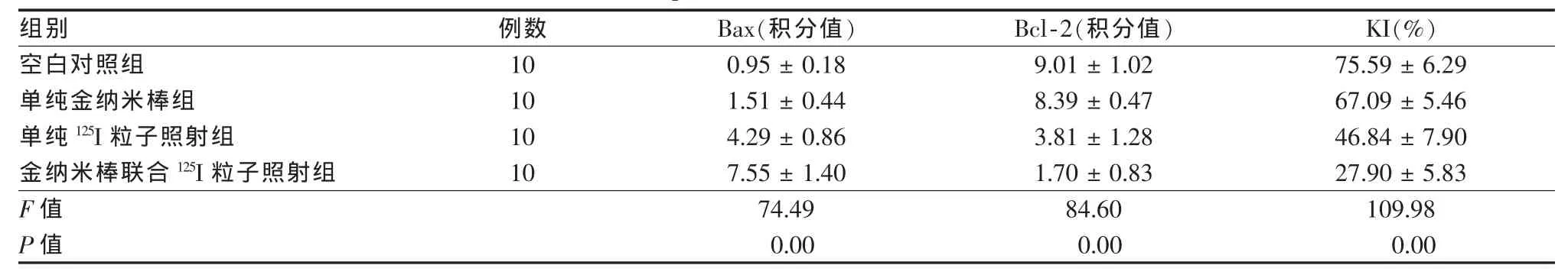
表2 4组肝癌HepG2细胞Bax、Bcl-2、KI蛋白表达情况

图3 各组肝癌HepG2细胞Bax、Bcl-2、KI蛋白表达情况(SP×400)
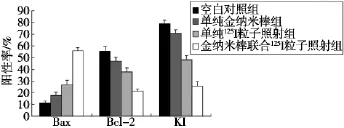
图4 各组肝癌HepG2细胞Bax、Bcl-2、KI蛋白表达情况
3 讨论
目前,肝癌多采用综合治疗的手段,手术、放疗、热疗等多种方法联合应用对抗肿瘤起到协同作用[5-6]。外放疗作为肝癌治疗的常规手段,由于正常肝脏组织对放射线的耐受量限制了肝癌照射量的提升,因此肝癌外放疗效果欠佳。125I粒子植入近距离治疗不同于外放疗,125I粒子具有在组织局部剂量最高、近籽源处剂量较高、周围组织剂量陡降等特性,经过足够的剂量和半衰期持续杀伤肿瘤细胞,使肿瘤组织损伤较为彻底。但125I粒子植入属于人工操作,难免存在冷点[7],通过放射增敏的办法,旨在达到完全适形放射治疗。
本实验采用的金纳米棒可作为放射治疗领域中一类新型的放射增敏剂[8],其机制主要是金纳米棒中的金元素具有高的原子序数[9-10],且金纳米棒的尺寸远大于金原子,其光电吸收截面积远超越金原子[11],都致使其在肿瘤组织内产生较周围正常组织强的光电吸收效应。另外,金纳米棒表面等离子共振特性即当光入射时在特定波长范围内具有强的光吸收能力,增强的光吸收量也可有效增强肿瘤组织的吸收剂量。金纳米棒联合射线照射后则产生更强的光电吸收效应,加速DNA链断裂,最终导致细胞死亡[12]。
细胞凋亡是一种多基因参与的调控机制,凋亡基因与抗凋亡基因的相互协调作用决定了凋亡的启动或抑制。目前研究最深入的一对细胞凋亡调节基因是bax和bcl-2[13]。bax基因最早是在人前B细胞基因库中发现,其产物主要定位于胞质中,具有拮抗Bcl-2蛋白的作用,还有直接促进细胞凋亡的功能。bcl-2基因最初是在滤泡性B细胞淋巴瘤的研究中发现,其产物主要定位于胞膜,具有抑制凋亡蛋白的功能。大量研究显示,bax/bcl-2比值决定细胞的生或死,bax/bcl-2升高,细胞接受凋亡信号刺激发生凋亡;bax/bcl-2降低细胞不凋亡[14]。有学者采用香芹酚、苦参碱等药物诱导人肝癌细胞凋亡的体外研究,通过线粒体途径上调Bax蛋白、下调Bcl-2蛋白表达水平,升高bax/bcl-2比值来治疗肝癌[15-16]。Ki67是一种与细胞周期相关的增殖核抗原,可作为肝癌治愈率和总生存率的独立预后指标[17],Ki67表达减少表明肿瘤细胞增殖受到抑制。
本研究结果表明,单纯金纳米棒组、单纯125I粒子照射组、金纳米棒联合125I粒子照射组与空白对照组相比,肝癌HepG2细胞Bax表达增加,Bcl-2、Ki67表达降低,说明金纳米棒与125I粒子二者单独或联合应用时均能增加肝癌HepG2细胞Bax的表达同时降低Bcl-2、Ki67的表达。金纳米棒联合125I粒子照射组与125I粒子照射组相比,Bax表达增加更显著,Bcl-2、Ki67表达降低更显著。
综上所述,在体外实验中证实金纳米棒联合125I粒子具有明显的协同抗肿瘤效果,目前国内外对金纳米棒联合125I粒子的研究尚不多见。本实验在分子水平上为金纳米棒联合125I粒子治疗肝癌提供了实验依据,但其明确的生物学机制尚待更深入研究。
[1]Pakin DM,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2002[J].CA Cancer J Clin,2005,55:74-75.
[2]叶胜龙.2013年肝癌领域新进展[J].中华肝脏病杂志,2014,22:2-4.
[3]贺克武,高斌,李嘉嘉.CT导引下125I粒子组织间植入治疗兔VX2肿瘤的实验研究[J].介入放射学杂志,2008,17:428-431.
[4]Lo Muzio L,Staibano S,Pannone G,et al.Expression of theapoptosisinhibitorsurvivinginaggressivesquamous cellcarcinoma[J].Exp Mol Pathol,2001,70:249-254.
[5]Ko SH,Ueno T,Yoshimoto Y,et al.Optimizing a novel regional chemotherapeutic agent against melanoma:hyperthermia-induced enhancement of temozolomide cytotoxicity[J].Clin Cancer Res,2006,12:289-297.
[6]储玉山,朱小庆,张玉宇,等.索拉非尼联合奥沙利铂对肝癌HepG2细胞的抑制作用[J].介入放射学杂志,2011,20:810-814.
[7]Skowronek J.Low-dose-rate or high-dose-rate bra-chytherapy in treatment of prostate cancer-between options[J].J Contemp Brachytherapy,2013,5:33-41.
[8]Gui C,Cui DX.Functionalized Gold nanorods for tumor imaging and targeted therapy[J].Cancer Biol Med,2012,9:221-233.
[9]Roeske JC,Nunez L,Hoggarth M,et al.Characterization of the theorectical radiation dose enhancement from nanoparticles[J]. Technol Cancer Res Treat,2007,6:395-401.
[10]Cho SH,Jones BL,Krishnan S.The dosimetric feasibility of Gold nanoparticle-aided radiation therapy(GNRT)via brachytherapy using low-energy gamma-/x-ray sources[J].Phys Med Biol,2009,54:4889-4905.
[11]Park YS,Kasuya A,Dmytruk A,et al.Concentrated colloids of silica-encapsulatedGoldnanoparticles:colloidalstability,cytotoxicity,and X-ray absorption[J].J Nanosci Nanotechnol,2007,7:2690-2695.
[12]Conde J,Doria G,Baptista P.Noble metal nanoparticles applications in cancer[J].J Drug Deliv,2012:751075.
[13]Cory S,Adams JM.Killing cancer cells by flipping the Bcl-2/ Bax Switch[J].Cancer Cell,2005,8:5-6.
[14]Stefanaki C,Antoniou C,Stefanaki K,et al.Bcl-2 and Bax in congenital naevi[J].Br J Dermatol,2006,154:1175-1179.
[15]Yin QH,Yan FX,Zu XY,et al.Anti-proliferative and proapoptotic effect of carvacrol on human hepatocellular carcinoma cell line HepG-2[J].Cytotechnology,2012,64:43-51.
[16]Liang CZ,Zhang JK,Shi Z,et al.Matrine induces caspasedependent apoptosis in human osteosarcoma cells in vitro and in vivothroughtheupregulationofBaxandFas/FasLand downregulation of Bcl-2[J].Cancer Chemother Pharmacol,2012,69:317-331.
[17]Stroescu C,Dragnea A,Ivanov B,et al.Expression of p53,Bcl-2,VEGF,Ki67 and PCNA and prognostic significance in hepatocellular carcinoma[J].J Gastrointestin Liver Dis,2008,17: 411-417.
Apoptosis of hepatoma cell line HepG2induced by the combination use of GNRs@SiO2-FA and125Iseeds:an experimental study
SHEN Lei,GAO Bin,HE Ke-wu,XIAO Wei-hua.Medical Imaging Center,Third Affiliated Hospital,Anhui Medical University,Hefei,Anhui Province 230061,China
GAO Bin,E-mail:gaobin_3136@163.com
ObjectiveTo explore the possible mechanism of the apoptosis of hepatoma cell line HepG2induced by the combination use of GNRs@SiO2-FA and125I seeds and to discuss its relationship with Bcl-2 and Bax protein expressions so as to provide theoretical basis for clinical treatment of hepatic cancer with interstitial brachytherapy by using125I seeds.MethodsIn vitro cultured HepG2cells were randomly divided into 4 groups:blank control group(not treated),simple GNRs@SiO2-FA group,simple125I seeds group,and combination group(GNRs@SiO2-FA plus125I seeds).The apoptosis of HepG2cells was determined by flow cytometry.The expression of Bax mRNA and Bcl-2 mRNA of HepG2cells were tested by RT-PCR. The apoptosis-related genes(Bax and Bcl-2)and the tumor proliferation cell nuclear antigen(Ki67)proteins expression on HepG2cells were examined with immunohistochemistry method.ResultsThe flow cytometry examination showed that the apoptosis rate of HepG2cells in the simple GNRs@SiO2-FA group and simple125I seeds group was higher than that in blank control group(P<0.05),and the apoptosis rate of the combination group was significantly higher than that of the simple GNRs@SiO2-FA group and the simple125I seeds group(P<0.05).The expression level of Bax mRNA in the combination group was higher than that in the simpleGNRs@SiO2-FA group and simple125I seeds group,while the expression level of Bcl-2 mRNA in the combination group was obviously lower than that in the simple GNRs@SiO2-FA group and simple125I seeds group.Bax protein was expressed on cytoplasm,Bcl-2 protein was expressed on cytoplasm and cell membrane,while Ki67 protein was expressed on nucleus.All of them presented as brown finely granular precipitations.Statistically significant differences in the amount of Bax,Bcl-2 and Ki67 protein expression existed between each other among the four groups(P<0.05).The positive expression rate of Bax protein in the combination group was significantly higher than that of the simple GNRs@SiO2-FA group and the simple125I seeds group,while the positive expression rate of Bcl-2 and Ki67 protein was significantly lower than that of the simple GNRs@SiO2-FA group and the simple125I seeds group,and the differences were statistically significant(P<0.05).ConclusionThe combination use of GNRs@SiO2-FA and125I seeds can more effectively induce the apoptosis of HepG2cells.This effect may be accomplished through increasing the expression of Bax protein and inhibiting the expression of Bcl-2 and Ki67 proteins.(J Intervent Radiol,2015,24:236-241)
gold nanorod;125I seed;hepatocarcinoma;apoptosis;Bax;Bcl-2;Ki67
R735.7
A
1008-794X(2015)-03-0236-06
2014-09-05)
(本文编辑:李欣)
10.3969/j.issn.1008-794X.2015.03.013
国家自然科学基金资助项目(81071240)
230061合肥安徽医科大学第三附属医院影像中心(沈蕾、高斌、贺克武);中国科技大学生命科学院(肖卫华)
高斌E-mail:gaobin_3136@163.com
