颈动脉分叉部动脉瘤模型的建立
2015-10-28王珏赵玉武朱悦琦李菁
王珏,赵玉武,朱悦琦,李菁
·实验研究Experimental research·
颈动脉分叉部动脉瘤模型的建立
王珏,赵玉武,朱悦琦,李菁
目的探讨建立犬颈动脉分叉部动脉瘤模型的可行性。方法建立18只犬新的颈总动脉(CCA)分叉部动脉瘤模型,随机分为分叉部顶端弹性蛋白酶处理组(实验组,n=9)和生理盐水处理组(对照组,n=9)。术后即刻、12周和24周分别行血管造影观察动脉瘤顶端形态变化,术后12周和24周分别行组织病理学分析。结果血管造影显示实验组中5只模型动脉分叉顶部观察到新生动脉瘤形成,平均直径(3.2±0.4)mm,对照组中所有模型分叉部顶端均未观察到有新生动脉瘤形成。实验组中新生动脉瘤在随访过程中未见到动脉瘤破裂。组织病理学分析显示实验组中分叉部顶端动脉瘤表现为内弹力膜不连续、弹力纤维断裂、肌层变薄、平滑肌细胞减少(与对照组相比,P<0.001)。结论犬重建颈动脉分叉顶端经弹力酶消化所致动脉壁退化可引起新生动脉瘤形成。
动脉瘤;动物模型;颈动脉
动脉瘤是动脉内腔局限性异常扩大所致动脉壁的异常瘤状突出。其中血管分叉部动脉瘤如颅内动脉瘤有着较高的患病率[1],且能引起致命性蛛网膜下腔出血。但其发生发展、破裂的具体机制,目前尚未明确[2-3]。动脉瘤发生发展、破裂机制研究,有赖于建立动脉瘤动物模型,然而仅少数动物模型较满意地模拟了分叉部动脉瘤的发生和生长[4-6]。因此,我们设计并建立一种新的犬颈动脉分叉模型,从血管造影和组织病理水平动态观察动脉瘤发生和生长。
1 材料与方法
1.1实验动物
本研究所有方案均经上海交通大学医学院动物研究委员会批准,并遵循国际动物保护协会的指导方针。实验采用18只8个月大的比格犬,体重为12~20 kg(由上海交通大学农学院提供,许可证:SCXK2007-0004)。
1.2弹性蛋白酶作用浓度和孵化时间的初筛研究
在无菌条件下,为3只犬行前下颈部正中切口,暴露和分离双侧颈总动脉(CCA),长度均为8~10 cm。在每一侧CCA中选取长度约1 cm的3段,对其外壁用弹性蛋白酶(1号犬0.75 u/μl,2号犬1.5 u/μl,3号犬3.0 u/μl)分别处理10、15、30 min。每个培育时间内取6个样本进行组织病理学观察分析,依据结果选择最佳弹性蛋白酶浓度和时间。CCA壁退化程度依据组织病理学进行分级:0级为无中膜弹力纤维损伤,内弹性膜(IEL)完整(-);Ⅰ级为中膜弹力纤维损伤,IEL完整(+);Ⅱ级为中膜弹力纤维损伤,IEL不连续(++);Ⅲ级为中膜弹力纤维损伤,IEL不连续,动脉壁结构破坏(+++)。每个断面的弹力纤维的破坏程度,由3名病理学家分别独自评分后确定。
1.3CCA分叉部动脉瘤模型建立
无菌条件下行犬前下颈部正中切口,暴露和分离双侧CCA各约10 cm。右侧CCA近端结扎,远端暂时性阻断,然后于结扎点远心端离断血管;左侧CCA两端阻断血流后中段离断。以肝素化生理盐水,用带钝头针的注射器冲洗游离血管段,保持切缘规整。然后对游离的右侧远心端CCA与左侧远心端CCA,用8-0缝线行端-端吻合,吻合血管中段切开后再与左侧近心端CCA作端-侧吻合,从而建立Y型血管分叉模型。血管夹松开并观察吻合口处无出血后,分层缝合颈部切口。18只犬的血管分叉模型建立后,随机分为分叉部顶端弹性蛋白酶处理组(实验组,n=9)和生理盐水处理组(对照组,n=9),每组有6只雌性和3只雄性。以弹性蛋白酶(3.0 u/ μl)处理实验组中9个重建的血管模型分叉部顶端15 min,面积约4 mm×4 mm。对照组模型分叉部顶端以同样方法用生理盐水处理。弹力蛋白酶孵化前,尽量多地去除血管外膜,以方便弹性蛋白酶渗透。
1.4血管造影
于模型构建后即刻、12周和24周分别行血管造影检查。右侧股动脉插管,采用4 F导管(美国Cook医疗公司)行选择性CCA造影,还施行三维DSA成像观察血管分叉顶部形态改变。如果动脉瘤样囊泡形成,从二维和三维DSA图像上测量瘤颈、瘤体直径和载瘤动脉直径。将瘤体最大径超过邻近动脉直径的一半,视为动脉瘤形成。术后第4周和第8周采用超声动态监测动脉瘤是否形成及其大小,观察重建血管通畅情况。
1.5组织病理学检查
实验组和对照组预实验和术后获得的重建CCA分叉样本分别在术后12周后(n=6)和24周后(n=3)取出,均在中性缓冲液甲醛中固定>48 h,经梯度乙醇脱水、石蜡包埋、连续切片(厚度4 μm)后行HE染色、Masson染色和弹力纤维染色,以评估重建血管分叉部组织学改变。每个样本至少有3个切片包括的完整血管分叉部,选择最佳切片用作病理学家评分。用EnVision技术以抗小鼠增殖细胞核抗原(PCNA)抗体NeoMarkers(1∶100,美国Thermo Fisher科技公司)、小鼠α单克隆平滑肌肌动蛋白抗体(1∶50,美国Santa Cruz生物技术公司)行免疫组化染色观察。测量平滑肌细胞增殖速率(PCNA阳性平滑肌细胞所占比例)、弹力层和肌动蛋白阳性平滑肌层厚。如果细胞核染色超过50%,即认为是阳性细胞。病理图片分别放大40、100、400倍观察。用Image-Pro Plus 6.0版图像分析软件分析组织病理学图像(美国Media Cybernetics公司),每个切片的血管间质区域放大400倍后至少随机选择20个。每个病理切片均由3名病理学家以盲法分别独自评分。
1.6统计分析
用GraphPad Prism 5.0版软件(美国San Diego公司)进行统计学分析。连续变量用平均值±标准差表示,数值变量以数量或百分比表示。用确切概率法(Fisher检验)比较分类资料,组间t检验比较平滑肌细胞增殖速率、弹力层、肌动蛋白阳性平滑肌层厚。所有数据均经双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1体内弹性蛋白酶暴露预实验
HE染色、Masson染色和弹力纤维染色结果证明,暴露在1.5 u/μl弹性蛋白酶30 min或3.0 u/μl中15 min,均可有效地损伤中膜弹力纤维,导致IEL结构不完整。低浓度弹性蛋白酶和较短的暴露时间不能有效损伤IEL,更长暴露时间可能会导致血管肌层过度消化;因此,我们在手术模型中使用弹性蛋白酶浓度为3.0 u/μl,孵育时间15 min(表1、图1)。
2.2CCA分叉部动脉瘤模型及血管造影结果
CCA分叉部动脉瘤模型在全部动物中均成功建立。超声或血管造影随访均显示吻合口无狭窄、无载瘤动脉闭塞。血管造影显示实验组9只模型犬中5只可在动脉分叉顶部观察到新生动脉瘤形成,其中4只为母犬,1只为公犬(P>0.05)。二维和三维DSA均显示动脉瘤位置位于分叉顶部,形态为宽基底型,瘤体平均直径(3.2±0.4)mm,瘤颈平均直径(6.7±2.3)mm,(图2)。实验组随访24周后未观察到动脉瘤破裂,较12周时仅有轻度增大,为(3.5±0.3)mm对(3.0±0.2)mm,P=0.076。超声监测于4周时均已发现所有新生动脉瘤。
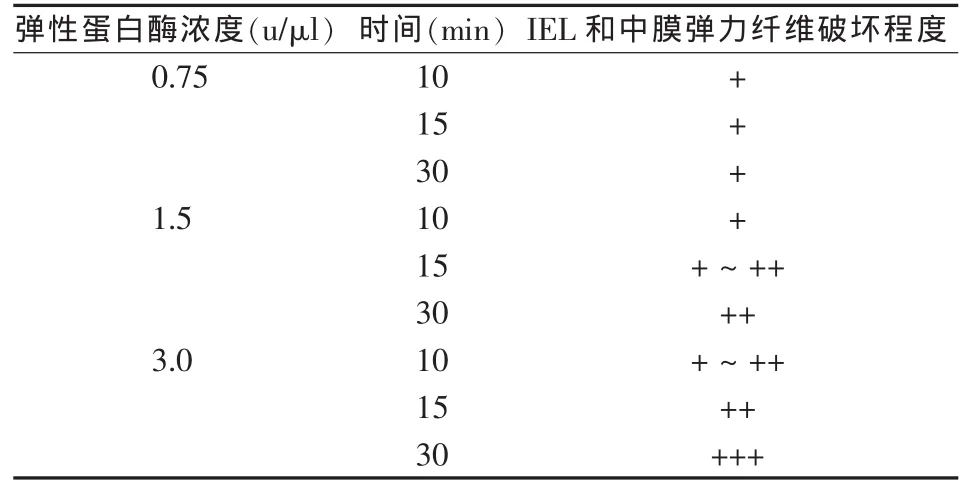
表1 预实验中犬CCA暴露在不同浓度和时间的弹性蛋白酶下组织病理学改变
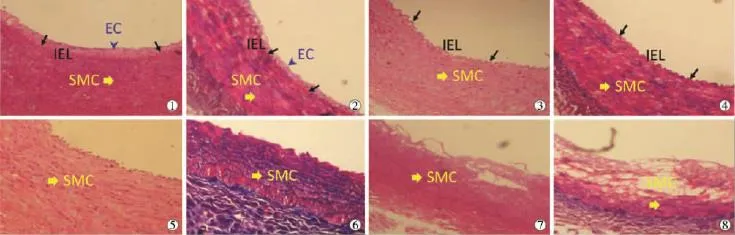
图1 不同浓度弹性蛋白酶和暴露时间影响活体预实验中犬CCA之IEL连续性
2.3动脉壁组织病理学改变
在形成动脉瘤的5个CCA分叉样本中,活体组织观察发现整个血管壁变薄,成为半透明状态,并能观察到内部血流,以致易引起变薄的血管壁膨出,分叉部动脉瘤形成。
HE染色、Masson染色显示实验组分叉部中膜变薄,平滑肌细胞减少,纤维连接缺失。弹力纤维染色显示实验组中IEL不连续,弹力纤维断裂;对照组中只有3只动物动脉分叉顶部出现内膜轻度损伤。
免疫组化染色显示,实验组中弹性蛋白酶处理过的动脉分叉顶部血管壁SMA阳性的平滑肌细胞数量减少,PCNA阳性的平滑肌细胞比例明显增加,平滑肌层变薄。
3 讨论
为进一步研究动脉瘤发生和生长机制,本研究建立动物模型,分析血管性病变的发展。先前已有相关模型报道,主要是在犬或猪颈动脉用静脉移植法构建血管分叉。这些模型主要用于指导治疗及评估治疗后血管组织病理学改变[7-8]。许多研究对动脉分叉处动脉瘤形成原因进行了分析,但模拟动脉瘤生长的较满意动物模型为数不多[5-6,9-10]。2007年,Meng等[5]通过在犬颈动脉建立血管分叉模型发现,血管高壁面切应力(WSS)或壁面切应力梯度(WSSG)与组织学损伤有关,而动脉瘤并没有发展,需要进一步研究确认观察到的组织学改变是否会引发动脉瘤。2008年,Gao等[4]通过结扎兔子双侧颈内动脉并增加血流动力学压力引发了颅内新生动脉瘤,认为血流动力学压力增加导致动脉瘤发生,与基底动脉血流增加有关;然而由于兔血管纤细,传统颅内血管造影及其他放射性手段并不能显示其结构改变。

图2 术后二维和三维DSA随访图像和大体解剖图
大型流行病学调查显示,动脉瘤尤其是颅内动脉瘤的发生与许多先天及后天因素,如遗传、血流动力学、年龄、性别、抽烟、高血压及动脉硬化等有关[11-12]。除持续血流因素外,许多研究证明血管壁退化是颅内动脉瘤发生最重要的一步[13]。血管分叉顶端与大血管不同,管壁肌层缺失。另外,颅内血管外弹力层易损或缺失及周围脑脊液分布,均会导致其易被机械力损伤[13-14]。由此推断,血管壁结构异常及胶原纤维和弹力纤维的缺失是动脉瘤发生的关键因素[15]。
本研究通过弹性蛋白酶诱导IEL和中膜弹力纤维损伤,从而导致血管壁退化。采用Meng方法,重建CCA血管分叉以模仿血流动力学环境,通过结扎对侧CCA增加血流[5]。此前已有弹性蛋白酶诱导的小鼠、大鼠和兔子模型建立[10],但用于有效损伤犬CCA的IEL及弹力纤维的弹性蛋白酶浓度不得而知。我们设计一项活体预实验,用于选择合适的弹性蛋白酶浓度损伤IEL及中膜弹力纤维,同时不损伤平滑肌细胞。由于预实验中血管壁内膜弹性蛋白酶损伤后极易导致血栓形成,我们以外膜为对象选择性损伤IEL和弹力纤维,模拟动脉壁退化。其中,去除尽可能多的外膜加强弹性蛋白酶渗透很关键。
目前大多数研究均采用小动物研究动脉瘤形成的相关机制[4-6,10]。尽管小动物血压和血流速度与人类相仿,但血管结构尤其是动脉壁肌层不尽相同。因此,小动物上建立动脉瘤模型不一定适用于大型动物。本实验使用犬模型来模拟人类血管,因为其血流动力学更接近于人类[16]。犬CCA较长(10~12 cm),为重建血管分叉提供了有利条件;犬CCA和人类ICA管径相仿,直径约4 mm;犬颅内血管供应大多来自椎基底动脉系统,再加上与ICA血管网的吻合[17],可以防止双侧CCA暂时夹闭后发生缺血致死;此外,犬类CCA细胞组成及蛋白聚糖排列与人类相同[18],这意味着犬动物模型可以准确预测人体对于危险因素的生理反应。
经过24周随访,实验组中5/9成功诱发动脉瘤,均经血管造影及组织病理学分析确认。我们假设动脉瘤退化,加上血流动力学改变,会有效地诱发动脉瘤。血管分叉顶部受损的血管壁对血流、血压和轴向拉伸会产生反应性改变。弹性蛋白酶作用区域的大小决定了瘤颈较宽、瘤体较小的动脉瘤形成,这些动脉瘤被视作早期动脉瘤。然而,这些早期动脉瘤与人类动脉瘤有相近的组织病理学改变:①IEL不连续,中部弹力层及平滑肌层层厚变薄;②中部平滑肌层有退化、变薄及损伤;③平滑肌细胞增殖减少。在对照组,3只动物对持续性血流动力学行为有着相同改变,但只有内膜损伤和IEL不连续可在弹力纤维缺失或中膜平滑肌细胞受损的动物中观察到。本研究模型还有个特点,即12周后血管造影或组织学检查均无血栓形成。这表明本实验中弹性蛋白酶作用于血管分叉部外膜,使得内膜完整,从而避免在CD39、一氧化氮、前列环素作用下血小板聚集和血栓形成[19]。
然而,本研究建立的犬CCA分叉部动脉瘤模型不能完全代表真正的颅内动脉瘤模型。因为相较颅外动脉,颅内动脉有以下特定的解剖和生理特点,本模型无法完全符合之:颅内动脉内膜层厚,内弹力层发达,而中膜和外膜较薄,仅有少量弹力纤维,没有外弹力膜,平滑肌细胞比例较小;其中最重要的是其受所处脑脊液环境的影响。
综上所述,本模型设计针对性强,制作规范,实用性高,可用于进一步研究血流动力学、基因、蛋白或生理通道等对动脉瘤发生发展、破裂的作用。
[1]Molyneux A,Kerr R,Stratton I,et al.International subarachnoid aneurysmtrial(ISAT)ofneurosurgicalclippingversus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J].Lancet,2002,360:1267-1274.
[2]Hashimoto T,Meng H,Young WL.Intracranial aneurysms:links among inflammation,hemodynamics and vascular remodeling[J]. Neurol Res,2006,28:372-380.
[3]Aoki T,Kataoka H,Moriwaki T,et al.Role of TIMP-1 and TIMP-2 in the progression of cerebral aneurysms[J].Stroke,2007,38: 2337-2345.
[4]Gao L,Hoi Y,Swartz DD,et al.Nascent aneurysm formation at the basilar terminus induced by hemodynamics[J].Stroke,2008,39:2085-2090.
[5]Meng H,Wang Z,Hoi Y,et al.Complex hemodynamics at the apex of an arterial bifurcation induces vascular remodeling resembling cerebral aneurysm initiation[J].Stroke,2007,38: 1924-1931.
[6]Nuki Y,Tsou TL,Kurihara C,et al.Elastase-induced intracranial aneurysms in hypertensive mice[J].Hypertension,2009,54: 1337-1344.
[7]杨志刚,刘建民,王奎重,等.犬侧壁动脉瘤模型建立方法的改良及评价[J].介入放射学杂志,2009,18:748-752.
[8]BerensteinA,SongJK,TsumotoT,etal.Treatmentof experimental aneurysms with an embolic-containing device and liquid embolic agent:feasibility and angiographic and histological results[J].Neurosurgery,2009,64:367-373.
[9]Meng H,Swartz DD,Wang ZJ,et al.A model system for mapping vascularresponsestocomplexhemodynamicsatarterial bifurcations in vivo[J].Neurosurgery,2006,59:1094-1100.
[10]马永迁,王育波,于金录,等.血管腔内弹性蛋白酶诱导兔动脉瘤模型制作进展[J].介入放射学杂志,2012,21:257-260.
[11]Norman PE,Powell JT.Site specificity of aneurysmal disease[J]. Circulation,2010,121:560-568.
[12]Humphrey JD,Taylor CA.Intracranial and abdominal aortic aneurysms:similarities,differences,and need for a new class of computational models[J].Annu Rev Biomed Eng,2008,10:221-246.
[13]Kataoka K,Taneda M,Asai T,et al.Structural fragility and inflammatoryresponseofrupturedcerebralaneurysms.A comparative study between ruptured and unruptured cerebral aneurysms[J].Stroke,1999,30:1396-1401.
[14]Kondo S,Hashimoto N,Kikuchi H,et al.Apoptosis of medial smooth muscle cells in the development of saccular cerebral aneurysms in rats[J].Stroke,1998,29:181-188.
[15]Nixon AM,Gunel M,Sumpio BE.The critical role of hemodynamics in the development of cerebral vascular disease[J].J Neurosurg,2010,112:1240-1253.
[16]Fischell TA,Virmani R.Intracoronary brachytherapy in the porcine model:a different animal[J].Circulation,2001,104: 2388-2390.
[17]Jung F,Beysang R,Guceve L,et al.Angiography of the cervicocephalic vessels of the dog.The carotid system[J].J Chir(Paris),1975,109:109-118.
[18]Oesterle SN,Whitbourn R,Fitzgerald PJ,et al.The stent decade: 1987 to 1997.Stanford Stent Summit faculty[J].Am Heart J,1998;136:578-599.
[19]Watson SP.Platelet activation by extracellular matrix proteins in haemostasis and thrombosis[J].Curr Pharm Des,2009,15:1358-1372.
The establishment of aneurysm model at the carotid artery bifurcation in experimental dogs
WANGJue,ZHAO Yu-wu,ZHU Yue-qi,LI Jing.School of Medicine,Soochow University,Suzhou,Jiangsu Province 215123,China
ZHAO Yu-wu,E-mail:zhaoyuwu6@163.com
ObjectiveTo investigate the feasibility of establishing aneurysm model at the carotid artery bifurcation in experimental dogs.MethodsNew aneurysm model at the common carotid artery(CCA)bifurcation was established in 18 experimental dogs,which were randomly and equally divided into study group(n=9)and control group(n=9).In the dogs of the study group,the bifurcation top was treated with elastase,while in the dogs of the control group the bifurcation top was treated with saline.Angiography was separately performed immediately after,and at 12 and 24 weeks after the operation to observe the changes of the aneurysm top.Pathological examination was separately carried out at 12 and 24 weeks after the operation. ResultsAngiography showed that nascent aneurysm formation(mean diameter of 3.2±0.4 mm)was demonstrated at the arterial bifurcation top in 5 dogs of the study group;while no nascent aneurysm at the arterial bifurcation top was observed in the control group.During the follow-up period,no rupture of the nascent aneurysm occurred in the study group.Pathological examination revealed that discontinued internal elastic membrane,elastic fiber fracture,thinning muscle layer and reduction of smooth muscle cells were detected in the aneurysm at bifurcation top in the study group;when compared with those in the control group,the difference was statistically significant(P<0.001).ConclusionThe elastase-induced digestive degeneration of artery wall can cause new aneurysm formation in the newly-established aneurysm located at carotid artery bifurcation in experimental dogs.(J Intervent Radiol,2015,24:231-235)
aneurysm;animal model;carotid artery
R543.5
A
1008-794X(2015)-03-0231-05
2014-09-22)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.03.012
215123苏州大学医学部(王珏、赵玉武);上海交通大学附属第六人民医院介入影像科(朱悦琦、李菁)
赵玉武E-mail:zhaoyuwu6@163.com
