粉红黏帚霉糖化酶基因的克隆、表达及酶学性质分析
2015-10-27张亮花尔并王华明
张亮花尔并王华明
(1. 天津科技大学生物工程学院,天津 300457;2.中国科学院天津工业生物技术研究所,天津 300308)
粉红黏帚霉糖化酶基因的克隆、表达及酶学性质分析
张亮1,2花尔并1王华明2
(1. 天津科技大学生物工程学院,天津 300457;2.中国科学院天津工业生物技术研究所,天津 300308)
用黑曲霉(Aspergillusniger)G1为宿主菌表达粉红黏帚霉(Gliocladiumroseum)糖化酶。运用PCR技术从粉红粘帚霉中扩增得到一个疑似糖化酶基因序列(约1.8 kb),并将其连接到载体pGm上组建成重组质粒pGm-3440。将重组质粒转化到黑曲霉G1菌株中,经amdS筛选及PCR验证获得表达糖化酶的黑曲霉重组工程菌。重组菌的发酵结果显示,糖化酶基因在黑曲霉中得到了分泌表达,用国标法(QB/T 1803-1993)测得重组糖化酶活性达292 U/mL。进一步对其酶学性质进行分析发现,该重组酶最适温度和pH分别为50℃和5.0,该酶的耐热性较差,pH稳定性较好。
糖化酶;粉红黏帚霉;黑曲霉G1;分泌表达
糖化酶,又称葡萄糖淀粉酶[Glucoamylase,系统命名为淀粉 α-1,4-葡聚糖葡萄糖水解酶,α-1,4-Glucanglucohydrolase(EC.3.2.1.3)],是一种具有外切活性的酶,它能把淀粉、糊精、糖原等从非还原性末端水解α-1,4-葡萄糖苷键,而得到终产物β-D-葡萄糖,也能缓慢水解α-1,6-葡萄糖苷键或α-1,3-葡萄糖苷键,转化为葡萄糖[1-3]。糖化酶在工业上具有重要的用途,例如,低热量啤酒的酿造,酒精工业中谷物的水解,淀粉糖工业中生产葡萄糖、高葡萄糖糖浆,农用化学品及药物合成等[4-6]。糖化酶来源广泛,已报道的产糖化酶真菌有23个属,35个种,细菌有3属3种[7]。由于黑曲霉能几乎100%水解淀粉产生葡萄糖,其产生的糖化酶转苷酶活性较低[8]。因此,工业生产用的糖化酶主要来自于黑曲霉。近些年,科学家们对糖化酶的研究主要集中在新基因、固定化、耐热机制、基因的调控转录及糖化酶的新应用等方面[9-11]。
黑曲霉是一种酶系丰富、代谢产物复杂的丝状真菌。黑曲霉表达系统具有优于大肠杆菌表达系统和酿酒酵母表达系统的独特优点。大肠杆菌在高表达外源蛋白时容易形成包涵体,缺少真核细胞的一些翻译后的修饰,其表达产物往往不具有生物活性,且包涵体的分离纯化也比较困难。酿酒酵母分泌蛋白的能力较弱,且往往会过度糖基化,表达真核生物蛋白通常没有活性。黑曲霉具有较强的蛋白质分泌能力,并具有与哺乳动物相似的糖基化修饰系统,可以对表达的蛋白进行正确的翻译后加工与修饰[12,13]。另外,黑曲霉已被美国政府认定为食品药品的安全生产菌株,其发酵工艺及下游分离纯化技术已相当成熟[14]。因此,黑曲霉作为一种重要生产菌株被广泛用于发酵工业。已报道的黑曲霉产品包括柠檬酸、葡糖酸、没食子酸、蛋白酶及淀粉酶等。
粉红黏帚霉(Gliocladiumroseum)异名粉红螺旋聚孢霉(Clonostachysrosea),是一种重寄生真菌(hyperparasites),能够寄生于其它真菌而营寄生生活。由于粉红黏帚霉能有效地抑制病原真菌的繁殖,自20世纪90年代发现以来粉红黏帚霉主要被用作植物病原菌的生防菌[15-17]。目前国内外对粉红黏帚霉的研究主要在其寄生机理以及植物病害的防治效果上,对其基因的克隆研究较少,尚未见有粉红黏帚霉糖化酶基因的研究报道。本研究首次将来源于粉红黏帚霉的糖化酶基因在黑曲霉G1中进行重组表达,并以酶活性高低和酶学性质为指标,旨在获得一种酶活性高、耐热性强、生产成本低、有重要应用价值的新型糖化酶。
1 材料与方法
1.1 材料
菌株大肠杆菌DH5α感受态购自北京全式金生物技术有限公司;粉红黏帚霉、黑曲霉G1为本实验室保藏。本研究所采用的黑曲霉G1宿主菌为糖化酶glaA基因和蛋白酶pepA基因双敲除的菌株。
穿梭载体pGm图谱如图1所示,共计8 982 bp,其上有来源于黑曲霉的糖化酶强启动子PglaA,来源于塔宾曲霉的终止子TglaA,并含有氨苄青霉素和乙酰胺选择性标记,3个常用的酶切位点Xba I、Pac I和Xho I。

图1 穿梭载体pGm图谱
酶和试剂:PhusionDNA聚合酶购自赛默飞世尔科技公司,Xba I、Xho I限制性内切酶、Gel Extraction Kit、Plasmid Kit、T4连接酶购自Fermentas公司,Fungal DNA Kit 购自OMEGA公司,预制蛋白胶购自英潍捷基(上海)贸易有限公司,酵母膏、蛋白胨购自OXOID公司,裂解酶、乙酰胺、氨苄青霉素购自Sigma公司,其余试剂为国产分析纯。
培养基与溶液LB、CMA、amdS筛选培养基[18]、MMSA、CSL、PromosoySpecial Medium 发酵培养基、Solution A、Solution B、Solution C、裂解液、微量元素。
粉红黏帚霉全基因组测序工作由编号为11ZCZDSY08300的天津市工业微生物基因组解析项目完成,序列暂未公开。本实验所用的启动子为黑曲霉糖化酶强启动子,诱导物为麦芽糖,该麦芽糖存在于发酵培养基中。
1.2 方法
1.2.1 糖化酶基因在粉红黏帚霉全基因组中的挖掘 用序列比对的方法将黑曲霉糖化酶(GenBank编号XP_001390530.1)序列与粉红黏帚霉全基因组预测蛋白序列进行比对,获取相似性较高的序列。将相似性较高的序列在NCBI数据库中进行BLAST比对分析,并用SignaIP分析信号肽,最终确定要克隆的糖化酶基因g3440。
1.2.2 糖化酶基因g3440的克隆 以粉红黏帚霉全基因组DNA为模板进行PCR扩增获得目的基因,PCR过程所用到的引物分别为:上游引物5'-CCGCTCGAGAGGATGGTGAAGATAATTC CCACTGTGC-3',下游引物5'-TGCTCTAGATCATCG CCAGTTATCATTAGTCGAG-3',下划线处表示Xho I、Xba I两限制酶酶切位点。PCR反应体系为20 μL:5×Phusion HF Buffer 4 μL,dNTP(10 mmol/L)0.4 μL,上下游引物(100 μmol/L)各0.4 μL,基因组1 μL,PhusionDNA polymerase 0.2 μL,Milli-Q H2O 13.6 μL。反应条件:98℃预变性30 s;98℃变性10 s,72℃延伸1 min,30个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测目的扩增产物。
1.2.3 重组表达载体的构建 用胶回收试剂盒纯化PCR产物,纯化后的PCR产物及pGm载体用Xho I、Xba I限制性内切酶进行双酶切,回收目的基因片段及载体片段进行连接,连接产物转化感受态大肠杆菌DH5α,经Amp抗性筛选阳性克隆,提取质粒,进行菌落PCR鉴定。鉴定正确后,委托英潍捷基(上海)贸易有限公司进行测序。将测序正确的质粒命名为pGm-3440。
1.2.4 黑曲霉原生质体的转化及筛选 将黑曲霉G1孢子在CMA液体培养基中30℃、200 r/min条件下培养过夜。用无菌滤布收集菌体并用Solution A冲洗,转移菌体至40 mL裂解液(40 mL Solution A中加0.6 g裂解酶)中,30℃、200 r/min裂解2-3 h。过滤并用两个无菌50 mL离心管收集原生质体,每管加Solution B至25 mL,4 000 r/min、5 min,弃上清;每管加 25 mL Solution B,4 000 r/min、5 min,弃上清;合并两管,加20 mL Solution B,4 000 r/min、5 min,弃上清。加10 μL DNA、12.5 μL Solution C、100 μL原声质体,冰浴20 min。取出,加1 mL Solution C、2 mL Solution B,9 mL MMSA上层培养基,混匀倒入平板MMSA中,培养7-10 d直至长出转化子。用amdS筛选培养基进行转化子筛选,将转化子进行基因组提取并进行PCR鉴定及测序鉴定,鉴定正确的菌株即为重组黑曲霉菌株。
1.2.5 重组菌的发酵验证 挑取重组黑曲霉菌株,接种于20 mL发酵培养基中,30℃、200 r/min培养5 d,14 000 r/min离心10 min收集上清液。取30 μL上清液,加10 μL 4×Loading Buffer,沸水煮5 min,用10%预制胶上样10 μL进行电泳,电泳条件200 V、45 min。
1.2.6 重组酶活性测定 重组糖化酶酶活测定按国家行业标准QB/T1803-1993进行。酶活定义:1 mL液体酶,于40℃、pH值为4.6的条件下,1 h分解可溶性淀粉产生1 mg葡萄糖,即为1个酶活力单位,以(U/mL)表示。
1.2.7 生淀粉糖化酶活性测定 预先将酶液用乙酸-乙酸钠缓冲液(pH6.0)稀释100倍,取3 mL加入250 mL三角瓶中,加入0.9 g玉米淀粉,再加入缓冲液24 mL,60℃、100 r/min培养1 h,并设未加酶液作为空白对照。取出加入3 mL 10%碳酸钠溶液,4 000 r/min离心10 min,取上清,用GOPOD试剂盒检测还原糖的含量。
1.2.8 重组酶最适温度及热稳定性测定 用DNS法在pH4.6条件下测定不同温度下重组酶的活力,以最高酶活100%计。在不同温度下将重组酶保温一段时间(5、10、15、30、60 和90 min),在最适条件下测定剩余酶活,以未处理的酶液酶活为100%计。1.2.9 重组酶最适pH及pH稳定性测定 在最适温度下测定不同pH值下重组酶的活力,以最高酶活100%计。在室温下将重组酶在不同pH值缓冲溶液中放置一段时间(1、2、4、8、20和32 h),在最适条件下检测剩余酶活力,以未处理的酶液酶活为100%计。
2 结果
2.1 糖化酶基因的挖掘
用序列比对的方法从粉红黏帚霉全基因组中获得了一个可能编码糖化酶的基因g3440,其注释信息为E5AAM7_Glucoamylase。该基因编码一个含有527个氨基酸的蛋白质,其序列已在2013年申请的专利(申请号201310718737.2)中公开。用VectorNTI软件预测其分子量为56.4 kD。该蛋白序列与黑曲霉糖化酶相似性达48%,覆盖度达97%(图2)。用SignaIP分析发现该序列存在一个信号肽切割位点,推断的信号肽切割位点在S22-E23之间,该信号肽属于真核生物信号肽。

图2 粉红黏帚霉g3440基因的氨基酸序列与黑曲霉糖化酶序列同源性比对分析
该基因大小为1 825 bp,其cDNA大小为1 584bp,含有3个内含子序列,大小分别为173、13和55 bp。将g3440基因的氨基酸序列在NCBI数据库中进行BLAST比对,结果显示该序列与NCBI中已公布的来源于Leptosphaeriamaculans JN3 的糖化酶(GenBank编号XP_003844197.1)相似性最高(62%),因此,可判断本研究扩增到的是一个新糖化酶基因。
2.2 PCR扩增产物鉴定
通过对粉红黏帚霉菌全基因组基因进行PCR,获得了大小正确的(1 825 bp)核苷酸序列(图3)。

图3 PCR扩增产物的电泳分析
2.3 转化子基因组PCR鉴定
提取黑曲霉转化子(5个)的基因组,PCR验证及电泳分析结果如图4所示。

图4 转化子菌株基因组PCR鉴定
2.4 重组菌的发酵产酶鉴定
SDS-PAGE(图5)显示1、4、5号转化子均有表达。目的基因随机重组到黑曲霉G1基因组中,2、3号菌可能是目的基因随机重组的位点不正确,未能转录与翻译。目的蛋白的分子量稍微偏大,用NetNGlyc 1.0 Server进行分析发现该氨基酸序列中有2个潜在的N-糖基化位点,因此推断该蛋白可能进行了糖基化修饰,造成其实际分子量比根据氨基酸预测值大[19]。

图5 黑曲霉转化子的SDS-PAGE分析
2.5 重组酶的活性及酶学性质分析
2.5.1 重组酶活性测定 用国标法(QB/T 1803-1993)对重组酶液进行酶活性测定,结果显示1号转化子酶活性高达292 U/mL,4、5号转化子酶活性分别为257 U/mL和263 U/mL。
2.5.2 生淀粉糖化酶活性测定 重组酶生淀粉糖化酶活性测定结果见表1。反应前后葡萄糖的变化可知1、4、5号转化子生淀粉糖化酶活性均较低,甚至比出发菌株G1还低,因此认为没有生淀粉糖化酶活性。

表1 葡萄糖的含量
2.5.3 重组酶的最适温度及热稳定性测定 用DNS法,在不同温度下测定重组酶的活性。结果(图6)显示该酶的最适温度为50℃。将重组酶在不同温度下保温并进行酶活性测定,结果(图7)表明重组酶的耐热性较差,在最适温度下保温15 min酶活性大约损失一半。

图6 重组酶最适温度曲线
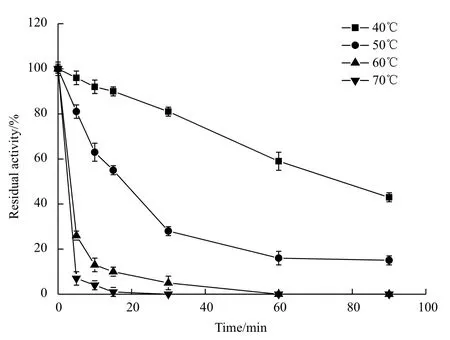
图7 重组酶热稳定性曲线
2.5.4 重组酶的最适pH及pH稳定性测定 在不同pH值下对重组酶活性进行测定,发现重组酶的最适pH为5.0(图8)。在将重组酶在不同pH溶液中室温放置一段时间,并进行酶活性测定,结果(图9)发现重组酶的pH稳定性较好,在pH5.0-6.0的缓冲液中放置20 h后仍有80%以上的酶活力。

图8 重组酶最适pH曲线

图9 重组酶pH稳定性曲线
3 讨论
随着全球经济的发展,能源短缺的问题日益突出,可再生能源的开发与利用受到了世界各国的高度重视。淀粉是绿色植物果实、种子、块茎、块根的主要成分,是空气中二氧化碳和水经光合作用合成的产物,是地球上最丰富的贮藏性多糖。然而,大多数微生物多以葡萄糖、麦芽糖等低聚糖为最适底物,天然淀粉却不能被有效的利用。将天然淀粉转化为可发酵性糖成为一个亟待解决的问题。糖化酶是水解淀粉的重要酶类之一,它可以水解生淀粉或低聚糖非还原性末端α-1,4-糖苷键生成葡萄糖。许多糖化酶水解生淀粉的活性较低且热稳定性差,工业上在进行糖化前需将淀粉质原料进行高温糊化和液化,并进行降温冷却,增加了生产成本。开发出酶活性高,耐热性强的新型糖化酶可大大降低生产成本,提高发酵工业的经济效益。近几年,国内对新型糖化酶基因及表达的研究较少,对黑曲霉糖化酶基因、表达及产酶条件的研究较多。2008年,李昆等[20]用黑曲霉糖化酶基因启动子PglaA替换质粒pRS303K上KmR基因启动子,构建成糖化酶基因启动子功能检测质粒pRS-PglaA-KmR,并将其转化E. coli JM109,通过对重组菌的氨基糖苷磷酸转移酶基因活性检测发现PglaA在E. coli中具有驱动KmR基因表达的活性。2011年贺莹等[21]对黑曲霉IN7-31产糖化酶的液态发酵参数与技术优化进行研究,其摇瓶发酵糖化酶酶活高达3 044 U/mL,较优化前提高了1.59倍。2012年,王强等[22]将黑曲霉糖化酶基因在毕赤酵母X33中进行了成功表达,其表达量达180 mg/L。本研究采用基因工程技术手段将粉红黏帚霉糖化酶基因插入到黑曲霉G1染色体中,并实现了成功表达,该重组酶酶活达292 U/mL,最适温度和pH分别为50℃和5.0。本研究为后续新型糖化酶的开发奠定了基础,同时也为糖化酶的研究提供了一种新的出发菌株。随着老一代糖化酶逐渐被新型糖化酶取代,筛选和开发高比酶活、耐高温或用于生淀粉加工的新型糖化酶基因,对于淀粉加工产业和酿酒糖化过程优化等工业生产技术提升提供支持。同时,新型糖化酶的开发可以打破国际专利对传统糖化酶的保护壁垒和技术垄断,为我国淀粉质原料的降解提供更高效的酶及辅助因子。传统糖化酶大都存在酶活性不高,耐热性差等问题,在实际生产运用中能耗大、耗时长、成本高,而开发出酶活性高,耐热性强的新型糖化酶可大大降低淀粉质原料的糖化成本,提高糖化效率。此外,传统糖化酶的生产菌株大多是野生菌株经过反复诱变而得到的突变株,在实际生产中存在着易污染、生产条件复杂且难以控制等技术性难题,而新型糖化酶菌株通过基因工程技术手段定向构建,可有效解决这些问题。本研究获得的重组酶活性有待进一步提升,同时该酶的酶学性质在耐热方面也需要改善。进行密码子优化及高通量筛选,提升重组酶的活性和酶学性质将是下一步研究工作的重心。
4 结论
本研究首次克隆并报道了粉红黏帚霉糖化酶基因,并将其转化到黑曲霉G1中获得了糖化酶的表达。120 h摇瓶发酵后,发酵液上清糖化酶活性达292 U/mL。对重组糖化酶的酶学性质进行研究表明,其最适温度和pH分别为50℃和5.0,该酶热稳定性较差,pH稳定性较好,在pH5.0-6.0的缓冲液中室温放置20 h后仍有80%的残余酶活。
[1] James JA, Lee BH. Glucoamylases:microbial sources, industrial applications andmolecular biology—a review[J]. Journal of Food Biochemistry, 1997, 21(1):1-52.
[2] Pandey A, Nigam P, Soccol CR, et al. Advances in microbial amylases[J]. Biotechnol Appl Biochem, 2000, 31(2):135-152.
[3]Kaur P, Satyanarayana T. Production and starch saccharification by a thermostable, and neutral glucoamylase of a thermophilic mould Thermomucor indicae-seudaticae[J]. World Journal of Microbiology& Biotechnology, 2004, 20(4):419-425.
[4]马丽娜, 陈喜文, 陈德富, 等. 曲霉属糖化酶基因的克隆及其在毕赤酵母中的表达[J]. 南开大学学报, 2007, 5(40):85-90.
[5]刘喜凤, 王肇悦, 张博润. 糖化酶及糖化酶基因在酿酒酵母中表达的研究进展[J]. 酿酒, 2007, 34(4):73-76.
[6]梁新红, 孙俊良, 唐玉, 等. 黑曲霉糖化酶分离纯化与酶学性质研究[J]. 河南科技学院学报, 2011, 39(4):24-27.
[7] 陈启和, 何国庆. 糖化酶及其基因研究进展[J]. 微生物学杂志,2000, 20(4):46-50.
[8]Mertens JA, Skory CD. Isolation and characterization of two genes that encode active glucoamylase without a starch binding domain from Rhizopusoryzae[J]. Curr Microbiol, 2007, 54(6):462-466.
[9]姚婷婷, 王衍敏, 顾建龙. 携多拷贝glaA的重组黑曲霉过量合成糖化酶的研究[J]. 生物工程学报, 2006, 22(4):567- 571.
[10]康东亮. 高产率糖化酶菌株的诱变选育[J]. 河南工业大学学报:自然科学版, 2006, 27(4):43- 46.
[11]王家东, 张茜, 侯红萍. 介孔分子筛MCM-41固定糖化酶的研究[J]. 中国酿造, 2012, 31(1):116-119.
[12]Durand H, Clanet M, Tiraby G. Genetic improvement of scale cellulase production[J]. Enzyme and Microbial Technology,1988, 10(6):341-346.
[13]Van den Hombergh JP, Van de Vondervoort PJ, Fraissinet-Tachet L,et al. Aspergillus as ahost for heterologous protein production:the problem of proteases[J]. Trends Biotechnology, 1997, 15(7):256-263.
[14]Pavezzi FC, Carneiro AA, Martins DA, et al. Influence of different substatesonthe production of a mutant thermostableglucoamylasein submerged fermentation[J]. Appl Bicohem Biotechnol, 2011,163(1):14-24.
[15]何迎春, 高必达. 立枯丝核菌的生物防治[J]. 中国生物防治,2000, 16(1):31-34.
[16]莫明和, 董林茜, 迟胜起, 等. 立枯丝核菌重寄生真菌的筛选[J]. 植物病理学报, 2002, 32(1):84-88.
[17]Vaili NG. Biological seed treatment of corn with mycopathogenic fungi[J]. Journal of Phytopathology, 1992, 134(4):313-323.
[18]赵颖, 巴再华, 张春艳. 双向选择标记amdS在黑曲霉中自发突变及amdS-检测[J]. 济宁医学院学报, 2008, 31(4):283-285.
[19]Duan YT, Wang Z, Wu W, et al. Polycistronic expression of human platelet factor 4 with heparin-neutralizing activity in Escherichia coli[J]. Bioscience, Biotechnology, And Biochemistry, 2012, 76(10):1855-1860.
[20]李昆, 李松, 牛丹丹, 等. 黑曲霉糖化酶基因启动子功能鉴定[J]. 微生物学杂志, 2008, 28(6):5-9.
[21]贺莹, 吕利华, 张婵, 等. 黑曲霉IN7-31产糖化酶的液态发酵参数与技术优化研究[J]. 中国酿造, 2011, 1:48-51.
[22]王强, 徐义兵, 郭春和, 等. 黑曲霉糖化酶基因在毕赤酵母X33中的高效表达[J]. 中国畜牧兽医, 2012, 39(4):21-24.
(责任编辑 李楠)
Cloning,Expression and Characterization of Glucoamylase from Gliocladium roseum
Zhang Liang1,2Hua Erbing1Wang Huaming2
(1. College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457;2.Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308)
Glucoamylase from Gliocladium roseum was secretively expressed in Aspergillus niger G1 strain. A putative glucoamylase gene(about 1. 8 kb)was amplified by PCR using genomic DNA of G. roseum as template. The amplified products were ligated into the clone vector pGm to construct recombinant plasmid pGm-3440. The recombinant plasmid transformed into A. niger G1 strain, and amdS screening and PCR validation confirmed that an engineering Aspergillus strain of expressing glucoamylase was obtained. Fermentation of recombinant strain indicated that secretive expression of the glucoamylase gene was available in A. niger, and its enzyme activity was measured by method defined in national standard(QB/T 1803-1993), and it reached 292 U/mL. Further enzymatic analysis demonstrated that the optimum pH and temperature for the recombinant enzyme were 5. 0 and 50℃, respectively. Meanwhile, it had poor thermal resistance, but promising pH stability.
glucoamylase;Gliocladium roseum;Aspergillus niger G1;secretive expression
10.13560/j.cnki.biotech.bull.1985.2015.07.029
2014-10-21
“十二五”基础前沿专项(Y1J4061201)
张 亮,男,硕士研究生,研究方向:生物工程;E-mail:929850607@qq.com
花尔并,男,博士,教授,研究方向:药物合成,E-mail:huarb@tust.edu.cn;王华明,男,博士,教授,研究方向:新型工业酶及表达系统,E-mail:wang_hm@tib.cas.cn
