酸性α-淀粉酶菌株的筛选及其发酵条件研究
2015-10-27屈建航尹伊焦国宝丁长河张倩屈凌波刘仲敏
屈建航尹伊焦国宝丁长河张倩屈凌波刘仲敏
(1. 河南工业大学生物工程学院,郑州 450000;2. 河南仰韶生化工程有限公司,渑池 472400)
酸性α-淀粉酶菌株的筛选及其发酵条件研究
屈建航1尹伊1焦国宝2丁长河1张倩1屈凌波1刘仲敏2
(1. 河南工业大学生物工程学院,郑州 450000;2. 河南仰韶生化工程有限公司,渑池 472400)
自淀粉厂周边土壤分离筛选到一株高效耐酸α-淀粉酶菌株SH3,初步鉴定为酵母菌,发酵粗酶pH范围3.8-8.0,最适作用pH5.0,该酶在80℃下仍有酶活,最适作用温度50℃。经单因素发酵条件的研究与优化,最适温度37℃,培养基初始pH5.0,可溶性淀粉作碳源,蛋白胨为氮源,200 mL装液量。正交试验确定最佳产酶条件为可溶性淀粉15 g/L、蛋白胨30 g/L、37℃、pH4.5,该条件下酶活力为96.8 U/mg。
耐酸α-淀粉酶;菌株筛选;发酵条件;工艺优化;酵母菌
α-淀粉酶可从淀粉分子内部切开α-1,4 糖苷键,生成糊精和还原糖,广泛应用于食品、酿造、制药、纺织及石油开采等诸多领域,在工业生产中有极其重要的地位,是目前用途较广泛的一种酶制剂[1,2]。目前工业应用的α-淀粉酶主要来源于细菌和丝状真菌[3,4],在原始菌株中,真菌来源的α-淀粉酶被发现比细菌更稳定[5]。国外对酸性α-淀粉酶的研究起步较早,1963年日本Yasuji等[6]发现可用真菌生产酸性α-淀粉酶。在酵母菌中也发现了部分能产生高酶活α-淀粉酶的菌株[7]。我国对产α-淀粉酶菌株的研究起步较晚,尤其是耐酸性α-淀粉酶。目前,国际上一些大的酶制剂公司生产耐酸α-淀粉酶的菌种50%是基因工程菌[8]。近年来,已发现数十株优良产α-淀粉酶菌,包括耶鲁维亚酵母(Yarrowia)、类酵母(Aureobasidium)、毕赤氏酵母(Pichia)、假丝酵母(Candida)、红酵母(Rhotolorula)等[9],对酵母菌应用于工业生产α-淀粉酶有了进一步推动[10]。本研究筛选出一株耐酸性α-淀粉酶酵母菌株,研究且优化其发酵条件,旨在为工业利用提供参考。
1 材料与方法
1.1 材料
1.1.1 土壤样品 河南省偃师某面粉厂污水排出口处采集土壤样品。4℃保存备用。
1.1.2 培养基 筛选培养基(g/L)[1]:牛肉膏 3,蛋白胨 10,NaCl 5,可溶性淀粉 10,琼脂粉 15,pH 5.0。种子及发酵培养基(g/L)[11]:胰蛋白胨5,可溶性淀粉10,(NH4)2SO42.5,KH2PO43,CaCl20.2,pH调至5.0。
1.2 方法
1.2.1 酸性α-淀粉酶产生菌的分离筛选 初筛:土壤样品,10倍梯度稀释法涂布于筛选培养基,28℃恒温培养。滴加碘液,记录有透明圈的菌株。复筛:将初筛有透明圈的菌株,接种种子培养基,37℃、200 r/min培养12 h,以10%的接种量转至发酵培养基,相同条件培养24 h。发酵液5 000 r/min离心15 min,上清为粗酶液,测定酶活[1]。
1.2.2 淀粉酶活力测定方法 Yoo酶活测定法[12,13]稍加改进:2.5 mL 0.5%可溶性淀粉溶液与2.5 mL柠檬酸-磷酸盐缓冲液(pH5.0)50℃恒温水浴锅预热10 min,加入酶液0.5 mL,50℃下准确反应10 min,加入5 mL 0.1 mol/L的盐酸终止反应,取上述混合液0.5 mL与5 mL碘液混匀,660 nm测定吸光度值R(以2.5 mL蒸馏水代替可溶性淀粉溶液,其余条件相同作为空白)。在上述反应条件下,以0.5 mL的缓冲液代替0.5 mL酶液,测定吸光度值R0[11]。
酶活定义:50℃、pH5.0条件下,10 min水解1 mg淀粉所需的酶量为一个酶活力单位。
酶活公式:待测酶活(U/mg)=100*D*(R0-R)/R
其中,D:稀释倍数,R0:对照吸光值,R:酶液的吸光值,100:转换系数。
1.2.3 菌种ITS序列鉴定
1.2.3.1 分子试剂及引物 Taq mix(TaKaRa)、ITS4引物5'-3':ggAAgTAAAAgTCgTAACAAgg、ITS5引物5'-3':TCCTCCgCTTATTgATATgC。
1.2.3.2 基因系统发育鉴定 基因组总DNA的提取参考文献[14]进行。ITS序列PCR扩增反应体系:Taq mix 12.5 μL,ITS4 0.5 μL,ITS5 0.5 μL,ddH2O 9 μL,基因组DNA模板2.5 μL,总体积25 μL。反应过程:95℃ 5 min,30次循环(94℃ 30 s,55℃ 1 min,72℃ 1 min),72℃ 10 min。PCR产物测定核苷酸序列,GenBank数据库完成BLAST比对。
1.2.4 酶学性质研究 37℃、200 r/min培养48 h的发酵液上清作为粗酶,pH3.8、4.0、4.5、5.0、6.0、7.0、8.0的缓冲条件,分别测定酶活以确定pH范围。设置30、37、45、50、55、60、70和80℃温度条件测定酶活以确定温度耐受性。
1.2.5 产酶发酵条件研究
1.2.5.1 菌株产酶曲线 种子液10 mL接种到100 mL发酵培养基,从3 h开始每小时测定酶活,以培养时间为横坐标,酶活力为纵坐标绘制产酶曲线。
1.2.5.2 温度对菌株产酶的影响 以5%的接种量将种子液接至100 mL发酵培养基,分别28、37、40℃振荡培养,从产酶高峰期开始每小时测定酶活。
1.2.5.3 初始pH对菌株产酶的影响 调节发酵培养基初始pH值为4.5、5.0、5.5、6.0,接入5%种子液,37℃、200 r/min培养,在产酶高峰期取样,测定酶活。
1.2.5.4 碳源对菌株产酶的影响 分别以0.5%葡萄糖、蔗糖、乳糖、可溶性淀粉作为碳源,5%的接种量至100 mL发酵培养基中,37℃、200 r/min培养,在产酶高峰期测定酶活[15]。
1.2.5.5 氮源对菌株产酶的影响 分别以0.5%蛋白胨、棉籽饼、黄豆饼、牛肉膏作为氮源,5%的接种量至100 mL发酵培养基中,37℃、200 r/min培养,在产酶高峰期测定酶活。
1.2.5.6 装液量对菌株产酶的影响 在500 mL三角瓶中分别装入50、100、150、200 mL发酵培养基,接入5%的种子液,37℃、200 r/min培养,在产酶高峰期测定酶活。
1.2.6 正交试验 根据单因素优化实验结果,针对碳源、氮源、温度和pH,经SPSS软件设计四因素三水平正交实验[16]。
2 结果
2.1 菌株筛选
共筛选出产酸性α-淀粉酶的菌株24株,部分筛选结果见表1,其中初筛SH3菌株,透明圈/菌落直径比最大,D/d为5,选其作为实验菌株。
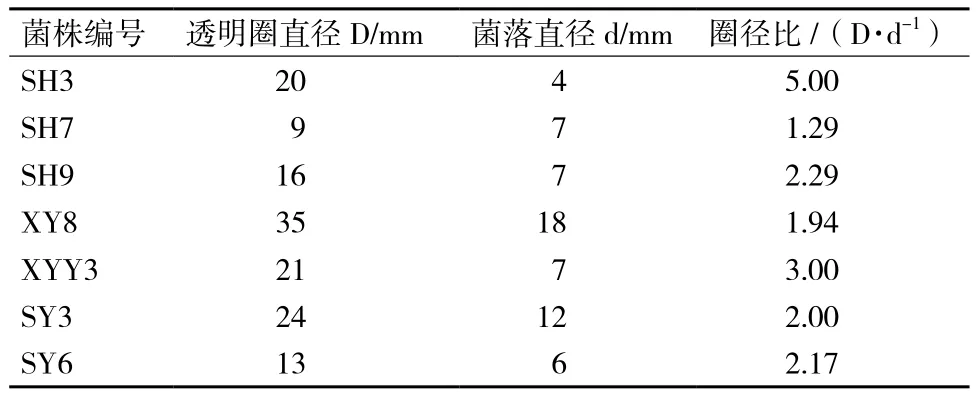
表1 菌种初筛结果
2.2 菌种鉴定
PCR扩增菌株18S ITS基因片段,测序后GenBank序列比对,结果与红酵母属(Rhodotorula sp.)的序列同源性最高,为97%(AM901697)-98%(NR073315),基本确定为酵母菌。
2.3 产酶曲线
产酶曲线见图1,由图1可见酶活先上升后下降,在14 h酶活达到91.4 U/mg,此后酶活迅速下降,12-15 h是高酶活时期。

图1 SH3菌株产酶曲线图
2.4 酶的pH和温度范围
50℃、不同pH下测定菌株SH3的α-淀粉酶活力,结果如表2所示。SH3所产淀粉酶活力受酸碱度影响较大,该酶在pH3.8-8.0之间均有酶活,在偏酸性条件下酶活力较高,pH5.0为酶反应最适pH,酶活为79.8 U/mg。

表2 酶的pH耐受范围
pH5.0、不同温度下测定SH3酶活力,结果由表3可知,该酶在30℃-80℃均有酶活,30℃-50℃酶活力随温度升高而升高,最适作用温度为50℃,酶活力为74.2 U/mg。

表3 酶的温度作用范围
2.5 产酶发酵条件优化结果
2.5.1 温度对菌株产酶的影响 28℃、37℃、40℃发酵条件下研究温度对菌株SH3产酶的影响,结果(图2)表明,37℃和40℃酶活均是先上升后下降,37℃酶活14 h达到最高91.6 U/mg,40℃酶活与37℃相比上升较快,13 h达到最高91.3 U/mg,但下降也较快。28℃菌体生长缓慢,高活性酶活出现较晚。可能随温度升高生长代谢加快,产酶高峰期提前。选取37℃作为最佳发酵温度。

图2 温度对产酶的影响
2.5.2 装液量对菌株产酶的影响 由图3可知,在发酵高峰期,相同时间内200 mL装液量的发酵酶活最高,14 h时达到最高88.2 U/mg。
2.5.3 初始pH对菌株产酶的影响 选取pH4.5、5.0、5.5、6.0的初始培养条件,分别测定SH3酶活力,结果(图4)表明,pH4.5-6.0条件下菌体均能生长,发酵14 h时测定酶活,pH5.0发酵条件下酶活最高,为89.7 U/mg,依次高于pH5.5、6.0和4.5,其中pH4.5发酵条件下酶活相对最低,为33.4 U/mg。

图3 装液量对菌株产酶影响

图4 初始培养基pH条件对产酶的影响
2.5.4 碳源和氮源对菌株产酶的影响 由表4可知,可溶性淀粉作为培养基碳源时酶活最高,为87.95 U/mg,葡萄糖作碳源时酶活最低。而氮源中蛋白胨为最佳氮源,酶活最高达到93.39 U/mg,棉籽饼作氮源时酶活最低,为53.82 U/mg。

表4 碳源和氮源对菌株产酶的影响
2.6 正交实验及结果
在单因素的基础上,对可溶性淀粉、蛋白胨、初始温度与pH四因素作三水平正交试验(表5)。由表6可知,最佳发酵条件为可溶性淀粉15 g/L、蛋白胨30 g/L、37℃、pH4.5,对应酶活最高为96.8 U/mg。极差分析结果可看出,碳源对菌株产酶的影响最大,影响程度依次为:可溶性淀粉>蛋白胨>pH>温度。

表5 四因素三水平表
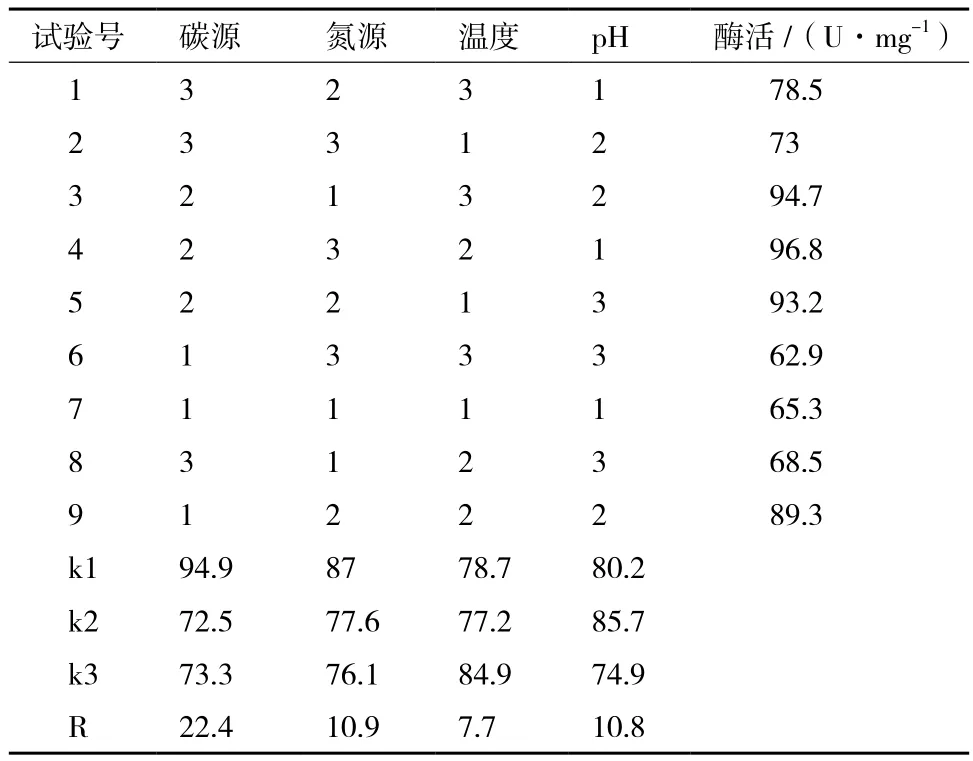
表6 正交实验结果及极差分析结果
3 讨论
酶α-淀粉酶是基于淀粉糖原料生产产品过程中使用的主要糖酶,在全球酶制剂产业中占30%左右[17,18]。传统α-淀粉酶最适作用pH值为5.8-6.2,而淀粉乳偏酸性(pH3.2-4.5),进一步糖化也是在酸性条件(pH4.2-4.5)下进行,即液化前后需两次调pH,影响产品提取,不利于节能减排。耐酸耐高温α-淀粉酶可有效解决这一问题,需求量越来越大,已在欧美等发达国家得到广泛应用,但菌种选育等核心技术也被国外跨国公司所垄断。我国缺乏高产菌株,尚不能自主生产。
现阶段筛选得到的产酸性α-淀粉酶菌株主要是芽孢杆菌和曲霉[20,21,22],普遍存在产酶水平较低的问题,仍需在自然界筛选高酶活菌株,并进一步优化耐酸、耐高温性能。采用基因工程技术对功能基因进行定向改造,构建工程菌,是选育高产、高性能菌株的重要途径[19]。
4 结论
从土壤样品中分离到一株产酸性α-淀粉酶菌株SH3,该菌18S ITS序列与红酵母菌相似性97%。其酶活性最适作用pH5.0,最适作用温度50℃。最佳发酵条件为可溶性淀粉15 g/L、蛋白胨30 g/L、37℃、pH4.5,对应酶活力96.8 U/mg。
[1]张丽靖, 沈江峰, 金庆超, 等. 一株酸性淀粉酶产生菌的分离、鉴定及酶学特性初步研究[J]. 生物技术通报, 2011(5):142-145.
[2]谢建华, 师永生, 杜丽琴, 等. 一株产酸性α-淀粉酶菌株的筛选、纯化及酶学性质[J]. 应用与环境生物学报, 2011, 17(1):95-99.
[3]Gupta R, Gigras P, Mohapatra H, et al. Microbial α-amylases:a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11):1599-1616.
[4]李松, 王正祥. 真菌α-淀粉酶的研究进展[J]. 生物技术通报,2011(3):66-70.
[5]姚清, 陈建华. 新型α-淀粉酶的研究进展[J]. 药物生物技术,2013, 20(6):553-555.
[6]Yasuji M. Acid-stable-amylase of black aspergilla partⅡ[J]. Agricultural and Biological Chemistry, 1968, 32(1):104-109.
[7]Augustin J, Zemek J, Kocková-Kratochvílová A, et al. Production of α-amylase by yeasts and yeast-like organisms[J]. Folia Microbiologica, 1978, 23:353-361.
[8] 王琦. 耐高温α-淀粉酶基因改造研究进展[J]. 食品研究与开发, 2013, 34(5):133-136.
[9]池振明, 龚方, 李静, 等. 海洋酵母菌胞外酶及其基因的最新研究进展[J]. 中国海洋大学学报, 2008, 38(5):766-774.
[10]Li H, Chi Z, Wang X, et al. Amylase production by the marine yeast Aureobasidium pullulans N13d[J]. Journal of Ocean University of China, 2007, 6:60-65.
[11]潘涛. 一株酸性α淀粉酶产生菌的筛选、发酵条件及基因克隆研究[D]. 郑州:河南工业大学, 2010.
[12]李翠香, 胡元森, 潘涛. 一株耐酸性α-淀粉酶产生菌的分离鉴定及发酵条件研究[J]. 河南工业大学学报:自然科学版,2009, 30(2):51-54.
[13]Yoo YJ, Hatch RT. Comparison of alpha-amylase activities from different assay methods[J]. Biotechnology and Bioengineering,1987, 30:147-151.
[14]吴文婷. 地芽孢杆菌CHB1产高温酶液态发酵条件优化及其粗酶液性质初探[D]. 福州:福建农林大学, 2012.
[15]朱中南, 郑毅, 章淑妹, 等. α-淀粉酶发酵条件的优化[J].海峡科学, 2011, 60(12):23-25.
[16]卢纹岱. SPSS for Windows统计分析[M]. 第3版. 北京:电子工业出版社, 2006.
[17]Sanchez S, Demain AL. Enzymes and bioconversions of industrial,pharmaceutical, and biotechnological significance[J]. Organic Process Research & Development, 2011, 15(11):224-230.
[18]Hashemi M, Shojaosadati SA, Razavi SH, et al. The efficiency of temperature-shift strategy to improve the production of α-amylase by Bacillus sp. in a solid-state fermentation system[J]. Food and Bioprocess Technology, 2012, 5:1093-1099.
[19]Sharma A, Satyanarayana T. High maltose-forming, Ca2+-independent and acid stable α-amylase from a novel acidophilic bacterium, Bacillus acidicola[J]. Biotechnology Letters, 2010,32:1503-1507.
[20]黄伟, 刘永乐, 王发祥, 等. 原生质诱变选育高产酸性α-淀粉酶黑曲霉菌株[J]. 食品工业科技, 2014, 3:160-167.
[21]Sharma A, Satyanarayana T. Microbial acid-stable α-amylases:characteristics, genetic engineering and applications[J]. Process Biochemistry, 2013, 48:201-211.
[22]王建玲, 陈志鑫, 刘逸寒, 等. 产耐酸性α-淀粉酶菌株的分离、鉴定、酶学特性研究及发酵培养基的优化[J]. 生物技术通报,2014(4):133-136.
(责任编辑 李楠)
Screening of a Strain Producing Acid-stable α-Amylase and Optimization of Its Fermentation Condition
Qu Jianhang1Yin Yi1Jiao Guobao2Ding Changhe1Zhang Qian1Qu Lingbo1Liu Zhongmin2
(1. College of Biological Engineering,Henan University of Technology,Zhengzhou 450000;2. Henan Yangshao Biochemical Engineering Company,Mianchi 472400)
A strain SH3 producing acid-stable α-amylase was isolated from the soil nearing a starch factory. It was preliminarily identified as yeast. The pH range of crude enzyme reaction was 3. 8-8. 0 with the optimum of 5. 0, and the activity of the enzyme was still available in the temperature of 80℃ with the optimum of 50℃. The optimization of single-factor fermentation revealed that the optimal condition for the enzyme production was 37℃, pH 5. 0, soluble starch as carbon source, peptone as nitrogen source and 200 mL liquid volume. Orthogonal test showed that the optimal fermentation condition was as soluble starch of 15 g/L, peptone of 30 g/L, 37℃ and pH4. 5, under which the enzyme activity was 96.8 U/mg.
acid-stable α-amylase;strain screening;fermentation condition;process optimization;yeast
10.13560/j.cnki.biotech.bull.1985.2015.07.028
2014-11-25
国家科技支撑计划项目(2013AA102101),国家自然科学面上基金项目(31370147),河南省高校青年骨干教师资助计划(2013GGJS-077),河南省高校科技创新团队(15IRTSTHN019)
屈建航,女,博士,研究方向:微生物学;E-mail:qjh_bata@163.com
