日本鳗鲡I型Cathelicidin基因的克隆与原核表达
2015-10-27张东玲喻达辉
张东玲喻达辉
(1. 集美大学水产学院 鳗鲡现代产业技术教育部工程研究中心,厦门 361021;2.中国水产科学研究院南海水产研究所,广州 510300)
日本鳗鲡I型Cathelicidin基因的克隆与原核表达
张东玲1喻达辉2
(1. 集美大学水产学院 鳗鲡现代产业技术教育部工程研究中心,厦门 361021;2.中国水产科学研究院南海水产研究所,广州 510300)
Cathelicidin是目前发现的一个最大抗菌肽家族,具有多重生物学功能。旨在探索和利用鱼类Cathelicidin抗菌机制和潜在的生物学功能。应用RACE-PCR技术获得日本鳗鲡I型Cathelicidin(AjCathI)基因的cDNA全长序列。AjCathI的cDNA全长为842 bp,开放阅读框为570 bp,编码189个氨基酸。氨基酸序列分析表明,AjCathI靠近C端有4个保守的半胱氨酸序列,抗菌成熟肽与香鱼(Plecoglossus altivelis)抗菌成熟肽相似性最高,同源性为65.57%。进化分析表明,AjCathI与其它鱼类亲缘关系较近,处于同一个分支上。将AjCathI基因克隆至pET-28a载体,转化Escherichia coli BL21(DE3)宿主菌进行表达。结果表明,AjCathI以包涵体形式表达,经鎳柱纯化、Western blot验证和透析复性,获得高纯度的重组蛋白。
日本鳗鲡;Cathelicidin;抗菌肽;RACE-PCR
抗菌肽又称宿主防御肽,作为生物体非特异性免疫的一个重要组成部分,是宿主防御细菌、病毒等病原生物体入侵的重要分子屏障,广泛分布于动植物、昆虫和细菌等多种生物体内。Cathelicidin是目前发现的一个最大抗菌肽家族,不同的Cathelicidin前体肽结构相似,包括pro、pre和C端成熟肽3个区域。Pro区又称信号肽区,引导小肽进入细胞内部;Pre区为结构域,包含一个高度保守的cathelin区,4个半胱氨酸靠近C端形成两个分子内二硫键,直接影响到整个分子的结构;C端成熟肽是一个高度变异的抗菌区域。Cathelicidin在信号肽的引导下进入细胞内部,然后切除pro区域,剩下C端成熟肽发挥抗菌功能。迄今,已陆续在盲鳗(Myxin eglutinosa)[1]、大西洋鲑(Salmo salar)[2]、大西洋鲟(Gadus morhua)[3,4]、茴鱼(Thymallus thymallus)[5]、香鱼(Plecoglossus altivelis)[6]等多种鱼类确认了Cathelicidin类抗菌肽的存在。但在鳗鲡还未见该抗菌肽的报道,因次,有必要深入研究该抗菌肽的结构和功能。
我国是世界上主要鳗鲡生产国之一,在多年的养殖过程中,病害发生较为频繁,病原复杂,其中以细菌性和寄生虫疾病最为严重[7,8]。鳗鲡人工养殖过程中多采用化学类药物,如抗生素等,导致细菌和寄生虫耐药性增强、水产品药残超标及对水环境污染,这些均严重制约着我国鳗业的健康发展[9]。抗菌肽的制备主要有天然材料提取、化学合成和基因工程表达3种方法,但抗菌肽天然提取原料有限,产量低,提取过程又非常复杂。化学合成成本高,价格昂贵,不利于投入实际应用。因此,借助成熟的基因工程技术获得抗菌肽,开发药用价值,是比较切实可行的方法。Cathelicidin抗菌肽具有高效广谱的抗菌活性和不易产生耐药性等特点,可在鱼病防治中起重要作用,因此倍受关注。本研究克隆和原核表达纯化日本鳗鲡Cathelicidin,以期为有效控制鳗鲡细菌性疾病提供新途径,同时也为鱼类抗菌肽的研究提供重要的参考价值。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 pMD18-T 载体购自TaKaRa公司;pET-28a载 体、 大肠 杆 菌(Escherichia coli)DH5α、大肠杆菌BL21(DE3)均由本实验保存。
1.1.2 主要试剂 SMARTerTMRACE cDNA Amplification Kit 购自Clontech公司;PVDF膜为Roche公司产 品;TRIZOL®Reagent Total RNA Isolation Reagent购自Invitrogen 公司;DAB染色试剂盒购自上海捷瑞生物工程有限公司;丙烯酰胺、N,N'-亚甲基双丙烯酰胺为BBI 公司产品;二硫苏糖(DDT)、过硫酸铵、TEMED为Amresco公司产品;SDS-PAGE低分子量标准蛋白质Marker、预染Marker购自Fermentas公司;咪唑为Sigma公司产品;Western blot 一抗(His·Tag单抗)为Roche公司产品;二抗(山羊抗鼠IgGAP)购自上海捷瑞生物工程有限公司;胰蛋白胨、酵母粉、氯化钙、氯化钠、无水乙醇、Trisbase、尿素、磷酸氢二钠等其它常用试剂均为国产分析纯。
1.1.3 实验动物 日本鳗鲡:购自集美大学海水养殖试验场,体重约300 g,外观无明显病变和损伤。
1.2 方法
1.2.1 日本鳗鲡AjCathI基因cDNA的克隆与序列分析 采用Trizol试剂盒并按照说明提取日本鳗鲡肝脏总RNA,提取的总RNA用1%琼脂糖电泳检测完整性。
以RNA为模板,SMARTer IIA oligo和5'- RACE CDS Primer A为反转录引物(表1),采用SMARTerTMRACE cDNA Amplification Kit反转录cDNA。根据日本鳗鲡的AjCathI EST(GenBank:HS106475,ttp://www.ncbi.- nlm.nih.gov/), 设 计 引 物 扩 增AjCathI基因5'端。以cDNA为模板,5CR1和UPM为引物第一轮PCR扩增,反应程序为:94℃预变性2 min;94℃变性30 s,65℃退火30 s,72℃延伸2 min,共25个循环;最后72℃延伸5 min。随后以第一轮PCR产物为模板,5CR2和Nest为引物第二轮PCR扩增,反应程序为:94℃预变性2 min;94℃变性30 s,70℃退火2 min,5 个循环;94℃变性30 s,68℃退火30 s,72℃延伸2 min,25 个循环;72℃延伸5 min。
用DNA胶回收试剂盒回收AjCathI基因的PCR产物,连接于克隆载体pMD18-T,构建pMD-AjCathI质粒并转化至DH5α感受态细胞,经PCR阳性克隆鉴定后送Invitrogen公司测序。
1.2.2 日本鳗鲡AjCathI原核表达载体的构建 根据已获得的日本鳗鲡AjCathI cDNA序列及pET-28a(+)多克隆位点,设计引物CF和CR(表1),引物分别加入Nco I和Xho I酶切位点。以日本鳗鲡AjCathI(cDNA)重组pMD18-T阳性质粒为扩增模板,以CF、CR为上下游引物,用pfu高保真Taq酶扩增目的片段。PCR反应程序:94℃预变性2 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸5 min。PCR产物电泳回收纯化后,经Nco I和Xho I双酶切后,克隆于表达载体pET-28a(+),转化至DH5α感受态细胞,并利用卡那霉素抗性平板筛选阳性克隆,经PCR阳性克隆鉴定后送Invitrogen公司测序。
1.2.3 重组蛋白诱导表达条件的优化与表达形式的鉴定 经测序准确后,将携带目的基因的pET-28a/ AjCathI的重组质粒转化入表达受体菌BL21(DE3)。挑取单克隆,接种于LB/KMN培养基,37℃、250 r/min培养过夜,次日按1∶100的比例加入到新鲜的LB/KMN培养基中,37℃,250 r/min剧烈震荡培养。分别进行诱导温度、诱导剂浓度、诱导时间和诱导菌起始生长量对重组蛋白表达量的影响。收集菌液,SDS-PAGE蛋白电泳检测。同时设空载体,未加IPTG的重组质粒作对照。
收集表达的菌体,超声波破碎,于4℃,4 000×g离心20 min,分别收集上清和沉淀,取样进行SDS-PAGE电泳检测,鉴定重组蛋白表达的形式。
1.2.4 重组表达蛋白的纯化与Western blot鉴定 大量表达重组蛋白AjCathI 2-3 L,离心收集菌体。用预冷的裂解缓冲液悬浮菌体,加入适当的蛋白酶抑制剂PMSF。冰浴下超声破碎菌体至菌液较清无黏性(功率400-480 W,破碎5 s间隔10 s,25 min)。4 000×g离心20 min,收集沉淀,再用10 mL 0.5 mol/L尿素,PBS洗涤液各清洗一次,4 000×g离心20 min取沉淀。沉淀用结合缓冲液充分溶解后,10 000×g离心10 min,取上清用0.45 μm滤膜过滤,滤液经AKTA-purifier 100纯化系统,金属镍螯合层析柱纯化。用25 mL洗脱缓冲液洗脱目标蛋白,流速1 mL/min,检测波长A280。收集洗脱峰蛋白,取少量SDS-PAGE电泳。

表1 AjCathI克隆和原核表达的引物
取纯化后的重组蛋白经SDS-PAGE电泳后,100 mA,转移1 h,将蛋白印迹至PVDF膜上。1%牛血清白蛋白/TBST封闭液1∶6 000稀释一抗(His·Tag单抗),4℃孵育过夜。1∶10 000稀释二抗(山羊抗鼠IgG-AP),室温孵育1 h。DAB显色,清水洗净,观察结果。
1.2.5 重组表达蛋白的复性 采用透析法,将洗脱缓冲液中的8 mol/L尿素逐步降低至6、4、2和1 mol/L透析重组表达蛋白,最后用PBS溶液透析1次,将目的蛋白溶液中的尿素完全去除。由于蛋白在变性状态时疏水残基暴露,一般水溶性很差,大多会形成可见的沉淀析出。复性后的蛋白溶解度增加,但仍然会有一些没有复性成功的蛋白沉淀,10 000×g离心10 min,收集上清。同时取少量SDS-PAGE电泳检测复性后的重组蛋白是否发生断裂。
2 结果
2.1 日本鳗鲡AjCathI基因cDNA的获得
应用特异性引物5CR1、5CR2和SMARTerTMRACE cDNA Amplification Kit 提供的通用引物,从日本鳗鲡肝组织扩增出一条约300 bp大小的片段,经纯化、连接、转化、质粒提取和阳性克隆鉴定,得到阳性重组子并测序。结果得到一条包含5' UTR和一部分编码在内的349 bp的片段,与日本鳗鲡AjCathI 3' Race产物比对,两者有一个223 bp的重叠区,经过序列拼接和碱基校对最终得到842 bp全长的AjCathI cDNA。AjCathI cDNA序列由69 bp 5' UTR、570 bp ORF和203 bp 3' UTR 三部分组成,编码189个氨基酸(图1)。经提交GenBank检索表明,从日本鳗鲡肝脏分离得到的AjCathI基因属于新的Cathelicidin家族基因,GenBank登录号为AFP72291。
2.2 日本鳗鲡AjCathI基因与其他动物Cathelicidin基因编码的氨基酸同源性比对与序列分析
日本鳗鲡AjCathI cDNA推导的氨基酸序列与部分已分离到的或由核苷酸推导出的Cathelicidin序列比对,显示4个半胱氨酸保守位点高度一致,并且同一属的鱼类,Cathelicidin在信号肽氨基酸的组成上基本一致。AjCathI并不含有Cathelin保守区,与其他动物Cathelicidin氨基酸同源性较低,为25%-53%。参考已报道源于嗜中性粒细胞弹性蛋白酶作用的位点,推测AjCathI成熟肽为50个氨基酸(图1)。AjCathI抗菌成熟肽与香鱼抗菌成熟肽相似性最高,同源性为65.57%。系统进化分析(图2)表明,AjCathI与鱼类亲缘关系较近,与大西洋鲟Cathelicidin同源性最高,处在同一个分支上。
2.3 日本鳗鲡AjCathI的原核表达
取单克隆阳性鉴定,测序,结果证明连接正确,核苷酸的开放阅读框(ORF)编码连续,并连有6个His标签,最终获得正确构建的pET-28a /AjCathI表达载体。将pET-28a /AjCathI重组质粒转化至BL21(DE3),诱导表达,表达产物经15% SDSPAGE,对凝胶染色、脱色后,重组质粒和空质粒相比,具有明显的表达蛋白带,重组质粒表达蛋白分子量在19.0 kD左右,与计算的理论分子量19.575 kD相似(图3)。
2.4 重组蛋白表达形式的鉴定
取表达菌体超声波破碎并离心后的上清和沉淀,进行SDS-PAGE电泳结果(图4)显示,可见表达产物绝大部分以包涵体形式存在于菌体沉淀中,菌体上清中几乎没有可溶状态的表达产物存在。
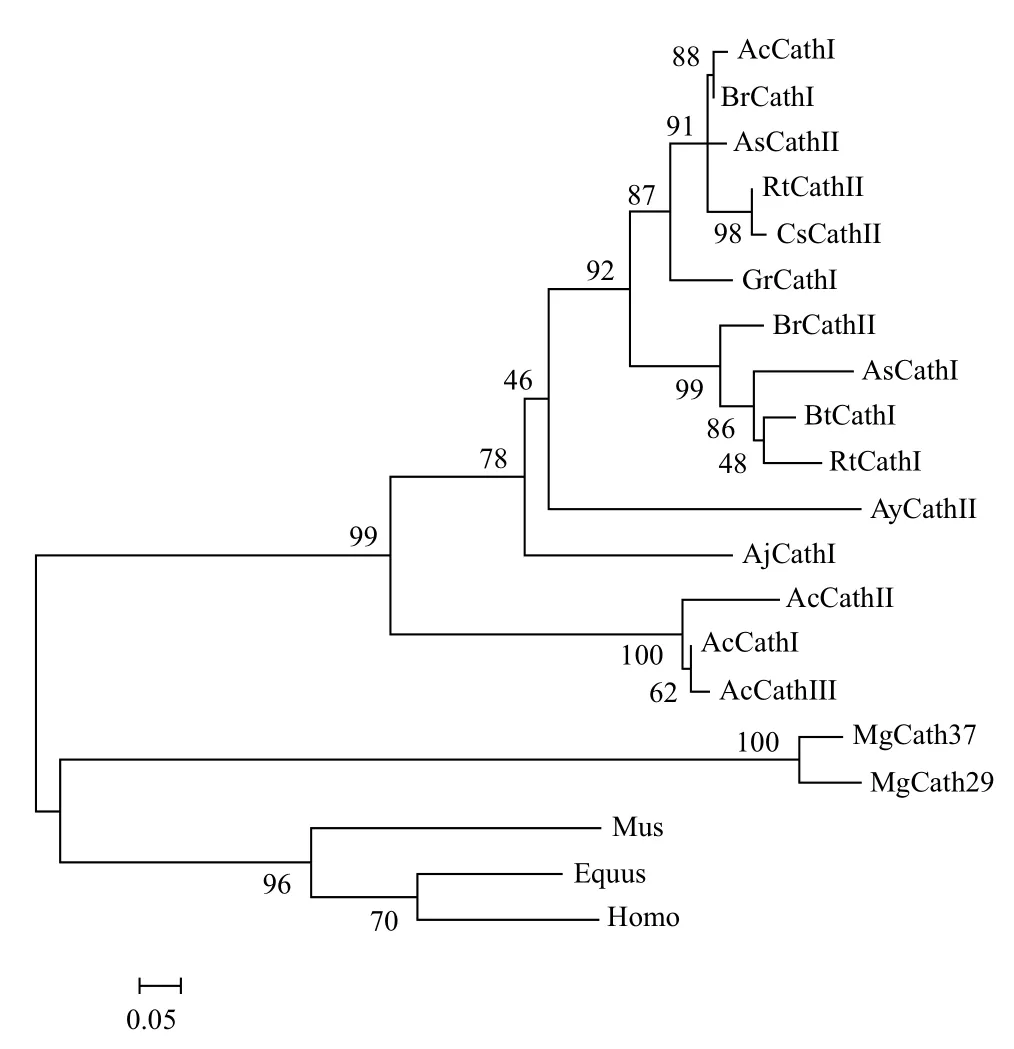
图2 日本鳗鲡AjCathI氨基酸序列与其它已知Cathelicidin氨基酸序列系统进化树分析

图3 pET-28a/AjCathI重组质粒在不同诱导时间下的表达结果
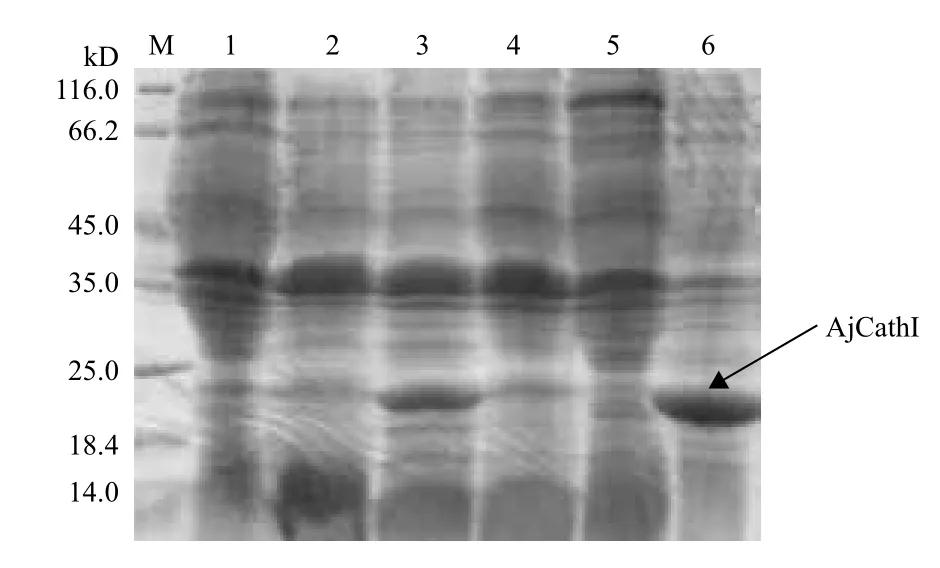
图4 重组表达pET-28a/AjCathI蛋白SDS-PAGE电泳结果
2.5 重组蛋白表达的纯化
为了得到AjCathI表达产物,将超声破碎菌体收集的沉淀部分过镍离子螯合亲和层析柱,用咪唑洗脱螯合的融合蛋白,280 nm检测紫外吸收曲线,可见到明显的洗脱蛋白峰(图5)。收集洗脱部分进行SDS-PAGE电泳(图6),两个蛋白洗脱峰中均含有目的蛋白AjCathI。以6-His-tag单克隆抗体做Western blot 鉴定纯化产物,结果(图7)显示为阳性条带。
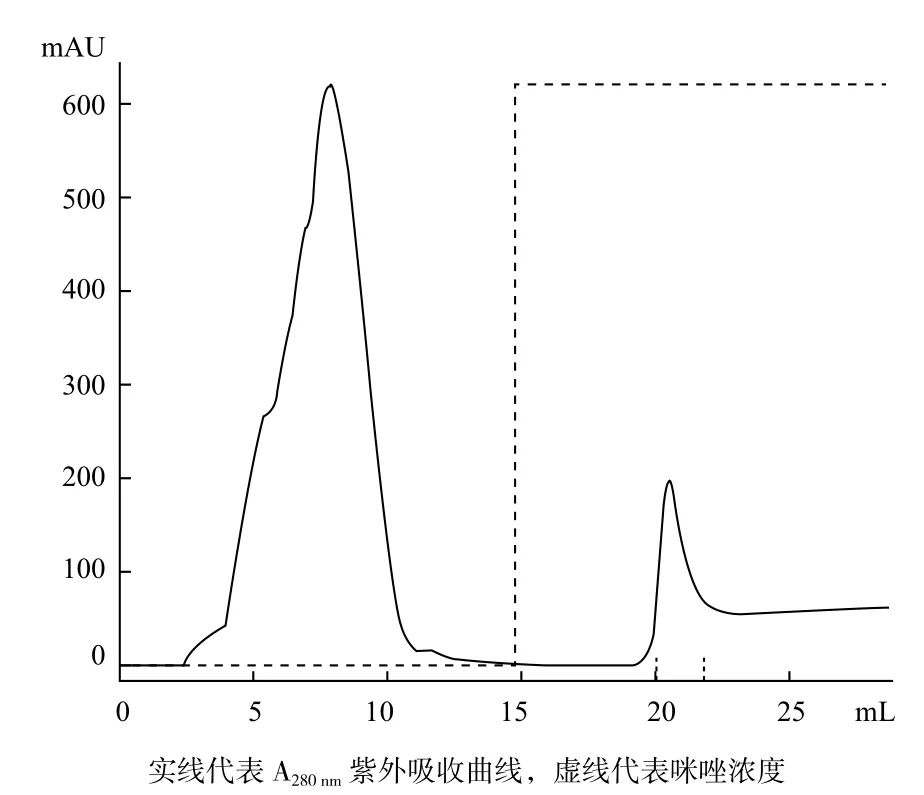
图5 亲和层析柱(IMAC)纯化目的蛋白AjCathI
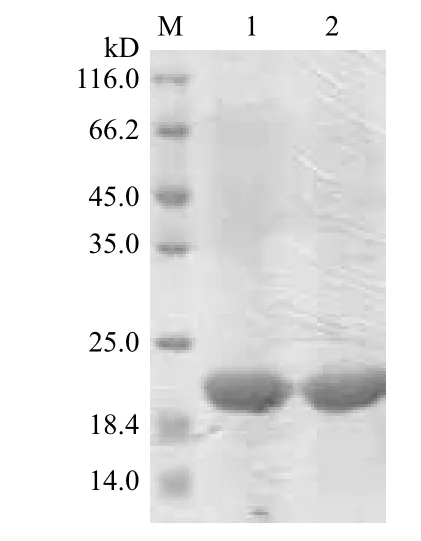
图6 IMAC洗脱蛋白电泳
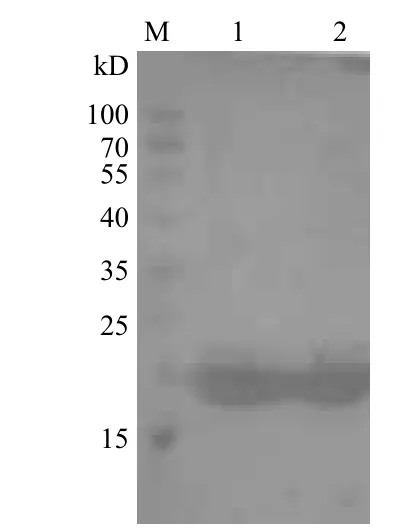
图7 Western blot鉴定AjCathI
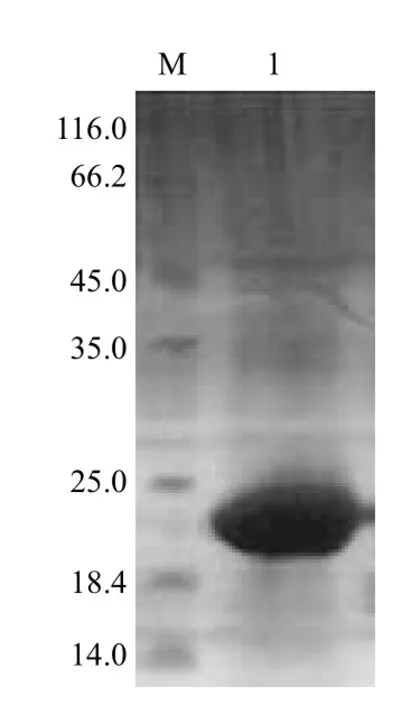
图8 重组蛋白复性分析
2.6 重组蛋白的复性
通过黏度和浊度判断蛋白复性效果,重组蛋白最终溶解于PBS溶液中,呈现透明状态,说明复性成功。SDS-PAGE电泳(图8)显示均有目的条带,说明蛋白复性过程中基本没有发生降解和断裂。
3 讨论
Cathelicidin根据成熟肽二级结构的不同分为以下四大类:第一类是α-螺旋结构(如鼠的CRAMP)[10];第二类是延伸螺旋结构(如牛的indolicidin)[11],一般含有大量的脯氨酸(13%-49%)和精氨酸(13%-33%);第三类是环状结构(如牛的bactenecin)[12],这一类分子由于含有一个二硫键而形成环状;第四类是β折叠结构(如猪的protegrin1)[13],这一类分子通常含有2-3个二硫键,这些分类结构有利于抗菌肽与细菌细胞膜结合[14]。抗菌肽预测工具(http://aps.unmc.edu/ AP/prediction/ prediction_main.php)分析AjCathI成熟肽含有疏水性氨基酸残基蛋氨酸1个,丙氨酸2个,疏水性比例为10%,电荷为+11。DNAstar软件分析,结果显示整个成熟肽形成亲水性很强的区域,AjCathI为亲水性强阳离子抗菌肽,没有α螺旋结构,形成延伸和任意卷曲的可能性比较大。Garnier等[15]方法分析,AjCathI形成延伸结构的比例为18%,任意卷曲的比例为82%。Geourjon等[16]方法分析,AjCathI形成延伸结构的比例为16%,任意卷曲的比例为84%。Frishman等[17]方法分析,AjCathI形成任意卷曲的可能性为100%。该抗菌肽与以往的抗菌肽结构有一定的差异,其是否在水溶液中形成任意卷曲结构,而在与生物膜接触时形成α螺旋结构有待进一步考证,因此抗菌作用机制还有待通过圆二色谱及定位圆二色谱法、固相核磁共振技术、中子衍射和X-光散射等技术进一步研究。
目前,用于原核表达系统的基因工程载体主要分为非融合表达载体和融合表达载体,后者又以携带6×His Tag和谷胱甘肽转移酶标签(GST Tag)的载体应用最为广泛。本试验选用了高效融合表达载体pET-28a,pET-28a为含有T7强启动子的原核高效表达载体,可将目的序列插入多克隆位点,表达出目的蛋白,同时载体携带有6个His标签,便于后续的纯化。在实验中我们曾经尝试用pGEX-4T-1表达载体,通过控制培养条件,诸如IPTG浓度、培养温度和诱导时间等来增加蛋白的表达量,但多次实验证明了pGEX-4T-1质粒无法表达重组蛋白。
诱导条件对重组蛋白的表达也有不同程度的影响,如IPTG浓度、诱导时间、诱导温度、大肠杆菌起始浓度、培养基的组成、pH和溶解氧等。王沛珍[18]报道低温16℃可以增加thanatin抗菌肽表达量和可溶性,同时诱导9 h为最佳诱导时间。Ramos等[19]报道将诱导温度从37℃降到30℃可以增加满月蛤(Lucina pectinata)rHbII的表达量。Ma等[20]报道在YT培养基中加入0.5%(w/v)的葡萄糖可以显著增加adenoregulin抗菌肽的表达量。本实验发现诱导温度和诱导时间对Cathelicidin蛋白的表达量有比较显著的影响。AjCathI在温度为42℃,诱导时间为7 h蛋白表达量最高。
在原核表达过程中导致包涵体形成的原因有很多[21-23]。本实验最终得到目的蛋白是以包涵体的形式存在,包涵体存在也有优点,如蛋白质表达量高,可避免宿主细胞蛋白酶对目的蛋白降解,包涵体易从宿主细胞中纯化,可避免毒性蛋白(如毒素蛋白)对宿主细胞的毒性等优势。洗脱目的蛋白的方法有两种,一种是降低pH洗脱,降低pH值可以减弱组氨酸和镍离子之间的作用力,从而对蛋白进行洗脱,降低pH值洗脱不会在洗脱的蛋白中带入高浓度的咪唑,但很可能引起目标蛋白在等电点附近的沉淀。另一种方法是升高咪唑的浓度,竞争目的蛋白与Ni2+结合,从而洗脱蛋白。此方法简单易行,但同时洗脱的目的蛋白含有高浓度的咪唑。此外,也有用咪唑和降低pH值相结合的方法进行洗脱,Zhang等[24]先用60 mmol/L pH8.0的咪唑洗脱杂蛋白,再用pH4.0的缓冲液洗脱目的蛋白hepcidin。本实验采用了一步咪唑洗脱方法,最终得到大量的AjCathI蛋白。包涵体复性的方法有很多,如稀释复性、透析复性、超滤复性、层析柱复性、温度跳跃式复性等。本实验采用了透析复性,最终灭菌水溶解冻干的目的蛋白澄清,说明复性成功,SDS-PAGE电泳检测蛋白完整性很好。
LL-37是人类唯一的Cathelicidin类抗菌肽,具有广谱的抗菌活性、化学趋化性及促进血管生成和伤口修复性等特点,致使许多学者采用不同的方法体外表达重组蛋白,包括采用GST和pET系列载体及不同的纯化方法。冯云等[25]表达了GST-FALL-39(最开始推测的人类Cathelicidin成熟肽,其比LL-37多两个氨基酸)抗菌肽,GST-FALL-39存在于菌体裂解液的上清中,通过凝胶4B柱及AU-PAGE得到高纯度的蛋白。Moon等[26]应用与冯云等相似的方法表达出GST-LL-37融合蛋白,并发现低温30℃,及低IPTG浓度(0.1 mmol/L)可以显著增加可溶性重组蛋白的产量。Li等[27]应用pET32a载体也表达出可溶性的LL-37重组蛋白,应用亲和色谱和反相色谱去除硫氧还原蛋白及其它杂蛋白,得到含有6个His-tag的LL-37蛋白。鱼类Cathelicidin如同哺乳动物一样只有成熟肽部分具有抗菌活性。一些学者原核表达出Cathelicidin prodomain,再用弹性蛋白酶酶解重组蛋白,确认出成熟肽序列。至今大西洋鳕鱼、虹鳟、香鱼Cathelicidin成熟肽已得到确认,成熟肽均具有较强的抗菌活性。
4 结论
本研究克隆并表达了日本鳗鲡抗菌肽AjCathI。AjCathI的cDNA全长为 842 bp,编码 189个氨基酸。将AjCathI基因克隆至pET-28a 载体,pET-28a/ AjCathI蛋白最佳表达条件为42℃,诱导7 h,并以包涵体形式存在。经鎳柱纯化、Western blot验证和透析复性,最终获得高纯度的重组蛋白。
[1] Uzzell T, Stolzenberg ED, Shinnar AE, et al. Hagfish intestinal antimicrobial peptides are ancient cathelicidin[J]. Peptides,2003, 24(11):1655-1667.
[2] Chang CI, Zhang YA, Zou J, et al. Two cathelicidin genes are present in both rainbow trout(Oncorhynchus mykiss)and Atlantic salmon(Salmo salar)[J]. Antimicrob Agents, 2006, 50(1):185-195.
[3] Maier VH, Dorn KV, Gudmundsdottir BK, et al. Characterisation of cathelicidin gene family members in divergent fish species[J]. Mol Immunol, 2008, 45(14):3723-3730.
[4] Broekman DC, Frei DM, Gylfason GA, et al. Cod cathelicidin:Isolation of the mature peptide, cleavage site characterization and developmental expression[J]. Dev Comp Immunol, 2011, 35(3):296-303.
[5] Scocchi M, Pallavicini A, Salgaro R, et al. The salmonid cathelicidin:A gene family with highly varied C-terminal antimicrobial domains[J]. Comp Biochem Physiol B, 2009, 152(4):376-381.
[6] Lu XJ, Chen J, Huang ZA, et al. Identification and characterizationof a novel cathelicidin from ayu, Plecoglossus altivelis[J]. Fish Shell Immunol, 2011:31(1):52-57.
[7] Arafa SZ, Reda ES. Surface features of the monogenean gill parasites Pseudodactylogyrus anguillae and Pseudodactylogyrus bini from the European eel Anguilla anguilla in Egypt[J]. Parasitol Res, 2012,110:127-133.
[8] Cao HP, He S, Wei RP, et al. Bacillus amyloliquefaciensG1:A potential antagonistic bacterium against eel-pathogenic Aeromonas hydrophila[J]. Evid Based Complement Alternat Med, 2011,82104:1-7.
[9] Bergwerff AA, Scherpenisse P. Determination of residues of malachite green in aquatic animals[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2003, 788:351-359.
[10] Chen K, Xiang Y, Huang J, et al. The formylpeptide receptor 2(Fpr2)and its endogenous ligand cathelinrelated antimicrobial peptide(CRAMP)promote dendritic cell maturation[J]. J BiolChem, 2014, 289(25):17553-17563.
[11] Végh AG, Nagy K, Bálint Z, et al. Effect of antimicrobial peptideamide:indolicidin on biological membranes[J]. J Biomed Biotechnol, 2011:670589.
[12] Lee JY, Yang ST, Kim HJ, et al. Different modes of antibiotic action of homodimeric and monomeric bactenecin, a cathelicidinderived antibacterial peptide[J]. BMB Rep, 2009, 42(9):586-592.
[13] Baumann A, Démoulins T, Python S, et al. Porcine cathelicidins efficiently complex and deliver nucleic acids to plasmacytoid dendritic cells and can thereby mediate bacteria-induced IFN-α responses[J]. J Immunol, 2014, 193(1):364-371.
[14] Ramanathan B, Davis EG, Ross CR, et al. Cathelicidin:microbicidal activity, mechanisms of action, and roles in innate immunity[J]. Microbes Infect, 2002, 4(3):361-372.
[15] Garnier J, Gibrat JF, Robson B. GOR method for predicting protein secondary structure from amino acid sequence[J]. Methods Enzymol, 1996, 266:540-553.
[16] Geourjon C, Déleage G. SOPMA: Significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments[J]. CABIOS, 1995, 11(6):681-684.
[17] Frishman D, Argos P. Incorporation of non-local interactions in protein secondary structure prediction from the amino acid sequence[J]. Protein Eng, 1996, 9(2):133-142.
[18] 王沛珍. Thanatin的原核表达、纯化及其抗菌活性的检测[D].广州:南方医科大学, 2010.
[19] Ramos C, Pietri R, Lorenzo W, et al. Recombinant hemoglobin II from Lucina pectinata:A large-scale method For hemeprotein expression in E. coli[J]. Protein J, 2010, 29(2):143-151.
[20] Ma YS, Cao W, Zhou YX, et al. Expression and purifcation of antimicrobial peptide adenoregulin with C-amidated terminus in Escherichia coli[J]. Protein Expr Purif, 2005, 40(2):404-410.
[21] Villaverde A, Carril M. Protein aggregation in recombinant bacteria:biological role of inclusion bodies[J]. Biotechnol Lett,2003, 25(17):1385-1395.
[22] Ventura S. Sequence determinants of protein aggregation:tools to increase protein solubility[J]. Microb Cell Fact, 2005, 4(1):11-18.
[23] 王增, 马会勒, 张文, 等. 包涵体蛋白的分离和色谱法体外复性纯化研究进展[J]. 中国生物工程杂志, 2009, 29(7):102-107.
[24] Zhang JJ, Yan QP, Ji RX, et al. Isolation and characterization of a hepcidin peptide from the head kidney of large yellow croaker,Pseudosciaena crocea[J]. Fish Shell Immunol, 2009, 26:864-870.
[25] 冯云, 杨云霞, 黄宁, 等. 人抗菌肽FALL-39在大肠杆菌中高效表达[J]. 生物医学工程杂志, 2003, 20(4):634-637.
[26] Moon JY, Henzler-Wildman KA, Ramamoorthy A. Expression and purification of a recombinant LL-37 from Escherichia coli[J]. Biochim Biophys Acta, 2006, 1758(9):1351-1358.
[27] Li Y, Li X, Wang G. Cloning, expression, isotope labeling, and purification of human antimicrobial peptide LL-37 in Escherichia coli for NMR studies[J]. Protein Expr Purif, 2006, 47(2):498-505.
(责任编辑 马鑫)
Cloning and Prokaryotic Expression of Cathelicidin Gene from Japanese Eel I,Anguilla japonica
Zhang Dongling1Yu Dahui2
(1. Fisheries College,Jimei University,Engineer Research Center of Eel Modern Industry Technology,Ministry of Education,Xiamen 361021;2. South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300)
Cathelicidin, an utmost family of antibacterial peptide so far, possesses multiple biological functions. In order to explore and exploit the antibacterial mechanism and potential biological functions of Cathelicidin, full-length sequence of cDNA of Cathelicidin gene from Japanese eel Anguilla japonica I(AjCathI)was obtained by RACE-PCR. The full cDNA of AjCathI was 842 bp and the ORF contained 570 bp encoding 189 amino acids. Analysis of amino acid sequence demonstrated that AjCathI contained 4 conservative cysteine residues at C terminal,and the mature antibacterial peptide had the highest similarity with Plecoglossus altivelis by homology of 65.57%. Phylogenetic analysis revealed that AjCathI shared a common evolutionary origin with other teleost fishes. AjCathI was cloned into pET-28a and expressed in Escherichia coli BL21(DE3). The result manifested that AjCathI protein was expressed in inclusion bodies. The protein was isolated by Ni column, identified by Western blot and re-natured by dialysis, the protein of high purity was gained. This study laid the foundation for further verifying mature peptide sequence of AjCathI and studying its antibacterial activities as well as other biological functions.
Anguilla japonica;Cathelicidin;antibacterial peptide;RACE-PCR
10.13560/j.cnki.biotech.bull.1985.2015.07.018
2014-10-22
福建省教育厅重点项目(JA13171),集美大学李尚大学科建设基金项目(ZC2013003),集美大学鳗鲡现代产业技术教育部工程研究中心开放基金项目(ZK2013005)
张东玲,女,博士,讲师,研究方向:水产动物免疫学;E-mail:donglingzhang@126.com
喻达辉,博士,研究员,研究方向:水产生物技术与遗传育种;E-mail:pearlydh@163.com
