2型糖尿病患者血清同型半胱氨酸、超敏C反应蛋白与踝肱指数的关系
2015-10-27李丹丹
李丹丹
(沈阳市第四人民医院,辽宁 沈阳 110031)
2型糖尿病患者血清同型半胱氨酸、超敏C反应蛋白与踝肱指数的关系
李丹丹
(沈阳市第四人民医院,辽宁 沈阳 110031)
2型糖尿病;血清;同型半胱氨酸;超敏C反应蛋白;踝肱指数
以往的研究证实,高血浆同型半胱氨酸是心脑血管疾病的独立危险因素,而近年来研究发现,同型半胱氨酸的水平的升高与糖尿病有高度的相关性。本文对我院近期住院的100例2型糖尿病患者的踝肱比、血清HCY及超敏C反应蛋白的变化及其相互关系做进一步的研究。
1 资料与方法
1.1临床资料:抽取2014年3月至2015年3月在我院住院的2型糖尿病患者100例,均符合1999年WHO糖尿病诊断与分型标准,均排除心血管、肝脏疾病等疾病,根据踝肱比将糖尿病患者分成四组。①踝肱比在1.0~1.4(正常值);②>0.7至<0.9(轻度缺血组);③0.5~0.7(中度缺血组);④<0.5(重度缺血组)。四组患者的年龄、吸烟史、体质量、血压、血糖、血脂等基础资料经统计学分析,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2研究方法
1.2.1标本采集:①血清Hcy的检测:采集前1 d忌食高蛋白饮食,禁水4 h,采用酶转换法荧光定量测定。②血清hs-CRP的检测:采用散射比浊法检测血清hs-CRP水平。踝肱指数(ABI)踝动脉-肱动脉血压比值。
1.2.2评价标准:血清Hcy水平正常值为5~15 µmol/L,轻度增高为16~30 µmol/L,中度增高30~50 µmol/L,重度增高为>50 µmol/L,血清hs-CRP水平>3 mg/L为异常。
1.3统计学处理:统计工具用SPSS17.0统计软件包,数据采用()表示,多组间的比较采用单因素方差分析,并用q检验法作均数间两两比较,以P<0.05为差异有统计学意义。
2 结 果
2.1100例2型糖尿病患者检测结果:踝肱比在正常值的患者25例,踝肱比异常的为75例,其中轻度缺血的30例,中度缺血的25例,重度缺血的20例。
2.2血清Hcy、hs-CRP水平与踝肱比的关系:轻度、中度、重度缺血的3组患者的血清Hcy、hs-CRP水平与踝肱比在正常值组的患者比较,P<0.05,差异有统计学意义(表2)。提示伴有动脉硬化及缺血的患者,血清Hcy、hs-CRP水平明显高于非缺血的患者。
2.3踝肱比异常的3组间比较结果显示,血清Hcy、hs-CRP含量比较,为差异有统计学意义(P<0.05)。轻度缺血与中度缺血组血清Hcy、hs-CRP水平比较,差异无统计学意义,(P>0.05)。重度缺血组的血清Hcy、hs-CRP含量与轻度及中度缺血组比较,差异有统计学意义(P<0.05)(表2)。提示伴有动脉硬化缺血的患者,血清Hcy、hs-CRP水平与缺血程度呈正相关,并与重度缺血的相关性更加突出。
3 讨 论
踝肱指数(ABI,踝动脉-肱动脉血压比值)是非常有价值的反映下肢血压与血管状态的指标,因其简便、敏感性高而被广泛应用。是反映下肢动脉硬化程度的可靠指标。
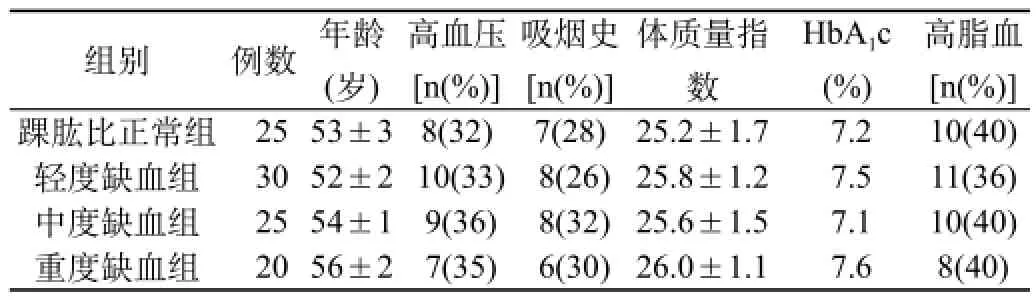
表1 各组一般临床资料
表2 各组血清Hcy、hs-CRP水平比较()

表2 各组血清Hcy、hs-CRP水平比较()
组别 例数 hs-CRP(mg/L) Hcy(µmol/L)踝肱比正常组 25 1.23±0.34 11.2±2.3轻度缺血组 30 3.21±0.23 14.7±3.4中度缺血组 25 3.55±0.29 15.6±4.5重度缺血组 20 4.87±0.57 19.7±5.9
CRP主要的是在肝脏细胞中合成的,动脉粥样硬化局部病灶也可以产生CRP。CRP直接影响一些动脉粥样硬化形成阶段通路补体的激活,细胞凋亡,血管细胞的活化作用,单核细胞聚集、脂质沉积、和血栓形成[1]。联合白细胞介素-6、白细胞介素-1和肿瘤坏死因子有协同放大的作用[2-3]。因此,过量的CRP本身存在有害的作用及影响,这种影响能促进动脉壁上的动脉粥样硬化斑块的破裂。
在动脉粥样硬化的患者血浆中C-reactive protein(CRP)可以显著的提升,它与动脉的损伤和免疫反应是息息相关的[4]。动脉粥样硬化是低级的炎性反应,对于CRP的测试不是很敏感,取而代之的是,超敏C反应蛋白(hs-CRP)的测量可能提供较敏感的结果。升高的hs-CRP可能预示再发的冠状动脉事件,如心肌梗死,冠状动脉成形术后再狭窄,周围性动脉硬化的疾病等。本研究显示,随着动脉硬化的加重,hs-CRP也逐渐升高(P<0.05)。提示炎性反应在动脉硬化患者病变发展过程中起着重要作用。
在近期的一些重要研究中发现,在糖尿病患者中,同型半胱氨酸的水平是与动脉粥样硬化是存在明确相关性的,同型半胱氨酸为动脉硬化的一个独立的危险因素,并与年龄、尿素氮、肌酐及维生素B12、叶酸水平,成为心血管疾病的常规的危险因素。
同样有研究发现证实同型半胱氨酸与动脉硬化有明确的相关性,它证实在没有任何症状的患者中,随着同型半胱氨酸水平的增加,颈动脉内膜中层厚度也明显增加[5],并且增加高血压患者的周身动脉硬化的程度[6],在许多报道中均证实:升高的同型半胱氨酸的水平是导致动脉硬化的因素[7-8]。此研究亦反应,随着同型半胱氨酸水平的升高,动脉硬化的程度逐渐加重(P<0.05),并与炎性反应存在一定的相关性。
同型半胱氨酸诱导的血管损伤的机制为它在动脉管壁可以诱导平滑肌细胞的增生、增加胶原蛋白的合成,促进弹力蛋白结构的改变[9-10]。血浆中高浓度的同型半胱氨酸可以促进氧化应激和减少内皮依赖性血管舒张功能[11]。最近,被证实内皮功能紊乱是因为抑制一氧化氮的形成[12]。除此之外,同型半胱氨酸能间接通过胰岛素抵抗引起大血管的病变、高血压及肾脏疾病[13-14]。综上所述,可以认为同型半胱氨酸是在动脉粥样硬化相关疾病中的活跃因素,但也有人提出升高的同型半胱氨酸是动脉粥样硬化的血管反应[15-16]。
将来的研究将针对同型半胱氨酸是否是一个动脉硬化的主要的独立的危险因素或是其动脉硬化的标志物。如何降低血浆的同型半胱氨酸的水平及减轻炎性反应将延缓动脉粥样硬化的发展,从而减少糖尿病患者心脑血管疾病的发生率。
[1]Bisoendial RJ,Kastelein JJ,Stroes ES.C-reactive protein and atherogenesis: from fatty streak to clinical event[J].Atheroscleros is,2007,195(2):e10-18.
[2]Li SP,Goldman ND.Regulation of human C-reactive protein gene expression by two synergistic IL-6 responsive elements[J]. Biochemistry,1996,35(28):9060-9068.
[3]Volanakis JE.Human C-reactive protein: expression,structure,and function[J].Mol Immunol,2001,38(2-3):189-197.
[4]Takahashi H.High-sensitivity C-reactive protein (CRP) assay:a novel method for assessment of risk ratios for atherosclerotic vascular diseases[J].Rinsho Byori,2002,50(1):30-39.
[5]Malinow MR,Nieto FJ,Szklo M,et al.Carotid artery intimalmedial wall thickening and plasma homocysteine in asymptomatic adults[J].Circulation,1993,87(4): 1107-1113.
[6]Tayama J,Munakata M,Yoshinaga K,et al.Higher plasma homocystein concentration is associated with more advanced systemic arterial stiffness and greater blood pressure response to stress in hypertensive patients[J].Hypertens Res,2006,29(6):403-409.
[7]Anan F,Misaki T,Umeno Y,et al.Correlations between homocysteine levels and atherosclerosis in Japanese type 2 diabetic patients[J].Metabolism,2007,56(10): 1390-1395.
[8]Konukodlu D,Serin O,Turhan MS.Plasma total homocysteine concentrations in obese and non-obese female patients with type 2 diabetes mellitus; its relations with plasma oxidative stress and nitric oxide levels[J].Clin Hemorheol Microcirc,2005,33(1): 41-46.
[9]Charpiot P,Bescond A,Augier T,et al.Hyperhomocysteinemia induces elastolysis in miniping arteries: structural consequences,arterial site specificity and effect of captoprilhydrochlorothiazide[J].Matrix Biol,1998,17(8-9): 559-574.
[10]Stamler JS,Osborne JA,Jaraki O,et al.Adverse vascular effects ofhomocysteinearemodulatedbyendotheliumderivedrelaxing factor and related oxides of nitrogen[J].J Clin Invest,1993,91(1):308-318.
[11]Tawakol A,Omland T,Gerhard M,et al.Hyper-homocysteinemia is associated with impaired endothelium-dependant vasodilatation in human[J].Circulation,1997,95(Suppl 1):1119-1121.
[12]Jin L,Caldwell RB,Li-Masters T,et al.Homocysteine induces endothelial dysfunction via inhibition of arginine transport[J].J Physiol Pharmacol,2007,58(2): 191-206.
[13]Buysschaert M,Dramais AS,Wallemacq PE,et al.Hyperhomocysteinemia in type 2 diabetes. Relationship to m acroangiopathy,nephropathy and insulin resistance[J].Diabetes Care,2000,23(12):1816-1822.
[14]Tayama J,Munakata M,Yoshinaga K,et al.Higher plasma homocystein concentration is associated with more advanced Sy stemic arterial stiffness and greater blood pressure response to stress in hypertensive patients[J].Hypertens Res,2006,29(6):403-409.
[15]Christen W,Ajani U,Glynn R,et al.Blood levels of homocysteine and increased risk of cardiovascular disease[J].Arch Intern Med,2000,160(2): 422-434.
[16]Melady R,Graham I.Plasma Homocysteine as a cardiovascular risk factor: causal,consequential,or of no consequence?[J].Nutr Rev,1999,57(11): 299-305.
R587.1
B
1671-8194(2015)29-0128-02
