保肝蒙药Ⅰ号对人肝癌Huh-7细胞的作用及机制研究
2015-10-27阿南达苏依拉其木格包景荣苏秀兰
阿南达 苏依拉其木格 包景荣 苏秀兰
1.内蒙古自治区鄂尔多斯市伊金霍洛旗蒙医院蒙医肝胆内科,内蒙古鄂尔多斯017200;2.内蒙古医科大学附属医院临床医学研究中心,内蒙古呼和浩特010050;3.内蒙古国际蒙医医院制剂中心,内蒙古呼和浩特010020
保肝蒙药Ⅰ号对人肝癌Huh-7细胞的作用及机制研究
阿南达1苏依拉其木格2包景荣3苏秀兰2
1.内蒙古自治区鄂尔多斯市伊金霍洛旗蒙医院蒙医肝胆内科,内蒙古鄂尔多斯017200;2.内蒙古医科大学附属医院临床医学研究中心,内蒙古呼和浩特010050;3.内蒙古国际蒙医医院制剂中心,内蒙古呼和浩特010020
目的探讨保肝蒙药Ⅰ号对人肝癌Huh-7细胞增殖的抑制作用及机制,为临床应用与推广提供科学的理论及实验数据。方法体外培养人肝癌Huh-7细胞,实验分为四组:对照组(生理盐水)、保肝蒙药Ⅰ号组、5-氟尿嘧啶(5-Fu)组、保肝蒙药Ⅰ号联合5-Fu组。分别采用MTT法、流式细胞术和Q-PCR技术观察药物干涉后对肝癌细胞增殖的抑制作用,对肝癌细胞凋亡、细胞周期阻滞和相关基因表达的影响。结果5-Fu组、保肝蒙药Ⅰ号(4 mg/mL)组和保肝蒙药Ⅰ号联合5-Fu组对Huh-7肝癌细胞增殖抑制率分别达到67.70%、73.67%和75.35%。保肝蒙药Ⅰ号组单独作用于Huh-7肝癌细胞以及保肝蒙药Ⅰ号联合5-Fu组联合作用,细胞的凋亡率均显示增加(P<0.05)。与对照组比较,保肝蒙药Ⅰ号组和5-Fu组分别作用于Huh-7肝癌细胞后显示细胞G0/G1期比率明显增加(P<0.05);然而,保肝蒙药Ⅰ号联合5-Fu组作用于Huh-7肝癌细胞后显示细胞S期比率明显增加(P<0.05)。保肝蒙药Ⅰ号组对凋亡相关基因Caspase-3、Caspase-8和Caspase-9的表达具有调控作用,能上调细胞色素C的表达。结论保肝蒙药Ⅰ号对人肝癌Huh-7细胞增殖有显著的抑制作用,其机制与细胞周期阻滞及影响肿瘤细胞凋亡相关基因的表达相关。研究成果将对阐明临床应用的保肝蒙药Ⅰ号治疗肝癌的机制及推广应用有重要意义。
保肝蒙药Ⅰ号;肝癌Huh-7细胞;5-氟尿嘧啶
蒙医药作为传统医学已经在临床疾病的预防与治疗中显示出其独特的作用。但是,目前临床应用的多数蒙药的药理作用机制尚未开展研究,仅凭药典、经验使用,缺少科学的实验证据。利用现代的细胞与分子生物学理论与方法阐明蒙药作用机制,是实现蒙药现代化,进行蒙药研发、推广应用的重要途径,是当前蒙药方剂研究中一个新兴的课题。
尽管保肝蒙药Ⅰ号在临床应用中已经呈现出较好的治疗肝癌的作用,但是,迄今为止其机制尚不清楚。根据保肝蒙药Ⅰ号的临床有效应用,笔者提出科学假设,保肝蒙药Ⅰ号可能通过影响肝癌细胞的增殖、凋亡过程抑制肝癌细胞增殖,其药理作用机制可能与影响凋亡途径中一些关键基因的表达相关。本文首次利用现代细胞与分子生物学技术展开研究,为保肝蒙药Ⅰ号的深入研究及临床推广应用提供了科学数据。
1 材料与方法
1.1材料与试剂
Huh-7细胞由内蒙古医科大学临床医学研究中心提供,培养基为含10%胎牛血清(FBS)的细胞培养基(DMEM),于37℃、5%CO2培养箱中培养,隔日换液,每3~4天传代。DMEM,胰蛋白酶和灭活的胎牛血清均为Hyclon公司产品。四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)购自美国Sigma公司。Annexin V/ PI双染法流式细胞分析试剂盒及细胞周期检测试剂均购自美国Becton-Dickinson公司。Caspase-3 P20(N-19)(产品编号:SC-1226)、Caspase-8 P18(D-8)(产品编号:SC-5263)、Caspase-9(9CSP03)(产品编号:SC-73548)和Cytochrome C(A-8)(产品编号:SC-13156)均购自于圣克鲁斯生物技术有限公司。RTPCR引物由生工生物工程(上海)股份有限公司合成。
1.2 MTT法测定蒙药Ⅰ号对人肝癌细胞增殖抑制作用
将处于对数生长期的细胞用0.25%胰酶消化,以4×103细胞/孔接种于96孔细胞培养板中,培养24 h后,分别加入不同浓度的保肝蒙药Ⅰ号、5-Fu、对照组(用等量的生理盐水)和保肝蒙药Ⅰ号联合5-Fu组(采用药物减半培养)。培养24 h后每孔加20 μL浓度为5 mg/mL的MTT继续培养4 h,弃去上清液,再加150 μL的DMSO,振荡10 min,使甲瓒充分溶解,用酶标仪测定570 nm处吸光度(A)值,每个药物浓度设立3个复孔,计算其平均值,各组选择半数致死量(IC50)的浓度进行下步实验。按下列公式计算平均细胞抑制率(IR):IR=(对照组A值-实验组A值)/对照组A值× 100%[1-2],计算各孔平均值。
1.3 HE染色
细胞接种于载玻片,待细胞进入对数生长期进行药物干预,将实验分为对照组、保肝蒙药Ⅰ号组、蒙药Ⅰ号联合5-Fu组和5-Fu组,继续培养24 h后,在倒置显微镜下观察细胞生长状况和形态,并用90%乙醇固定1 h,进行HE染色,采集图像。
1.4流式细胞术分析细胞凋亡和细胞周期
将Huh-7细胞接种于6孔板,1×104细胞/孔,37℃、5%CO2培养24 h,待细胞进入对数生长期,实验各组药物干预,继续培养24 h后,常规0.25%胰酶消化细胞,充分吹打,制成单细胞悬液;离心半径18 cm,1000 r/min离心5 min后,弃上清液,PBS充分洗涤;再次1000 r/min离心5 min,逐滴加入70%冰乙醇,边加边振荡,使细胞充分分散,固定后将样品放入-20℃冰箱内保存;上机前取出固定的细胞,1000 r/min离心5 min,弃上清液,加PBS 1 mL,充分洗涤细胞,使之成为单细胞悬液;1000 r/min离心5 min,弃上清液;加入Binding Buffer调整细胞浓度至5×106细胞/mL;再加入5 μL Annexin V-FITC和20 μL Propidium Iodide,混匀;室温避光,反应15 min;在1 h内进行流式细胞仪的观察和细胞凋亡的检测。离心收集检测细胞周期的细胞,冷PBS洗涤细胞3次,加入15 μL 100 μg/mL的RNase,振荡混合均匀,4℃避光放置15 min,加入PI,含50 μg/mL PBS,总量500 μL,4℃避光孵育30 min,流式细胞仪检测细胞周期分布情况[3]。
1.5 Trizol法提取细胞总RNA,荧光定量PCR反应检测蒙药对肝癌细胞凋亡的影响
反转录体系组成由2 μL的Template RNA,1 μL的oligo(dT)primer和9 μL的RNase-free water组成。65℃条件下反应5 min后加入4 μL的RT Buffer溶液,1 μL的Ribolock,10 mmol/L的dNTP Mix和2 μL的RevertAid RT。PCR反应体系由5 μL的Mix、0.3 μL的上游引物、0.3 μL的下游引物、0.02 μL的Rox、3.88 μL的RNase-free water和0.5 μL的cDNA组成。扩增目的基因引物,由上海生工生物工程技术服务有限公司合成,以actin为内参,合成引物及扩增片段大小如下所述。引物:Caspase-3:Forward 5'-h-cas3-F:AGA ACT GGA CTG TGG CAT TGA G;Reverse 5'-GCT TGT CGG CAT ACT GTT TCA;扩增片段为191 bp。Caspase-8:Forward 5'-GGA TGG CCA CTG TGA ATA ACT G;Reverse 5'-TCG AGG ACA TCG CTC TCT CA;扩增片段为101 bp。Caspase-9:Forward 5'-GTC CTA CTC TAC TTT CCC AGG TTT TG;Reverse 5'-GTG AGC CCA CTG CTC AAA GAT;扩增片段为100 bp。Cyt-C:Forward 5'-GAG CGG GAG TGT TCG TTG T;Reverse 5'-:CTT CCG CCC AAA GAG ACC AT;扩增片段为165 bp。actin:Forward 5'-CAGC CTC AAGATCATCAGCA;Reverse 5'-TG TGG TCATG AG TCCTTCCA;扩增片段为452 bp。分别检测各组actin、Caspase-3、Caspase-8、Caspase-9和Cyt-C的表达量,每组3个复孔,重复检测3次。Real time-PCR反应体系如下所示:5 μL的2×Quanti Tect SYBR Green PCR Master Mix,0.3 μL的Primer A,0.3 μL的Primer B,0.5 μL的cDNA,3.88 μL的RNase-free water和0.02 μL的Rox。反应条件为95℃条件下PCR初始热激活持续5 min,经过两步循环后,在95℃指示10 s,经60℃下伸展30 s,再循环40 s完成。采用比较法(△△CT)计算各组Caspase-3、Caspase-8、Caspase-9和Cyt-C相对定量,并用2-△△CT来比较各组基因mRNA表达情况。
1.6统计学方法
采用统计软件SPSS 13.0进行统计描述与统计分析。计量资料的统计描述采用均数±标准差(x±s)表示;多组间的比较采用单因素方差分析或多个独立样本的秩和检验,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MTT结果
保肝蒙药Ⅰ号及联合化疗药物作用于人肝癌细胞Huh-7,与未治疗组比较,各组均呈现出较强的细胞增殖抑制作用,见表1。
2.2 HE染色病理学分析
与对照组比较,保肝蒙药Ⅰ号组及保肝蒙药Ⅰ号联合5-Fu组作用于Huh-7细胞后,细胞均呈现不同程度的凋亡,出现细胞体积缩小,与周围的细胞脱离,核质浓缩。5-Fu组单独用药未见明显凋亡现象。保肝蒙药Ⅰ号组对Huh-7细胞具有较好的增殖抑制作用。见图1。
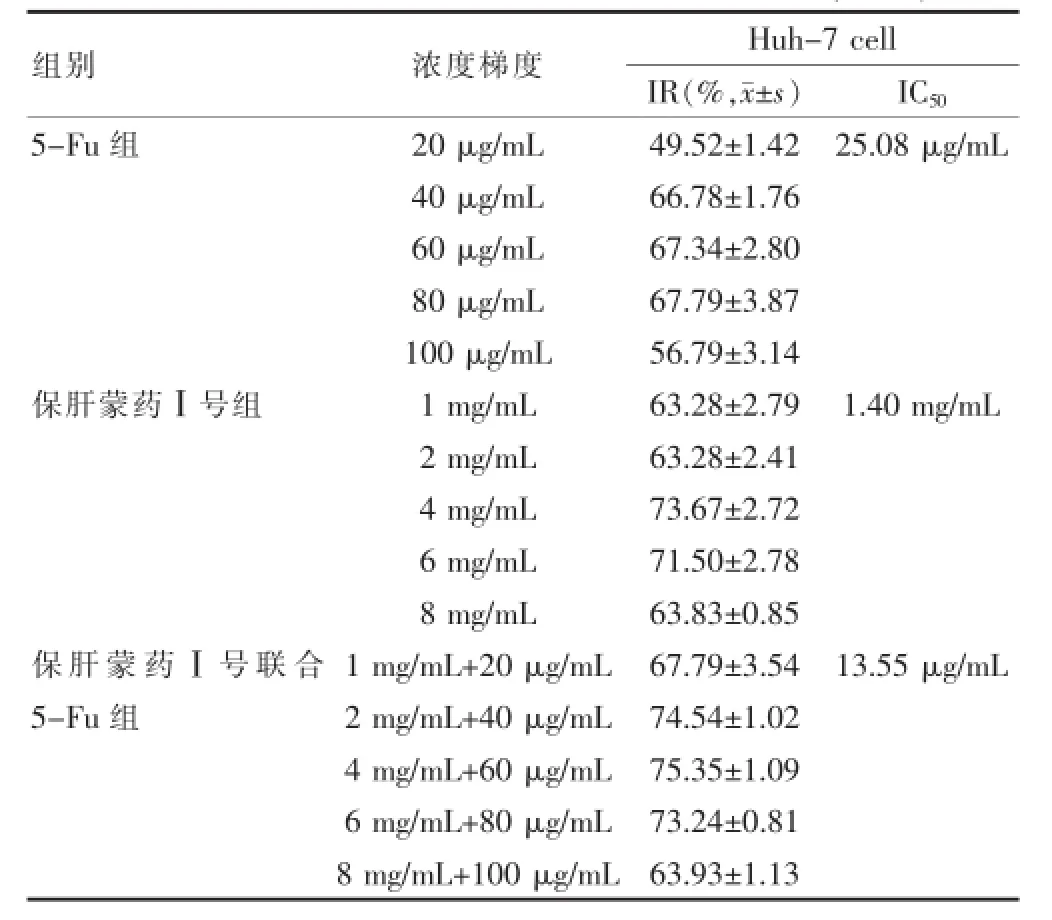
表1 各组药物对人肝癌Huh-7细胞的抑制作用(n=3)
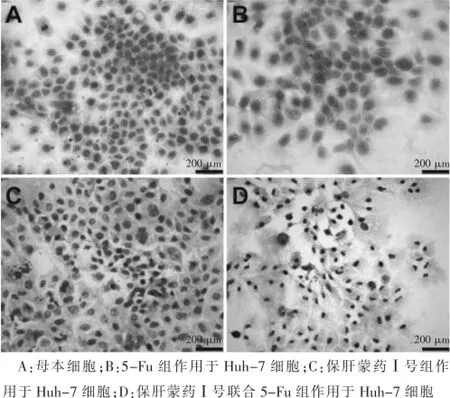
图1 不同药物对Huh-7细胞的HE染色图(400×)
2.3流式细胞术分析保肝蒙药Ⅰ号组对肝癌细胞凋亡及细胞周期的影响
对照组与5-Fu组细胞凋亡率差异无统计学意义(P>0.05),保肝蒙药Ⅰ号组与保肝蒙药Ⅰ号联合5-Fu组细胞凋亡率显著高于对照组及5-Fu组(P<0.05),且保肝蒙药Ⅰ号联合5-Fu组细胞凋亡率显著高于保肝蒙药Ⅰ号组(P<0.05)。细胞周期检测结果显示,对照组与保肝蒙药Ⅰ号联合5-Fu组细胞G0/G1期差异无统计学意义(P>0.05),5-Fu组与保肝蒙药Ⅰ号组细胞G0/G1期显著高于对照组及保肝蒙药Ⅰ号联合5-Fu组(P<0.05),5-Fu组细胞G0/G1期显著高于保肝蒙药Ⅰ号组(P<0.05);保肝蒙药Ⅰ号组细胞S期显著高于5-Fu组(P<0.05),对照组细胞S期显著高于保肝蒙药Ⅰ号组(P<0.05),保肝蒙药Ⅰ号联合5-Fu组细胞S期显著高于对照组(P<0.05);对照组及5-Fu组细胞G2/M期显著高于保肝蒙药Ⅰ号联合5-Fu组(P<0.05)。见表2。
表2 FCM检测保肝蒙药Ⅰ号对Huh-7细胞凋亡和周期的影响(48 h)(%,)
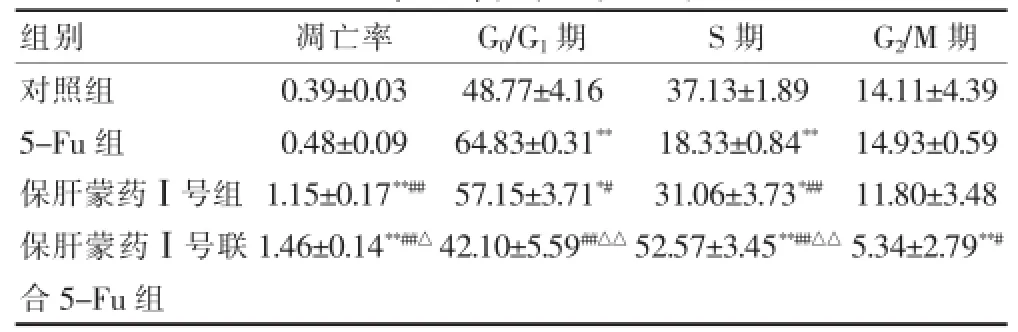
表2 FCM检测保肝蒙药Ⅰ号对Huh-7细胞凋亡和周期的影响(48 h)(%,)
注:与对照组比较,*P<0.05,**P<0.01;与5-Fu组比较,#P<0.05,##P<0.01;与保肝蒙药Ⅰ号组比较,△P<0.05,△△P<0.01
组别凋亡率G0/G1期S期G2/M期对照组5-Fu组保肝蒙药Ⅰ号组保肝蒙药Ⅰ号联合5-Fu组0.39±0.03 0.48±0.09 1.15±0.17**##1.46±0.14**##△48.77±4.16 64.83±0.31**57.15±3.71*#42.10±5.59##△△37.13±1.89 18.33±0.84**31.06±3.73*##52.57±3.45**##△△14.11±4.39 14.93±0.59 11.80±3.48 5.34±2.79**#
2.4 Q-PCR分析保肝蒙药Ⅰ号组对肝癌细胞凋亡调控基因表达的影响
保肝蒙药Ⅰ号组与保肝蒙药Ⅰ号联合5-Fu组 Cyt-C基因的表达显著高于对照组(P<0.05),5-Fu组Cyt-C基因的表达显著高于保肝蒙药Ⅰ号组及保肝蒙药Ⅰ号联合5-Fu组(P<0.05),保肝蒙药Ⅰ号组与保肝蒙药Ⅰ号联合5-Fu组Cyt-C基因的表达差异无统计学意义(P>0.05);保肝蒙药Ⅰ号组Caspase-3基因的表达显著高于保肝蒙药Ⅰ号联合5-Fu组(P<0.05),对照组Caspase-3基因的表达显著高于保肝蒙药Ⅰ号组(P<0.05),5-Fu组Caspase-3基因的表达显著高于对照组(P<0.05);保肝蒙药Ⅰ号组Caspase-8基因的表达显著高于保肝蒙药Ⅰ号联合5-Fu组(P<0.05),对照组Caspase-8基因的表达显著高于保肝蒙药Ⅰ号组(P<0.05),5-Fu组Caspase-8基因的表达显著高于对照组(P<0.05);保肝蒙药Ⅰ号组Caspase-9基因的表达显著高于保肝蒙药Ⅰ号联合5-Fu组(P<0.05),对照组及5-Fu组Caspase-9基因的表达显著高于保肝蒙药Ⅰ号组(P<0.05),对照组与5-Fu组Caspase-9基因的表达差异无统计学意义(P>0.05)。见表3。
3 讨论
尽管常规的化学疗法是肿瘤的常规治疗途径,但是,其在杀伤肿瘤细胞的同时对正常细胞仍然存在一定的杀伤作用,易产生骨髓抑制和胃肠道反应等副作用,特别是产生的肿瘤耐药问题成为治疗失败的重要原因之一[4-5]。寻找毒副作用小、安全、高效的肿瘤治疗方法是目前肿瘤研究的热点。中蒙药在肿瘤的综合治疗中能显著改善患者的生活质量,减轻治疗中产生的毒副作用,有延长患者生存期的作用,日益引起研究者与临床工作者的重视。
表3 Huh-7人肝癌细胞中Cyt-C、Caspase-3、Caspase-8、Caspase-9基因的表达

表3 Huh-7人肝癌细胞中Cyt-C、Caspase-3、Caspase-8、Caspase-9基因的表达
注:与对照组比较,*P<0.05,**P<0.01;与5-Fu组比较,#P<0.05,##P<0.01;与保肝蒙药Ⅰ号组比较,△P<0.05,△△P<0.01
组别Cyt-CCaspase-3Caspase-8Caspase-9对照组5-Fu组保肝蒙药Ⅰ号组保肝蒙药Ⅰ号联合5-Fu组1.01±0.16 91.90±36.22**1.89±0.32*##2.02±0.42**#1.01±0.21 298.94±125.31**0.47±0.02**##0.35±0.02**##△△1.085±0.531 69.584±6.563**0.025±0.012**##0.010±0.004**##△△1.0196±0.2490 0.2973±0.4827 0.0093±0.0007**#0.0044±0.0010**##△
我国肝癌的发病率目前仍未下降,依然是癌症之王[6-7]。中国每年新发肝癌病患者30万例,这些新发肝癌患者就诊时70%~80%已属中晚期[8-10]。开展肝癌早期诊断与综合治疗的研究,包括探索抑制肝癌细胞增殖与诱导其凋亡的药物研究是世界范围内的热点[11-13]。探索直接针对晚期肝癌的分子靶向药物的研究是发展的方向和研究的热点[14]。在过去的50年,几乎47%的被批准抗癌药物为天然产物或其产物的合成分子[15]。保肝蒙药Ⅰ号由18位天然植物组成,其君药为诃子,而诃子由于其含有的成分丰富,具有广泛的药理作用,包括预防与治疗肿瘤的作用[16-17]。保肝蒙药Ⅰ号在针对晚期肝癌患者的治疗中表现出总体生存率显著改善的有效性,但是,目前的瓶颈是阐释其抑制肿瘤细胞增殖的机制,在传承的基础上再探索和发展,期望保肝蒙药验方成为预防与治疗肝癌的有发展前景的民族药。因此,深入研究保肝蒙药Ⅰ号对肿瘤作用的分子机制,具有重要的理论意义和广泛的应用前景。
本研究通过体外实验提示保肝蒙药Ⅰ号(4 mg/mL)能显著抑制人肝癌Huh-7细胞的增殖。光学显微镜下观察发现未经药物处理的对照组细胞生长旺盛,生长速度快,而经过保肝蒙药Ⅰ号处理后,随着药物浓度增加,细胞出现变圆和贴壁能力减弱的变化,细胞的数量明显减少。通过MTT分析发现,保肝蒙药Ⅰ号在1 mg/mL的浓度时即呈现细胞增殖抑制作用,在4 mg/mL时增殖抑制作用显著。在减少化疗药物浓度,联合保肝蒙药Ⅰ号作用于人肝癌细胞系Huh-7,其增殖抑制作用明显,且呈浓度依赖性。细胞周期阻滞研究结果显示,细胞周期阻滞可能是导致Huh-7细胞存活率下降的原因之一。流式细胞术分析提示,与对照组比较,保肝蒙药Ⅰ号组呈现细胞周期阻滞变化。另一方面,保肝蒙药Ⅰ号也会影响肝癌细胞的凋亡。
半胱天冬酶(Caspase)在细胞凋亡过程中具有重要的作用,其Caspase-8和Caspase-9分别代表线粒体上游和下游的凋亡因素,对调节细胞的凋亡非常重要[18-20]。因此,笔者研究了保肝蒙药Ⅰ号对Cyt-C、Caspase-3、Caspase-8和Caspase-9的基因表达的影响。actin作为内参,保肝蒙药Ⅰ号和保肝蒙药Ⅰ号联合5-Fu对凋亡调控相关基因的表达呈上调,对Cyt-C基因的表达量增加。结果显示保肝蒙药Ⅰ号组对凋亡相关基因Caspase-3、Caspase-8和Caspase-9的表达具有调控作用[21-23]。本研究提示Caspase-3、Caspase-8、Caspase-9和Cyt-C是保肝蒙药Ⅰ号诱导肿瘤细胞凋亡的重要靶点。
综上所述,传承保肝蒙药Ⅰ号不但可抑制肝癌细胞增殖并诱导其凋亡,而且对化疗药物有一定的减毒增敏作用,为肝癌的治疗提供了新途径,因此其有望成为一种高效低毒的抗肿瘤新药。由于临床应用的化疗药物存在耐药性以及其毒副作用,探索如何提高治疗效率和减轻毒副作用制剂是世界范围内研究的热点。本文同时探讨了保肝蒙药Ⅰ号是否可以在化疗药物治疗肿瘤中减少其用量,降低毒性,同时增加肿瘤细胞对药物的敏感性。结果显示保肝蒙药Ⅰ号联合5-Fu组具有较强的增敏作用。研究结果为深入研究保肝蒙药Ⅰ号抗肿瘤作用及机制奠定了基础,也为蒙医药走向世界提供了科学的佐证。
[1]Ahmad A,Asthana N,Azmi S,et al.Structure-function study of cathelicidin-derived bovine antimicrobial peptide BMAP-28:design of its cell-selective analogs by amino acid substitutions in the heptad repeat sequences[J]. Biochim Biophys Acta,2009,1788(11):2411-2420.
[2]Batista MN,Carneiro BM,Braga AC,et al.Caffeine inhibits hepatitis C virus replication in vitro[J].Arch Virol,2015,160(2):399-407.
[3]Guo YD,Wang JH,Lu H,et al.The human epididymis protein 4 acts as a prognostic factor and promotes progression of gastric cancer[J].Tumor Biol,2015,36(4):2457-2464.
[4]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J]. CA:A Cancer Journal for Clinicians,2011,61(2):69-90.
[5]Koehn FE,Carter GT.The evolving role of natural products indrug discovery[J].Nature Reviews Drug Discovery,2005,4(3):206-220.
[6]Hobbs KE,Dusheiko GM.Management of hepatocellular carcinoma[J].J Hepatology,1992,15(2):281-283.
[7]Laurent-Puig P,Legoix P,Bluteau O,et al.Genetic alterations associated with hepatocellular carcinomas define distinct pathways of hepatocarcinogenesis[J].Gastroenterology,2001,120(7):1763-1773.
[8]Chiang DY,Villanueva A,Hoshida Y,et al.Focal gains of VEGFA and molecular classification of hepatocellular carcinoma[J].Cancer Res,2008,68(16):6779-6788.
[9]Ferguson LR.Antimutagens as cancer chemopreventive agents in the diet[J].Mut Res,1994,307(1):395-410.
[10]Stavric B.Role of chemopreventers in human diet[J]. Clinical Biochem,1994,27(5):319-332.
[11]韩泽广.肿瘤基因组研究进展[J].中国科学C辑:生命科学,2008,38(10):907-912.
[12]张慧慧,苏金仁,黄秀深,等.中药治疗肝癌机制方面的试验研究概况[J].中药与临床,2014,1(4):66-68.
[13]谢益,戴建国.原发性肝癌的中医药临床机制研究[J].长春中医药大学学报,2011,27(5):738-740.
[14]Keating GM,Santoro A.Sorafenib:a review of its use in advanced hepatocellular carcinoma[J].Drugs,2009,69(2):223-240.
[15]Newman DJ,Cragg GM.Natural products as sources of new drugs over the 30 years from 1981 to 2010[J].J Nat Prod,2012,75(3):311-335.
[16]钟振国,黄金兰,梁红,等.余甘子叶化学成分没食子酸对人肝癌-细胞株凋亡的影响[J].中药材,2009,7(32):1097-1101.
[17]Anwesa B,Bhattacharyya SK,Chattopadhyay RR.The development of Terminalia chebuLa Retz(Combretaceae)in clinical research[J].Asian Pac J Trop Biomed,2013,3(3):244-252.
[18]Yco NJ,Lee SH,Jeong EG,et al.Expression of phosphorylated Ceaspase-9 in gastric carcinomas[J].APMIS,2007,115(4):354-359.
[19]Cho S,Lee JH,Cho SB,et al.Epigeneic methy|ation and expression of caspase 8 and survivin in hepatocellular carcinoma[J].Pathol Int,2010,60(3):203-211.
[20]Zhivotovsky B,Orrenius S.Carcinogenesis and apoptosis:paradigms and paradoxes[J].Carcinogenesis,2006,27(10):1939-1945.
[21]袁伟伟,林秋雄,朱杰宁,等.靶向caspase-8小发夹RNA减轻去血清/缺氧诱导的人骨髓间充质干细胞凋亡[J].中国病理生理杂志,2014,1(7):1172-1178.
[22]李敏,林俊.细胞凋亡途径及其机制[J].国际妇产科学杂志,2014,1(2):103-107.
[23]李宏,冯有胜.线粒体的释放机制及其在细胞凋亡中的作用[J].生物信息学,2010,8(3):210-213.
Study on the role and mechanism of Hepatoprotective MongolianⅠon hepatocellular carcinoma Huh-7 cells
A Nanda1Suyila Qimuge2BAO Jingrong3SU Xiulan2
1.Department of Hepatobiliary Mongolian Medicine,Ejin Horo Banner Hospital of Ordos City,Inner Mongolia Autonomous Region,Ordos017200,China;2.Clinical Medical Research Center,the Affiliated Hospital of Inner Mongolia Medical University,Inner Mongolia Autonomous Region,Huhhot010050,China;3.Preparations Center,Inner Mongolia International Mongolian Hospital,Inner Mongolia Autonomous Region,Huhhot010020,China
Objective To explore the role and mechanism of Hepatoprotective MongoliaⅠon hepatocellular carcinoma Huh-7 cells and to provide the scientific theory and experimental data for the clinical application of Hepatoprotective MongoliaⅠ.Methods Hepatocellular carcinoma Huh-7 cells were cultured in vitro,and the experiment was divided into four groups:control group(normal saline),5-Fluorouracil(5-Fu)group,Hepatoprotective MongoliaⅠgroup and Hepatoprotective MongoliaⅠcombined with 5-Fu group.Cell proliferation was measured by MTT in Huh-7 cells. Apoptosis and cell cycle were measured by flow cytometry.Gene expression was examined by real-time fluorescence PCR.Results The proliferation inhibition rate of 5-Fu group,Hepatoprotective MongoliaⅠ(4 mg/mL)group and Hepatoprotective MongoliaⅠcombined with 5-Fu group on the Huh-7 liver cancer cell was 67.70%,73.67%and 75.35%respectively.Hepatoprotective MongoliaⅠgroup and Hepatoprotective MongoliaⅠcombined with 5-Fu group acted on the Huh-7 cell showed that the apoptosis rate was significantly increased(P<0.05).Compared with control group,Hepatoprotective MongoliaⅠgroup and 5-Fu group acted on the count of Huh-7 cells in G0/G1phase was significantly increased(P<0.01),while Hepatoprotective MongoliaⅠcombined with 5-Fu group in S phase was significantly increased(P<0.01).QPCR data also showed that apoptosis genes,such asCaspase-3,Caspase-8 and Caspase-9 had regulatory role upon Hepatoprotective MongoliaⅠgroup and expression of cytochrome C was increased.Conclusion Hepatoprotective MongoliaⅠshows significant anti-proliferative effects on the Huh-7 cells and its inhibition mechanism involves cell cycle arrest and related gene expression,which affects tumor cell apoptosis.The research results have important significance to the application and mechanism of liver cancer treated by Hepatoprotective MongoliaⅠin explanation for clinical application.
Hepatoprotective MongoliaⅠ;Hepatocellular carcinoma Huh-7 cells;5-Fluorouracil
R965;R979.1
A
1673-7210(2015)12(b)-0026-05
2015-09-09本文编辑:张瑜杰)
内蒙古自治区草原英才团队基金(内组通字[2013]17号-16)。
苏秀兰(1956-),女,硕士,教授,博士生导师;研究方向:肿瘤学及分子生物学。
