海州香薷Actin基因片段克隆及表达分析
2015-10-26蔡深文熊治廷刘晨徐仲瑞邓松强
蔡深文熊治廷刘晨徐仲瑞邓松强
(1. 遵义师范学院资源与环境学院,遵义 563002;2. 武汉大学资源与环境科学学院,武汉 430079)
海州香薷Actin基因片段克隆及表达分析
蔡深文1熊治廷2刘晨2徐仲瑞2邓松强2
(1. 遵义师范学院资源与环境学院,遵义 563002;2. 武汉大学资源与环境科学学院,武汉 430079)
通过克隆海州香薷Actin基因片段并分析其组织表达,为研究海州香薷重金属抗性相关基因的表达调控奠定基础。根据GenBank中其他植物Actin基因保守序列设计兼并引物,以海州香薷根总RNA为模板,利用RT-PCR技术分离得到Actin基因片段。序列分析结果表明,海州香薷Actin基因片段长576 bp,编码192个氨基酸,与其他植物同源基因的氨基酸序列相似性为84%-97%,所克隆的序列为Actin基因的同源片段,将其命名为EhACT,在GenBank中提交序列,获得登录号AGT37260。半定量RT-PCR分析结果表明,EhACT在海州香薷的根、茎和叶中表达相对稳定,初步表明其可作为研究海州香薷基因表达的内参基因。
海州香薷;Actin基因;克隆;表达
海州香薷(Elsholtzia haichowensis Sun)是一年生草本植物,属唇形科,广泛分布于长江中下游铜矿区和铜污染的土壤中,是一种铜矿指示植物,俗称“铜草”[1,2]。海州香薷在非铜矿区也有发现[3]。铜矿区的海州香薷由于长期生活在高浓度Cu污染的环境胁迫条件下,可能已经发生了与Cu污染相适应的抗性进化,形成了与非矿区种群不同的抗性生态型[4],通常来自矿区种群的海州香薷对Cu具有较高的吸收富积能力和耐受能力[5]。海州香薷是植物重金属抗性机理研究领域的理想植物材料,从抗性相关基因表达角度能够更深入地理解海州香薷的铜抗性机理,对于基因表达量的研究通常需要稳定的内参基因作为标准来衡量,选择合适的内参基因至关重要。植物肌动蛋白(Actin)在植物细胞形成和物质运输方面起着重要作用[6],是组成型表达蛋白,高度保守,在基因表达调控中被广泛作为内参基因[7]。而关于海州香薷Actin基因的研究还未见报道。因此,本研究通过同源克隆方法分离海州香薷Actin基因片段并进行表达分析,以此基因为内参标准,旨在为其他功能基因在海州香薷中的表达调控研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 海州香薷(E. haichowensis)种子采自湖北大冶铜绿山古铜矿遗址(11453’E,30 05’N,MP)。海州香薷种子用0.3% NaClO溶液浸泡消毒20 min,去离子水冲洗5遍后用去离子水浸泡过夜,使种子充分吸收水分。第2天,将种子转移至底部铺有滤纸的塑料碗中,加去离子水,水面浸没种子的一半左右,置于HSR025型人工气候箱中黑暗萌发,温度设定为25℃,湿度75%。约96 h后种子基本全部萌发。随后采用水培方法培养海州香薷幼苗,待长至4对真叶时剪取新鲜的根尖(约2 cm)用于RNA提取。
1.1.2 试剂 RNA提取使用的Trizol试剂购自Invitrogen公司;PCR反应所用的Ex Taq,dNTPmixture,pMD18-T载体和RNase Inhibitor,均购自TaKaRa公司;反转录酶M-MLV RT购自Promega公司;DNA凝胶回收试剂盒为Axygen公司产品;大肠杆菌TOP10感受态细胞购自天根生化科技有限公司;其他生化试剂购自丁香园生物技术有限公司,引物由上海博道生物技术公司合成,序列测定由华大基因完成。
1.2 方法
1.2.1 海州香薷总RNA提取 采用Trizol法提取总RNA,结果用1.2%琼脂糖凝胶电泳检测,紫外分光光度计测定总RNA浓度及纯度,-80℃超低温冰箱保存备用。
1.2.2 RT-PCR扩增 首先以海州香薷根部总RNA为模板,反转录酶与引物Oligo(dT)18引导cDNA第一链的合成。0.2 mL离心管中依次加入12.5 μL总RNA,3 μL Oligo(dT)18,11 μL DEPC处理的水,70℃温浴5 min,迅速置于冰上冷却,微离心收集溶液至离心管底部,再依次加入5×M-MLV RT Buffer 10 μL,RNase Inhibitor 1.5 μL,dNTP Mixture(2.5 mmol/L each) 10 μL,M-MLV RT 2 μL,用移液枪吸打混匀,于PCR仪上42℃反应60 min,70℃温浴10 min失活反转录酶,冰上分装后-20℃保存备用。根据其他物种Actin基因序列,设计其上游引物PrimerF 5'-TGTGGTCCTTTTGTGTCATT-3'和下游引物PrimerR:5'-CTCCTTGCTCATCCTGTCAGC-3',以反转录所得的cDNA为模板,进行PCR反应,反应体系为20 μL:10× Ex Taq Buffer(Mg2+plus) 2 μL,dNTP Mixture(2.5 mmol/L each) 1 μL,PrimerF 1 μL,PrimerR 1 μL,cDNA 1 μL,Ex Taq 0.2 μL,ddH2O 13.8 μL。PCR反应程序为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,32个循环;72℃延伸5 min。PCR产物用1.2%琼脂糖凝胶电泳检测。
1.2.3 阳性克隆鉴定 目的片段按照DNA凝胶回收试剂盒操作说明进行切胶回收纯化,连接至pMD18-T载体,转化TOP10感受态细胞,扩大培养后提取质粒DNA,进行PCR检测,选取带有目的片段的重组质粒测序。
1.2.4 序列分析 使用NCBI网站的BLAST在线软件(http://www.ncbi.nlm.nih.gov/blast)进行海州香薷Actin基因片段的同源性比对分析与相似性搜索。使用ClustalX软件将海州香薷和其他物种Actin基因的氨基酸序列进行比对[8]。
1.2.5 半定量RT-PCR分析Actin基因表达 根据已获得的Actin基因片段序列,设计特异性引物Actin--F(5'-TTCTTTGGCAGGTATTGTTCTCG-3')和ActinR(5'-TTC-CCGCTCGGCTGTAGTTGT-3')用于半定量RT-PCR反应。分别提取海州香薷的根、茎和叶的总RNA,并反转录生成cDNA,以该cDNA为模板进行PCR反应,反应体系为20 μL:10×Ex Taq Buffer(Mg2+plus) 2 μL,dNTP Mixture(2.5 mmol/L each)1 μL,PrimerF 1 μL,PrimerR 1 μL,cDNA 1 μL,Ex Taq 0.2 μL,ddH2O 13.8 μL。PCR反应程序为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,28个循环;72℃延伸5 min。PCR产物用1.2%琼脂糖凝胶电泳检测。
2 结果
2.1 总RNA提取
海州香薷根中的总RNA经1.2%琼脂糖凝胶电泳检测(图1)显示,呈现3条清晰的条带,其中28S rRNA的亮度约为18S rRNA的两倍,5S rRNA亮度较低,无明显降解,紫外分光光度计测定RNA样品OD260/OD280的平均值为1.91,表明所提取的总RNA质量较好,可用于反转录反应。
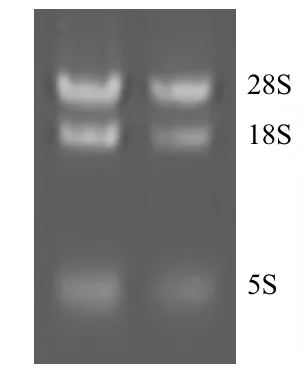
图1 海州香薷根部总RNA提取
2.2 RT-PCR扩增和克隆
以第一链cDNA为模板,用引物PrimerF和PrimerR进行PCR扩增,获得一条约550 bp的条带,与预期大小相似,将目的条带进行凝胶回收,随后连接至pMD18-T载体上,转化大肠杆菌TOP10。从转化平板上随机挑取5个白斑进行菌液PCR检测,结果(图2)表明5个均为阳性克隆。

图2 阳性克隆的PCR鉴定
2.3 测序结果与序列分析
将5个克隆进行测序,其测序结果完全一致,得到576 bp的序列,编码192个氨基酸(图3)。Blast结果表明,海州香薷与其他植物Actin基因的核苷酸序列相似性为78%-91%,氨基酸序列相似性为84%-97%,其中与唇形科植物丹参(Salvia miltiorrhiza)(GenBank:ADK11998)的相似性最高,达97%。将EhACT与其他8种植物Actin基因的氨基酸序列进行多重比对(图4),EhACT具有153个保守氨基酸,非保守氨基酸为38个,表明所克隆的序列片段为Actin基因片段,将其命名为EhACT,在GenBank中提交序列,获得登录号AGT37260。

图3 海州香薷Actin基因片段的核苷酸序列及推导的氨基酸序列
2.4 Actin基因的组织表达分析
通过特异性引物ActinF和ActinR克隆海州香薷不同组织中的Actin基因片段,将目的片段进行测序验证,结果显示其长度为184 bp,属于EhACT基因序列。半定量RT-PCR分析结果(图5)显示,海州香薷Actin基因在根、茎和叶组织中的表达相对稳定,不具有组织表达特异性。
3 讨论
本研究通过同源克隆方法分离得到海州香薷的Actin基因片段序列,序列分析结果表明EhACT与其他植物Actin基因的序列相似性较高,氨基酸序列高度保守,表明所克隆的序列为Actin基因片段序列。大量研究表明,Actin基因在核苷酸和氨基酸水平都具有高度的保守性和同源性[9-11],这种高度保守性是由于植物肌动蛋白起源于一个共同祖先,在进化过程中通过复制和变异而被保留下来[12,13]。因此,Actin基因在植物生命活动过程中起着十分重要的作用,克隆海州香薷的Actin基因对于认识海州香薷在铜胁迫环境下的进化过程也具有重要意义。Actin基因的重要性不仅表现在生命活动过程中,且由于该基因的表达属于组成型表达,在研究其他基因的表达调控过程中也起着重要作用。

图4 海州香薷Actin基因氨基酸序列片段与其他植物Actin基因的氨基酸序列多重比对
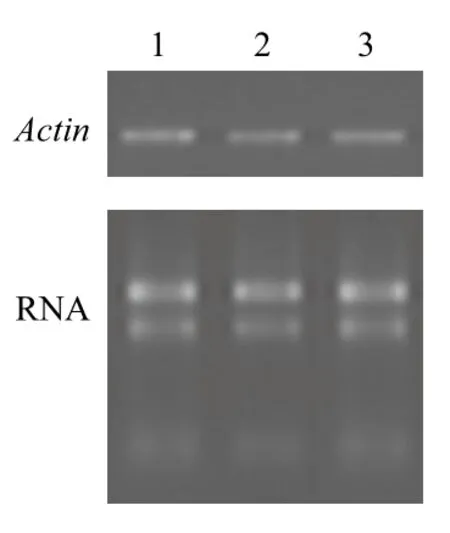
图5 海州香薷Actin基因的组织表达
植物基因表达分析研究中比较常用的内参对照基因即管家基因主要有肌动蛋白基因(ACT)、甘油醛-3-磷酸脱氢酶基因(G3PDH/GAPDH)、18S和 28S核糖体RNA基因(18S rRNA、28S rRNA)及肽链延伸因子(ef1-α)基因等[14-16]。其中肌动蛋白是真核细胞中主要的胞质微丝骨架组分之一,是植物基因表达研究中广泛使用的内参基因[17-19]。虽然上述管家基因一直被作为内参基因来标准化目的基因,但最近许多研究表明,不同管家基因在不同细胞类型和不同生理状态下的表达并不是恒定不变的,如Xu等[20]分析了GAPDH、ACT、TUA、TUB、18SrRNA、RPII、EF-1b和TEF2基因在萝卜不同组织、品种和发育时期的表达稳定性,其中只有ACT、RPII 和TEF2基因的表达相对稳定,可作为内参基因。Podevin等[21]通过实时荧光定量PCR分析了芭蕉(Musa)GAPDH等9个基因的表达,结果表明只有EF1、TUB 和ACT可以在不同组织稳定表达。因此,在基因表达研究中需选择合适的管家基因作为内参基因,本试验克隆了一条576 bp长的海州香薷Actin基因片段,并通过半定量RT-PCR分析发现其在不同组织部位的表达相对稳定,初步表明其可作为内参基因,为研究其他基因特别是重金属抗性相关基因在海州香薷体内的表达和调控奠定了基础。本试验仅研究了EhACT基因的组织表达特异性,其他管家基因在不同条件下是否能够稳定表达,以及与EhACT基因相比是否更加稳定,还有待进一步研究证实。
4 结论
本研究通过同源克隆得到海州香薷Actin基因片段(EhACT,GenBank登录号AGT37260),片段长576 bp,编码192个氨基酸,与其他植物同源基因的氨基酸序列相似性为84%-97%。半定量RT-PCR分析结果表明EhACT在海州香薷的根、茎和叶中表达相对稳定,可作为研究海州香薷基因表达的内参基因。
[1] 柯文山, 席红安, 杨毅, 等. 大冶铜绿山矿区海州香薷(Elsholtzia haichowensis)植物地球化学特征分析[J]. 生态学报, 2001,21(6):907-912.
[2]谢学锦, 徐邦梁. 铜矿指示植物——海州香薷[J]. 地质学报,1952, 32(4):360-368.
[3]Liu J, Xiong ZT. Differences in accumulation and physiological response to copper stress in three populations of Elsholtzia haichowensis S. [J]. Water Air Soil Pollut, 2005, 168(1-4):5-16.
[4] 熊治廷. 植物抗污染进化及其遗传生态学代价[J]. 生态学杂志,1997, 16(1):53-57.
[5]Yang MJ, Yang XE, Römheld V. Growth and nutrient composition of Elsholtzia splendens Nakai under copper toxicity [J]. J Plant Nutr,2002, 25(7):1359-1375.
[6] 陈颖, 王刚, 赵俊霞. 高等植物体内的肌动蛋白[J]. 生物学通报, 2003, 38(2):13-15.
[7]Meagher RB, McKinney EC, Kandasamy MK. Isovariant dynamics expand and buffer the responses of complex systems:the diverse plant actin gene family [J]. Plant Cell, 1999, 11(6):995-1005.
[8]Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_ X windows interface:flexible strategies for multiple sequence alignment aided by quality qnalysis tools [J]. Nucl Acid Res, 1997,25(24):4876-4882.
[9]Pollard TD, Cooper JA. Actin, a central player in cell shape and movement [J]. Science, 2009, 326(5957):1208-1212.
[10]Erickson HP. Evolution of the cytoskeleton [J]. Bioessays, 2007,29(7):668-677.
[11]Carlon E, Dkhissi A, Malki ML, et al. Stability domains of actin genes and genomic evolution [J]. Phys Rev E, 2007, 76(5):051916.
[12]Skaloud P, Peksa O. Evolutionary inferences based on ITS rDNA and actin sequences reveal extensive diversity of the common lichen alga Asterochloris(Trebouxiophyceae, Chlorophyta) [J]. Mol Phylogenet Evol, 2010, 54(1):36-46.
[13] Baruaa B, Pamulab MC, Hitchcock-DeGregori SE. Evolutionarily conserved surface residues constitute actin binding sites of tropomyosin [J]. Proc Nat Acad Sci USA, 2011, 108(25):10150-10155.
[14]牙库甫江·阿西木, 关波, 张富春. 植物基因表达转录分析中内参基因的选择与应用 [J]. 生物技术通报, 2011(7):7-11.
[15] Lopez-Pardo R, de Galarreta JIR, Ritter E. Selection of housekeeping genes for qRT-PCR analysis in potato tubers under cold stress[J]. Mol Breeding, 2013, 23(1):39-45.
[16] Eisenberg E, Levanon EY. Human housekeeping genes, revisited[J]. Trends Genet, 2013, 29(10):569-574.
[17]Reid K, Olsson N, Schlosser J, et al. An optimized grapevine RNA isolation procedure and statistical determination of reference genes for real-time RT-PCR during berry development [J]. BMC Plant Biol, 2006, 6(1):27.
[18]Hruz T, Wyss M, Docquier M, et al. RefGenes:identification of reliable and condition specific reference genes for RT-qPCR data normalization [J]. BMC Genomics, 2011, 12(1):156.
[19]Yan J, Yuan F, Long G, et al. Selection of reference genes for quantitative real-time RT-PCR analysis in citrus [J]. Mol Biol Rep, 2012, 39(2):1831-1838.
[20]Xu Y, Zhu X, Gong Y, et al. Evaluation of reference genes for gene expression studies in radish(Raphanus sativus L.) using quantitative real-time PCR [J]. Biochem Biophys Res Commun,2012, 424(3):398-403.
[21]Podevin N, Krauss A, Henry I, et al. Selection and validation of reference genes for quantitative RT-PCR expression studies of the non-model crop Musa [J]. Mol Breeding, 2012, 30(3):1237-1252.
(责任编辑 李楠)
Cloning and Expression Analysis of Actin Gene Gragment from Elsholtzia haichowensis
Cai Shenwen1Xiong Zhiting2Liu Chen2Xu Zhongrui2Deng Songqiang2
(1. School of Resource and Environment,Zunyi Normal College,Zunyi 563002;2. School of Resource and Environmental Sciences,Wuhan University,Wuhan 430079)
Cloning and expression analysis of Actin gene fragment from Elsholtzia haichowensis would provide foundation for the study of gene expression and regulation of heavy metal resistance related genes. Degenerate primers were designed based on the conserved sequences of the Actin genes from other plants. Total RNA was extracted from the root of E. haichowensis. An Actin gene fragment was separated by reverse transcription polymerase chain reaction(RT-PCR). The sequence analysis results revealed that Actin gene fragment from E. haichowensi contains 576 bp, encoding a protein of 192 amino acids. Homology comparison with other plants Actin gene sequences in the GenBank showed that it shared 84%-97% amino acid sequence homology with other plants. The cloned sequence was Actin gene fragment. It was named as EhACT and was registered into GenBank(accession number:AGT37260). Semi-quantitative PCR assays indicated that the expression of EhACT in root, stem and leaf of E. haichowensis was relatively stable, suggesting that EhACT can be used as the reference to analyze the gene expression in E. haichowensis.
Elsholtzia haichowensis;Actin gene;cloning;expression
10.13560/j.cnki.biotech.bull.1985.2015.02.016
2014-07-17
国家自然科学基金项目(30870365,31270432)
蔡深文,男,博士,讲师,研究方向:环境生物学;E-mail:caishenwen@163.com
