丹参根腐病生防芽孢杆菌2-1海藻菌剂的研制
2015-10-25周莹袁孟娟韩军陈芳
周莹 袁孟娟 韩军 陈芳
(聊城大学药学院,聊城252059)
丹参根腐病生防芽孢杆菌2-1海藻菌剂的研制
周莹 袁孟娟 韩军 陈芳
(聊城大学药学院,聊城252059)
以海藻渣为载体,菌种为丹参根腐病生防菌:枯草芽孢杆菌Bacillus subtilis2-1(已保存CGMCC No.9256),研制成的海藻菌剂兼具营养及生物防治功能,同时菌剂的基本指标符合农用微生物菌剂产品的技术指标。用物理方法选择菌种发酵液与海藻渣混合的最佳配比,结合农用微生物菌剂产品质量检测方法对菌剂中有效活菌数、含水量、pH值及有效期进行测定,并进行大田试验,测试生防效果。菌剂有效活菌数为2.32×109/g,含水量为6.75%,pH值为6.7,常温下有效期约为11.6个月,均符合颗粒菌剂的技术指标,大田试验中根腐病的发病率比空白对照组降低37.6%,生防效果较为显著。
根腐病;生防菌;海藻菌剂;制备
非致病性枯草芽孢杆菌2-1是从本地感染根腐病的丹参根际土壤筛选分离得出,对丹参根腐病具有生物防治作用的一种生防菌,生防机制是该枯草芽孢杆菌的代谢产物对丹参根腐病病原菌——腐皮镰刀菌(Fusarium solani)[1,2]具有抑制作用[3-7]。根腐病作为一种严重的根茎类病害,对中药材的品质及产量都造成了很大的影响(图1,图2)。一直以来,人们对丹参根腐病的防治大都依赖化学药剂及一些合理的耕作管理方法,但作为一种不易根治的土传病害,根腐病一旦病发,就需施用大量药物,一方面造成了环境污染,另一方面还影响了中药材的出口贸易[8-10]。由此可见,生物农药的推广是我国农业可持续发展的迫切需求。生物防治具有环保无污染的特点,因此将生防菌剂应用到中药材根腐病的防治中意义重大[11,12]。目前用于防治根腐病的生防菌剂在国内外还较为少见,国内登记的微生物农药主要用于小麦全蚀病、水稻和小麦纹枯病及果蔬枯萎病,其中有两种生防菌剂用于防治根腐病,分别为“百抗”和“根腐消”,且都是用于三七根腐病[13],但针对丹参根腐病的生防菌剂还未见报道,故值得深入研究。海藻渣中含粗蛋白约20%,粗纤维约50%,灰分约3%,海藻渣中还含特有的有效活性成分,不仅使其成为优良的有机肥,还可以作为生防菌的载体应用到农业生产中。本试验利用物理方法及生物方法制备出的海藻生防菌剂,兼具海藻营养及生物菌剂的活体调节功能,实现了促进植物生长,防治根腐病害的双赢目的。

图1 感染根腐病丹参根部(左)与正常丹参根部(右)

图2 根腐病丹参根部纵剖图
1 材料与方法
1.1 材料
1.1.1 培养基 LB固体培养基及LB液体培养基(配制方法略)。
1.1.2 菌种及海藻 实验室保存枯草芽孢杆菌2-1,无菌鲜海藻渣由青岛明月海藻公司提供。
1.1.3 仪器与设备 立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂(BXM-30R);电热恒温鼓风干燥箱:苏州江东精密仪器有限公司(DGG-9070A);实验室pH计:梅特勒-托利多仪器(上海)有限公司(FE20);快速水分测定仪:Metrohm Herisau S(885 Compact OvenSC);漩涡混合器:IKA LAB DANCER(07.433333);超净工作台:江苏通净净化设备有限公司(SW-CJ-2FD);恒温培养箱:上海新苗医疗器械制造有限公司(QYC-2102C);生化培养箱:上海新苗医疗器械制造有限公司(SPX-150BSH-Ⅱ);电子天平:奥豪斯仪器(上海)有限公司(GB/T26497);微波炉:广东格兰仕微波炉电器制造有限公司(G70D20CNIP-D2CSO);1 mL、0.1 mL移液枪:德国,Eppendorf。
1.2 方法
1.2.1 接种发酵 在无菌操作条件下,用0.1 mL移液枪将保存在甘油管中的菌种接种到LB液体培养基中。将接种完毕的三角瓶置于30℃恒温箱中,转速160 r/min,培养18 h。
1.2.2 发酵液菌种单一性鉴定 在无菌条件下,取1 mL菌液进行梯度稀释,取10-8浓度的菌悬液0.1 mL,在LB固体培养基平板上进行涂布。室温下静置5-10 min后,倒置于恒温培养箱,30℃过夜培养。观察菌落形态是否一致,包括色泽、是否有褶皱、致密或者疏松、质地、边缘沟纹等。细菌鉴定参照《常见细菌系统鉴定手册》[14,15]。随机挑取几个菌落制片,分别经革兰氏、芽孢染色,显微镜下观察菌体大小及颜色是否一致。
1.2.3 鲜海藻渣水分测定 取适量鲜海藻渣,用卡式快速水分测定仪测定其水分含量。
1.2.4 海藻菌剂初成品制备 选含水30%的海藻渣作为制备初成品的载体,按1 mL发酵菌液分别对应2 g,3 g,4 g,5 g含水30%海藻渣(后面简称1∶2,1∶3,1∶4,1∶5)的比例,计算出各比例需要的原鲜海藻渣,将菌液与海藻渣混合均匀,难以混合均匀时需加适量无菌水。放入25℃恒温干燥箱中干燥至含水30%。
1.2.5 最佳配比的确定 用电子天平准确称取1.000 g初成品菌剂,放入9 mL无菌水中,充分溶解后作梯度稀释。在无菌条件下,分别取10-6、10-7、10-8[16,17]浓度的菌悬液0.1 mL,在LB固体培养基平板上进行涂布并标记。室温下静置5-10 min后,倒置于30℃恒温培养箱中培养24 h。观察菌落成长情况,确定菌液与海藻渣的最佳配比。
1.2.6 含水量的测定 将初成品的海藻菌剂,置于室内自然风干2 d成颗粒成品,取适量测定其水分含量。
1.2.7 pH值的测定 将颗粒成品研过1.00 mm试验筛,称取过筛样品粉末15 g,放入50 mL的烧杯中,按1∶5的比例用去离子水溶解样品,搅拌均匀。然后静置30 min,测样品上清液的pH值,仪器读数稳定后记录,重复测试3次求平均值。
1.2.8 有效期的测定 取1 g菌剂于常温(25℃)、50℃、70℃下的恒温干燥箱中保存,然后间隔一定时间(0、8、24、36、60、84 h)后取样。根据在50℃、70℃及常温3个温度下进行加速试验所测得的活菌数,参照温度加速法,对有效期进行测定[18]。细菌死亡属于热力学一级速度过程[19],在一定条件下符合下述方程:
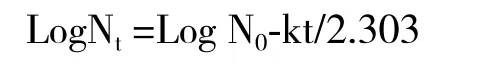
其中N0为原始菌体数,Nt为t时残存的菌体数,k为速度常数,用LogN对t作图,即可得斜率,求出各温度下的速度常数k值。
加速试验中的经典恒温法的理论依据是指数定律[20],其对数形式为:

其中A为频率因子,Ea为反应活化能,T为绝对温度,R为气体常数。以Logk对1/T作图得斜率-Ea/2.303 R,及Y轴截距LogA,即可得出活化能Ea,A值,带回原式即可求得常温下菌剂的贮存期。
1.2.9 大田试验 将制备好的海藻颗粒菌剂按20 g/m2在丹参生长过程中施用3次,并设置多菌灵药液对照组及空白对照组[21]。统计各组发病率及丹参实际产量。
2 结果
2.1 发酵液菌体单一性鉴定
观察菌落,基本特征一致,均为枯草芽孢杆菌的特征:菌落呈圆形,表面粗糙不透明,污白色,中间褶皱,边缘波纹状,经革兰氏染色均呈阳性,芽孢染色可见呈现绿色的椭圆或柱状的芽孢体。菌体颜色大小均一致。
2.2 海藻菌剂初成品制备
经测定鲜海藻渣的含水量为87.3%,按4个比例做成的初成品如图3、图4所示。重复多次平行试验后,得出1∶4为最佳比例(图5-图8),即1 mL菌液对应4 g含水30%的海藻渣时,有效活菌数≥2.32×109/g,符合农用微生物菌剂产品的技术指标,(指标要求:颗粒制剂有效活菌数需≥1× 108/g,见附录)。

图3 菌液与海藻渣混匀

图4 干燥至含水30%的初成品

图5 1∶2比例菌落生长情况

图6 1∶3比例菌落生长情况

图7 1∶4比例菌落生长情况

图8 1∶5比例菌落生长情况
2.3 含水量测定
经卡氏快速水分测定仪对静置干燥后的成品含水量进行测试,测得含水量为6.75%,符合农用微生物菌剂产品的技术指标,(指标要求:颗粒制剂水分含量需≤20%,见附录)。
2.4 pH值测定
用pH计测得pH平均值为6.7,符合农用微生物菌剂产品的技术指标,(指标要求:颗粒制剂pH值范围为5.5-8.5,见附录)。
2.5 有效期测定
分别在常温(25℃),50℃,70℃三个温度下,不同时间点取样品对其中有效生防菌数量进行测定(表1-表3),并绘制各时间点活菌数的自然对数Log(N,%)对时间(t)图(图9-图11),分别得到各个温度时的一元线性回归方程,K值及LogK值(表4)。

表1 25℃加速试验各时间点样品的测定结果

表2 50℃加速试验各时间点样品的测定结果

表3 70℃加速试验各时间点样品的测定结果

图9 25℃ Log(N,%)/t线性回归图
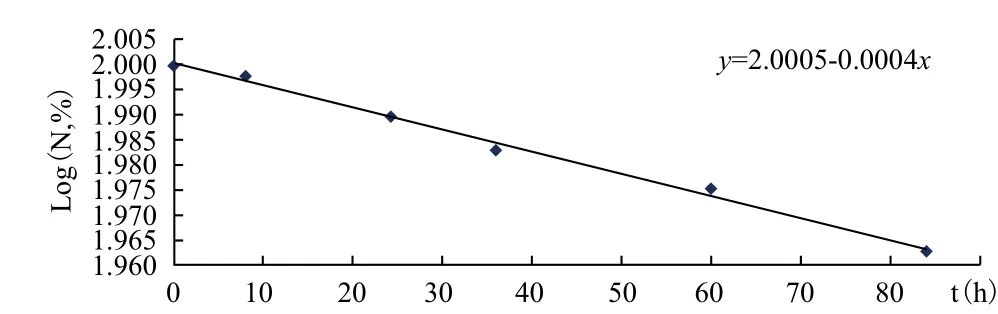
图10 50℃ Log(N,%)/t线性回归图

图11 70℃ Log(N,%)/t线性回归图

表4 生防芽孢杆菌在不同温度条件下的回归方程
再对Logk对1/T做线性回归图(图12),运用Arrhenius方程计算得出Ea值为4 318.85,A值为730.5,并计算出海藻菌剂的有效期为8 384 h约为11.6个月,符合农用微生物菌剂产品的技术指标,(指标要求:颗粒制剂保质期需≥6个月,见附录)。

图12 Logk对1/T的线性回归图
2.6 大田试验结果
试验统计,施用海藻菌剂的丹参长势明显好于多菌灵组及空白组,根腐病发病率比空白组降低约37.6%,与多菌灵效果相当,但施用海藻菌剂的丹参实际产量要明显高于多菌灵组及空白组,分别高出11%,18.4%,说明海藻颗粒菌剂的生防及营养效果均较好。
3 讨论
枯草芽孢杆菌抗逆性强,易于定殖,能产生多种抗菌素和酶,具有广谱抗菌活性[22-24]。目前国内外已有将其成功用于植物病害防治的报道。在我国,已登记的防治土传病害的微生物农药有14种,其中以枯草芽孢杆菌为生防菌的有6种,主要用于水稻和小麦纹枯病的防治[25],近几年已迅速推广应用到番茄青枯病、棉花黄萎病、辣椒枯萎病、西瓜枯萎病、烟草黑胫病、水稻稻瘟病及甘蓝黑腐病等各种作物或果蔬的严重病害[26]。国外应用枯草芽孢杆菌防治植物病害较成功的实例有美国Agraquest公司用QST713菌株和QST2808菌株分别开发出活菌杀菌剂SerenadeTM和Sonata AS,并于2000年登记,用于防治蔬菜、樱桃、葡萄、葫芦和胡桃等多种作物的白粉病、霜霉病、疫病及灰霉病等[27]。其他国家也有用于防治马铃薯、玉米、蔬菜类和观赏植物的真菌病害的枯草芽孢杆菌菌剂[28]。可见,枯草芽孢杆菌用于生物防治已深受认可。大多数的生物菌剂为粉剂或液体,颗粒菌剂较少,海藻作为一种优良的菌剂载体,近几年愈发受到关注,本试验将根腐病生防枯草芽孢杆菌吸附于海藻渣后制备颗粒菌剂,并对初成品的物理及生物指标进行了测定,效果良好,推动了丹参根腐病害的生物防治研究。
4 结论
经初步测定,海藻生防菌剂的水分含量,pH值,有效期等均符合农用颗粒微生物菌剂产品的技术指标,说明海藻渣作为菌剂载体的效果是较好的。且在大田试验中,海藻颗粒菌剂的生防效果与多菌灵效果相当,营养助长效果明显。目前已有一些企业在探索海藻菌肥的研发并运营至市场,作为一种将营养与生物防治于一体的复合菌剂,海藻菌剂有着广大的应用前景,值得深入研究。

附录:农用微生物菌剂产品的技术指标(中华人名共和国国家标准GB 20278-2006,2006年9月1日起实施)
[1]徐同, 钟静萍, 李德葆.木霉对土传病原真菌的拮抗作用[J].植物病理学报, 1993, 23(1):36-37.
[2]Kerr A, Biggs J, Ophel K.Biological control of crown gall[A].Proc Int Symp on Biological Control of Plant Diseases[C].1994.11-26.
[3]刘雪, 穆常青, 蒋细良, 等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治学报, 2006, 22(增刊):179-184.
[4]程洪斌, 刘晓桥, 陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J].上海农业学报, 2006, 22(1):109-112.
[5]任争光, 刘媛, 刘素花, 等.芽孢杆菌BJ-6的抗菌物质及其抑菌作用[J].北京农学院学报, 2006, 21(3):49-52.
[6] 张彦杰, 罗俊彩, 武燕萍, 杨合同.生防枯草芽孢杆菌研究进展[J].生命科学仪器, 2009, 7(4):19-23.
[7] 别小妹, 陆兆新.影响枯草芽孢杆菌fmbR菌株抗菌物质提取的主要因子[J].南京农业大学学报, 2005, 28(4):26-29.
[8] 李琼芳, 曾华兰, 叶鹏盛, 等.哈茨木霉(Trichoerma harzianum)T23生防菌筛选及防治中药材根腐病的研究[J].西南大学学报:自然科学版, 2007, 29(11):119-122.
[9] Harling R, Sutton M. Spear rot of Calabrese fact sheet 13/02,Horticultural Development Council. East Malling, Kent, UK. 2002.
[10] Darling D. Bacterial head rot of broccoli:Pathogenicity and host susceptibility[D]. Scolland, UK:1998.
[11]王进强, 吴刚, 许文耀.植物病害生防制剂的研究进展[J].福建农林大学学报:自然科学版, 2004, 33(4):448-452.
[12]刘士旺, 郭泽建.生防制剂与诱导植物抗病性[J].西北农林科技大学学报:自然科学版, 2005, 33(8):209-214.
[13]陈昱君, 王勇, 刘芸芝, 等.生物菌剂控制三七根腐病的初步研究[J].中国中药杂志, 2004, 29(11):1102-1103.
[14] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社:2001:267-388.
[15] 中国科学院微生物所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社, 1978.
[16] 戚薇, 陈莹, 王建玲, 等.高浓度凝结芽孢杆菌粉剂的研究及特性研究[J].天津轻工业学院学报, 2003, 2(18):1-4.
[17] Glick BR, Jacobson CB, SchwarzeMMK.1-Aminocyclopropane-1-carboxylic acid deaminase mutants of the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 do not stimulate canola root elongation[J].Canadian Journal of Microbiology,1994, 40(11):911-915.
[18] 李凡, 徐建军, 倪海峰, 等.运用经典恒温加速实验法推断维生素C注射液的贮存期[J].宁夏石油化工, 2001, 6(3):23-24.
[19] 杜连祥.工业微生物学实验技术[M]. 天津:天津科学技术出版社, 1992, 3:273.
[20] 张传志, 巩传国, 赵吉兵, 等.维生素C注射液有效期的测定[J].齐鲁药事, 2004, 8(23):26-27.
[21] 叶鹏盛, 曾华兰, 江怀仲, 李琼芳.丹参根腐病及其微生物防治研究[J].世界科学技术, 2003, 5(2):63-66.
[22] Cazorla FM, Romero D. Isolation and characterization of antagonistic Bacillus subtilis strains from the avocado rhizoplane displaying biocontrol activity[J].J Appl Microbiol, 2007, 103:1950.
[23] 李丽梅, 高丙利, 柳东, 等.抗黄瓜灰霉病的枯草芽孢杆菌筛选及其抑菌活性的初步研究[J].天津科技大学学报, 2012,27(3):14.
[24] Luo Y, Sun L, Zhu Z, et al. Identification and characterization of an anti-fungi Fusarium oxysporum f.sp.cucumerium protease from the Bacillus subtilis strain N7[J].J Microbiol, 2013, 51(3):359.
[25] 黄海婵, 裘娟萍.枯草芽孢杆菌防治植物病害的研究进展[J].浙江农业科学, 2005(3):213-215.
[26] Kloepper JW, Ryu CM, Zhang S. Induced systemic resistance and promotion of plant growth by Bacillus spp[J].Phytopathology,2004, 94(11):1259-1266.
[27] Turner JT, Backman PA. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis[J]. Plant Disease,1991, 75(4):347-353.
[28] Kilian U, Steiner B, Krebs B, et al. FZB24(r)Bacillus subtilis mode of action of a microbial agent enhancing plant vitality[J]. Pflanzenschutz Nachrichten Bayer, 2000, 53(1):72-93.
(责任编辑 李楠)
Preparation of Algae Agents for S. miltiorrhiza Bunge Root Rot Biocontrol Bacillus subtilis2-1
Zhou Ying Yuan Mengjuan Han Jun Chen Fang
(School of Pharmaceutical,Liaocheng University,Liaocheng 252059)
With algae residue as carrier, S. miltiorrhiza bunge root rot biocontrol agents: Bacillus subtilis2-1(CGMCC No.9256),were developed into algae agents, which features both nutritional and cell biological control function, also in line with the basic indicators of agricultural products, technical indicators microbial agents. Then appropriate ratio of seaweed broth and residue was chosen by physical means. Besides, the number of viable cells, moisture content, pH value and expiration date were measured by agricultural product quality testing methods, and field experiments was conducted to test biocontrol effect. Results showed that number of effective viable agents was 2.32×109/ g, moisture content was 6.75%, pH value was 6.7, and the expiration date was about 11.6 months , all of which were in line with the technical specifications of the particles. The incidence of root rot in field trials rate decreased 37.6% compared with the blank control group, the effect of biocontrol was obvious.
root rot;biocontrol;algae agents;preparation
10.13560/j.cnki.biotech.bull.1985.2015.01.025
2014-09-28
山东省自然科学基金项目(ZR2013CQ019),聊城大学博士科研启动基金项目(3010)
周莹,女,硕士研究生,研究方向:生物制药,E-mail:hebe11183@yeah.net
陈芳,女,博士,副教授,研究方向:微生物制药,E-mail:chenfang20045@163.com
