耐盐碱石油烃降解菌的筛选、鉴定及其耐盐碱性研究
2015-10-25张海荣唐景春孙克静张清敏
张海荣 唐景春 孙克静 张清敏
(南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市城市生态环境修复与污染防治重点实验室,天津300071)
耐盐碱石油烃降解菌的筛选、鉴定及其耐盐碱性研究
张海荣 唐景春 孙克静 张清敏
(南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市城市生态环境修复与污染防治重点实验室,天津300071)
从大港油田区石油污染盐碱化土壤和油泥中筛选得到10株耐盐碱石油烃降解菌,通过形态特征、生理生化特征和16S rRNA序列分析确定这些菌株为苍白杆菌属、葡萄球菌属、迪茨菌属、棒状杆菌属、无色杆菌属、微杆菌属、芽孢杆菌属。通过液体培养试验,研究了10株菌的耐盐碱能力。结果表明,除B07仅能耐受3%盐度外,其他菌株均能耐受5%或者更高的盐度环境,其中B02和B05在盐度高达11%时仍具有较高的生长活性;10株菌均能耐受pH为9的碱度环境,B01、B03、B04、B06、B09能耐受pH为10的环境,其中,B03和B04在pH为11时仍具有较高的生长活性。研究表明石油烃降解菌在不同微生物种属中广泛存在,并具有较好的耐盐碱特性,有望在石油污染盐碱化土壤修复中广泛应用。
耐盐碱;石油污染;土壤;石油烃降解菌;生物修复
土壤石油污染是一个世界各国普遍关注的环境问题。在油田的勘探、开采以及油品的储存、运输和使用过程中发生的各种漏油事故,对土壤造成了严重的石油污染[1]。土壤石油污染不仅能够破坏土壤,还能够向下渗透污染地下水,挥发到空气中污染空气,并直接影响到人体健康[2]。
微生物降解是修复石油污染土壤的一种既有效又经济环保的方法,国内外对于微生物修复石油污染土壤的成功实例已有很多报道[3,4],但是石油污染土壤常常是高盐碱环境,抑制了传统非耐盐碱微生物的生长代谢,使生物降解效果降低甚至消失[5]。因此筛选优良的耐盐碱石油烃降解菌,是修复石油污染盐碱化土壤的首要前提[6-8]。
本研究从长期受石油污染的大港油田区石油污染盐碱土壤和油泥中,筛选到了多株具有耐盐碱性能的石油烃降解土著微生物,通过形态观察、生理生化特征和16S rRNA序列比对对其进行鉴定,并考察这些菌株的耐盐碱情况,以期为石油污染盐碱土壤的生物修复提供依据。
1 材料与方法
1.1 材料
1.1.1 原油培养基 在250 mL锥形瓶中加入100 mL无机盐培养基,并加入所需量的原油,用硅胶塞封口,然后蒸汽(121℃)灭菌15 min。
1.1.2 无机盐培养基(M9MM)配方(1 L) 8.5 g Na2HPO4·2H2O,3.0 g KH2PO4,1.0 g NH4Cl,0.49 g MgSO4·7H2O,0.011 g CaCl2,NaCl的量根据需要加入。微量元素:0.4 mg CuSO4,1.0 mg KI,4.0 mg MnSO4·H2O,4.0 mg ZnSO4·7H2O,5.0 mg H3BO3,1.6 mg H2MoO4·2H2O,2.0 mg FeCl3·6H2O。其中1 mol/L的MgSO4·7H2O和1 mol/L的CaCl2分开灭菌之后再加入培养基中[9]。pH值根据需要调节。
1.1.3 LB培养基配方(1 L):10 g胰蛋白胨,5 g酵母提取物,10 g NaCl,pH7.0-7.2。
1.2 方法
1.2.1 耐盐碱原油降解菌的富集、分离与保存 分别称取10 g石油污染土壤和10 g油泥(均采自大港油田),无菌操作将其接种于灭过菌的盛有90 mL无机盐培养基的250 mL锥形瓶中,30℃、160 r/min条件下,振荡培养7 d,然后取富集液10 mL接种于新鲜原油无机盐培养基中,相同条件连续培养4-5次。驯化过程中培养基的pH、盐度和原油(采自大港油田)含量逐渐升高,具体条件如表1所示。
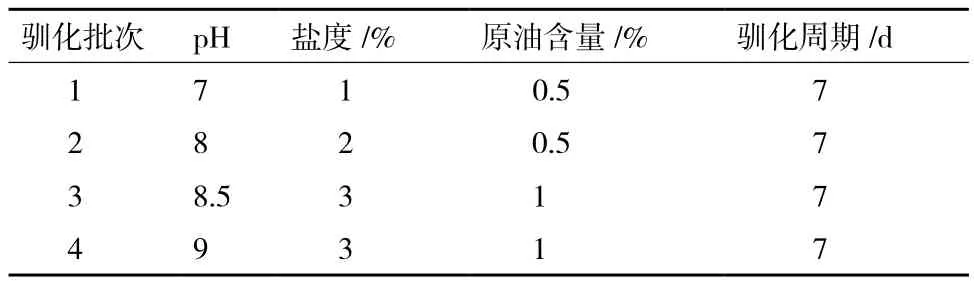
表1 驯化过程中的各参数设置
取驯化完成之后的培养液梯度稀释后涂布于LB-琼脂平板,待菌落长出后,挑取不同形态的单菌落,并划线纯化,分离单菌。再将分离纯化完成之后的单菌挑入LB液体培养基中,培养至对数生长期,5 000 r/min离心5 min,用0.85%的氯化钠溶液冲洗两次来除去剩余的碳源[10],用该氯化钠溶液重悬至原体积,梯度稀释后涂布于M9MM-琼脂平板,然后取少量灭菌原油涂布于该平板上,恒温培养箱中30℃培养3-5 d,观察是否有菌落长出,以及菌落和溶油圈的大小。
甘油保存:挑取能够在油平板上生长的菌株接种于LB培养基,长至对数期,在灭过菌的2. 0 mL离心管中加750 μL活化后的培养液和750 μL灭过菌的50%甘油,旋涡5 min混匀,然后将离心管做好标记置于-80℃冰箱中保存。
1.2.2 菌株形态观察 在OPTEC解剖镜下观察每种菌株在LB-琼脂平板和M9MM-琼脂平板上的菌落形态。革兰氏染色,并在显微镜(OLYMPUS CX31)下1 000×油镜镜检观察细菌的形态。
1.2.3 菌株鉴定 利用OMEGA bio-tec细菌DNA提取试剂盒D3350-01对每种菌株的基因组DNA进行提取。提取结果通过1%的琼脂糖凝胶电泳来监测。
对提取的DNA进行16S rRNA PCR扩增,所用引物为:27F(5'-AGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGCTACCTTGTTACGACTT-3')[11]。PCR反应体系(50 μL)(原料购自北京全式金生物技术有限公司)为:3 μL模板DNA,5 μL 10×EasyTaq® Buffer,4 μL dNTPs(2.5 mmol/L),1 μL EasyTaq® DNA Polymerase,27F、1492R各1 μL,35 μL ddH2O。PCR扩增条件为:94℃预变性5 min;94℃预变性1min,退火温度从65℃到55℃,每个循环降低1℃,72℃延伸1min,共10个循环;然后94℃变性1 min,55℃退火1 min,72℃延伸1 min,共25个循环;再72℃延伸7 min。用1%琼脂糖凝胶电泳监测PCR产物。
将16S rRNA PCR产物送至北京华大科技有限公司测序,使用EzBioCloud(http://www.ezbiocloud. net/eztaxon)在线比对序列,确定该菌株的近缘模式种及其相似性。从GenBank中调取与分离菌株最相似的菌株序列构建系统发育树,用Mega6.06软件包中的Kimura 2-Parameter Distance模型进行多序列匹配排列,以邻接法(Neighbor-Joining Method)重复1 000次计算构建16S rRNA系统发育树。
1.2.4 菌株的生长曲线 将菌株接种至LB培养基中,30℃、180 r/min摇床培养,根据菌株生长快慢的不同选取不同的时间间隔取样(B01、B02、B05、B06、B07和B09为2 h,B08为3 h,B04和B05为12 h),测定菌液的吸光度OD(λ=600 nm),以时间与OD600做每种菌的生长曲线。
1.2.5 菌株耐盐试验 以LB液体培养基为基础,将NaCl浓度分别设置为5、10、20、30、50、70、90和110 g/L,接种量为1%,pH调至7.0-7.2,30℃、180 r/min恒温摇床培养至对数期,于600 nm波长处测定吸光度OD值。
1.2.6 菌株耐碱试验 以LB液体培养基为基础,将pH值分别设置为5、6、7、8、9、10和11,盐度设置为1%,接种量为1%,30℃、180 r/min恒温摇床培养至对数期,于600 nm波长处测定吸光度OD值。
2 结果
2.1 石油降解菌的筛选
通过在M9MM-琼脂原油平板上涂板培养,能够在以原油为唯一碳源的平板上长出菌落的菌株被认为具有降解原油的作用,试验共获得10株石油降解菌,石油污染土壤中获得5株(编号为B01、B02、B03、B04和B05),油泥中获得5株(编号为B06、B07、B08、B09和B10),原油平板图片(图1)(取部分)显示,菌株在以原油为唯一碳源的培养基上能够较好地生长,且B05菌落周围具有明显的溶油圈,说明其生长过程中可能产生了生物表面活性剂。

图1 B01、B03、B05、B07在以原油为唯一碳源的油平板上的生长情况
2.2 菌株形态观察
10株菌在LB-琼脂平板上的菌落形态如表2所示。由表可知,B01、B06、B07、B08为革兰氏阴性菌,其余为革兰氏阳性菌。B01、B02、B05、B06、B07和B10在LB-琼脂平板上的菌落为白色或乳白色;B03和B09为橘红色;B04为橘黄色;B08为黄色。除B05和B10菌落表面干燥之外,其他菌株菌落表面均湿润。除B10菌落形状不规则,其他菌菌落为圆形。
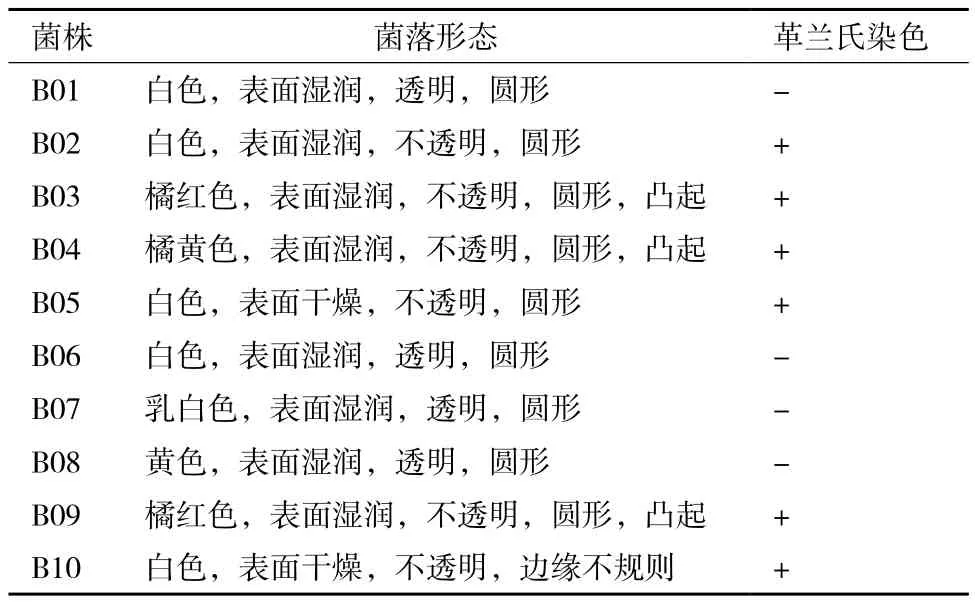
表2 耐盐碱石油烃降解菌的菌落形态
10株菌革兰氏染色后的镜检部分结果如图2所示,其中,B01、B06和B07菌株形态相似(图2中B01),为革兰氏阴性杆菌,菌体长度为2.0 μm左右;B02为革兰氏阳性球菌,菌体直径为1.0 μm左右;B03、B04和B09菌株形态相似(图2中B04),为革兰氏阳性短杆菌,菌体长度为1.0 μm左右;B05为革兰氏阳性杆菌,菌体长度为1.5 μm左右;B08为革兰氏阴性短杆菌,菌体长度为0.5 μm左右;B10为革兰氏阳性杆菌,菌体长度为2.5 μm左右,菌体中间可看出有浅色芽孢存在。

图2 革兰氏染色后1000×显微镜下观察到的细菌形态
2.3 石油降解菌的分子生物学分析
10株菌的DNA提取和16S rRNA PCR产物电泳结果(图3)显示,所有的电泳条带均很亮,说明10株菌的DNA提取以及16S rRNA PCR结果成功。
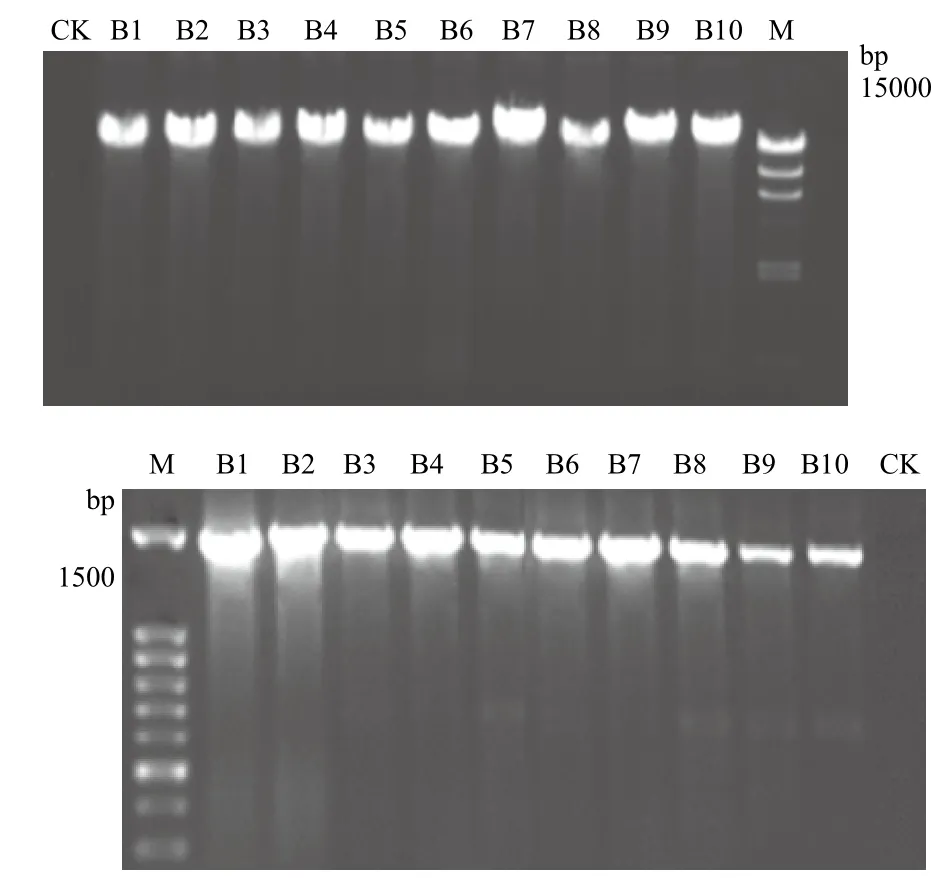
图3 10株菌的DNA提取和16S rRNA PCR产物电泳图

表3 石油烃降解菌的16SrRNA基因序列鉴定结果
10株耐盐碱石油降解菌的16S rRNA基因序列通过在EzBioCloud中在线比对,得到每株菌的近缘模式种及相似性结果(表3)显示,经筛选所获得的10株耐盐碱石油烃降解菌与GenBank中已知的16S rRNA基因序列有较高的同源性,同源性在98.5%以上。利用MEGA6.06软件构建10株菌和GenBank中亲缘关系较近菌株的系统发育树(图4)显示,B01和B07属于苍白杆菌(Ochrobactrum)属,B02为葡萄球菌(Staphylococcus)属,B03、B04和B09为迪茨菌(Dietzia)属,B05为棒状杆菌(Corynebacterium)属,B06为无色杆菌(Achromobacter)属,B08为微杆菌(Microbacterium)属,B10为芽孢杆菌(Bacillus)属。
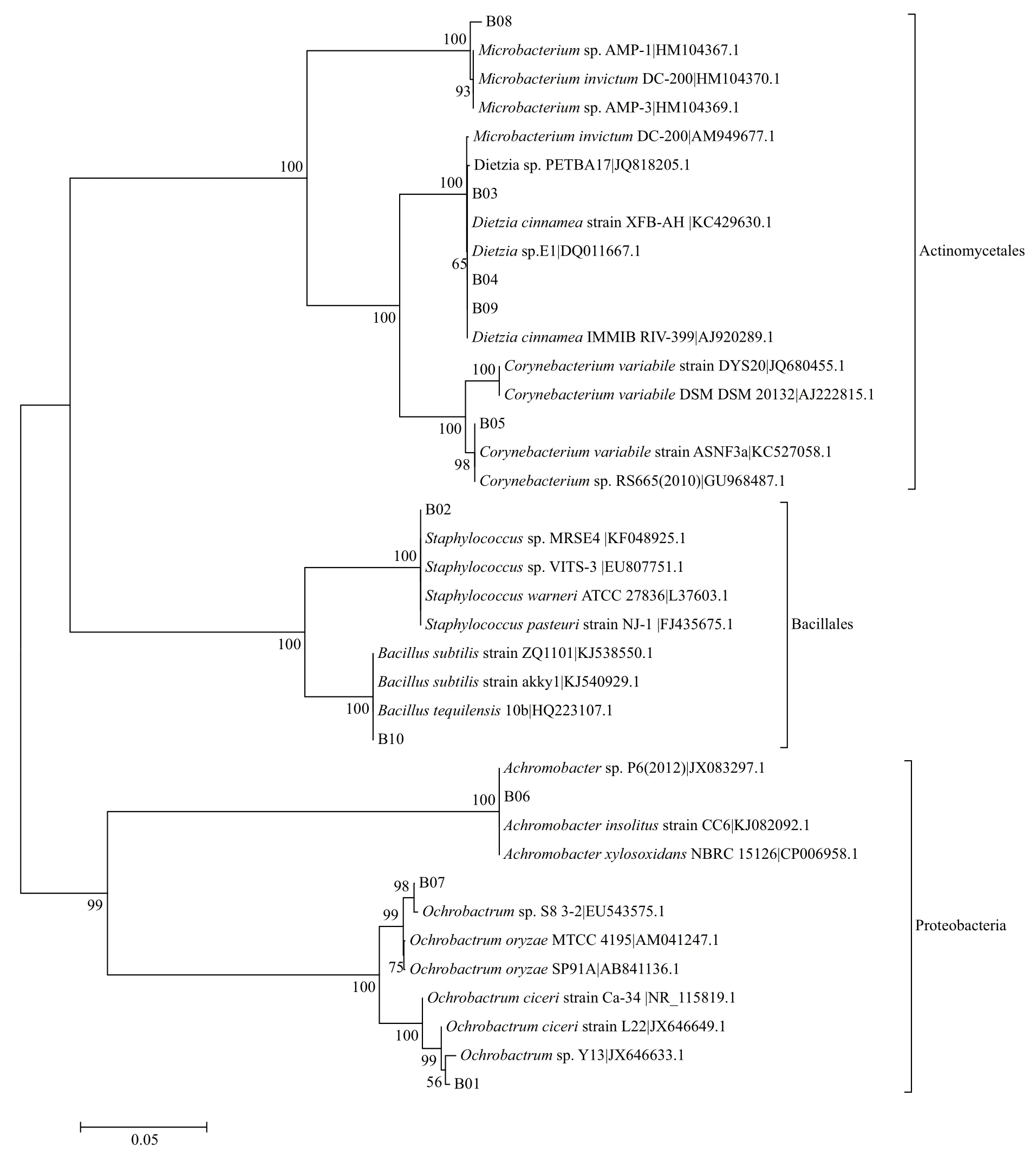
图4 10株耐盐碱菌基于16S rRNA序列的系统发育树
2.4 菌株的生长曲线以及耐盐碱结果
2.4.1 生长曲线 10株菌的生长曲线如图5显示,B01、B02指数期在8 h左右,12 h之后进入平衡期;B05、B06、B07和B09指数期在12 h左右,16 h之后进入平衡期;B08指数期在20 h左右,27 h之后进入平衡期;B03、B04和B09指数期在72 h左右,48 h之后进入平衡期。结果表明B1、B2、B5、B6、B7和B8生长较快,B3、B4和B9生长较慢,微生物的不同生长情况可为微生物的实际应用价值提供重要参考。
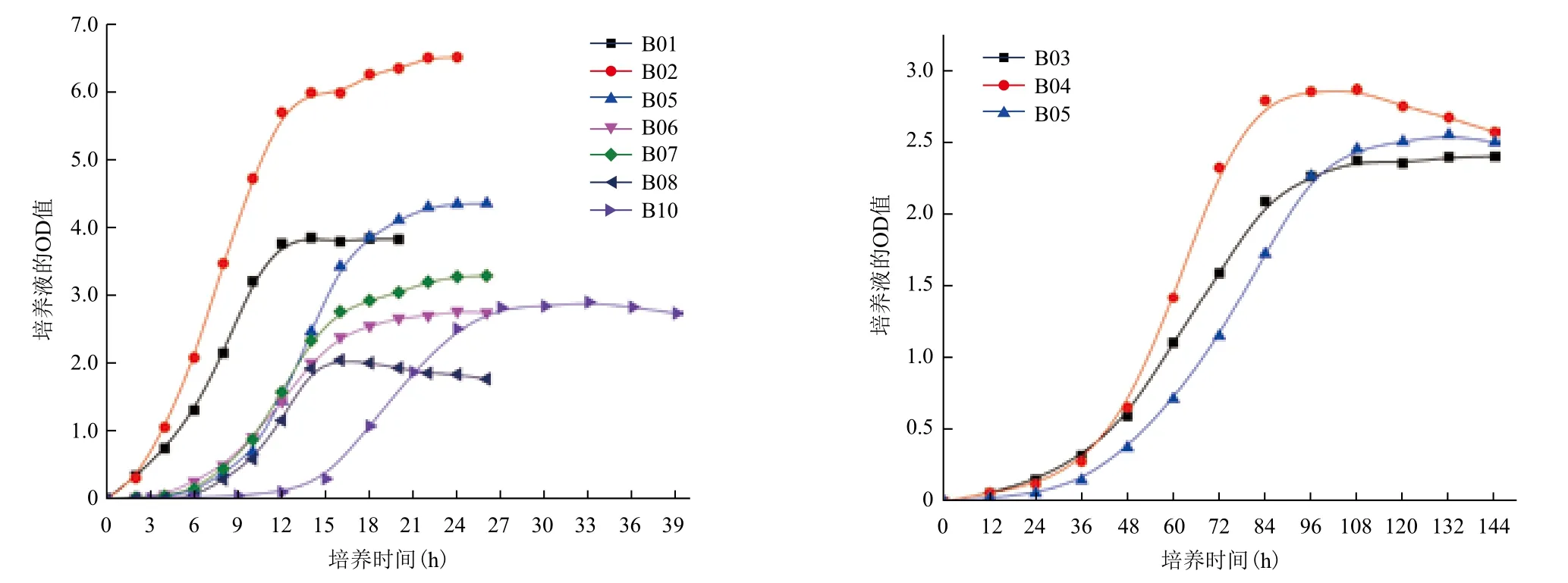
图5 10株耐盐碱菌株的生长曲线
2.4.2 菌株的耐盐性 10株菌的耐盐性检测结果(图6)显示,10株菌的最适盐度都在2%左右,且在盐度≤3%时均具有较好的生长活性。其中B05在盐度<3%时随盐度增加生长活性逐渐增加,在3%<盐度<7%时生长活性基本不变,盐度>7%时生长活性开始呈下降趋势,但直到盐度为11%时,B05菌具有较高的生长活性,说明B05的耐盐能力非常强;B10在盐度<7%时,随盐度的增加菌株的生长活性逐渐增大,但当盐度>7%时,菌株的生长活性急剧下降,说明B10为嗜盐菌,但其最高耐受盐度为7%;当盐度>3%时,B02、B03、B04、B09生长活性呈逐渐下降的趋势,但并没有急剧下降;B01、B06、B07、B08均是当盐度大于某一值时,生长活性急剧下降,其中B01在2%<盐度<5%时下降比较缓慢,盐度>5%生长活性急剧下降,认为当盐度>5%时B01不能生长。同理,B06当盐度>5%不能生长,B07在盐度>3%时不能生长,B08在盐度>5%时生长活性极低,在盐度>7%时不能生长。综合上述分析,B02、B03、B04、B05、B09和B10具有较好的耐盐性能。
2.4.3 菌株的耐碱性 10株菌的耐碱性检测结果(图7)显示,10株菌在6<pH<9时均具有较高的生长活性,除B05、B07、B10的最适pH为7外,其他菌的最适pH均在8。其中B03、B04在pH≥11时仍具有较高的生长活性,说明其耐碱性能非常强;B01在pH<10时生长活性基本不变,说明B01的耐碱能力也较强。当pH>10时生长活性急剧下降,说明当pH>10时,B01不能生长;B02和B08在pH>8时,生长活性开始下降,但当pH为9时,菌株仍具有较高的生长活性,pH为10时生长活性较低,pH为11时,菌株不能生长;B06和B09在pH>9时,生长活性开始下降,但当pH为10时,菌株仍具有较高的生长活性,pH为11时,菌株不能生长;B05、B07、B10能够耐受pH为9的条件,当pH≥10时,菌株不能生长。综合上述分析,除B02和B08外,其他8种菌均具有较好的耐碱性能。
3 讨论
本研究从天津大港油田区石油污染盐碱土壤及油泥中筛选出10株耐盐碱石油烃降解菌,通过16S rRNA序列分析确定10株菌分别为苍白杆菌(Ochrobactrum)属,葡萄球菌(Staphylococcus)属,迪茨菌(Dietzia)属,棒状杆菌(Corynebacterium)属,无色杆菌(Achromobacter)属,微杆菌(Microbacterium)属,芽孢杆菌(Bacillus)属。根据之前的文献报道,苍白杆菌属[12-14]、葡萄球菌属[14,15]、迪茨菌属[16-19]、棒状杆菌属[20,21]、无色杆菌属[22-24]、微杆菌属[25]、芽孢杆菌属[26,27]均具有在高盐碱环境下降解石油烃的能力。
迄今为止,对于石油烃降解菌的筛选和鉴定的报道非常多,但对于高耐盐碱石油烃降解菌的报道还不是很多,宋立超等[28]通过筛选耐盐碱PAHs高效降解菌并通过固定化、添加表面活性剂的方法有效治理了盐碱地石油污染土壤;张竹圆等[29]在辽河口湿地土壤中筛选到两株耐盐碱石油烃降解菌,对石油中所有正构烷烃的去除率均在85%以上;Nicholson等[30]筛选得到的嗜盐微生物菌群对俄克拉荷马州石油区石油烃污染盐土具有较好的处理效果。微生物的耐盐碱性能决定了其在自然环境中修复石油污染盐碱化土壤的效果[31]。
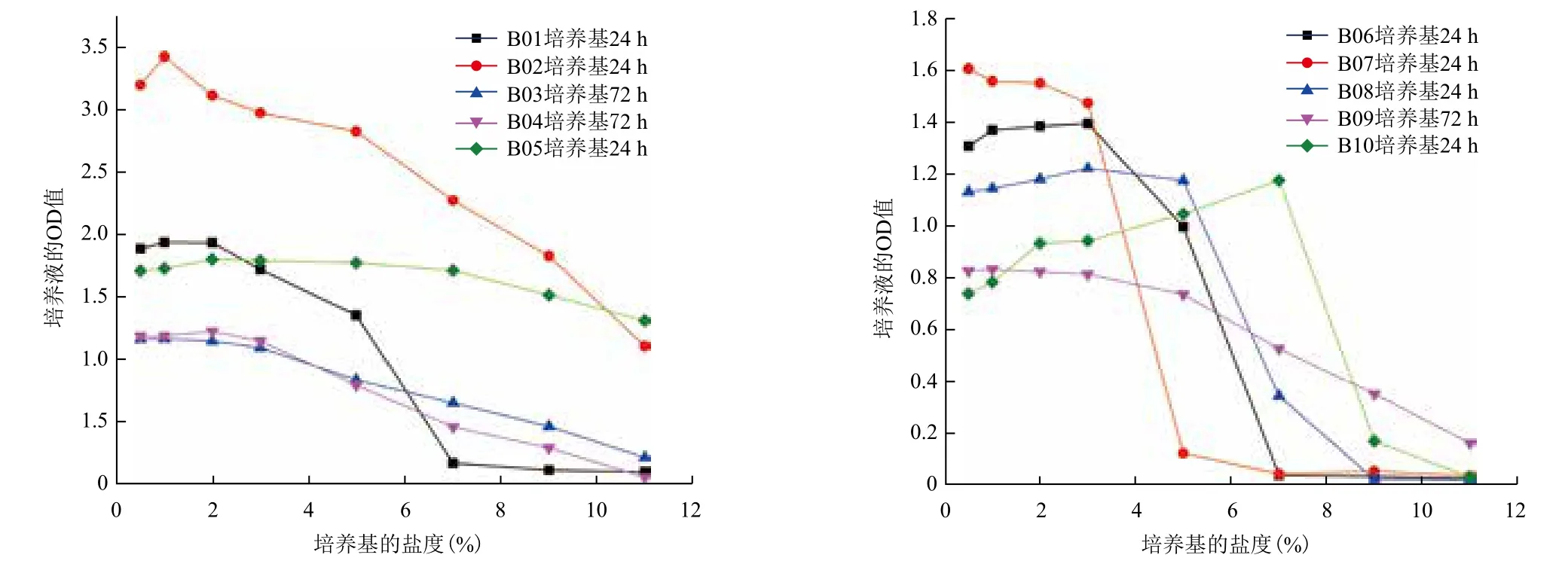
图6 10株耐盐碱菌株的耐盐情况
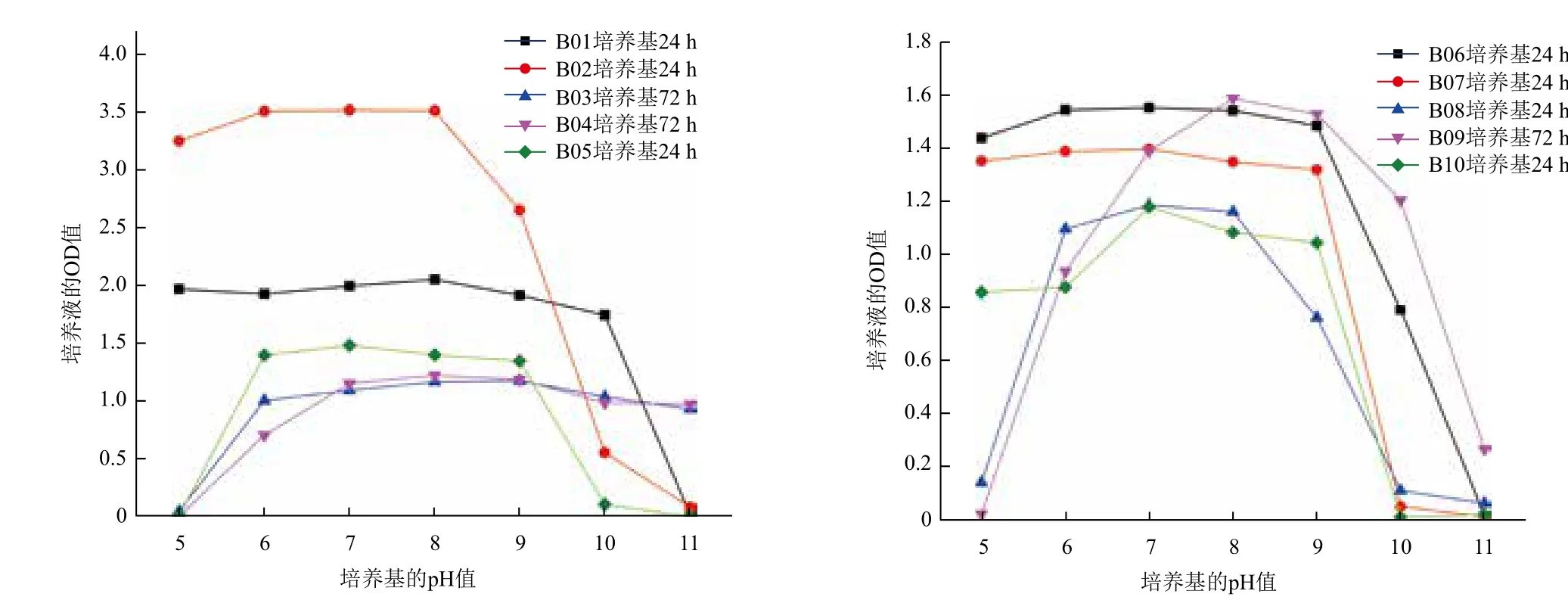
图7 10株耐盐碱菌株的耐碱情况
本研究耐盐性试验的结果表明,B05能够耐受11%的盐度,B10能够耐受7%的盐度,B01、B06和B08能够耐受5%的盐度,B07能够耐受3%的盐度,当盐度>3%时,B02、B03、B04、B09生长活性呈逐渐下降的趋势,说明过高的盐度对菌株的生长造成了一定的毒害,但菌株的生长活性没有急剧下降,说明菌株盐度较高时,菌株仍具有一定的耐受能力,综合上述分析得出B02,B03,B04,B05,B09,B10具有较好的耐盐性能;耐碱性试验的结果表明,B03和B04能够耐受pH为11的环境,且除B02和B08外,其它菌均具有较好的耐碱性能。综合考察本研究中10株菌对盐碱的耐受情况,发现B03、B04、B05、B09和B10具有较好的耐盐和耐碱性能,有望在盐碱化石油烃污染现场应用。
在资源短缺与环境污染日益严峻的背景下,耐盐碱菌作为一条有效可行的生物学途径,能够充分发挥自身潜力,减轻高盐碱石油污染对环境所造成的压力。筛选得到的耐盐碱石油烃降解菌在修复石油污染盐碱化土壤中具有很大的应用潜力。
4 结论
本研究从天津大港油田石油污染盐碱化土壤中分离出10株细菌,经过初步液体培养和油平板培养试验,发现10株菌均有较好的原油乳化和降解性能。通过形态特征、生理生化特征和16S rRNA序列分析确定这些菌株为苍白杆菌属、葡萄球菌属、迪茨菌属、棒状杆菌属、无色杆菌属、微杆菌属、芽孢杆菌属。这表明石油降解微生物在不同种属中广泛存在。
耐盐碱试验表明,10株菌均有较高的耐盐碱性能。在盐度为3%,pH为9的盐碱环境下,10株菌的生长性能均未受到影响。其中,菌B02和B05能够耐受11%的盐度环境;菌B03和B04能够耐受pH为11的碱度环境。菌B03、B04、B05、B09和B10为具有较好耐盐碱性能的微生物,有望在盐碱化石油烃污染现场应用。
[1]邱清华, 哈尼帕, 邓绍云, 等.石油降解混合菌剂的筛选及降解条件研究[J].中国农学通报, 2013, 29(3):184-189.
[2]詹研.中国土壤石油污染的危害及治理对策[J].环境污染与防治, 2008, 30(3):91-93.
[3]Verma S, Bhargava R, Pruthi V. Oily sludge degradation by bacteria from Ankleshwar, India[J]. International Biodeterioration& Biodegradation, 2006, 57(4):207-213.
[4]Obayori OS, Adebusoye SA, Adewale AO, et al. Differential degradation of crude oil(Bonny light)by four Pseudomonas strains[J]. Journal of Environmental Sciences, 2009, 21(2):243-248.
[5]Margesin R, Schinner F. Biodegradation and bioremediation of hydrocarbons in extreme environments[J]. Applied Microbiology &Biotechnology, 2001, 56(5-6):650-663.
[6]徐金兰, 黄廷林, 唐智新, 等.高效石油降解菌的筛选及石油污染土壤生物修复特性的研究[J].环境科学学报, 2007, 27(4):622-628.
[7]陆昕, 陈立, 李娟, 等.假单胞菌Nwu 1-mu对陕北石油污染土壤的生物修复作用研究[J].农业环境科学学报, 2010, 29(5):910-917.
[8]Wang XB, Chi CQ, Nie Y, et al. Degradation of petroleum hydrocarbons(C6-C40)and crude oil by a novel Dietzia strain[J]. Bioresource Technology, 2011, 102(17):7755-7761.
[9]Karamalidis AK, Evangelou AC, Karabika E, et al. Laboratory scale bioremediation of petroleum-contaminated soil by indigenous microorganisms and added Pseudomonas aeruginosa strain Spet[J]. Bioresource Technology, 2010, 101(16):6545-6552.
[10]Zhang Z, Gai L, Hou Z, et al. Characterization and biotechnological potential of petroleum-degrading bacteria isolated from oilcontaminated soils[J]. Bioresource Technology, 2010, 101(21):8452-8456.
[11]Balachandran C, Duraipandiyan V, Balakrishna K, et al. Petroleum and polycyclic aromatic hydrocarbons(PAHs)degradation and naphthalene metabolism in Streptomyces sp.(ERI-CPDA-1)isolated from oil contaminated soil[J]. Bioresource Technology,2012, 112:83-90.
[12]Lu L, Huggins T, Jin S, et al. Microbial metabolism and community structure in response to bioelectrochemically enhanced remediation of petroleum hydrocarbon-contaminated soil[J]. Environmental Science & Technology, 2014, 48(7):4021-4029.
[13]Gargouri B, Karray F, Mhiri N, et al. Application of a continuously stirred tank bioreactor(CSTR)for bioremediation of hydrocarbonrich industrial wastewater effluents[J]. Journal of Hazardous Materials, 2011, 189(1):427-434.
[14]Mariano AP, Bonotto DM, Angelis DF, et al. Biodegradability of commercial and weathered diesel oils[J]. Brazilian Journal of Microbiology, 2008, 39(1):133-142.
[15]Mariano AP, Kataoka APAG, Angelis DF, et al. Laboratory study on the bioremediation of diesel oil contaminated soil from a petrol station[J]. Brazilian Journal of Microbiology, 2007, 38(2):346-353.
[16]von der Weid I, Marques JM, Cunha CD, et al. Identification and biodegradation potential of a novel strain of Dietzia cinnamea isolated from a petroleum-contaminated tropical soil[J]. Systematic and Applied Microbiology, 2007, 30(4):331-339.
[17]Angelim AL, Costa SP, Farias BCS, et al. An innovative bioremediation strategy using a bacterial consortium entrapped in chitosan beads[J]. Journal of Environmental Management, 2013,127:10-17.
[18]陈露, 李淑芹, 薛燕芬.一株产脂肽类表面活性剂的碱性Dietzia菌及特性研究[J].微生物学通报, 2012, 39(11):1573-1579.
[19]王兴彪, 汤岳琴, 吴钢, 等.细菌Dietzia sp. DQ12-45-1b代谢十六烷产物分析和检测方法优化[J].应用与环境生物学报,2013, 19(3):519-522.
[20]Ma Q, Lin A, Ma E, et al. A review of micro-biological degradation and remediation of total petroleum hydrocarbon in soil[J]. Asian Journal of Ecotoxicology, 2008, 3(1):1-8.
[21]Torres LG, Rojas N, Bautista G, et al. Effect of temperature, and surfactant’s HLB and dose over the TPH-diesel biodegradation process in aged soils[J]. Process Biochemistry, 2005, 40(10):3296-3302.
[22]Gojgic-Cvijovic GD, Milic JS, Solevic TM, et al. Biodegradation of petroleum sludge and petroleum polluted soil by a bacterial consortium:a laboratory study[J]. Biodegradation, 2012, 23(1):1-14.
[23]Bacosa H, Suto K, Inoue C. Preferential degradation of aromatic hydrocarbons in kerosene by a microbial consortium[J]. International Biodeterioration & Biodegradation, 2010, 64(8):702-710.
[24]Vinas M, Sabaté J, Espuny MJ, et al. Bacterial community dynamics and polycyclic aromatic hydrocarbon degradation during bioremediation of heavily creosote-contaminated soil[J]. Applied and Environmental Microbiology, 2005, 71(11):7008-7018.
[25]Maqbool F, Wang Z, Xu Y, et al. Rhizodegradation of petroleum hydrocarbons by Sesbania cannabina in bioaugmented soil with free and immobilized consortium[J]. Journal of Hazardous Materials,2012, 237:262-269.
[26]Ebkowska M, Zborowska E, Karwowska E, et al. Bioremediation of soil polluted with fuels by sequential multiple injection of native microorganisms:Field-scale processes in Poland[J]. Ecological Engineering, 2011, 37(11):1895-1900.
[27]Tang J, Wang R, Niu X, et al. Enhancement of soil petroleum remediation by using a combination of ryegrass(Lolium perenne)and different microorganisms[J]. Soil and Tillage Research,2010, 110(1):87-93.
[28]宋立超.盐土多环芳烃降解菌筛选分离及其污染修复应用基础研究[D].沈阳:沈阳农业大学, 2011.
[29]张竹圆, 白洁, 周方, 等.两株河口湿地耐盐石油降解菌的生物学特性及降解能力研究[J].海洋湖沼通报, 2011, 25(1):147-153.
[30] Nicholson CA, Fathepure BZ. Biodegradation of benzene by halophilic and halotolerant bacteria under aerobic conditions[J]. Applied and Environmental Microbiology, 2004, 70(2):1222-1225.
[31]Obuekwe CO, Badrudeen AM, Al-Saleh E, et al. Growth and hydrocarbon degradation by three desert fungi under conditions of simultaneous temperature and salt stress[J]. International Biodeterioration & Biodegradation, 2005, 56(4):197-205.
(责任编辑 马鑫)
Isolation and Identification of Saline-alkaline Tolerant Hydrocarbondegrading Strains and Study on Their Saline-alkaline Tolerant Characteristics
Zhang Hairong Tang Jingchun Sun Kejing Zhang Qingmin
(College of Environmental Science and Engineering,Nankai University,Key Laboratory of Pollution Processes and Environmental Criteria(Ministry of Education),Tianjin Key Laboratory of Environmental Remediation and Pollution Control,Tianjin 300071)
10 saline-alkaline tolerant strains which can degrade hydrocarbons were isolated from a petroleum-contaminated saline soil in Dagang oilfield of China. According to their morphology, physiochemical characteristics and 16S rRNA sequence analysis, the 10 strains were identified as Ochrobactrum, Staphylococcus, Dietzia, Corynebacterium, Achromobacter, Microbacterium and Bacillus. Moreover, a series of liquid incubation experiments were conducted to investigate their saline tolerant and alkaline tolerant characteristics. The salt resistance test demonstrated that 10 strains grew well at NaCl concentrations ranging from 0.5% to 5.0% or even higher except B07 which could grow under 3% of NaCl. B02 and B05 still had high growth activity under a salinity of 11%. The alkalinity resistance test demonstrated that all the 10 strains grew well at pH 9. Besides, B01, B03, B04, B06 and B09 could endure the pH of 10, B03 and B04 still had high growth activity with the pH of 11. The results indicated that petroleum-degradation bacteria with high saline tolerant and alkaline tolerant abilities were widespread among different microbial species. Therefore, they are expected to be widely used in the remediation of oil-contaminated saline alkaline soil.
saline-alkaline tolerance;petroleum contamination;soil;petroleum-degradation bacteria;bioremediation
10.13560/j.cnki.biotech.bull.1985.2015.01.023
2014-06-23
国家自然科学基金面上项目(31270544),国家高技术研究发展计划(“863”计划)重大项目(2013AA06A205),教育部博士点基金项目(博导类)(20120031110015)
张海荣,女,硕士研究生,研究方向:生物修复;E-mail:zhanghairong1017@sina.com
唐景春,男,教授,研究方向:生物修复;E-mai:tangjch@nankai.edu.cn
